Impact of antimicrobial resistance on sustainable development goals and countermeasures
-
摘要: 抗微生物药物耐药(AMR)已成为全球性公共卫生危机,严重威胁联合国可持续发展目标(SDGs)的实现。本文基于SDGs的视角,探讨AMR对全球健康体系、经济发展和社会福祉等产生的潜在后果及深远影响。分析全球及中国AMR防控的现状与挑战,提出综合性的应对建议:构建AMR全球协同治理机制,深化“同一健康”(One Health)实践框架,完善AMR监测与感染防控体系,加速新型疫苗研发,探索AMR创新应对技术,加强全民AMR素养教育。研究结论可为全球特别是发展中国家统筹应对AMR威胁,推进SDGs进程提供参考。Abstract: Antimicrobial resistance (AMR) has become a global public health crisis, posing a serious threat to the achievement of sustainable development goals (SDGs) of the United Nations. This article explores the potential consequences and far-reaching impacts of AMR on the global health system, economic development, and social well-being from the perspective of SDGs. This article analyzes the current situation and challenges of AMR prevention and control globally and domestically, proposes comprehensive response suggestions, such as establishing a global collaborative governance mechanism for AMR, deepening the "One Health" practice framework, perfecting survei-llance as well as infection prevention and control system on AMR, accelerating the development of new vaccines, exploring AMR innovative response technologies, and strengthening AMR literacy education for all people. The research findings can provide reference globally, especially for developing countries to comprehensively respond to the threat of AMR and promote the SDGs process.
-
抗微生物药物耐药(antimicrobial resistance, AMR)已成为实现联合国可持续发展目标(sustai-nable development goals, SDGs)的关键威胁之一[1]。2019年,AMR菌直接导致全球127万人死亡,间接导致495万人死亡[2]。在欧美地区,每年有高达5万人死于AMR菌感染,若缺乏有效干预,预计到2050年,全球每年因耐药性微生物感染导致的死亡人数可能攀升至1 000万[3]。AMR对可持续发展的破坏性影响具有多维性:其不仅造成人口健康损失,更通过医疗成本、加剧健康不平等、削弱卫生系统韧性等路径,深度冲击全球经济格局与社会公平[4]。基于此,本研究从SDGs的视角,系统解析AMR对全球经济发展、健康与福祉、健康公平等方面的多重影响,并提出综合治理策略,以遏制AMR蔓延,加速推进SDGs进程。
1. AMR对SDGs的跨维度冲击
1.1 SDGs进展与AMR的关联性
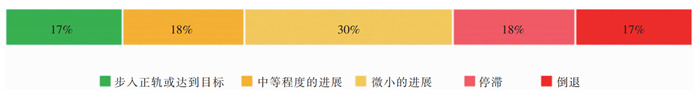
SDGs是指联合国制定的17个全球发展目标,旨在指导2015—2030年的国际发展合作(表 1)[5]。SDGs下有169个具体目标及相应的指标清单。2024年SDGs进展评估显示,全球实现2030年议程的进程严重滞后:在有明确数据的135个具体目标中,仅17%的目标正步入正轨或达到预期,18%的目标出现停滞,而17%的目标已倒退至2015年基线水平以下(见图 1)[6]。AMR的全球扩散通过侵蚀医疗卫生成果、加剧贫困与不平等,已成为阻碍SDGs落实的核心风险因子。系统分析AMR对SDGs的跨维度影响,可为厘清其作用机制、制定针对性干预策略提供科学依据,进而推动将AMR治理纳入全球可持续发展议程优先事项。
表 1 SDGs内容SDGs 内容 SDG1: No poverty 在世界各地消除一切形式的贫困 SDG2: Zero hunger 消除饥饿,实现粮食安全,改善营养和促进可持续农业 SDG3: Good health and wellbeing 确保各年龄段人群的健康生活与福祉 SDG4: Quality education 确保包容、公平的优质教育,促进全民终身享有学习机会 SDG5: Gender equality 实现性别平等,增强所有妇女和女童的权能 SDG6: Clean water and sanitation 确保所有人享有清洁饮用水与卫生设施 SDG7: Affordable and clean energy 确保人人获得可负担、可靠和可持续的现代能源 SDG8: Decent work and economic growth 促进持久、包容和可持续的经济增长,实现充分就业与生产性就业,确保所有人获得体面工作 SDG9: Industry, innovation and infrastructure 建设具有防灾减灾能力的基础设施,促进包容和可持续的工业并促进创新 SDG10: Reduced inequalities 减少国家内部和国家之间的不平等 SDG11: Sustainable cities and communities 建设包容、安全、有风险抵御能力和可持续的城市及人类居住区 SDG12: Sustainable consumption and production 确保可持续的消费和生产模式 SDG13: Climate action 采取紧急行动应对气候变化及其负面影响 SDG14: Life below water 保护和可持续利用海洋及海洋资源,促进海洋生态系统可持续发展 SDG15: Life on land 保护、恢复和促进可持续利用陆地生态系统,可持续管理森林,防治荒漠化,制止和扭转土地退化现象,遏制生物多样性的丧失 SDG16: Institutions, good governance 促进和平、包容的社会,保障可持续发展,确保所有人享有司法正义,并在各级建立有效、负责和包容的机构 SDG17: Partnerships for the goals 加强执行手段,激活促进可持续发展的全球伙伴关系 1.2 AMR对SDGs的影响
1.2.1 AMR给中低收入国家消除贫困(SDG1)带来巨大挑战
世界银行(World Bank, WB)2016年发布的《耐药性感染:对我们经济未来的威胁》报告指出,到2050年AMR可能导致2 830万人因高昂的治疗费用和慢性感染陷入极端贫困[7]。Pokharel等[8]指出,AMR将对所有国家均构成威胁,但中低收入国家所受冲击尤为严重。Ahmad等[9]指出,在资源匮乏的欠发达国家和发展中国家,贫困人群和受教育程度较低的人群更容易陷入医疗贫困陷阱,AMR导致的医疗自付费用增加将进一步加剧其贫困程度。
1.2.2 AMR影响粮食安全,阻碍零饥饿(SDG2)目标实现
SDG2旨在“消除饥饿,实现粮食安全,改善营养和促进可持续农业”,其核心目标是至2030年实现农业生产力倍增并构建可持续、有弹性的粮食系统。随着全球动物性食品消费指数增长[10],“集约化生产模式”变得更加普遍,养殖密度过大导致动物疫情暴发的风险显著提升。AMR削弱抗微生物药物疗效,导致动物感染治疗难度加剧,进而引发动物源疫情扩散,最终破坏农业生产系统的可持续性与恢复力。世界卫生组织(World Health Organization, WHO)2021年报告指出,低收入国家畜牧业受AMR冲击最为严重,在高耐药性情景下,预计到2050年畜牧业产量降幅可达11%[11],对农业生产力构成系统性威胁。
1.2.3 AMR直接导致生命健康损失,影响全民健康覆盖(SDG3)
WHO报告称,耐药性疾病每年在全球造成至少70万人死亡[12]。AMR对传染病防治构成挑战[13]。以肺炎为例,其作为全球儿童死亡的主要原因,每年造成逾70多万例5岁以下儿童死亡[14],而AMR加剧将导致肺炎的治疗更加困难。抗微生物药物为防治性传播感染疾病及降低其后遗症风险提供可能,但随着AMR问题的加剧,抗微生物药物的不合理使用也成为减轻全球性传播感染疾病负担的主要障碍[15]。耐药结核病对公共卫生构成严重威胁,2019年全球耐多药结核病病例数已达68万例[16]。
AMR威胁非传染性疾病(noncommunicable diseases, NCDs)患者的生命安全。NCDs和AMR之间也存在复杂的联系。四类主要NCDs(心血管疾病、癌症、糖尿病与慢性呼吸道疾病)占WHO欧洲区域死亡人数的75%[17]。NCDs患者因免疫功能受损,更易发生感染,若为耐药菌感染,则治疗更加复杂。慢性病患者住院频率更高,长期且复杂的治疗过程将进一步增加其感染风险。若无有效抗菌药物,慢性病患者生命健康将面临更严重的风险。研究证实,AMR将威胁外科手术安全性、癌症治疗效果及器官移植成功率[18],进一步威胁NCDs患者的健康和生命安全。
此外,AMR导致药物使用增加,慢性感染及药物研发成本增加,加重各国卫生筹资负担,医疗卫生服务的可负担性降低,将直接影响全民健康覆盖的实现。据WHO与WB联合报告,截至2021年,全球仍有约半数人口(45亿人)未享有基本卫生服务[19]。将AMR防治纳入全民健康覆盖体系,是实现2030年健康目标的关键路径[20]。
1.2.4 抗菌药物残留影响清洁水及卫生设施(SDG6)
WHO统计显示,全球半数人口仍无法获得安全的饮用水、环境卫生和个人卫生设施(water, sanitation and hygiene, WASH)[21]。水环境污染主要源自生活污水、工业废水及农业废弃物排放中的抗菌药物残留[22]。尽管废水处理技术持续改进,常规处理工艺仍难以有效清除抗菌药物成分,导致残留药物持续渗入水环境中[23]。López-Pacheco等[24]研究发现,抗菌药物在湖泊、河流、水库、地下水中广泛检出,甚至存在于处理后的饮用水系统。生态系统中抗菌药物残留与耐药菌增值的双重压力,已对SDG6目标达成构成实质性威胁[11]。
1.2.5 AMR致使全球经济产出下降,阻碍充分就业(SDG8)
2015—2050年,AMR预计造成全球GDP损失达85万亿美元,贸易损失超23万亿美元;到2050年全球GDP或将较基线值下降3.8%[25]。至2030年,AMR可能导致全球经济产出下降1%~3%,损失高达3.4万亿美元;至2050年,AMR可能给全球经济造成累计100万亿美元的损失[2]。世界动物卫生组织报告指出,AMR可能通过4种机制冲击经济增长:(1)医疗保健成本攀升;(2)人口结构变化(由于人口减少导致消费减少);(3)劳动力规模缩减(AMR致劳动力退出或转行);(4)关联产业衰退(AMR负担较重的国家旅游业、高接触性娱乐服务业受创)[26]。经济合作与发展组织《采用“同一健康(One Health)”框架对抗抗微生物药物耐药性》报告指出,AMR会通过减少就业、助长旷工或“出勤主义”(员工在工作效率降低的情况下仍继续工作的行为或文化)而对劳动力市场产生负面影响[27]。
1.2.6 AMR可能加剧健康不平等,阻碍健康公平(SDG5和SDG10)的实现
健康公平指在健康领域实现社会公正,健康不平等则是由于更广泛的社会和经济不平等而导致的不同群体健康差异。这些差异往往由性别、国籍、社会经济资源或地位等因素造成[28]。研究表明,妇女、难民等脆弱群体更易遭受耐药菌感染的影响[11],进而加剧健康不平等[29]。女性因生理结构特性更易罹患性传播疾病,尽管抗微生物药物降低了相关健康风险[30],但AMR加剧可能逆转此趋势;此外,全球70%的卫生工作者为女性,使其职业暴露风险显著升高[31]。
难民群体通常面临生活条件恶劣、居住环境拥挤和营养不良等诸多健康挑战,导致耐药菌感染风险增加[32]。Nellums等[33]针对欧洲移民的研究显示,难民群体耐药细菌携带率及耐药性微生物感染的总体患病率高于其他移民群体。Yıldız等[34]在土耳其的调研发现,叙利亚难民耐甲氧西林金黄色葡萄球菌流行率高于本地居民,战争导致的公共卫生系统崩溃是主要诱因。研究[35]指出,难民群体常面临无法获得基本医疗保健和药物的情况,更容易受到AMR的健康威胁。
1.2.7 AMR影响抗微生物药物的可持续消费和生产(SDG12)
AMR加剧意味着越来越多的抗微生物药物疗效降低甚至失效,可供感染性疾病治疗使用的抗微生物药物减少。构建可持续的抗微生物药物分配和使用模式需要采取“节约机制”,确保其合理使用[36]。耐药形势的加剧迫切需要开发新型抗微生物药物以避免AMR问题的进一步恶化[37],但开发新型抗微生物药物是一项长期且艰巨的任务[38]。新型抗微生物药物的研发面临长期的瓶颈[39],包括监管严苛、科学研究停滞、经济回报周期长等种种障碍。从监管的角度,过去30年中很少有临床效果显著的抗菌药物获得批准,许多制药公司正在放弃抗菌药物研发计划[40]。从科学研究的角度,近几十年来,人类也没有发现具有临床价值的新型抗菌药物分子[41]。从经济的角度,经济回报周期长是抗菌药物开发的最大障碍,抗菌药物盈利能力不足极大地阻碍了新抗菌药物的研发和生产[40]。
1.2.8 水产养殖环境中的抗菌药物积累给水下生物(SDG14)造成负面影响
残留在水产养殖环境中的抗菌药物不仅影响浮游植物和浮游动物的多样性,还会破坏浮游动物的早期发育过程[42]。不仅如此,抗菌药物在水环境中的持续积累导致环境中抗菌药物耐药基因的增加[42],部分耐药基因转移至致病细菌中,进而导致人类、鱼类和其他水生动物的耐药性感染[43]。鱼类、植物和其他水生生物长期暴露于耐药基因,导致其产生毒性,致使食用这些鱼类的人和动物具有潜在的健康风险[44-45]。喹诺酮类、磺胺类、四环素类及大环内酯类等四大类抗菌药物还被认为对鱼类具有“遗传毒性”[46]。
2. 应对AMR威胁,促进SDGs实现
鉴于AMR对实现SDGs进程的影响,亟需加大遏制AMR的力度,以加快推进SDGs进程,笔者对此做了一些思考,其中重点探讨我国应对AMR挑战的现状以及未来努力方向。
2.1 AMR全球协同治理是SDGs的必然路径
鉴于AMR对全球健康造成的威胁,亟需开展AMR的全球协同治理[47]。各国之间通过合作可以集中资源、分享知识、开展标准化监测,减缓AMR在全球的蔓延。中国在全球AMR治理中将扮演重要角色。Yin等[48]指出,目前中国尚未接入WHO全球抗菌药物耐药监测系统(Global Antimicrobial Resistance and Use Surveillance System, GLASS),与国际社会在AMR监测方面数据共享有限。未来中国可以通过民间组织及“一带一路”倡议、上海合作组织、中东欧“16+1合作”等多边合作伙伴关系,更好地支持全球AMR治理计划。
2.2 同一健康:应对AMR挑战与推动SDGs进程的战略路径
“同一健康”是一种综合的、多学科的框架,旨在通过人类健康、动物健康和环境健康的协同管理解决全球健康挑战。“同一健康”理念认为健康是社会生态系统与可持续发展相融合的结果[1]。“同一健康”早期主要强调人畜共患病,如今已转向更广泛的范式,包括生态、可持续发展、经济、社会正义、公平等[49],其本身就包含了可持续发展的理念。AMR作为严重影响人类、环境和动物健康可持续发展的全球性问题,有必要在全球范围内采取“同一健康”方法加以应对[47],该方法现已融入全球应对AMR的行动中[50]。如WHO最新报告指出应对AMR需要“同一健康”方法[51],四方组织(联合国粮食及农业组织、联合国环境规划署、WHO、世界动物卫生组织)发布报告称要将“同一健康”纳入联合国可持续发展合作框架以应对包括AMR威胁在内的多维度健康挑战[47],并制定了针对AMR的“同一健康”优先研究议程[52]。该议程实际上是一项联合倡议,旨在引导和激发各国对优先研究议程的财政投资和科研兴趣[52]。
中国在实施“同一健康”顶层设计方面取得了进展,但在落实“同一健康”政策方面面临困难。其原因在于缺乏具体的实施机制,尚未成立专门的政府机构来协调“同一健康”事务,没有建立透明的共享数据环境等等。我国需进一步加强“同一健康”的能力建设,在做好顶层设计的同时,完善政府和利益相关方责任、激励等具体实施机制[53]。
2.3 加强AMR监测和感染预防控制(infection prevention and control, IPC)系统是实现SDGs的根本性措施
加强AMR监测和IPC系统不仅能保护人类健康(SDG3),还能促进环境可持续性(SDG6),减轻经济负担(SDG1和SDG8),并推动全球合作(SDG17)。加强AMR监测和IPC系统,可增强社会和生态系统的韧性,为其可持续发展提供关键保障。如对AMR进行监测可明确特定地理区域的微生物耐药性水平和趋势,并将获取的监测信息用于改善抗菌药物处方的合理性,还能及时发现新的耐药机制并对干预措施进行监测,以提高全球应对健康风险的能力(SDG3)[54]。此外,根据WHO报告,循证的IPC措施可有效预防35%~70%的医源性感染[55]。IPC通过预防感染可以有效降低人们对抗微生物药物的依赖,同时减缓耐药菌的产生和扩散。因此,加强IPC不仅能够减少感染的发生,还能减缓AMR的加剧,从而能够降低与之相关的直接、间接经济成本,改善弱势群体的健康和经济状况(SDG1和SDG8)。
目前,我国国家级、省级和地级市医疗机构的AMR监测系统日益完善。卫生部于2005年建立了全国细菌耐药监测网(China Antimicrobial Resistance Surveillance System, CARSS)[56],旨在监测全国抗菌药物临床使用以及入院患者感染的病原菌耐药情况,并以年度报告的形式公布耐药数据[57]。2023年,CARSS核心网成员2 000所医院,其中上报数据医院共1 997所,其中二级医院581所,三级医院1 416所。2004年建立了中国抗菌药物监测网(China Antimicrobial Surveillance Network, CHINET)。目前CHINET成员单位73所医院,包括53所综合性医院和20所儿童医院,其中三级医院57所,二级医院16所[56]。全国医疗机构感染监测网(National Medical Institution Infection Surveillance System of China, CMIISS)致力于获取客观、准确的医疗机构感染监测过程数据,及时掌握医院感染流行趋势和新出现的威胁,为卫生行政管理部门和各级医疗机构制定相关政策及评估干预措施提供科学依据。目前我国仍由国家卫生健康委员会、农业农村部等部门分别开展AMR监测工作,尚未建立跨部门协调机构或专项工作组以统筹推进相关监测任务。环境源和水产动物源耐药菌仍未纳入监测体系,临床和动物源性耐药数据的利用和政策转化力度也有待加强。我国亟需在持续强化医院感染控制体系的基础上,构建跨部门AMR协调监测网络,并推进流行病学与基因组学等多源数据的整合应用,为公共卫生、动物健康以及环境保护等领域的科学决策提供依据[57]。此外,还应加大对AMR监测工作的财政投入,将更多医疗机构纳入国家AMR监测体系[58]。
2.4 开发新型疫苗或利用AMR新型应对策略为良好健康(SDG3)提供保障
Sevilla等[59]研究指出,抗菌药物研发面临双重困境;科学门槛高于疫苗的研发,且市场创收激励小于疫苗研发[60]。相比于开发新抗菌药物,从技术和经济的角度,开发新型疫苗更具可行性,疫苗在应对AMR威胁中的作用被忽视。抗菌肽、纳米抗菌剂、酶抑制剂等与抗菌药物的联合使用[61],针对双组分调控系统(two-component regulatory systems, TCSs) 的靶向干预[62],植物化学物质与抗菌剂协同作用[63],人工智能、机器学习方法等均是有效应对AMR问题的新型策略[64-65],可为实现SDG3良好健康与福祉提供保障。
目前,我国未将一些全球公认的重要疫苗,如肺炎球菌疫苗(pneumococcal conjugate vaccine, PCV)纳入“扩大免疫规划(expanded programme on immunization, EPI)”[66]。将PCV纳入EPI可使PCV的价格更合理,还能提高民众对PCV的可获得性,进而提高中国PCV的覆盖率。增加PCV的覆盖率不仅可以挽救更多生命,还可以减缓AMR的加剧,并减少因AMR而产生的相关费用(5年内可以达到数十亿美元)[59]。
2.5 加强AMR教育,为实现SDGs提供关键支撑
加强AMR教育不仅有助于应对AMR,还为SDGs的实现提供关键支撑,尤其体现在促进健康(SDG3)、增强教育质量(SDG4)、减少不平等(SDG10)和建立全球合作(SDG17)等领域。如通过开展AMR教育,可以提升公众知识,减少因不当使用抗微生物药物造成的健康不平等(SDG10);增强弱势群体(如农村居民)AMR教育支持,可以使其拥有平等获取科学信息的权利。目前,WHO已制定针对医务人员的AMR教育和培训指导[67],一些国家(如英国)也已开始采用专门针对AMR的教育策略[68]。
近年来,国家卫健委医院管理研究所和合理用药委员会办公室筹划与组织的培元、培英、培微等培训项目和继续教育课程,为细菌真菌感染诊治、预防和抗菌药物合理应用培训了大量骨干人才。这些项目涵盖了临床微生物学培训,以及抗微生物药物的临床应用、管理和政策等多个方面,旨在提升医务人员的抗微生物药物合理使用能力,遏制AMR的发展。但也有研究[69]指出我国利用大众媒体开展面向公众的AMR教育工作做得仍不够,需进一步完善相关政策支持与体系建设,明确AMR教育的优先级,并将其纳入国家公共卫生服务政策,设立专项资金支持AMR教育活动和科研项目等。
3. 结语
AMR已成为21世纪最紧迫的全球公共卫生威胁之一,其对联合国SDGs的实现构成重大挑战。本文深入分析AMR对SDGs的多维影响,包括加剧贫困、阻碍健康与福祉的提升、拉大健康差距等,以助于理解AMR影响的复杂性和广泛性,为制定科学的公共政策,推动全球健康事业发展和SDGs的实现提供参考。
本文也为应对AMR威胁、推进SDGs进程提出了思考,包括AMR的全球协同治理,落实“同一健康”理念,加强AMR监测和IPC系统,开发新型疫苗或利用新型AMR应对策略,以及加强AMR教育。只有加强综合行动才能更有效遏制AMR的威胁,向实现2030年联合国SDGs迈出更坚实的步伐。
利益冲突:所有作者均声明不存在利益冲突。
-
表 1 SDGs内容
SDGs 内容 SDG1: No poverty 在世界各地消除一切形式的贫困 SDG2: Zero hunger 消除饥饿,实现粮食安全,改善营养和促进可持续农业 SDG3: Good health and wellbeing 确保各年龄段人群的健康生活与福祉 SDG4: Quality education 确保包容、公平的优质教育,促进全民终身享有学习机会 SDG5: Gender equality 实现性别平等,增强所有妇女和女童的权能 SDG6: Clean water and sanitation 确保所有人享有清洁饮用水与卫生设施 SDG7: Affordable and clean energy 确保人人获得可负担、可靠和可持续的现代能源 SDG8: Decent work and economic growth 促进持久、包容和可持续的经济增长,实现充分就业与生产性就业,确保所有人获得体面工作 SDG9: Industry, innovation and infrastructure 建设具有防灾减灾能力的基础设施,促进包容和可持续的工业并促进创新 SDG10: Reduced inequalities 减少国家内部和国家之间的不平等 SDG11: Sustainable cities and communities 建设包容、安全、有风险抵御能力和可持续的城市及人类居住区 SDG12: Sustainable consumption and production 确保可持续的消费和生产模式 SDG13: Climate action 采取紧急行动应对气候变化及其负面影响 SDG14: Life below water 保护和可持续利用海洋及海洋资源,促进海洋生态系统可持续发展 SDG15: Life on land 保护、恢复和促进可持续利用陆地生态系统,可持续管理森林,防治荒漠化,制止和扭转土地退化现象,遏制生物多样性的丧失 SDG16: Institutions, good governance 促进和平、包容的社会,保障可持续发展,确保所有人享有司法正义,并在各级建立有效、负责和包容的机构 SDG17: Partnerships for the goals 加强执行手段,激活促进可持续发展的全球伙伴关系 -
[1] Gurung D, Bhardwaj VK, Fotedar S. Antimicrobial resistance challenge to sustainable development goals and targets: a one-health perspective[J]. J Integr Med Public Health, 2024, 3(1): 9-13. doi: 10.4103/JIMPH.JIMPH_11_24 [2] Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis[J]. Lancet, 2022, 399(10325): 629-655. doi: 10.1016/S0140-6736(21)02724-0 [3] O'NEILL J. Tackling drug-resistant infections globally: final report and recommendations[EB/OL]. (2016-05)[2024-08 -20]. https://amr-review.org/sites/default/files/160525_Final%20paper_with%20cover.pdf. [4] Khan MS, Durrance-Bagale A, Legido-Quigley H, et al. 'LMICs as reservoirs of AMR': a comparative analysis of policy discourse on antimicrobial resistance with reference to Pakistan[J]. Health Policy Plan, 2019, 34(3): 178-187. doi: 10.1093/heapol/czz022 [5] FUND S. Sustainable development goals[EB/OL]. [2024-08-20]. https://www.un.org/sustainabledevelopment/inequality/. [6] Secretary-General of the United Nations. Progress towards the sustainable development goals: report of the secretary-general[EB/OL]. [2024-08-20]. https://unstats.un.org/sdgs/files/report/2024/SG-SDG-Progress-Report-2024-advanced-un-edited-version.pdf. [7] World Bank Group. Drug-resistant infections: a threat to our economic future[M]. [2024-08-20]. https://www.world-bank.org/en/topic/health/publication/drug-resistant-infectio-ns-a-threat-to-our-economic-future. [8] Pokharel S, Raut S, Adhikari B. Tackling antimicrobial resistance in low-income and middle-income countries[J]. BMJ Glob Health, 2019, 4(6): e002104. doi: 10.1136/bmjgh-2019-002104 [9] Ahmad M, Khan AU. Global economic impact of antibiotic resistance: a review[J]. J Glob Antimicrob Resist, 2019, 19: 313-316. doi: 10.1016/j.jgar.2019.05.024 [10] McGill J, Moss A, Swick R, et al. The future protein decade: perspectives on global pressure to agriculture[J]. Anim Prod Sci, 2019, 59(11): 1951-1956. doi: 10.1071/AN19308 [11] WHO. Antimicrobial resistance and the United Nations sustainable development cooperation framework: guidance for United Nations country teams[EB/OL]. (2021-10-26)[2024-08-20]. https://www.who.int/publications/i/item/9789240036024. [12] WHO. No time to wait: securing the future from drug-resis-tant infections: report to the secretary-general of the United Nations[EB/OL]. (2019-04-29)[2024-08-20]. https://www.who.int/publications/i/item/no-time-to-wait-securing-the-future-from-drug-resistant-infections. [13] Asokan GV, Kasimanickam RK. Emerging infectious diseases, antimicrobial resistance and millennium development goals: resolving the challenges through one health[J]. Cent Asian J Glob Health, 2013, 2(2): 76. [14] UNICEF Data. Pneumonia in children statistics[EB/OL]. [2024-08-20]. https://data.unicef.org/topic/child-health/pneumonia/. [15] WHO. Sexually transmitted infections (STIs)[EB/OL]. (2024-05-21)[2024-08-20]. https://www.who.int/newsroom/fact-sheets/detail/sexually-transmitted-infections-(stis). [16] Lv HL, Zhang X, Zhang XL, et al. Global prevalence and burden of multidrug-resistant tuberculosis from 1990 to 2019[J]. BMC Infect Dis, 2024, 24(1): 243. doi: 10.1186/s12879-024-09079-5 [17] WHO. Action against antimicrobial resistance and noncommunicable diseases[EB/OL]. (2024-04-08)[2024-08-20]. https://www.who.int/europe/publications/i/item/WHO-EURO-2024-9543-49315-73713. [18] Laxminarayan R, Duse A, Wattal C, et al. Antibiotic resis-tance-the need for global solutions[J]. Lancet Infect Dis, 2013, 13(12): 1057-1098. doi: 10.1016/S1473-3099(13)70318-9 [19] WHO. Tracking universal health coverage: 2023 global monitoring report[EB/OL]. (2023-09-18)[2024-08-20]. https://www.who.int/publications/i/item/9789240080379. [20] Cipriano P, Chau J, Jashi M, et al. Leveraging universal health coverage to leave no one behind in tackling AMR[J]. Lancet Glob Health, 2024, 12(9): e1389-e1390. doi: 10.1016/S2214-109X(24)00309-7 [21] WHO. Improving access to water, sanitation and hygiene can save 1.4 million lives per year, says new WHO report[J]. (2023-06-28)[2024-08-20]. https://www.who.int/news/item/28-06-2023-improving-access-to-water--sanita-tion-and-hygiene-can-save-1.4-million-lives-per-year--says-new-who-report. [22] Prasad MNV, Vithanage M, Kapley A. Pharmaceuticals and personal care products: waste management and treatment technology: emerging contaminants and micro pollutants[M]. Oxford: Butterworth-Heinemann, 2019. [23] Ebrahimi SM, Dehghanzadeh Reyhani R, Asghari-JafarAbadi M, et al. Diversity of antibiotics in hospital and municipal wastewaters and receiving water bodies and removal efficiency by treatment processes: a systematic review protocol[J]. Environ Evid, 2020, 9(1): 19. doi: 10.1186/s13750-020-00201-z [24] López-Pacheco IY, Silva-Núñez A, Salinas-Salazar C, et al. Anthropogenic contaminants of high concern: existence in water resources and their adverse effects[J]. Sci Total Environ, 2019, 690: 1068-1088. doi: 10.1016/j.scitotenv.2019.07.052 [25] Ahmed SA, Barış E, GO DS, et al. Assessing the global po-verty effects of antimicrobial resistance[J]. World Dev, 2018, 111: 148-160. doi: 10.1016/j.worlddev.2018.06.022 [26] Adamie BA, Akwar HT, Arroyo M, et al. Forecasting the fallout from AMR: economic impacts of antimicrobial resis-tance in food-producing animals[EB/OL]. (2024-10-03)[2024-08-20]. https://www.rand.org/pubs/external_publications/EP70657.html. [27] OECD Health Policy Studies. Embracing a one health framework to fight antimicrobial resistance[EB/OL]. (2023-09-14)[2024-08-20]. https://www.oecd.org/en/publications/embracing-a-one-health-framework-to-fight-antimicrobial-resistance_ce44c755-en.html. [28] Braveman PA, Kumanyika S, Fielding J, et al. Health dispa-rities and health Equity: the issue is justice[J]. Am J Public Health, 2011, 101 (Suppl 1): S149-S155. [29] Wong C. Drug-resistant infections more likely to strike women, says WHO[J/OL]. Nature. (2024-06-05)[2024-08-20]. https://doi.org/10.1038/d41586-024-01476-9. [30] Reid L. Antimicrobial resistance and social inequalities in health: considerations of justice[M]//Jamrozik E, Selgelid M. Ethics and Drug Resistance: Collective Responsibility for Global Public Health. Cham: Springer International Publishing, 2020: 257-278. [31] Freitas AR, Karaman DŞ, Teh CSJ. Editorial: women in antimicrobials, resistance and chemotherapy: 2022[J]. Front Microbiol, 2023, 14: 1148777. doi: 10.3389/fmicb.2023.1148777 [32] Patel PK, Mehrotra P, Ladines-Lim JB. An opportunity for global antimicrobial stewardship research: refugee populations[J]. Antimicrob Steward Healthc Epidemiol, 2022, 2(1): e23. doi: 10.1017/ash.2022.8 [33] Nellums LB, Thompson H, Holmes A, et al. Antimicrobial resistance among migrants in Europe: a systematic review and Meta-analysis[J]. Lancet Infect Dis, 2018, 18(7): 796-811. doi: 10.1016/S1473-3099(18)30219-6 [34] Yıldız SS, Hekimoǧlu CH, Sucaklı MB, et al. Community-acquired antimicrobial resistance among Syrian refugees and the local population in Türkiye[J]. Eur J Public Health, 2023, 33(5): 809-814. doi: 10.1093/eurpub/ckad119 [35] Adebisi YA, Ogunkola IO. The global antimicrobial resistance response effort must not exclude marginalised populations[J]. Trop Med Health, 2023, 51(1): 33. doi: 10.1186/s41182-023-00524-w [36] Heyman G, Cars O, Bejarano MT, et al. Access, excess, and ethics-towards a sustainable distribution model for antibiotics[J]. Ups J Med Sci, 2014, 119(2): 134-141. doi: 10.3109/03009734.2014.904958 [37] Chinemerem Nwobodo D, Ugwu MC, Oliseloke Anie C, et al. Antibiotic resistance: the challenges and some emerging stra-tegies for tackling a global menace[J]. J Clin Lab Anal, 2022, 36(9): e24655. doi: 10.1002/jcla.24655 [38] Rosini R, Nicchi S, Pizza M, et al. Vaccines against antimicrobial resistance[J]. Front Immunol, 2020, 11: 1048. doi: 10.3389/fimmu.2020.01048 [39] Gupta SK, Nayak RP. Dry antibiotic pipeline: regulatory bo-ttlenecks and regulatory reforms[J]. J Pharmacol Pharmaco-ther, 2014, 5(1): 4-7. doi: 10.4103/0976-500X.124405 [40] Dutescu IA, Hillier SA. Encouraging the development of new antibiotics: are financial incentives the right way forward? a systematic review and case study[J]. Infect Drug Resist, 2021, 14: 415-434. doi: 10.2147/IDR.S287792 [41] Iskandar K, Murugaiyan J, Hammoudi Halat D, et al. Antibio- tic discovery and resistance: the chase and the race[J]. Antibiotics (Basel), 2022, 11(2): 182. doi: 10.3390/antibiotics11020182 [42] Okeke ES, Chukwudozie KI, Nyaruaba R, et al. Antibiotic resis-tance in aquaculture and aquatic organisms: a review of current nanotechnology applications for sustainable management[J]. Environ Sci Pollut Res Int, 2022, 29(46): 69241-69274. doi: 10.1007/s11356-022-22319-y [43] Rasul M, Majumdar B. Abuse of antibiotics in aquaculture and it's effects on human, aquatic animal and environment[J]. The Saudi Journal of Life Sciences, 2017, 2(3): 81-88. [44] Miranda CD, Godoy FA, Lee MR. Current status of the use of antibiotics and the antimicrobial resistance in the Chilean sal-mon farms[J]. Front Microbiol, 2018, 9: 1284. doi: 10.3389/fmicb.2018.01284 [45] Chen JM, Sun RX, Pan CG, et al. Antibiotics and food safety in aquaculture[J]. J Agric Food Chem, 2020, 68(43): 11908-11919. doi: 10.1021/acs.jafc.0c03996 [46] Yang C, Song G, Lim W. A review of the toxicity in fish exposed to antibiotics[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2020, 237: 108840. doi: 10.1016/j.cbpc.2020.108840 [47] WHO. One health and the United Nations sustainable development cooperation framework: guidance for united nations country teams[EB/OL]. (2023-10-19)[2024-08-20]. https://www.who.int/publications/i/item/WHO-OHI-2023.2. [48] Yin J, Wang Y, Xu XR, et al. The progress of global antimicrobial resistance governance and its implication to China: a review[J]. Antibiotics (Basel), 2021, 10(11): 1356. doi: 10.3390/antibiotics10111356 [49] Zinsstag J, Mackenzie JS, Jeggo M, et al. Mainstreaming one health[J]. Ecohealth, 2012, 9(2): 107-110. doi: 10.1007/s10393-012-0772-8 [50] Velazquez-Meza ME, Galarde-López M, Carrillo-Quiróz B, et al. Antimicrobial resistance: one health approach[J]. Vet World, 2022, 15(3): 743-749. [51] WHO. Action against antimicrobial resistance requires a one health approach[EB/OL]. (2024-04-16)[2024-08-20]. https://www.who.int/europe/publications/i/item/WHO-EU-RO-2024-9510-49282-73655. [52] WHO. A one health priority research agenda for antimicrobial resistance[EB/OL]. (2023-07-03)[2024-08-20]. https://www.who.int/publications/i/item/9789240075924. [53] Liu JS, Li XC, Zhang QY, et al. China's application of the one health approach in addressing public health threats at the human-animal-environment interface: advances and challenges[J]. One Health, 2023, 17: 100607. doi: 10.1016/j.onehlt.2023.100607 [54] Jansen WTM, van der Bruggen JT, Verhoef J, et al. Bacterial resistance: a sensitive issue complexity of the challenge and containment strategy in Europe[J]. Drug Resist Updat, 2006, 9(3): 123-33. doi: 10.1016/j.drup.2006.06.002 [55] WHO. Global report on infection prevention and control[EB/OL]. (2022-05-23)[2024-08-20]. https://www.who.int/publications/i/item/9789240051164. [56] Hu FP, Zhu DM, Wang F, et al. Current status and trends of antibacterial resistance in China[J]. Clin Infect Dis, 2018, 67 (Suppl 2): S128-S134. [57] 李敏, 姜天翔, 陈伟叶, 等. 基于全健康理念的微生物耐药性监测体系研究进展[J]. 中国热带医学, 2024, 24(11): 1293-1300. Li M, Jiang TX, Chen WY, et al. Research on the antimicrobial resistance monitoring system based on the One Health concept[J]. China Tropical Medicine, 2024, 24(11): 1293-1300. [58] Wang JC. The challenges of antimicrobial resistance survei-llance in China[J]. Am J Infect Control, 2019, 47(11): 1403-1404. [59] Sevilla JP, Bloom DE, Cadarette D, et al. Toward economic evaluation of the value of vaccines and other health technologies in addressing AMR[J]. Proc Natl Acad Sci U S A, 2018, 115(51): 12911-12919. doi: 10.1073/pnas.1717161115 [60] Lu EY, Chen HH, Zhao HQ, et al. Health and economic impact of the pneumococcal conjugate vaccine in hindering antimicrobial resistance in China[J]. Proc Natl Acad Sci U S A, 2021, 118(13): e2004933118. doi: 10.1073/pnas.2004933118 [61] Yu TR, Jiang GM, Gao RF, et al. Circumventing antimicro-bial-resistance and preventing its development in novel, bacterial infection-control strategies[J]. Expert Opin Drug Deliv, 2020, 17(8): 1151-1164. doi: 10.1080/17425247.2020.1779697 [62] 刘欢, 刘畅, 雷化雨, 等. 双组分调控系统对革兰氏阴性菌抗生素耐药性的调控研究进展[J]. 食品与发酵工业, 2025, 51(1): 381-389. Liu H, Liu C, Lei HY, et al. Advancements in antibiotic resistance regulation by two-component regulatory systems in Gram-negative bacteria[J]. Food and Fermentation Industries, 2025, 51(1): 381-389. [63] 管斌斌, 李艳梅. 植物化学物质与抗菌剂的协同相互作用: 对抗耐药性的潜在策略分析--评《民族植物资源化学与生物活性研究》[J]. 中国实验方剂学杂志, 2024, 30(20): 119. Guan BB, Li YM. Synergistic interactions between phytochemicals and antimicrobial agents: analysis of potential stra-tegies to combat drug resistance-a review of "chemistry and biological activity of ethnobotanical resources"[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2024, 30(20): 119. [64] Cai T, Anceschi U, Prata F, et al. Artificial intelligence can guide antibiotic choice in recurrent UTIs and become an important aid to improve antimicrobial stewardship[J]. Antibiotics (Basel), 2023, 12(2): 375. doi: 10.3390/antibiotics12020375 [65] Marra AR, Nori P, Langford BJ, et al. Brave new world: leveraging artificial intelligence for advancing healthcare epidemiology, infection prevention, and antimicrobial stewardship[J]. Infect Control Hosp Epidemiol, 2023, 44(12): 1909-1912. doi: 10.1017/ice.2023.122 [66] Zheng YM, Rodewald L, Yang J, et al. The landscape of vaccines in China: history, classification, supply, and price[J]. BMC Infect Dis, 2018, 18(1): 502. doi: 10.1186/s12879-018-3422-0 [67] WHO. Health workers' education and training on antimicrobial resistance: curricula guide[EB/OL]. (2019-11-17)[2024-08-20]. https://www.who.int/news/item/17-10-2019-global-symposium-on-health-workforce-accreditation-and-regulation-december-2019. [68] Marvasi M, Casillas L, Vassallo A, et al. Educational activities for students and citizens supporting the one-health approach on antimicrobial resistance[J]. Antibiotics (Basel), 2021, 10(12): 1519. doi: 10.3390/antibiotics10121519 [69] Xiao YH. Antimicrobial stewardship in China: systems, actions and future strategies[J]. Clin Infect Dis, 2018, 67 (Suppl 2): S135-S141. doi: 10.1093/cid/ciy641

 下载:
下载:
