Me chanism of tigecycline insensitivity of multidrug-resistant Acinetobacter baumannii
-
摘要:
目的 探讨多重耐药鲍曼不动杆菌(MDR-AB)对替加环素不敏感的耐药机制,为临床合理用药及医院感染防控提供参考。 方法 收集2022年4月—2023年5月广州医科大学附属第一医院临床分离的替加环素不敏感MDR-AB(TIS-MDR-AB)及替加环素敏感MDR-AB(TS-MDR-AB)各22株。应用外排泵抑制剂羰基氰化物间氯苯腙(CCCP)进行外排泵表型抑制试验,采用聚合酶链式反应(PCR)技术对主要外排泵基因(adeB、adeG、adeJ)和替加环素耐药基因tet(X)进行筛选,并应用实时荧光定量PCR检测其mRNA表达水平;Sanger测序分析外排泵调控基因adeRS的突变。 结果 两组MDR-AB外排泵基因adeB、adeG、adeJ的检出率均>95%,未检测到tet(X)基因。外排泵抑制剂试验显示,TIS-MDR-AB菌株在加入CCCP后最低抑菌浓度(MIC)下降,且有3株菌株外排泵表型阳性。TIS-MDR-AB组MDR-AB adeB的mRNA表达水平高于TS-MDR-AB组(P<0.01),adeG和adeJ基因的表达差异无统计学意义。adeR基因和adeS基因中发现多个突变,且有2株菌株adeS基因中插入ISAba1,3株菌株插入ISAba13。 结论 外排泵系统adeABC过度表达可能在MDR-AB对替加环素敏感性下降机制中起重要作用,且其过度表达可能与外排泵调控基因adeRS中出现插入序列或突变有关。 Abstract:Objective To explore the resistance mechanism of tigecycline insensitivity of multidrug-resistant Acine- tobacter baumannii, and provide reference for clinical rational antimicrobial use as well as prevention and control of healthcare-associated infection. Methods 22 strains of tigecycline insensitive multidrug-resistant Acinetobacter baumannii (TIS-MDR-AB) and 22 strains of tigecycline sensitive multidrug-resistant Acinetobacter baumannii (TS-MDR-AB) isolated clinically from the First Affiliated Hospital of Guangzhou Medical University from April 2022 to May 2023 were collected. Efflux pump phenotype inhibition assay was performed using efflux pump inhibitor carbonyl cyanide m-chlorophenylhydrazone (CCCP). The main efflux pump genes (adeB, adeG, adeJ), as well as tigecycline-resistant gene tet (X), were screened by polymerase chain reaction (PCR) technique, and their mRNA expression levels were detected by real-time fluorescence quantitative PCR. Mutations in the efflux pump regulatory gene adeRS were analyzed by Sanger sequencing analysis. Results The detection rates of efflux pump genes adeB, adeG and adeJ were all above 95% in two MDR-AB groups, and tet (X) gene was not detected. Efflux pump inhibitor assay showed that the minimum inhibitory concentration (MIC) of TIS-MDR-AB strains decreased after adding CCCP, 3 strains showed positive efflux pump phenotype. The mRNA expression level of MDR-AB adeB in the TIS-MDR-AB group was higher than that in the TS-MDR-AB group (P < 0.01), while the expression of adeG and adeJ genes was no statistically different. Multiple mutations were found in the adeR and adeS genes, the adeS of 2 strains was inserted ISAba1, and 3 strains were inserted ISAba13. Conclusion The overexpression of adeABC in the efflux pump system may play an important role in the mechanism of reduced sensitivity of MDR-AB to tigecycline, and its overexpression may be related to the insertion sequence or mutation in the efflux pump regulatory gene adeRS. -
Keywords:
- Acinetobacter baumannii /
- multidrug resistance /
- tigecycline /
- RND efflux pump
-
鲍曼不动杆菌(Acinetobacter baumannii, AB)主要引起肺炎、菌血症、尿路感染、继发性脑膜炎等多种感染性疾病[1],是导致全球医院获得性感染的ESKAPE(屎肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、AB、铜绿假单胞菌和肠杆菌属)病原体的成员之一。近年来,随着抗菌药物的广泛使用和滥用,导致多重耐药AB(multidrug-resistant Acinetobacter baumannii, MDR-AB)的检出率与日俱增。2023年CHINET细菌耐药监测网[2]数据显示,AB对临床常用抗菌药物表现出较高耐药率,仅对替加环素、米诺环素及多黏菌素B表现出较低耐药率。替加环素是第三代四环素类抗生素,可有效解决因细菌外排及核糖体保护所引起的耐药问题[3-4],其在治疗多重耐药菌感染中起到重要作用。但自从2007年第一例替加环素耐药菌株出现以来,世界各地不断有替加环素不敏感菌株检出。目前AB对替加环素的耐药机制有外排泵的过度表达、替加环素失活酶的产生、外膜通透性的改变及替加环素作用靶点的改变等[5]。其中,耐药结节细胞分化(resistance-nodulation cell division, RND)外排泵系统及替加环素灭活酶的产生在替加环素耐药过程中发挥重要作用。因此,研究RND外排泵及替加环素灭活酶在某院住院患者分离的MDR-AB菌株中的作用,并探讨其对替加环素不敏感的耐药机制,对指导临床合理用药和医院感染防控起到重要作用。
1. 材料与方法
1.1 菌株来源
收集2022年4月—2023年5月广州医科大学附属第一医院住院患者分离的对替加环素不敏感的MDR-AB(tigecycline insensitive multidrug-resistant Acinetobacter baumannii, TIS-MDR-AB)22株,并选取同一时期对替加环素敏感的22株MDR-AB(tigecycline sensitive multidrug-resistant Acinetobacter baumannii, TS-MDR-AB)作为研究对象。所有菌株经基质辅助激光解吸电离飞行时间(MALDI-TOF)质谱确定为AB。质控菌株为大肠埃希菌ATCC 25922。多重耐药定义为对三类或三类以上抗菌药物不敏感,且对这三类或三类以上抗菌药物中的每一类抗菌药物至少有一种药物获得性不敏感[6]。
1.2 药敏试验
应用VITEK 2 Compact全自动微生物鉴定药敏系统对所有菌株进行体外抗菌药物敏感性试验,采用微量肉汤稀释法测定替加环素的最低抑菌浓度(minimum inhibitory concentration, MIC)。替加环素MIC参照美国食品药品监督管理局(FDA)判读标准,头孢哌酮/舒巴坦的MIC值根据《CHINET中国细菌耐药监测网技术方案》(2022年版)进行判读,其他抗菌药物根据2022年美国临床实验室标准化协会(CLSI)标准进行药敏判断[7]。
1.3 外排泵抑制剂试验
通过微量肉汤稀释法测定加入10 μg/mL外排泵抑制剂羰基氰化物间氯苯腙(carbonyl cyanide m-chlorophenylhydrazone, CCCP)处理前后的MIC值,若CCCP存在时MIC值下降至原值的1/4或以下,则判定为外排泵表型阳性菌株。
1.4 聚合酶链式反应(PCR)扩增外排泵基因及替加环素耐药基因
采用煮沸法提取菌株DNA。刮取适量新鲜培养的菌落于加入200 μL无菌水的无菌管中,100 ℃煮沸10 min,12 000 r/min离心10 min,吸取上清液作为模板,-20℃保存备用。PCR引物由北京擎科生物科技股份有限公司合成,PCR反应试剂及2 000 bp DNA marker购自南京诺唯赞生物科技有限公司。PCR反应条件:预变性95℃ 3 min;变性95℃ 15 s,退火30 s,延伸72℃ 15 s,循环数35个;72℃彻底延伸5 min。取PCR扩增产物5 μL分别加入到2%琼脂糖凝胶电泳加样孔中,在120 V电压下电泳30 min,凝胶成像分析系统观察结果。相关引物见表 1。
表 1 外排泵基因的引物序列及扩增产物大小Table 1 Primer sequences and amplified product size of efflux pump genes基因名称 引物序列(5’—3’) 扩增产物大小(bp) 参考文献 adeB F: TTAACGATAGCGTTGTAACC 541 [8] R: TGAGCAGACAATGGAATAGT adeG F: TTCATCTAGCCAAGCAGAAG 652 [8] R: ATGTGGGCTAGCTAACGGC adeJ F: ATTGCACCACCAACCGTAAC 463 [8] R: TAGCTGGATCAAGCCAGATA tet(X) F: TTAGCCTTACCAATGGGTGT 243 [9] R: CAAATCTGCTGTTTCACTCG adeR F: ATGTTTGATCATTCTTTTTCTTTTG 876 [10] R: TAAATGACATAACCCAGT adeS F: AGCTGTAAAAGATGACGCCTAAATA 1 094 [10] R: ACTTTTCGAGCCTTGATTGCTATAT adeB-RT F: GAATAAGGCACCACAACAAT 124 [11] R: TTTCGCAATCAGTTGTTCCA adeG-RT F: ATCGCGTAGTCACCAGAACC 92 [11] R: CGTAACTATGCGGTGCTCAA adeJ-RT F: GAATGGACGTATGGTTCTCC 111 [11] R: CATTGCTTTCATGGCATCAC gyrB-RT F: GAGTCTAATGGCGGTGGTTC 110 [11] R: ATTGCTTCATCTGCTGGTTG 1.5 实时荧光定量PCR(RT-qPCR)检测外排泵表达水平
采用Trizol法分别提取AB标准菌株ATCC 19606、TIS-MDR-AB组、TS-MDR-AB组菌株对数生长期细菌总RNA。每20 μL反转录体系使用0.8 ng总RNA合成第1链cDNA,反应条件:37℃ 15 min,85℃ 5 s。采用RT-qPCR检测外排泵基因adeB、adeG和adeJ转录水平,高通量实时荧光定量PCR仪配套软件分析得到各个样本管家基因gyrB和Ct值,以管家基因gyrB为内参,标准菌株ATCC 19606为参考菌株,采用2-△△CT法计算各外排泵基因的相对表达量。相关引物见表 1。
1.6 双组份调节系统基因插入序列检测
对外排泵基因adeB表达水平升高的14株TIS-MDR-AB菌株,采用PCR对其adeR和adeS基因进行扩增,并将扩增产物送至深圳华大基因科技有限公司进行Sanger测序。应用Snapgene软件对获得的测序数据进行序列比对分析,并通过ISFinder数据库进行插入序列的查找与比对。
1.7 统计分析应用WHONET
5.6软件对药敏结果统计分析。应用SPSS 25.0版本软件包进行统计分析。符合正态分布的数据采用t检验或Fisher确切概率法进行连续变量的组间比较,不符合正态分布的数据采用非参数秩和检验进行组间比较。采用卡方检验进行分类变量的组间比较。应用Grapad prism 9.0软件对数据进行统计分析及作图。P≤0.05为差异具有统计学意义。
2. 结果
2.1 菌株分布
22株TIS-MDR-AB菌株分离自呼吸内科(10株)、重症监护病房(10株)及其他科室(2株)。22株TS-MDR-AB菌株分离自呼吸内科(4株)、重症监护病房(10株)、器官移植科(1株)、心脏外科(1株)、胸外科(1株)及其他科室(5株)。TIS-MDR-AB和TS-MDR-AB菌株主要从下呼吸道标本中分离(分别为20、19株),其他标本来源检出率较低。
2.2 体外药敏试验结果
22株TIS-MDR-AB菌株对米诺环素耐药率较低,对其他抗菌药物耐药率较高,所有菌株均对黏菌素敏感。见表 2。22株TIS-MDR-AB菌株对哌拉西林/他唑巴坦、头孢他啶、亚胺培南、美罗培南、阿米卡星、妥布霉素、左氧氟沙星及环丙沙星的耐药率均为100%。
表 2 TIS-MDR-AB对抗菌药物药敏试验结果[株(%)]Table 2 Antimicrobial susceptibility testing results of TIS-MDR-AB (No. of isolates [%])抗菌药物 敏感 中介 耐药 头孢吡肟 0(0) 2(9.1) 20(90.9) 头孢哌酮/舒巴坦 2(9.1) 3(13.6) 17(77.3) 米诺环素 3(13.6) 13(59.1) 6(27.3) 替加环素 0(0) 11(50.0) 11(50.0) 黏菌素 22(100) 0(0) 0(0) 2.3 外排泵基因检出情况
为探究外排泵基因的存在与替加环素耐药机制的关系,通过PCR技术检测外排泵基因在两组间的分布情况。22株TIS-MDR-AB中,adeB、adeG和adeJ的检出率均为100%。22株TS-MDR-AB中,adeJ检出率为100%,adeB、adeG检出率均为95.5%(各有1株菌未检出,分别为34号、166号)。两组均未检测到tet(X) 基因。见表 3。
表 3 MDR-AB菌株替加环素耐药基因检出情况[株(%)]Table 3 Detection results of tigecycline-resistant genes in MDR-AB strains (No. of isolates [%])基因 TIS-MDR-AB(n=22) TS-MDR-AB(n=22) P adeB 22(100) 21(95.5) 1.000 adeG 22(100) 21(95.5) 1.000 adeJ 22(100) 22(100) - tet(X) 0(0) 0(0) - 注:-表示数据不存在。 2.4 外排泵抑制试验结果
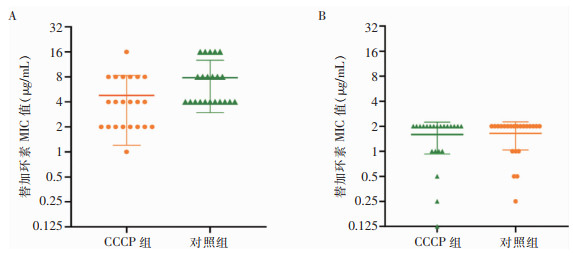
外排泵过度表达是导致替加环素耐药的原因之一,故使用外排泵抑制剂CCCP来探究外排泵对TIS-MDR-AB和TS-MDR-AB菌株的作用。结果显示,TIS-MDR-AB菌株加入CCCP后(CCCP组)MIC下降趋势明显,与不加CCCP时(对照组)的MIC值相比,差异具有统计学意义(P=0.001),且有3株菌株加入CCCP后的MIC值是不加CCCP时的1/4及以下,为外排泵表型阳性菌株。而TS-MDR-AB组在加入CCCP前后MIC无变化(P=0.066)。以上结果表明CCCP抑制剂能够降低替加环素对TIS-MDR-AB菌株的MIC值,菌株存在对替加环素的主动外排作用,见图 1。
2.5 RND外排泵表达情况
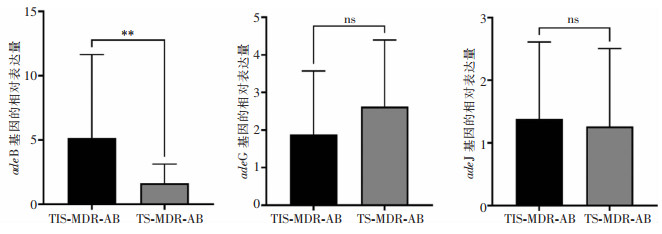
为证实外排泵的过度表达与替加环素的耐药机制有关,通过实时荧光定量PCR技术检测各外排泵基因mRNA的表达水平。在TIS-MDR-AB组中,不同菌株间的adeB表达水平差异明显,一些菌株的表达水平约是参考菌株ATCC 19606的21~25倍。与TS-MDR-AB组相比,TIS-MDR-AB组中adeB基因的mRNA表达水平增加,差异有统计学意义(P<0.01)。然而,adeG、adeJ的mRNA的表达水平在两组菌株间差异均无统计学意义(均P>0.05)。见图 2。
2.6 外排泵调控基因adeRS突变
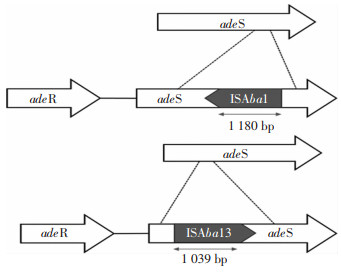
情况外排泵表达水平的高低受到上游双组份调节系统adeRS基因的调控,adeRS基因中存在突变或插入序列均可导致外排泵的高表达。因此,为探究adeB基因的过度表达是否与adeRS基因突变有关,通过Sanger测序检测外排泵基因adeB表达水平升高的14株TIS-MDR-AB菌株中adeRS基因的突变情况。与AB标准菌株ATCC 19606相比,adeR基因中V120I、A136V氨基酸取代存在于所有菌株(14株),D26G、R41Q各1株。adeS基因中,L172P、G186V、N268H、T303P和V348I氨基酸取代存在于所有菌株(14株),G319C取代存在于3株菌株,S136F、G103V、R313W各1株。见表 4。以上结果表明,adeS基因更易发生突变,且该院AB对替加环素的耐药性可能与上述adeR和adeS基因突变有关。
表 4 TIS-MDR-AB菌株外排泵调节基因氨基酸取代和插入情况Table 4 Amino acid substitution and insertion of efflux pump regulatory genes in TIS-MDR-AB strains菌株号 替加环素MIC(μg/mL) adeR adeS 1 8 V120I、A136V L172P、G186V、N268H、T303P、V348I 2 16 V120I、A136V L172P、G186V、N268H、T303P、V348I 3 8 V120I、A136V S136F、L172P、G186V、N268H、T303P、V348I、ISAba1 6 4 V120I、A136V L172P、G186V、N268H、T303P、V348I 9 8 V120I、A136V L172P、G186V、N268H、T303P、V348I、ISAba1 10 4 V120I、A136V L172P、G186V、N268H、T303P、V348I 82 16 V120I、A136V G103V、L172P、G186V、N268H、T303P、V348I 124 4 V120I、A136V L172P、G186V、N268H、T303P、V348I 162 8 V120I、A136V、D26G、R41Q L172P、G186V、N268H、T303P、R313W、V348I 167 4 V120I、A136V L172P、G186V、N268H、T303P、V348I 188 16 V120I、A136V L172P、G186V、N268H、T303P、G319C、V348I、ISAba13 207 16 V120I、A136V L172P、G186V、N268H、T303P、G319C、V348I、ISAba13 208 8 V120I、A136V L172P、G186V、N268H、T303P、G319C、V348I、ISAba13 90 4 V120I、A136V L172P、G186V、N268H、T303P、V348I 此外,14株TIS-MDR-AB菌株中3号和9号菌株在adeS基因的1 165 bp位置插入ISAba1,188号、207号和208号菌株在adeS基因的13 bp位置插入ISAba13,见图 3。
3. 讨论
近年来,AB耐药情况越来越严峻,使其成为临床治疗中难以应对的病原菌之一,给临床用药和医院感染带来了极大挑战。目前,替加环素因其具有广谱高效的体外抗菌活性,成为了治疗MDR-AB感染的有效药物之一[12]。在MDR-AB感染缺乏新型抗菌药物治疗的时代,探索替加环素耐药机制尤为重要。
研究[13]显示,RND外排泵过度表达在AB对替加环素耐药性中发挥着主要作用。CCCP是一种氧化磷酸化的解偶联剂[14],可以破坏细菌膜的质子梯度,从而抑制RND外排泵的功能[15]。本研究中,加入CCCP后,TIS-MDR-AB组替加环素MIC下降程度大于TS-MDR-AB组,表明阻断外排泵的激活可以有效降低替加环素MIC值,同时也提示,协同使用外排泵抑制剂可以有效抑制菌株的耐药性。TIS-MDR-AB组有36.4%(8/22)的分离株对CCCP抑制剂没有反应,这表明可能存在其他机制导致替加环素耐药。
RND家族主要由AdeABC、AdeFGH和AdeIJK组成,它们分别受adeRS双组份调控系统(TCS)、LysR型转录调节因子AdeL和TetR样转录调节因子adeN控制[16]。本研究发现TIS-MDR-AB菌株adeB、adeG和adeJ的检出率均为100%,但与替加环素敏感的菌株相比,替加环素不敏感菌株中adeB基因的转录水平上升,表明adeABC的高表达可能在替加环素耐药中起到了关键作用。
此外,所有菌株未检测到与质粒相关的tet(X)基因,表明该院尚不存在此类基因的流行现象。Tet(X)是一种黄素依赖性的单加氧酶,通过氧依赖性机制催化替加环素的裂解,较多出现于动物源性分离株。近年来,在中国[17]、非洲国家[18]发现了含有tet(X)及其变异体的临床分离株。尽管相关报道较少,但随着动物和人类中出现了此类可移动的替加环素耐药基因,提醒需要迫切监测tet(X)变异在临床替加环素耐药病原体中发生,以免造成暴发流行。
AdeR由一个跨膜传感器激酶和一个反应调节因子组成。在此系统中,组氨酸激酶AdeS感知环境刺激,而反应调节因子AdeR通过接收AdeS的磷酸化信号介导细胞反应,并进一步刺激其靶基因的表达[19]。本研究发现adeR基因中存在V120I、A136V、D26N和R41Q四种突变,其中V120I、A136V、D26N氨基酸取代在Li等[20]和Gerson等[21]研究中也有报道,其氨基酸取代可能与替加环素耐药性有关。此外,在更容易发生突变的adeS基因中,存在G103V、L172P、G186V、N268H等氨基酸取代,其他研究[8, 22-23]中亦有报道。以上结果表明该院AB对替加环素的耐药性可能与上述adeR和adeS基因突变有关。Sun等[24]研究证实发现,adeS中插入ISAba1可突变为1个N末端截短的adeS,截短的adeS能够激活adeR,并增强adeABC基因持续高表达,导致替加环素耐药。本研究也发现有2株分离株在adeS基因中插入了ISAba1。此外,发现有3株分离株在adeS基因中检测到ISAba13,这是首次在AB中观察到ISAba13插入adeS基因。
综上所述,本文研究了该院MDR-AB对替加环素耐药的机制,adeABC外排泵的过度表达及其调控系统内特定核苷酸替换和插入序列的存在可能是导致其耐药的机制之一。由于AB对替加环素的耐药机制十分复杂且多样,因此本研究的局限性在于未能探究外膜通透性蛋白PlsC和Abrp及替加环素作用靶点rpsJ和trm的改变是否在该院菌株替加环素耐药性中发挥重要作用,今后将更多地关注替加环素耐药的分子机制,为寻找新的治疗策略提供参考。
利益冲突:所有作者均声明不存在利益冲突。
-
表 1 外排泵基因的引物序列及扩增产物大小
Table 1 Primer sequences and amplified product size of efflux pump genes
基因名称 引物序列(5’—3’) 扩增产物大小(bp) 参考文献 adeB F: TTAACGATAGCGTTGTAACC 541 [8] R: TGAGCAGACAATGGAATAGT adeG F: TTCATCTAGCCAAGCAGAAG 652 [8] R: ATGTGGGCTAGCTAACGGC adeJ F: ATTGCACCACCAACCGTAAC 463 [8] R: TAGCTGGATCAAGCCAGATA tet(X) F: TTAGCCTTACCAATGGGTGT 243 [9] R: CAAATCTGCTGTTTCACTCG adeR F: ATGTTTGATCATTCTTTTTCTTTTG 876 [10] R: TAAATGACATAACCCAGT adeS F: AGCTGTAAAAGATGACGCCTAAATA 1 094 [10] R: ACTTTTCGAGCCTTGATTGCTATAT adeB-RT F: GAATAAGGCACCACAACAAT 124 [11] R: TTTCGCAATCAGTTGTTCCA adeG-RT F: ATCGCGTAGTCACCAGAACC 92 [11] R: CGTAACTATGCGGTGCTCAA adeJ-RT F: GAATGGACGTATGGTTCTCC 111 [11] R: CATTGCTTTCATGGCATCAC gyrB-RT F: GAGTCTAATGGCGGTGGTTC 110 [11] R: ATTGCTTCATCTGCTGGTTG 表 2 TIS-MDR-AB对抗菌药物药敏试验结果[株(%)]
Table 2 Antimicrobial susceptibility testing results of TIS-MDR-AB (No. of isolates [%])
抗菌药物 敏感 中介 耐药 头孢吡肟 0(0) 2(9.1) 20(90.9) 头孢哌酮/舒巴坦 2(9.1) 3(13.6) 17(77.3) 米诺环素 3(13.6) 13(59.1) 6(27.3) 替加环素 0(0) 11(50.0) 11(50.0) 黏菌素 22(100) 0(0) 0(0) 表 3 MDR-AB菌株替加环素耐药基因检出情况[株(%)]
Table 3 Detection results of tigecycline-resistant genes in MDR-AB strains (No. of isolates [%])
基因 TIS-MDR-AB(n=22) TS-MDR-AB(n=22) P adeB 22(100) 21(95.5) 1.000 adeG 22(100) 21(95.5) 1.000 adeJ 22(100) 22(100) - tet(X) 0(0) 0(0) - 注:-表示数据不存在。 表 4 TIS-MDR-AB菌株外排泵调节基因氨基酸取代和插入情况
Table 4 Amino acid substitution and insertion of efflux pump regulatory genes in TIS-MDR-AB strains
菌株号 替加环素MIC(μg/mL) adeR adeS 1 8 V120I、A136V L172P、G186V、N268H、T303P、V348I 2 16 V120I、A136V L172P、G186V、N268H、T303P、V348I 3 8 V120I、A136V S136F、L172P、G186V、N268H、T303P、V348I、ISAba1 6 4 V120I、A136V L172P、G186V、N268H、T303P、V348I 9 8 V120I、A136V L172P、G186V、N268H、T303P、V348I、ISAba1 10 4 V120I、A136V L172P、G186V、N268H、T303P、V348I 82 16 V120I、A136V G103V、L172P、G186V、N268H、T303P、V348I 124 4 V120I、A136V L172P、G186V、N268H、T303P、V348I 162 8 V120I、A136V、D26G、R41Q L172P、G186V、N268H、T303P、R313W、V348I 167 4 V120I、A136V L172P、G186V、N268H、T303P、V348I 188 16 V120I、A136V L172P、G186V、N268H、T303P、G319C、V348I、ISAba13 207 16 V120I、A136V L172P、G186V、N268H、T303P、G319C、V348I、ISAba13 208 8 V120I、A136V L172P、G186V、N268H、T303P、G319C、V348I、ISAba13 90 4 V120I、A136V L172P、G186V、N268H、T303P、V348I -
[1] Karageorgopoulos DE, Falagas ME. Current control and treatment of multidrug-resistant Acinetobacter baumannii infections[J]. Lancet Infect Dis, 2008, 8(12): 751-762. doi: 10.1016/S1473-3099(08)70279-2 [2] 郭燕, 胡付品, 朱德妹, 等. 2023年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2024, 24 (6): 627-637. Guo Y, Hu FP, Zhu DM, et al. Antimicrobial resistance profile of clinical isolates in hospitals across China: report from the CHINET antimicrobial resistance surveillance program, 2023[J]. Chinese Journal of Infection and Chemotherapy, 2024, 24 (6): 627-637. [3] Bauer G, Berens C, Projan SJ, et al. Comparison of tetracycline and tigecycline binding to ribosomes mapped by dimethylsulphate and drug-directed Fe2+ cleavage of 16S rRNA[J]. J Antimicrob Chemother, 2004, 53(4): 592-599. doi: 10.1093/jac/dkh125 [4] Someya Y, Yamaguchi A, Sawai T. A novel glycylcycline, 9-(N, N-dimethylglycylamido)-6-demethyl-6 -deoxytetracycline, is neither transported nor recognized by the transposon Tn10-encoded metal-tetracycline/H+antiporter[J]. Antimicrob Agents Chemother, 1995, 39(1): 247-249. doi: 10.1128/AAC.39.1.247 [5] Sun CL, Yu YS, Hua XT. Resistance mechanisms of tigecycline in Acinetobacter baumannii[J]. Front Cell Infect Microbiol, 2023, 13: 1141490. doi: 10.3389/fcimb.2023.1141490 [6] Magiorakos AP, Srinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance[J]. Clin Microbiol Infect, 2012, 18(3): 268-281. doi: 10.1111/j.1469-0691.2011.03570.x [7] CLSI. Performance standards for antimicrobial susceptibility testing: M100 32nd edition[S]. Malvern, PA, USA: CLSI, 2022. [8] Salehi B, Ghalavand Z, Yadegar A, et al. Characteristics and diversity of mutations in regulatory genes of resistance-nodulation-cell division efflux pumps in association with drug-resis-tant clinical isolates of Acinetobacter baumannii[J]. Antimicrob Resist Infect Control, 2021, 10(1): 53. doi: 10.1186/s13756-021-00924-9 [9] Ghalavand Z, Eslami G, Hashemi A, et al. Characterization of sequence types and mechanisms of resistance to tigecycline among Acinetobacter baumannii isolated from children[J]. Curr Microbiol, 2022, 79(9): 285. doi: 10.1007/s00284-022-02976-5 [10] 王健. 鲍曼不动杆菌对替加环素耐药机制的研究[D]. 合肥: 安徽医科大学, 2018. Wang J. Study on the mechanism of dug resistance to tigecycline in Acinetobacter baumannii[D]. Hefei: Anhui Medical University, 2018. [11] Foong WE, Wilhelm J, Tam HK, et al. Tigecycline efflux in Acinetobacter baumannii is mediated by TetA in synergy with RND-type efflux transporters[J]. J Antimicrob Chemother, 2020, 75(5): 1135-1139. doi: 10.1093/jac/dkaa015 [12] Sader HS, Flamm RK, Jones RN. Tigecycline activity tested against antimicrobial resistant surveillance subsets of clinical bacteria collected worldwide (2011)[J]. Diagn Microbiol Infect Dis, 2013, 76(2): 217-221. doi: 10.1016/j.diagmicrobio.2013.02.009 [13] Nowak J, Schneiders T, Seifert H, et al. The Asp20-to-Asn substitution in the response regulator AdeR leads to enhanced efflux activity of AdeB in Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2016, 60(2): 1085-1090. doi: 10.1128/AAC.02413-15 [14] Nakajima Y. Mechanisms of bacterial resistance to macrolide antibiotics[J]. J Infect Chemother, 1999, 5(2): 61-74. doi: 10.1007/s101560050011 [15] Park YK, Ko KS. Effect of carbonyl cyanide 3-chlorophenylhydrazone (CCCP) on killing Acinetobacter baumannii by colistin[J]. J Microbiol, 2015, 53(1): 53-59. doi: 10.1007/s12275-015-4498-5 [16] Xu C, Bilya SR, Xu W. adeABC efflux gene in Acinetobacter baumannii[J]. New Microbes New Infect, 2019, 30: 100549. doi: 10.1016/j.nmni.2019.100549 [17] Deng M, Zhu MH, Li JJ, et al. Molecular epidemiology and mechanisms of tigecycline resistance in clinical isolates of Acine- tobacter baumannii from a Chinese university hospital[J]. Antimicrob Agents Chemother, 2014, 58(1): 297-303. doi: 10.1128/AAC.01727-13 [18] Leski TA, Bangura U, Jimmy DH, et al. Multidrug-resistant tet(X)-containing hospital isolates in Sierra Leone[J]. Int J Antimicrob Agents, 2013, 42(1): 83-86. doi: 10.1016/j.ijantimicag.2013.04.014 [19] Groisman EA. Feedback control of two-component regulatory systems[J]. Annu Rev Microbiol, 2016, 70: 103-124. doi: 10.1146/annurev-micro-102215-095331 [20] Li HN, Wang XJ, Zhang YW, et al. The role of RND efflux pump and global regulators in tigecycline resistance in clinical Acinetobacter baumannii isolates[J]. Future Microbiol, 2015, 10(3): 337-346. doi: 10.2217/fmb.15.7 [21] Gerson S, Nowak J, Zander E, et al. Diversity of mutations in regulatory genes of resistance-nodulation-cell division efflux pumps in association with tigecycline resistance in Acinetobac-ter baumannii[J]. J Antimicrob Chemother, 2018, 73(6): 1501-1508. doi: 10.1093/jac/dky083 [22] Hornsey M, Ellington MJ, Doumith M, et al. AdeABC-media- ted efflux and tigecycline MICs for epidemic clones of Acinetobacter baumannii[J]. J Antimicrob Chemother, 2010, 65(8): 1589-1593. doi: 10.1093/jac/dkq218 [23] Sun JR, Jeng WY, Perng CL, et al. Single amino acid substitution Gly186Val in AdeS restores tigecycline susceptibility of Acinetobacter baumannii[J]. J Antimicrob Chemother, 2016, 71(6): 1488-1492. doi: 10.1093/jac/dkw002 [24] Sun JR, Perng CL, Chan MC, et al. A truncated AdeS kinase protein generated by ISAba1 insertion correlates with tigecycline resistance in Acinetobacter baumannii[J]. PLoS One, 2012, 7(11): e49534. doi: 10.1371/journal.pone.0049534

 下载:
下载: