Analysis on clinical efficacy and influencing factors based on omadacycline treatment
-
摘要:
目的 探讨奥马环素治疗感染性疾病的临床疗效及治疗效果的影响因素。 方法 回顾性分析2022年1月—2023年12月在中南大学湘雅医院接受奥马环素单药或联合治疗的住院患者资料。通过单因素分析和多因素logistic回归分析奥马环素治疗无效的影响因素。 结果 共纳入160例患者,总体治疗有效率为69.4%(111例)。经奥马环素治疗后,观察到治疗有效组患者体温好转[(36.83±0.52)℃ VS (37.85±0.92)℃,P < 0.001],白细胞计数[(7.78±4.07)×109/L VS (10.06±6.49)×109/L,P < 0.001]、降钙素原[(0.63±1.19)ng/mL VS (4.43±10.14)ng/mL,P=0.001)]、C反应蛋白[(35.16±37.82) mg/L VS (105.08±99.47)mg/L,P < 0.001]和天冬氨酸转氨酶[(50.50±40.04) U/L VS (77.17±91.43)U/L,P=0.004)]均显著下降。仅有1例患者出现腹泻等不良反应,但未中断治疗。单因素分析显示:治疗无效组患者急性生理与慢性健康评分(APACHE Ⅱ)[17.0(9.5~22.0) VS 12.0(9.0~19.0),P=0.046]和序贯器官衰竭评分(SOFA)[7.0(4.5~10.0) VS 4.0(2.0~9.0),P=0.019]更高。多因素分析显示:终末期肝病(OR=77.691,95%CI:5.448~1 107.880,P=0.001)、机械通气(OR=6.686,95%CI:1.628~27.452,P=0.008)及联合万古霉素治疗(OR=6.432,95%CI:1.891~21.874,P=0.003)是奥马环素治疗无效的危险因素;而奥马环素疗程(OR=0.905,95%CI:0.825~0.994,P=0.037)是治疗有效的保护因素。 结论 奥马环素可作为难治性严重感染的替代疗法,不良反应较少,终末期肝病、机械通气、联合万古霉素治疗是感染患者奥马环素治疗无效的危险因素,足够的奥马环素疗程可改善患者的临床结局,亟待大样本的病例研究来证实该结论。 Abstract:Objective To explore the clinical efficacy and influencing factors of omadacycline (OMC) in the treatment of patients with infectious diseases. Methods Data about hospitalized patients who received OMC monotherapy or combination therapy at Xiangya Hospital of Central South University from January 2022 to December 2023 were analyzed retrospectively. The influencing factors for failure of OMC treatment was analyzed by univariate and multivariate logistic regression analysis. Results A total of 160 patients were included in analysis, with an overall effective treatment rate of 69.4% (n=111). After treatment with OMC, patients in effective group was observed that body temperature improved ([36.83±0.52]℃ vs [37.85±0.92]℃, P < 0.001), white blood cell count ([7.78±4.07]×109/L vs [10.06±6.49]×109/L, P < 0.001), procalcitonin ([0.63±1.19] ng/mL vs [4.43±10.14] ng/mL, P=0.001), C-reactive protein ([35.16±37.82] mg/L vs [105.08±99.47] mg/L, P < 0.001), and aspartate aminotransferase ([50.50 ±40.04] U/L vs [77.17± 91.43] U/L, P=0.004) all decreased significantly. Only one patient had adverse reactions such as diarrhea, but treatment was not interrupted. Univariate ana-lysis showed that patients in failure treatment group had a higher acute physiology and chronic health evaluation Ⅱ (APACHE Ⅱ) score (17.0 [9.5-22.0] vs 12.0 [9.0-19.0], P=0.046) and sequential organ failure assessment (SOFA) score (7.0 [4.5-10.0] vs 4.0 [2.0-9.0], P=0.019). Multivariate analysis showed that end-stage liver disease (OR=77.691, 95%CI: 5.448-1 107.880, P=0.001), mechanical ventilation (OR=6.686, 95%CI: 1.628-27.452, P=0.008) and the combination treatment of vancomycin (OR=6.432, 95%CI: 1.891-21.874, P=0.003) were risk factors for the failure of OMC treatment, while the course of OMC treatment (OR=0.905, 95%CI: 0.825-0.994, P=0.037) was a protective factor for the effective treatment. Conclusion OMC can be used as an alternative therapy for refractory severe infection, with fewer adverse reaction. End-stage liver disease, mechanical ventilation and combination treatment of vancomycin are risk factors for failure of OMC treatment in infected patients. Adequate OMC treatment course can improve patients' clinical outcome, large-scale case studies are needed to confirm the initial conclusion. -
多重耐药菌如耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistant Acinetobacter baumannii, CRAB)、耐碳青霉烯类肠杆菌目(carbapenem-resistant Enterobacterales, CRE)、耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)和耐万古霉素屎肠球菌(vancomycin-resistant Enterococcus faecium, VAN-R-Efm),于2019年被美国疾病预防与控制中心列为“紧急和严重威胁”[1],可导致难治性感染性疾病,且显著增加患者器官功能障碍和死亡的风险[2]。多重耐药菌已成为妨碍21世纪全球医疗保健事业的主要危险。尽管现存多种高级别抗菌药物,如β-内酰胺类抗生素/β-内酰胺酶抑制剂(β-lactam and β-lactamase inhi-bitor, BLBLI)复方制剂、多黏菌素、碳青霉烯类、新型四环素衍生物和糖肽类抗生素等可治疗多重耐药菌引起的严重感染,但这些药物的敏感性正在下降[3]。
奥马环素(omadacycline)是国内首个获批上市的新型氨甲基四环素类药物,对临床常见的革兰阳性菌(Gram-positive bacteria, GPB)、革兰阴性菌(Gram-negative bacteria, GNB)、厌氧菌和非典型病原体均具有良好的抗菌活性[4],且不受任何已知的大环内酯类、四环素类或氟喹诺酮类抗菌药物耐药机制的影响[5]。奥马环素被批准用于治疗成人社区获得性细菌性肺炎(community-acquired bacte-rial pneumonia, CABP)与急性细菌性皮肤和皮肤结构感染(acute bacterial skin and skin structure infection, ABSSSI)[4]。在全球范围内,使用奥马环素治疗感染的临床实践经验不多,支持其疗效和安全性的临床数据有限。因此,本文对使用奥马环素治疗的病例进行回顾性分析,评估其疗效和安全性,探讨疗效不佳的影响因素。
1. 对象与方法
1.1 研究对象
2022年1月—2023年12月在中南大学湘雅医院因感染接受奥马环素单药或联合治疗至少72 h的住院患者。排除标准:①年龄<18岁;②用药疗程<72 h;③缺失重要的医疗记录(重复入院的患者,只纳入第一次接受奥马环素治疗的住院记录)。本研究经该院伦理委员会审批通过(伦理批号:202006081)。
1.2 资料收集
收集患者的基本信息、实验室指标、影像学表现、病原学结果及治疗转归等资料,分析奥玛环素治疗前后各项指标的差异。
1.3 疗效评价标准
按照临床疗效将患者分为治疗有效组和治疗无效组。根据《抗菌药物临床试验技术指导原则》[6],疗效评价按照临床治愈、临床改善和临床无效进行评定。临床有效包括临床治愈和临床改善,表现为治疗结束后,患者感染的症状、体征、影像学和实验室检验指标部分或完全恢复或改善,以及病原菌部分或完全清除;临床无效指治疗结束后,患者感染相关症状、体征持续或恶化或复发、原致病菌未清除,更换其他针对此感染的抗菌治疗措施,以及死亡、临终关怀或治疗中止。
1.4 微生物标本的检测
采集患者标本进行病原学培养检查。部分患者通过第二代基因组学测序(next-generation sequencing, NGS)检测病原学,作为对培养阴性患者的补充。
1.5 统计分析
应用SPSS软件进行统计分析。单样本K-S检验用于验证数据是否符合正态分布。正态分布连续性变量用均值±标准差(x ± s)表示,组间比较用独立样本t检验;非正态分布连续性变量采用中位数(四分位间距)[M(P25,P75)]表示,组间比较采用非参数Mann-Whitney U检验。分类变量采用卡方检验。将单变量分析中P<0.1的变量纳入二元logistic回归分析模型,比较P值,并列出优势比(OR)和相应的95%置信区间(95%CI)。采用配对样本t检验比较有效组治疗前后体温、炎症指标和肝功能变化,并应用GraphPad Prism 9软件绘制箱式图。以P≤0.05为差异具有统计学意义。
2. 结果
2.1 基本情况
共收集237例接受奥马环素治疗的住院患者。通过纳入与排除标准筛选后,最终有160例患者纳入分析。患者中位年龄(63.2±15.0)岁,116例(72.5%)男性;92.5%来源社区获得性感染。58例(36.3%)患者为多部位感染,最常见的感染部位是肺部感染(90.0%)。奥马环素治疗有效者111例(治疗有效组),治疗无效者49例(治疗无效组),总体治疗有效率为69.4%。治疗无效组患者更多的接受机械通气(69.4% VS 45.0%,P=0.004) 和血管活性药物治疗(65.3% VS 41.4%,P=0.005);具有更高的急性生理与慢性健康评分(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ) [17.0(9.5~22.0) VS 12.0(9.0~19.0),P=0.046] 和序贯器官衰竭评分(sequential organ failure assessment, SOFA)[7.0(4.5~10.0) VS 4.0(2.0~ 9.0),P=0.019],合并终末期肝病比例更高(16.3% VS 4.5%,P=0.027)。见表 1。
表 1 两组患者基线临床特征Table 1 Baseline clinical characteristics of two groups of patients变量 全部(n=160) 治疗有效组(n=111) 治疗无效组(n=49) t/χ2/z P 年龄(x±s,岁) 63.2±15.0 63.2±14.4 63.2±16.4 -0.004 0.997 男性[例(%)] 116(72.5) 79(71.2) 37(75.5) 0.321 0.571 医院获得性感染[例(%)] 12(7.5) 10(9.0) 2(4.1) 0.585 0.444 社区获得性感染[例(%)] 148(92.5) 101(91.0) 47(95.9) 0.585 0.444 住院时长[M(P25,P75),d] 19.0(12.0~35.0) 19.0(12.0~35.0) 22.0(12.5~35.5) -0.607 0.544 入住重症监护病房[例(%)] 99(61.9) 64(57.7) 35(71.4) 2.733 0.098 APACHE Ⅱ评分[M(P25,P75)] 14.0(9.0~20.0) 12.0(9.0~19.0) 17.0(9.5~22.0) -1.994 0.046 Charlson合并症指数[M(P25,P75)] 5.0(3.0~7.0) 5.0(3.0~7.0) 5.0(3.0~7.0) -0.403 0.687 SOFA评分[M(P25,P75)] 5.0(2.0~10.0) 4.0(2.0~9.0) 7.0(4.5~10.0) -2.341 0.019 合并症[例(%)] 多器官功能障碍综合征 17(10.6) 11(9.9) 6(12.2) 0.195 0.659 糖尿病 14(8.8) 11(9.9) 3(6.1) 0.228 0.633 终末期肝病 13(8.1) 5(4.5) 8(16.3) 4.879 0.027 终末期肾病 2(1.3) 1(0.9) 1(2.0) / 0.520 实体肿瘤 7(4.4) 7(6.3) 0(0) 1.900 0.168 血液肿瘤 5(3.1) 5(4.5) 0(0) 1.033 0.309 机械通气[例(%)] 84(52.5) 50(45.0) 34(69.4) 8.078 0.004 使用血管活性药物[例(%)] 78(48.8) 46(41.4) 32(65.3) 7.749 0.005 实验室指标 WBC[例(%),×109 /L] -0.288 0.774 <4 16(10.0) 11(9.9) 5(10.2) 4~10 79(49.4) 54(48.7) 25(51.0) >10 65(40.6) 46(41.4) 19(38.8) CRP[M(P25,P75),mg/L] 73.3(24.4~127.0) 76.5(29.1~116.0) 58.7(20.1~143.0) -0.599 0.549 PCT[例(%),ng/mL] -1.292 0.196 <0.05 7(4.4) 6(5.4) 1(2.0) 0.05~2.00 119(74.3) 77(69.4) 42(85.7) >2.00 34(21.3) 28(25.2) 6(12.3) 肌酐[M(P25,P75),μmol/L] 76.7(54.9~141.4) 76.0(51.9~143.1) 83.0(65.0~136.9) -1.078 0.281 ALT[M(P25,P75),U/L] 31.9(19.7~61.2) 32.9(19.8~71.3) 30.1(19.2~49.3) -0.979 0.327 AST[M(P25,P75),U/L] 42.1(24.3~70.8) 39.8(21.4~74.3) 46.7(27.2~67.6) -0.499 0.618 感染性休克[例(%)] 23(14.4) 12(10.8) 11(22.4) 3.741 0.053 脓毒症[例(%)] 63(39.4) 39(35.1) 24(49.0) 2.729 0.099 感染部位[例(%)] 多部位 58(36.3) 42(37.8) 16(32.7) 0.395 0.529 肺部 144(90.0) 103(92.8) 41(83.7) 2.210 0.137 皮肤和软组织 14(8.8) 11(9.9) 3(6.1) 0.228 0.633 腹腔 17(10.6) 12(10.8) 5(10.2) 0.013 0.909 尿路 24(15.0) 17(15.3) 7(14.3) 0.028 0.866 血流 15(9.4) 14(12.6) 1(2.0) 3.314 0.069 其他部位 12(7.5) 6(5.4) 6(12.2) 1.412 0.235 注:/为采用Fisher确切概率法,WBC为白细胞计数,CRP为C反应蛋白,PCT为降钙素原,AST为天冬氨酸转氨酶,ALT为丙氨酸转氨酶。 2.2 感染微生物学特征
160例患者中,65例(40.6%) 患者感染多重耐药菌。其中耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)感染17例(10.6%),CRAB感染46例(28.8%),MRSA感染4例(2.5%),衣原体、军团菌等非典型病原体感染7例(4.4%)。共检出病原体172株,其中最常见的是鲍曼不动杆菌(30.2%),其次是肺炎克雷伯菌(20.9%)。44例(27.5%)患者检出2种及以上的细菌,7例(4.4%)患者检出CRKP和CRAB,为合并感染。病原体标本来源构成比最高的是痰(40.1%)。治疗无效组患者鲍曼不动杆菌(45.3% VS 25.4%,P=0.015)及CRAB (42.9% VS 21.5%,P=0.007)检出率更高。见表 2。
表 2 两组患者分离病原菌及标本构成情况Table 2 Constituents of isolated pathogens and specimens in two groups of patients (No. of isolates [%])项目 全部(n=172) 治疗有效组(n=130) 治疗无效组(n=42) χ2 P 病原体分布[株(%)] 肺炎克雷伯菌 36(20.9) 28(21.5) 8(19.0) 0.119 0.730 CRKP 17(9.9) 14(10.8) 3(7.1) 0.150 0.699 鲍曼不动杆菌 52(30.2) 33(25.4) 19(45.3) 5.932 0.015 CRAB 46(26.7) 28(21.5) 18(42.9) 7.364 0.007 大肠埃希菌 4(2.3) 4(3.1) 0(0) / 0.573 嗜麦芽窄食单胞菌 11(6.4) 7(5.4) 4(9.5) 0.349 0.555 洋葱伯克霍尔德菌 8(4.7) 8(6.2) 0(0) 1.501 0.100 金黄色葡萄球菌 7(4.1) 6(4.6) 1(2.4) 0.035 0.851 MRSA 4(2.3) 4(3.1) 0(0) / 0.573 屎肠球菌 8(4.7) 6(4.6) 2(4.8) <0.001 1.000 衣原体 4(2.3) 4(3.1) 0(0) / 0.573 军团菌 3(1.7) 3(2.3) 0(0) / 1.000 其他病原体 39(22.7) 31(23.8) 8(19.0) 0.417 0.518 标本来源[株(%)] 痰 69(40.1) 56(43.1) 13(31.0) 1.943 0.163 支气管肺泡灌洗液 41(23.9) 27(20.8) 14(35.0) 3.385 0.066 血 20(11.6) 17(13.1) 3(7.1) 0.587 0.444 尿 16(9.3) 11(8.4) 5(11.9) 0.131 0.717 其他标本 26(15.1) 19(14.6) 7(6.3) 0.104 0.747 注:/为采用Fisher确切概率法。 2.3 治疗方案
64例(40.0%)为经验性使用奥马环素治疗,96例(60.0%)为目标性使用奥马环素治疗。96例目标性治疗的患者,其中30例(31.3%)因同时感染两种及以上病原体,35例(36.5%)因一线药物不耐受,31例(32.7%)因治疗效果不佳而选择奥马环素作为替代治疗;在选择奥马环素治疗之前,曾接受一线抗菌药物治疗,最常用的是碳青霉烯类(32.3%),其次是β-内酰胺类(24.0%)和替加环素(15.6%)。22例(13.8%)患者采用奥马环素单药治疗,138例(86.3%)患者采用联合治疗,最常联合β-内酰胺类(49.3%)。奥马环素治疗无效组更多地接受多黏菌素B(40.5% VS 17.7%,P=0.004) 或万古霉素(38.1% VS 14.6%,P=0.002)联合治疗;治疗有效患者接受了更长疗程的奥马环素治疗[8.0(5.0~12.0)d VS 7.0(5.0~9.0)d,P=0.019],哌拉西林/他唑巴坦药物暴露比率更高(18.8% VS 2.4%,P=0.010)。见表 3。
表 3 两组患者抗菌药物治疗情况Table 3 Antimicrobial treatment of two groups of patients治疗方案 全部(n=160) 治疗有效组(n=111) 治疗无效组(n=49) χ2/z P 基于奥马环素的经验性治疗[例(%)] 64(40.0) 41(36.9) 23(46.9) 1.417 0.234 基于奥马环素的联合治疗[例(%)] 138(86.3) 96(86.5) 42(85.7) 0.017 0.896 多黏菌素B 34(24.6) 17(17.7) 17(40.5) 8.157 0.004 碳青霉烯类 33(23.9) 23(24.0) 10(23.8) <0.001 0.985 β-内酰胺类 68(49.3) 51(53.1) 17(40.5) 1.870 0.171 哌拉西林/他唑巴坦 19(13.8) 18(18.8) 1(2.4) 6.594 0.010 头孢哌酮/舒巴坦 35(25.4) 26(27.1) 9(21.4) 0.494 0.482 头孢他啶/阿维巴坦 15(10.9) 9(9.4) 6(14.3) 0.309 0.578 氨基糖苷类 5(3.6) 5(5.2) 0(0) 1.023 0.312 左氧氟沙星 21(15.2) 15(15.6) 6(14.3) 0.041 0.840 万古霉素 30(21.7) 14(14.6) 16(38.1) 9.494 0.002 利奈唑胺 20(14.5) 13(13.5)) 7(16.7) 0.230 0.631 复方磺胺甲 
14(10.1) 8(8.3) 6(14.3) 0.577 0.448 奥马环素治疗前抗菌药物使用史[例(%)] 96(60.0) 69(62.2) 27(55.1) 0.706 0.401 多黏菌素B 3(3.1) 2(2.9) 1(3.7) / 1.000 碳青霉烯类 31(32.3) 21(30.4) 10(37.0) 0.387 0.534 β-内酰胺类 23(24.0) 18(26.1) 5(18.5) 0.610 0.435 喹诺酮类 5(5.2) 4(5.8) 1(3.7) <0.001 1.000 糖肽类 8(8.3) 6(8.7) 2(7.4) <0.001 1.000 利奈唑胺 12(12.5) 8(11.6) 4(14.8) 0.007 0.932 替加环素 15(15.6) 10(14.5) 5(18.5) 0.031 0.860 奥马环素疗程[M(P25,P75),d] 8.0(5.0~11.8) 8.0(5.0~12.0) 7.0(5.0~9.0) -2.350 0.019 注:/为采用Fisher确切概率法。 2.4 奥马环素治疗无效的风险因素分析
将单因素分析中P<0.1的17个变量纳入二元logistic回归模型进行多因素分析。结果显示,终末期肝病(OR=77.691,95%CI:5.448~1 107.880,P=0.001)、机械通气(OR=6.686,95%CI:1.628~27.452,P= 0.008)和与万古霉素联合治疗(OR=6.432,95%CI:1.891~21.874,P=0.003)是奥马环素治疗无效的危险因素,而用药疗程长(OR=0.905,95%CI:0.825~0.994,P=0.037)是奥马环素治疗有效的保护因素。见表 4。
表 4 奥马环素治疗无效的logistic多因素分析Table 4 Multivariate logistic analysis of failure of omadacycline treatment变量 β Sb Waldχ2 OR(95%CI) P 终末期肝病 4.353 1.356 10.306 77.691(5.448~1 107.880) 0.001 机械通气 1.900 0.721 6.952 6.686(1.628~27.452) 0.008 奥马环素+万古霉素联合治疗方案 1.861 0.625 8.882 6.432(1.891~21.874) 0.003 奥马环素疗程 -0.099 0.048 4.366 0.905(0.825~0.994) 0.037 2.5 疗效指标
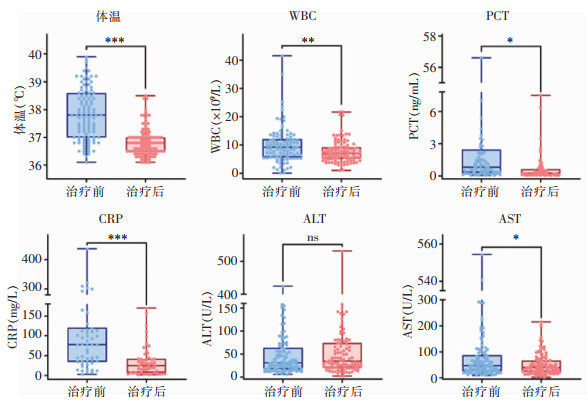
奥马环素治疗后,治疗有效组患者的体温[(36.83±0.52)℃ VS (37.85±0.92)℃]、WBC[(7.78±4.07)×109/L VS (10.06±6.49)×109/L]、PCT[(0.63±1.19)ng/mL VS (4.43± 10.14)]、CRP[(35.16±31.82)mg/L VS (105.08±99.47)mg/L]、AST[(50.50±40.04)U/L VS (77.17±91.43)U/L]均下降(均P < 0.05),ALT在治疗前后差异无统计学意义(P>0.05)。见图 1。
3. 讨论
目前全球范围内细菌耐药形势严峻,治疗药物选择有限。新型BLBLI复方制剂是目前治疗CRE的一线选择。当无法使用或无法耐受新型BLBLI复方制剂时,四环素类药物(替加环素和依拉环素)可作为替代治疗药物,而奥马环素并未提及[7]。奥马环素是一种新型氨甲基四环素类抗生素,于2018年10月获美国食品药品监督管理局(FDA)批准,随后于2021年12月在中国上市,适应证为成人CABP与ABSSSI[4]。奥马环素Ⅲ期临床试验结果表明,其早期临床应答率、治疗成功率以及微生物清除率均不劣于利奈唑胺[8-9]和莫西沙星[10]。国内一项多中心队列研究[11]结果显示,奥马环素对肺部感染的整体疗效优于美罗培南与利奈唑胺联合治疗方案,且有效率高达93.1%。本研究中奥马环素主要应用于多重耐药GPB、GNB和非典型病原体引起的严重感染患者。奥马环素针对鹦鹉热衣原体、嗜肺军团菌等非典型病原体的疗效显著,治疗有效率为100%(7/7),而其总体有效率为69.4%,低于既往研究[8-11]。究其原因,可能与纳入患者病情危重[APACHE Ⅱ评分14.0(9.0~20.0)和SOFA评分5.0(2.0~10.0)],基础疾病多[Charlson合并症指数5.0(3.0~7.0)]以及感染情况复杂有关。本研究中有近40%的患者表现为多部位感染并检出多种病原体混合感染,针对这些患者,选择奥马环素进行治疗,可同时覆盖GPB、GNB及非典型病原体,减少联合用药,降低抗菌药物使用强度,也减轻直接医疗成本。
本研究中60.0%的患者曾接受过β-内酰胺类、碳青霉烯类、替加环素、万古霉素、利奈唑胺或氟喹诺酮类等抗菌药物治疗,其中36.5%的患者对一线治疗不耐受,如合并MRSA感染的肾功能不全患者无法耐受万古霉素,使用利奈唑胺治疗后出现骨髓抑制,使用替加环素治疗后出现肝功能不全等,从而选择奥马环素作为替代治疗。本研究中炎症指标(WBC、PCT和CRP)在治疗后均有明显改善(均P<0.05),而治疗前后肝功能指标未见明显恶化(P>0.05),表明该药安全性尚可。Kovacs等[12]研究发现,肝功能损伤患者和健康受试者静脉注射或口服奥马环素后的体内药物暴露量接近,且肝功能损伤患者耐受性良好,无需调整奥马环素剂量。Zhu等[13]报道6例嗜肺军团菌肺炎患者经一线治疗出现肝功能异常后改用奥马环素治疗成功的案例。Cornely等[14]研究提示在肾功能轻、中度受损的患者中奥马环素也无需进行剂量调整。因此,对于肝、肾功能不全患者,奥马环素可能是一种安全且有效的替代药物。
本研究对奥马环素治疗效果进行多因素分析,确定了4个影响奥马环素治疗效果的独立因素:终末期肝病、机械通气、奥马环素与万古霉素联合治疗方案及奥马环素疗程。终末期肝病临床表现为肝功能严重受损和失代偿,合并感染后治疗选择受限且预后差、致死率高[15]。机械通气是呼吸衰竭患者常用的侵入性支持治疗手段之一,但其同时也会破坏人体的防御屏障,导致病原体感染风险增加,奥马环素治疗难度增大。本研究中采用奥马环素与万古霉素联合治疗方案的患者均入住重症监护病房(ICU),且中位APACHE Ⅱ评分[19.0(13.3~22.8) VS 14.0(9.0~20.0)]和多重耐药菌感染率(63.3% VS 40.6%)均高于总体中位水平,提示该部分患者基线病情更重,可能影响奥马环素抗感染疗效。本研究发现机械通气和奥马环素与万古霉素联合治疗方案是奥马环素治疗无效的独立危险因素。此外,疗程是奥马环素治疗有效的保护因素,提示充足的用药疗程对奥马环素治疗至关重要。既往分析替加环素治疗保护因素的研究也体现了长用药疗程的重要性[16]。目前研究尚未阐明联合治疗的必要性和标准的疗程。本研究中,单药或联合治疗、用药疗程根据说明书和治疗反应而定。在治疗由肠球菌引起的尿路感染、皮肤和软组织MRSA感染以及敏感的肺炎克雷伯菌肺部感染时,采用单药治疗方案。在治疗由多种细菌混合感染或多重耐药革兰阴性菌(如CRKP和CRAB)引起的严重感染时,奥马环素与多黏菌素B、碳青霉烯类和/或β-内酰胺类抗生素联合使用。在治疗由鹦鹉热衣原体或军团菌引起的严重肺部感染时,则单药或联合使用氟喹诺酮类抗菌药物。
本文存在一定的局限性。首先,为单中心回顾性设计,无法进行随机化分组,使得本研究存在结果偏差和不稳定性。其次,由于部分病例为NGS检出病原体,未进行药敏试验和耐药基因检测,缺乏针对病原体的耐药机制和不同抗菌药物的敏感性分析。最后,目前未有针对不同感染部位和严重程度的奥马环素疗程和剂量的明确指导。亟待更集中的大规模病例研究以探讨奥马环素的疗效和安全性。
综上所述,基于奥马环素的替代疗法可作为临床上难治性严重感染的一种选择,尤其是治疗由多重耐药菌和非典型病原体引起的多部位、多病原体合并感染患者和肝、肾功能不全的重症感染患者。治疗失败可能与患者感染严重、合并终末期肝病、用药时机较晚相关,足够的疗程可能是治疗有效的保证。
-
表 1 两组患者基线临床特征
Table 1 Baseline clinical characteristics of two groups of patients
变量 全部(n=160) 治疗有效组(n=111) 治疗无效组(n=49) t/χ2/z P 年龄(x±s,岁) 63.2±15.0 63.2±14.4 63.2±16.4 -0.004 0.997 男性[例(%)] 116(72.5) 79(71.2) 37(75.5) 0.321 0.571 医院获得性感染[例(%)] 12(7.5) 10(9.0) 2(4.1) 0.585 0.444 社区获得性感染[例(%)] 148(92.5) 101(91.0) 47(95.9) 0.585 0.444 住院时长[M(P25,P75),d] 19.0(12.0~35.0) 19.0(12.0~35.0) 22.0(12.5~35.5) -0.607 0.544 入住重症监护病房[例(%)] 99(61.9) 64(57.7) 35(71.4) 2.733 0.098 APACHE Ⅱ评分[M(P25,P75)] 14.0(9.0~20.0) 12.0(9.0~19.0) 17.0(9.5~22.0) -1.994 0.046 Charlson合并症指数[M(P25,P75)] 5.0(3.0~7.0) 5.0(3.0~7.0) 5.0(3.0~7.0) -0.403 0.687 SOFA评分[M(P25,P75)] 5.0(2.0~10.0) 4.0(2.0~9.0) 7.0(4.5~10.0) -2.341 0.019 合并症[例(%)] 多器官功能障碍综合征 17(10.6) 11(9.9) 6(12.2) 0.195 0.659 糖尿病 14(8.8) 11(9.9) 3(6.1) 0.228 0.633 终末期肝病 13(8.1) 5(4.5) 8(16.3) 4.879 0.027 终末期肾病 2(1.3) 1(0.9) 1(2.0) / 0.520 实体肿瘤 7(4.4) 7(6.3) 0(0) 1.900 0.168 血液肿瘤 5(3.1) 5(4.5) 0(0) 1.033 0.309 机械通气[例(%)] 84(52.5) 50(45.0) 34(69.4) 8.078 0.004 使用血管活性药物[例(%)] 78(48.8) 46(41.4) 32(65.3) 7.749 0.005 实验室指标 WBC[例(%),×109 /L] -0.288 0.774 <4 16(10.0) 11(9.9) 5(10.2) 4~10 79(49.4) 54(48.7) 25(51.0) >10 65(40.6) 46(41.4) 19(38.8) CRP[M(P25,P75),mg/L] 73.3(24.4~127.0) 76.5(29.1~116.0) 58.7(20.1~143.0) -0.599 0.549 PCT[例(%),ng/mL] -1.292 0.196 <0.05 7(4.4) 6(5.4) 1(2.0) 0.05~2.00 119(74.3) 77(69.4) 42(85.7) >2.00 34(21.3) 28(25.2) 6(12.3) 肌酐[M(P25,P75),μmol/L] 76.7(54.9~141.4) 76.0(51.9~143.1) 83.0(65.0~136.9) -1.078 0.281 ALT[M(P25,P75),U/L] 31.9(19.7~61.2) 32.9(19.8~71.3) 30.1(19.2~49.3) -0.979 0.327 AST[M(P25,P75),U/L] 42.1(24.3~70.8) 39.8(21.4~74.3) 46.7(27.2~67.6) -0.499 0.618 感染性休克[例(%)] 23(14.4) 12(10.8) 11(22.4) 3.741 0.053 脓毒症[例(%)] 63(39.4) 39(35.1) 24(49.0) 2.729 0.099 感染部位[例(%)] 多部位 58(36.3) 42(37.8) 16(32.7) 0.395 0.529 肺部 144(90.0) 103(92.8) 41(83.7) 2.210 0.137 皮肤和软组织 14(8.8) 11(9.9) 3(6.1) 0.228 0.633 腹腔 17(10.6) 12(10.8) 5(10.2) 0.013 0.909 尿路 24(15.0) 17(15.3) 7(14.3) 0.028 0.866 血流 15(9.4) 14(12.6) 1(2.0) 3.314 0.069 其他部位 12(7.5) 6(5.4) 6(12.2) 1.412 0.235 注:/为采用Fisher确切概率法,WBC为白细胞计数,CRP为C反应蛋白,PCT为降钙素原,AST为天冬氨酸转氨酶,ALT为丙氨酸转氨酶。 表 2 两组患者分离病原菌及标本构成情况
Table 2 Constituents of isolated pathogens and specimens in two groups of patients (No. of isolates [%])
项目 全部(n=172) 治疗有效组(n=130) 治疗无效组(n=42) χ2 P 病原体分布[株(%)] 肺炎克雷伯菌 36(20.9) 28(21.5) 8(19.0) 0.119 0.730 CRKP 17(9.9) 14(10.8) 3(7.1) 0.150 0.699 鲍曼不动杆菌 52(30.2) 33(25.4) 19(45.3) 5.932 0.015 CRAB 46(26.7) 28(21.5) 18(42.9) 7.364 0.007 大肠埃希菌 4(2.3) 4(3.1) 0(0) / 0.573 嗜麦芽窄食单胞菌 11(6.4) 7(5.4) 4(9.5) 0.349 0.555 洋葱伯克霍尔德菌 8(4.7) 8(6.2) 0(0) 1.501 0.100 金黄色葡萄球菌 7(4.1) 6(4.6) 1(2.4) 0.035 0.851 MRSA 4(2.3) 4(3.1) 0(0) / 0.573 屎肠球菌 8(4.7) 6(4.6) 2(4.8) <0.001 1.000 衣原体 4(2.3) 4(3.1) 0(0) / 0.573 军团菌 3(1.7) 3(2.3) 0(0) / 1.000 其他病原体 39(22.7) 31(23.8) 8(19.0) 0.417 0.518 标本来源[株(%)] 痰 69(40.1) 56(43.1) 13(31.0) 1.943 0.163 支气管肺泡灌洗液 41(23.9) 27(20.8) 14(35.0) 3.385 0.066 血 20(11.6) 17(13.1) 3(7.1) 0.587 0.444 尿 16(9.3) 11(8.4) 5(11.9) 0.131 0.717 其他标本 26(15.1) 19(14.6) 7(6.3) 0.104 0.747 注:/为采用Fisher确切概率法。 表 3 两组患者抗菌药物治疗情况
Table 3 Antimicrobial treatment of two groups of patients
治疗方案 全部(n=160) 治疗有效组(n=111) 治疗无效组(n=49) χ2/z P 基于奥马环素的经验性治疗[例(%)] 64(40.0) 41(36.9) 23(46.9) 1.417 0.234 基于奥马环素的联合治疗[例(%)] 138(86.3) 96(86.5) 42(85.7) 0.017 0.896 多黏菌素B 34(24.6) 17(17.7) 17(40.5) 8.157 0.004 碳青霉烯类 33(23.9) 23(24.0) 10(23.8) <0.001 0.985 β-内酰胺类 68(49.3) 51(53.1) 17(40.5) 1.870 0.171 哌拉西林/他唑巴坦 19(13.8) 18(18.8) 1(2.4) 6.594 0.010 头孢哌酮/舒巴坦 35(25.4) 26(27.1) 9(21.4) 0.494 0.482 头孢他啶/阿维巴坦 15(10.9) 9(9.4) 6(14.3) 0.309 0.578 氨基糖苷类 5(3.6) 5(5.2) 0(0) 1.023 0.312 左氧氟沙星 21(15.2) 15(15.6) 6(14.3) 0.041 0.840 万古霉素 30(21.7) 14(14.6) 16(38.1) 9.494 0.002 利奈唑胺 20(14.5) 13(13.5)) 7(16.7) 0.230 0.631 复方磺胺甲 
14(10.1) 8(8.3) 6(14.3) 0.577 0.448 奥马环素治疗前抗菌药物使用史[例(%)] 96(60.0) 69(62.2) 27(55.1) 0.706 0.401 多黏菌素B 3(3.1) 2(2.9) 1(3.7) / 1.000 碳青霉烯类 31(32.3) 21(30.4) 10(37.0) 0.387 0.534 β-内酰胺类 23(24.0) 18(26.1) 5(18.5) 0.610 0.435 喹诺酮类 5(5.2) 4(5.8) 1(3.7) <0.001 1.000 糖肽类 8(8.3) 6(8.7) 2(7.4) <0.001 1.000 利奈唑胺 12(12.5) 8(11.6) 4(14.8) 0.007 0.932 替加环素 15(15.6) 10(14.5) 5(18.5) 0.031 0.860 奥马环素疗程[M(P25,P75),d] 8.0(5.0~11.8) 8.0(5.0~12.0) 7.0(5.0~9.0) -2.350 0.019 注:/为采用Fisher确切概率法。 表 4 奥马环素治疗无效的logistic多因素分析
Table 4 Multivariate logistic analysis of failure of omadacycline treatment
变量 β Sb Waldχ2 OR(95%CI) P 终末期肝病 4.353 1.356 10.306 77.691(5.448~1 107.880) 0.001 机械通气 1.900 0.721 6.952 6.686(1.628~27.452) 0.008 奥马环素+万古霉素联合治疗方案 1.861 0.625 8.882 6.432(1.891~21.874) 0.003 奥马环素疗程 -0.099 0.048 4.366 0.905(0.825~0.994) 0.037 -
[1] Centers for Disease Control and Prevention. Antibiotic resis-tance threats in the United States, 2019[EB/OL]. (2019-11-01)[2022-08-20]. https://stacks.cdc.gov/view/cdc/82532. [2] Cassini A, Högberg LD, Plachouras D, et al. Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis[J]. Lancet Infect Dis, 2019, 19(1): 56-66. doi: 10.1016/S1473-3099(18)30605-4 [3] Cars O, Chandy SJ, Mpundu M, et al. Resetting the agenda for antibiotic resistance through a health systems perspective[J]. Lancet Glob Health, 2021, 9(7): e1022-e1027. doi: 10.1016/S2214-109X(21)00163-7 [4] Kounatidis D, Dalamaga M, Grivakou E, et al. Third-generation tetracyclines: current knowledge and therapeutic potential[J]. Biomolecules, 2024, 14(7): 783. doi: 10.3390/biom14070783 [5] Dong D, Zheng YG, Chen QQ, et al. In vitro activity of oma-dacycline against pathogens isolated from Mainland China during 2017-2018[J]. Eur J Clin Microbiol Infect Dis, 2020, 39(8): 1559-1572. doi: 10.1007/s10096-020-03877-w [6] 《抗菌药物临床试验技术指导原则》写作组. 抗菌药物临床试验技术指导原则附件: 抗菌药物立题原则建议[J]. 中国临床药理学杂志, 2014, 30(9): 857-858. Writing Group of Guidance for clinical trials of anti-bacterial drugs, China Food and Drug Administration. Guidance for clinical trials of anti-bacterial drugs appendix: antimicrobial reference principle suggestion[J]. The Chinese Journal of Clinical Pharmacology, 2014, 30(9): 857-858. [7] Tamma PD, Aitken SL, Bonomo RA, et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing Enterobacterales (ESBL-E), carbapenem-resistant Enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa)[J]. Clin Infect Dis, 2022, 75(2): 187-212. doi: 10.1093/cid/ciac268 [8] O'Riordan W, Green S, Overcash JS, et al. Omadacycline for acute bacterial skin and skin-structure infections[J]. N Engl J Med, 2019, 380(6): 528-538. doi: 10.1056/NEJMoa1800170 [9] O'Riordan W, Cardenas C, Shin E, et al. Once-daily oral oma- dacycline versus twice-daily oral linezolid for acute bacterial skin and skin structure infections (OASIS-2): a phase 3, double-blind, multicentre, randomised, controlled, non-infe-riority trial[J]. Lancet Infect Dis, 2019, 19(10): 1080-1090. doi: 10.1016/S1473-3099(19)30275-0 [10] Stets R, Popescu M, Gonong JR, et al. Omadacycline for community-acquired bacterial pneumonia[J]. N Engl J Med, 2019, 380(6): 517-527. doi: 10.1056/NEJMoa1800201 [11] 史海燕, 胡英, 黄建荣, 等. 奥马环素对比美罗培南联合利奈唑胺治疗肺部感染: 一项真实世界队列研究[J]. 中华临床感染病杂志, 2023, 16(3): 210-214. doi: 10.3760/cma.j.issn.1674-2397.2023.03.008 Shi HY, Hu Y, Huang JR, et al. Comparison of omadacycline and meropenem plus linezolid in treatment of pulmonary infection: a real-world cohort study[J]. Chinese Journal of Clinical Infectious Diseases, 2023, 16(3): 210-214. doi: 10.3760/cma.j.issn.1674-2397.2023.03.008 [12] Kovacs SJ, Ting L, Praestgaard J, et al. An open-label study of the impact of hepatic impairment on the pharmacokinetics and safety of single oral and intravenous doses of omadacycline[J]. Antimicrob Agents Chemother, 2020, 64(11): e01650-20. [13] Zhu A, Ma Q, Liu ZY. Omadacycline for the treatment of patients with Legionella pneumophila pneumonia after experiencing liver dysfunction: case series[J]. Front Microbiol, 2024, 15: 1408443. doi: 10.3389/fmicb.2024.1408443 [14] Cornely OA, File TM Jr, Garrity-Ryan L, et al. Safety and efficacy of omadacycline for treatment of community-acquired bacterial pneumonia and acute bacterial skin and skin structure infections in patients with mild-to-moderate renal impairment[J]. Int J Antimicrob Agents, 2021, 57(2): 106263. doi: 10.1016/j.ijantimicag.2020.106263 [15] Wong F, Piano S, Singh V, et al. Clinical features and evolution of bacterial infection-related acute-on-chronic liver failure[J]. J Hepatol, 2021, 74(2): 330-339. doi: 10.1016/j.jhep.2020.07.046 [16] 冯绪强, 高萍, 孙超, 等. 替加环素治疗感染性疾病临床疗效及影响因素[J/OL]. 山东大学学报(医学版). (2024-06-15)[2024-07-20]. http://kns.cnki.net/kcms/detail/37.1390.R.20240614.1642.006.html. Feng XQ, Gao P, Sun C, et al. Clinical efficacy and influencing factors of tigecycline in treatment of infectious diseases[J/OL]. Journal of Shandong University (Health Sciences). (2024-06-15)[2024-07-20]. http://kns.cnki.net/kcms/detail/37.1390.R.20240614.1642.006.html.

 下载:
下载:
