2. 浙江医院医院感染管理科,浙江 杭州 310058;
3. 浙江医院微生物实验室,浙江 杭州 310058;
4. 浙江省疾病预防控制中心免疫规划所,浙江 杭州 310052
2. Department of Healthcare-associa-ted Infection Management, Zhejiang Hospital, Hangzhou 310058, China;
3. Microbiology Laboratory, Zhejiang Hospital, Hangzhou 310058, China;
4. Immunization Program Institute, Zhejiang Provincial Center for Disease Control and Prevention, Hangzhou 310052, China
医院感染(healthcare-associated infection, HAI)是目前医疗机构面临的重大公共卫生问题之一,其发生对患者生命质量产生严重影响,并给医疗机构与公共卫生系统带来巨大压力[1-3]。根据世界卫生组织(WHO)的报告,每100例住院患者中有7~15例患者在住院期间至少发生一种HAI,而每10例受影响的患者中将有1例死于HAI[4]。研究[5-9]表明,医院内的多种环境因素,包括工作人员的手、高频接触物体表面(high-touch surface, HTS)、医疗设备以及供水系统等,都可能成为多种病原体的潜在贮存库。如ESKAPE病原体[10]及艰难梭菌(Clostridioides difficile)均能够在医疗环境中长时间存活,一旦这些病原体形成生物膜并大量增殖,可能进一步引发HAI暴发。虽然国内外文献与指南[11-12]提出了感染防控的推荐措施,以帮助医疗机构预防HAI,但医疗环境中实际的微生物负荷仍不确切,描述环境微生物负荷与HAI发生关系的研究方法和证据相对欠缺[13-14],因此迫切需要通过定量分析的方法对两者关系加以明确。
鉴于环境微生物负荷对HAI的效应存在复杂的非线性关系,本研究采用广义相加模型(genera-lized additive model, GAM)进行建模分析。GAM最初由Hastie T.和Tibshirani R.开发[15],是一种灵活的非参数回归方法,可有效捕捉线性和非线性的动态并且建模。目前GAM较多应用于大气污染物对人体健康影响的研究[16],本研究首次将该模型引入医疗机构环境因素与HAI的相关性研究中,旨在阐明医疗环境的细菌负荷对HAI发生风险的影响,从而为HAI预防与控制方案提供数据驱动的科学依据。
1 对象与方法 1.1 研究对象回顾性选取2018年1月1日—2022年12月31日杭州市某综合性三甲医院全部265 616例住院患者为研究对象。另回顾性收集同时期该院15 461份环境卫生学监测标本为研究对象,包括工作人员手、HTS、空气、水、医疗器械与医用织物。
1.2 研究方法 1.2.1 资料收集方法HAI的诊断标准依据卫生部2001年颁发的《医院感染诊断标准(试行)》执行[17]。该医院自2018年1月1日启用医院感染实时监控系统(nosocomial infection surveillance system, NISS),以实现对住院患者HAI情况的前瞻性监测。NISS自动收集和记录HAI关键结构化数据,包括HAI患者的人口学特征、感染部位、感染发生时间、感染发生科室、感染转归情况、感染转归时间、是否为新发HAI、是否为手术部位感染以及实验室检出感染病原菌等。此外,NISS配备了HAI疑似病例提醒功能,当系统未能自动筛查出潜在HAI病例或临床医生主动报告了系统未捕获的HAI病例时,此类疑似病例将由专职HAI监测人员进一步审查和确认。NISS通过住院患者的HAI临床数据建立感染信息数据库(nosocomial infection surveillance database, NISD)。本研究通过NISD获取HAI病例结构化数据,包括HAI患者的性别、年龄、住院时长以及入住病房。
本研究还通过该院环境卫生学专家系统(environmental hygiene expert system, EHES)获取环境卫生学监测数据。监测数据的范围覆盖该院所有病房,包括综合重症监护病房(ICU)、内科病房与外科病房,共28个医疗单元。同时还纳入手术中心、血液净化中心、内镜中心、静脉用药调配中心(pharmacy intravenous admixture service, PIVAS)、消毒供应中心(central sterile supply department, CSSD)等17个HAI重点监测单元。环境监测数据的类别包括:工作人员手(CFU/cm2)、HTS(CFU/cm2)、空气(CFU/90 mm皿×5 min)、水(CFU/mL)、医疗器械(CFU/件)以及医用织物(CFU/100 cm2)菌落数。以上所有监测数据由该院感染预防与控制(IPC)专业团队收集,数据收集过程严格遵循保密原则,调查完成后由专人负责数据审核与存储。
1.2.2 环境标本采集、培养与菌落计数方法本研究中所有环境标本采样方法严格遵循《医院消毒卫生标准》(GB 15982—2012)执行(以下简称GB 15982)[18]。由该院IPC团队通过EHES建立基于GB 15982的医院内环境卫生学监测框架,其中包括监测点、监测频率、监测内容、采样方法、合格标准等关键要素的设定。由采样人员根据EHES内预先设定的监测计划(包括常规监测与随机抽检),定期从监测单元采集环境标本。EHES会通过信息界面自动提醒采样人员执行监测任务,确保任务的全面执行。为避免重复与遗漏,每个标本都由系统生成唯一标识码,并由检验人员在EHES的标本入库接口进行扫描与确认。
1.2.2.1 工作人员手标本根据环境监测计划,采样人员每月系统性收集工作人员手微生物标本。手标本月度常规监测计划涵盖洁净手术室、非洁净手术室、综合ICU、内科病房、外科病房等30个监测点,月度标本总数为40份。随机抽检策略为每月在以上监测点中随机选取,采集1~10份标本进行检验。采样人员于采样对象手卫生后进行标本采集,采样对象包括医生、护士、医技人员,以及护理员和卫生员等后勤人员。手卫生操作严格按照《医务人员手卫生规范》(WS/T 313—2019)执行(以下简称WS/T 313)[19],包括:(1)卫生手消毒(antiseptic handrubbing, AH)。采样对象使用抗菌洗手液(杭州朗索医用消毒剂有限公司),按七步洗手法清洗双手,然后再进行卫生手消毒。(2)外科手消毒(surgical hand antisepsis, SHA)。完成(1)中的步骤后继续执行外科免冲洗手消毒步骤。采样操作严格按照GB 15982中附录A.4执行。
1.2.2.2 HTS标本HTS标本月度常规监测计划涵盖洁净手术室、非洁净手术室、综合ICU、内科病房、外科病房、血液净化中心、CSSD等,共17个监测点,月度标本总数为35份。随机抽检策略同工作人员手标本。采样对象包括:床栏、床头柜、门把手、电话机、电脑键盘与鼠标、水龙头开关、移动护理车等手频繁接触的物体表面。潜在污染区与污染区的HTS标本均在消毒后采集。清洁区的高频接触标本均在清洁后采集(无肉眼可见污染)。采样操作严格按照GB 15982中附录A.3执行。
1.2.2.3 空气、水、医疗器械与医用织物标本(1) 空气:月度常规监测计划涵盖洁净手术室、非洁净手术室、血液净化中心、PIVAS、CSSD、综合ICU、内科病房、外科病房等,共40个监测点,月度标本总数为80份。随机抽检策略同工作人员手标本。空气标本通过被动方法(沉降法)采集,采样操作严格按照GB 15982中附录A.2执行。(2)水:月度常规监测计划涵盖手术中心、血液净化中心、内镜中心、CSSD、综合ICU等10个监测点,月度标本总数为40份。随机抽检策略同工作人员手标本。采样对象包括饮用水源和纯化水源,饮用水源位于监测点的饮水间,纯化水源位于手术中心、血液净化中心、内镜中心与CSSD。采样操作严格按照GB 15982中附录A.7执行。(3)医疗器械:月度常规监测计划涵盖内镜中心、CSSD、综合ICU等11个监测点,月度标本总数为30份。随机抽检策略同工作人员手标本。采样对象包括,①一般医疗器械:听诊器、血压计、呼吸球囊、呼吸机回路、止血带、剪刀、镊子、超声探头等。②内镜:纤维支气管镜、十二指肠镜、胃镜与结肠镜。医疗器械经消毒或灭菌处理后,在规定有效期内采用无损采样技术采集标本,采样操作严格参照GB 15982中附录A.5执行。(4)医用织物:月度常规监测计划涵盖织物库房、地巾清洗消毒中心、综合ICU、内科病房及外科病房,共5个监测点,月度标本总数为5份。随机抽检策略同工作人员手标本。采样对象包括清洗消毒后的患者服、床单、枕套、床帘、地巾和抹布。采样操作严格参照GB 15982中附录A.3执行。
以上所有采样过程中,采样人员均严格遵守手卫生规范与无菌采样技术。所有培养皿均在(36±1)℃下培养48 h后,由2名独立的微生物学专家进行常规人工计数。根据Brugger等[20]的方法,对于超过300 CFU的平板,计数程序包括将平板分成相等的扇区(从1/2至1/8),对单个扇区进行计数后,通过将其乘以扇区数量来推断总计数,从而估计整个平板的总菌落数。由2名独立的微生物实验室工作人员将菌落计数结果录入EHES,并进行交叉核对。本研究中纳入所有环境标本均严格排除了污染标本与对照组阳性标本。
1.3 统计学方法本研究采纳了定量微生物学分析技术,通过每月采集的培养皿内检测到的菌落总数,计算出月度平均菌落形成单位(mean colony-forming unit per dish, MCFU/Dish)。进一步将MCFU/Dish转换为6类特定环境度量单位下的菌落数,包括CFU/cm2(工作人员手与HTS)、CFU/90 mm皿×5 min(空气)、CFU/mL(水)、CFU/件(医疗器械)以及CFU/100 cm2(医用织物),具体计算公式参照GB 15982执行。描述性统计指标包括均数、标准差、中位数、最大值、最小值与四分位数间距(inter-quartile range, IQR),用于描述月度MCFU/Dish与月度HAI发生频数的集中趋势与离散趋势。采用Kolmogorov-Smirnov Test对月度HAI发生例数的分布进行描述。采用Spearman相关分析对MCFU/Dish与月度HAI发生例数之间的相关性进行检验。建立GAM模型以评估环境检出菌落数对HAI的影响。选择Log链接作为链接函数。使用样条函数(P-splines)[21]来控制时间序列中的长期趋势、季节效应及其他可能与时间相关的混杂变异因素。同时分析不同亚组,以及滞后0~6个月(lag0~lag6)的滞后效应,选择最大效应值的滞后月数,计算超额风险(excess risk, ER)。模型基本公式如下:
| $ \log \left[E\left(Y_t\right)\right]=\beta_0+\beta_1 X_t+s({month}, df)+\varepsilon $ |
Log[E(Yt)]为链接函数,E(Yt)为第t月医院感染发生数的期望值;β1是估计系数;Xt表示第t月环境平均菌落数;s(month, df)表示长期趋势的平滑函数,month是时间变量,df是自由度;β0是截距项;ε是误差项。本模型通过广义交叉验证(gene-ralized cross-validation, GCV)来实现最优自由度。应用R软件(version 4.3.1)进行统计建模与数据分析。P≤0.05为差异具有统计学意义。
2 结果 2.1 HAI发生情况与环境细菌负荷2018年1月1日—2022年12月31日该院265 616例住院患者中共发生3 097例HAI,平均每月52例,期间总发病率为1.17%。其中男性占60.19%,年龄≥65岁占67.94%,住院时长<30 d占58.85%,入住内科病房占58.90%。HAI月度发生频数的基线特征见表 1。
| 表 1 HAI月度发生频数的描述性统计(例) Table 1 Descriptive statistics of monthly occurrence frequency of HAI (Case) |
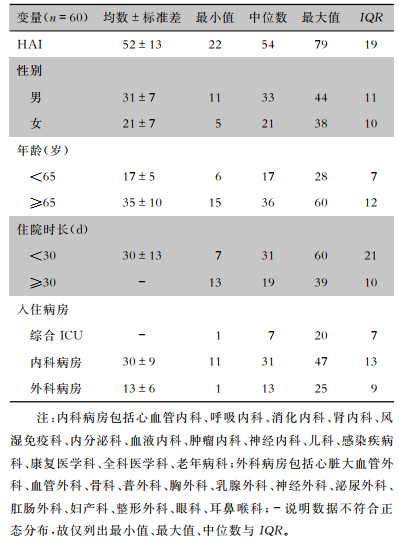
|
同时期共采集该院15 592份环境标本,排除131份污染标本与对照组阳性标本(0.84%),最终纳入研究的标本数为15 461份。具体包括:工作人员手2 748份(17.77%),其中卫生手消毒后(post-antiseptic handrubbing, P-AH)2 201份,外科手消毒后(post-surgical hand antisepsis, P-SHA)547份;HTS 2 519份(16.29%),空气5 283份(34.17%),水2 601份(16.82%),医疗器械1 916份(12.39%),医用织物394份(2.55%)。总体MCFU/Dish分别为:工作人员手15.15 CFU/cm2,P-AH 16.65 CFU/cm2,P-SHA 7.63 CFU/cm2,HTS 4.34 CFU/cm2,空气0.37 CFU/90 mm皿×5 min,水41.50 CFU/mL,医疗器械85.41 CFU/件,医用织物140.10 CFU/100 cm2。该院连续60个月内6类环境标本的月度MCFU/Dish的一般统计描述见表 2。
| 表 2 不同环境标本月度MCFU/Dish的描述性统计 Table 2 Descriptive statistics of monthly MCFU/Dish for different environmental specimens |
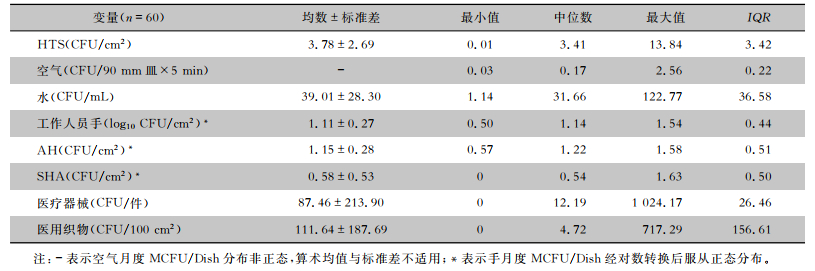
|
经Kolmogorov-Smirnov检验,该院每月HAI发生例数符合泊松分布(Z=1.350,P=0.052)。工作人员P-AH、医务人员P-SHA以及医疗器械的月度MCFU/Dish与HAI每月发生例数呈正相关,Spearman相关系数分别为0.348、0.356、0.275,P值均<0.05;HTS月度MCFU/Dish与HAI每月发生例数呈较弱的负相关,Spearman相关系数为-0.253,P=0.05;空气、水、医用织物月度MCFU/Dish与HAI每月发生例数无相关性(均P>0.05),见图 1。
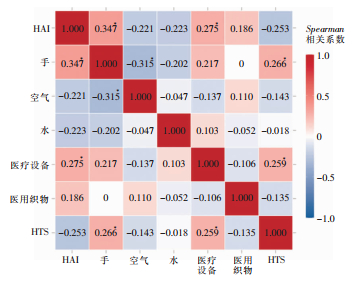 |
| 注:*表示P<0.05。 图 1 HAI发生例数与环境检出菌落数之间的Spearman相关系数热力图 Figure 1 Heatmap of Spearman correlation coefficient between the occurrence frequency of HAI and the number of bacterial colonies detected from environment |
在考虑长期趋势与季节性波动的情况下,将各环境月度MCFU/Dish变量纳入GAM模型,得到工作人员手、HTS、空气、水、医疗器械、医用织物的系数估计值β1分别为0.009、0.020、-0.086、0.451×10-3、-0.971×10-4、0.733×10-6,P值分别为0.012、0.127、0.105、0.640、0.366、0.995。因此,除工作人员手外,未发现其他环境月度MCFU/Dish对HAI每月发生例数的单独效应。
单污染模型显示,工作人员手检出月度MCFU/Dish对HAI每月发生例数存在显著正向影响(β1=0.009,P=0.012)。工作人员手检出月度MCFU/Dish增加1个IQR,HAI发生率预计增加约13.28%(95%CI:2.82%~24.81%)。平滑项s(month)的效应也具有显著性(k=34,P<0.001)。亚组分析显示,P-AH的月度MCFU/Dish对HAI有显著影响,且滞后效应表现为当月最大(lag0,P=0.007),而P-SHA的月度MCFU/Dish对HAI无显著影响(P>0.05)。当月P-AH的MCFU/Dish升高1个IQR,总HAI的ER为16.26%(95%CI:15.45%~17.09%),其中女性、年龄≥65岁、住院时长≥30 d、入住内科病房的ER值较高,分别为19.80%(95%CI:18.42%~21.20%)、19.11%(95%CI:18.08%~20.15%)、24.88%(95%CI:23.95%~25.82%)、22.88%(95%CI:21.79%~23.97%), 见图 2。
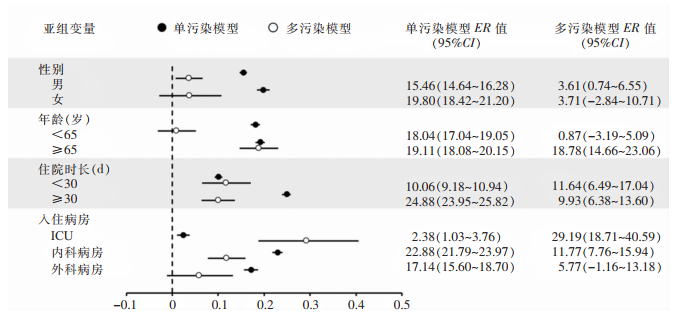 |
| 图 2 基于P-AH和HTS月度MCFU/Dish的HAI ER森林图 Figure 2 HAI ER forest map based on P-AH and HTS monthly MCFU/Dish |
本研究还在单污染模型基础上,通过添加张量乘积平滑器(tensor product smoother, TPS)以捕获潜在的非线性交互关系,建立了关于环境污染因素与HAI的多污染模型。在HTS单污染模型中加入TPS(HTS、P-AH、水三者间交互效应)后,HTS检出月度MCFU/Dish对HAI月度发生数的影响具有统计学意义(β1=0.032,P=0.024),且交互项te(HTS、P-AH、水)对HAI的影响也具有统计学意义(edf=4.00,P=0.005)。HTS的月度MCFU/Dish增加1个IQR,HAI发生例数预计增加约11.42%(95%CI:8.32%~14.60%),其中男性、年龄≥65岁、住院时长<30 d、入住综合ICU的ER值较高,分别为3.61%(0.74%~6.55%)、18.78%(14.66%~23.06%)、11.64%(95%CI:6.49%~17.04%)、29.19%(95%CI:18.71%~40.59%),见图 2。调整TPS,考虑HTS、P-AH、医疗器械三者的交互效应时,发现HTS检出的菌落数月度均值对HAI的影响无统计学意义(β1=0.081,P=0.052),交互项te(HTS、P-AH、医疗设备)的edf为5.46(P=0.097),提示HTS的细菌污染对HAI的影响可能受到P-AH、HTS、医疗设备三者之间的交互关系的影响。其余环境污染因素的交互效应分析则无统计学意义(均P>0.05)。
3 讨论本研究对某三甲综合医院近5年来连续60个月的环境卫生学与医院感染监测资料进行了全面分析与评估。发现该院工作人员手、医疗器械检出的月度MCFU/Dish与HAI每月发生例数呈正相关。进一步通过GAM分析环境卫生与HAI的关系,单污染模型中,当工作人员手菌落数增多时,HAI预期发生数也随之增加,这与国外研究[22-23]报道的结果相似。经亚组分析与滞后效应分析,HAI的超额风险增加与当月(lga0)P-AH的MCFU/Dish显著相关,当月P-AH的MCFU/Dish升高1个IQR,女性、年龄≥65岁、住院时长≥30 d、入住内科病房的患者HAI的ER值较高。Lee等[24]研究表明,增加洗手液的使用与HAI和医疗保健相关耐甲氧西林金黄色葡萄球菌(HA-MRSA)感染发生率的下降显著相关。但一项最新的研究[25]显示,ICU护士必须花费17%的工作时间进行正确的手卫生,100%的手卫生依从率似乎无法实现。该院工作人员P-AH、医务人员P-SHA检出的总体MCFU/Dish分别为16.65、7.63 CFU/cm2,均超出了GB 15982中规定的标准值(P-AH手细菌菌落总数≤10 CFU/cm2,P-SHA手细菌菌落总数≤5 CFU/cm2)。
本研究还通过建立多污染模型分析环境污染因素之间的交互效应,发现HTS检出月度MCFU/Dish对HAI例数的影响可能取决于HTS、工作人员手、水这三者污染程度的交互关系。Russotto等[26]研究显示,如果医务人员在接触患者之前和之后未能正确执行手卫生,可能会增加环境污染和患者随后发生HAI的风险。医护人员不仅可以通过直接接触患者,还可以通过接触患者周围环境的无生命表面和设备造成污染,且细菌可以在干燥表面存活几个月。有研究[27]对医护人员手和高频接触区域进行筛查发现,分离出的酵母菌发生了跨医院的传播,并在念珠菌血症患者的血液标本中检测到同一克隆株。因此,本研究的结论支持加强工作人员手清洁,以及HTS消毒工作以降低住院患者发生HAI的风险。
本研究中该院IPC团队和后勤管理中心共同制定了标准操作流程(SOP),该院保洁人员于每日7点和17点清洁患者床单元及附近区域,以含有效氯500 mg/L的消毒剂为基础,使用清洁的抹布消毒物体表面。同时,该院对定植或感染多重耐药菌(MDRO)的患者实施了严格的接触隔离,患者出院后使用含有效氯500 mg/L的消毒剂对房间及床单元进行终末消毒。因此该院HTS检出总体MCFU/Dish达到了4.34 CFU/cm2,符合GB 15982的标准。但国外也有研究[28]提出医疗机构内HTS的细菌学检测风险阈值应设定在2.5 CFU/cm2以下。Schmidt等[29]研究发现,即使在保洁团队严格落实清洁措施的情况下,患者病床表面微生物载量仍可能超过标准浓度,并且微生物载量随患者住院时间增加而升高。这可能与干燥表面生物膜(Dry Surface Biofilm, DSB)在医疗机构环境中的持续存在有关[30]。另外,有研究[31]提出使用专门的微生物清洁剂可以使物体表面污染程度趋于稳定。因此,本研究的发现进一步强调了医疗机构积极并持续实施环境卫生学监测的重要性。该策略将为医疗机构提供全面的基线数据,使临床部门能够及时实施针对性的干预措施,从而在提升患者安全和减少医院感染方面发挥关键作用。
根据Roux等[32]报道,HAI的发生具有一定季节性。本研究中单污染模型与多污染模型结果均显示时间序列的平滑项s(month)具有统计学意义(k=34,P<0.001),说明HAI的发生与月份之间存在显著的非线性关系,这种非线性关系可能较多来自环境温湿度、空气质量或其他季节性因素的影响。国外已有研究[33]开始应用GAM对HAI进行预测,证明GAM在HAI防控领域的应用具有前景。还有研究团队在一项队列研究中使用人工智能(Artificial Intelligence, AI)算法进行医院感染监测[34],且报道了较高的准确性:受试者工作特征曲线下面积为90.27%,特异度为78.86%,灵敏度为88.57%。未来可以考虑将环境卫生学监测数据纳入AI模型,以便更准确地预测HAI发生。
综上所述,本研究的创新点在于首次采用GAM探讨环境污染因素与HAI风险之间的关联,将GAM模型的应用扩展到环境卫生与公共卫生的交叉研究领域。此外,本研究包含的环境标本种类全面,覆盖了现行HAI管理规范推荐的重点监测类别,并且利用大样本数据及长达5年的时间序列数据进行深度建模分析,为HAI防控策略的制定和实施提供了新的视角。另外,本研究作为一项回顾性分析,其标本采集过程中质量控制可能未达预期,对结果的准确性可能产生一定程度的偏倚。此外,由于是单中心研究,结果的普适性受到限制,因此对结论的推广需谨慎考虑。未来亟待通过多中心、前瞻性研究对本研究模型与方法进行优化与改进。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Tchouaket Nguemeleu E, Beogo I, Sia D, et al. Economic analysis of healthcare-associated infection prevention and control interventions in medical and surgical units: systematic review using a discounting approach[J]. J Hosp Infect, 2020, 106(1): 134-154. DOI:10.1016/j.jhin.2020.07.004 |
| [2] |
Cassini A, Plachouras D, Eckmanns T, et al. Burden of six healthcare-associated infections on European population health: estimating incidence-based disability-adjusted life years through a population prevalence-based modelling study[J]. PLoS Med, 2016, 13(10): e1002150. DOI:10.1371/journal.pmed.1002150 |
| [3] |
Rosenthal VD, Bat-Erdene I, Gupta D, et al. International nosocomial infection control consortium (INICC) report, data summary of 45 countries for 2013-2018, adult and pediatric units, device-associated module[J]. Am J Infect Control, 2021, 49(10): 423-432. |
| [4] |
World Health Organization. Global report on infection prevention and control[EB/OL]. (2022-05-23)[2023-12-10]. https://www.who.int/publications-detail-redirect/9789240051164.
|
| [5] |
Rawlinson S, Cloutman-Green E, Asadi F, et al. Surface sampling within a pediatric ward-how multiple factors affect cleaning efficacy[J]. Am J Infect Control, 2020, 48(7): 740-745. DOI:10.1016/j.ajic.2019.10.023 |
| [6] |
Adams CE, Smith J, Watson V, et al. Examining the association between surface bioburden and frequently touched sites in intensive care[J]. J Hosp Infect, 2017, 95(1): 76-80. DOI:10.1016/j.jhin.2016.11.002 |
| [7] |
Hayward C, Brown MH, Whiley H. Hospital water as the source of healthcare-associated infection and antimicrobial-resistant organisms[J]. Curr Opin Infect Dis, 2022, 35(4): 339-345. DOI:10.1097/QCO.0000000000000842 |
| [8] |
Najotra DK, Malhotra AS, Slathia P, et al. Microbiological surveillance of operation theatres: five year retrospective ana-lysis from a tertiary care hospital in north India[J]. Int J Appl Basic Med Res, 2017, 7(3): 165-168. DOI:10.4103/ijabmr.IJABMR_281_16 |
| [9] |
Facciolà A, Pellicanò GF, Visalli G, et al. The role of the hospital environment in the healthcare-associated infections: a general review of the literature[J]. Eur Rev Med Pharmacol Sci, 2019, 23(3): 1266-1278. |
| [10] |
Perry-Dow KA, de Man TJB, Halpin AL, et al. The effect of disinfectants on the microbial community on environmental healthcare surfaces using next generation sequencing[J]. Am J Infect Control, 2022, 50(1): 54-60. DOI:10.1016/j.ajic.2021.08.027 |
| [11] |
World Health Organization. Minimum requirements for infection prevention and control programmes[EB/OL]. (2019-11-18)[2023-12-10]. https://www.who.int/publications-detail-redirect/9789241516945.
|
| [12] |
中华人民共和国国家卫生和计划生育委员会. 病区医院感染管理规范: WS/T 510—2016[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission of the People's Republic of China. Regulation for healthcare associated infection control in ward in healthcare facilities: WS/T 510-2016[S]. Beijing: Standards Press of China, 2017. |
| [13] |
Gaudart J, Cloutman-Green E, Guillas S, et al. Healthcare environments and spatial variability of healthcare associated infection risk: cross-sectional surveys[J]. PLoS One, 2013, 8(9): e76249. DOI:10.1371/journal.pone.0076249 |
| [14] |
Smith J, Adams CE, King MF, et al. Is there an association between airborne and surface microbes in the critical care environment?[J]. J Hosp Infect, 2018, 100(3): e123-e129. DOI:10.1016/j.jhin.2018.04.003 |
| [15] |
Hastie TJ, Tibshirani RJ. Generalized additive models[M]. London: Chapman and Hall, 1990.
|
| [16] |
Sheng WX, Liu AZ, Peng H, et al. A time-series analysis on generalized additive model for atmospheric pollen concentration and the number of visits of allergic conjunctivitis, Beijing, China[J]. Environ Sci Pollut Res Int, 2022, 29(40): 61522-61533. DOI:10.1007/s11356-022-19897-2 |
| [17] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. Ministry of Health of the People's Republic of China. Diagnostic criteria for nosocomial infections(proposed)[J]. National Medical Journal of China, 2001, 81(5): 314-320. |
| [18] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 医院消毒卫生标准: GB 15982—2012[S]. 北京: 中国标准出版社, 2012. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of China. Hygienic standard for disinfection in hospitals: GB 15982-2012[S]. Beijing: Standards Press of China, 2012. |
| [19] |
中华人民共和国国家卫生健康委员会. 医务人员手卫生规范: WS/T 313—2019[S]. 北京: 中国标准出版社, 2020. National Health Commission of the People's Republic of China. Specification of hand hygiene for healthcare workers: WS/T 313-2019[S]. Beijing: Standards Press of China, 2020. |
| [20] |
Brugger SD, Baumberger C, Jost M, et al. Automated coun-ting of bacterial colony forming units on agar plates[J]. PLoS One, 2012, 7(3): e33695. DOI:10.1371/journal.pone.0033695 |
| [21] |
Maindonald J. Smoothing terms in GAM models[EB/OL]. (2010-08-29)[2023-12-15]. https://maths-people.anu.edu.au/~johnm/r-book/xtras/autosmooth.pdf.
|
| [22] |
Tahir S, Chowdhury D, Legge M, et al. Transmission of Staphylococcus aureus from dry surface biofilm (DSB) via di-fferent types of gloves[J]. Infect Control Hosp Epidemiol, 2019, 40(1): 60-64. DOI:10.1017/ice.2018.285 |
| [23] |
Pittet D, Hugonnet S, Harbarth S, et al. Effectiveness of a hospital-wide programme to improve compliance with hand hygiene. Infection control programme[J]. Lancet, 2000, 356(9238): 1307-1312. DOI:10.1016/S0140-6736(00)02814-2 |
| [24] |
Lee YT, Chen SC, Lee MC, et al. Time-series analysis of the relationship of antimicrobial use and hand hygiene promotion with the incidence of healthcare-associated infections[J]. J Antibiot (Tokyo), 2012, 65(6): 311-316. DOI:10.1038/ja.2012.20 |
| [25] |
Siebers C, Mittag M, Grabein B, et al. Hand hygiene compliance in the intensive care unit: hand hygiene and glove changes[J]. Am J Infect Control, 2023, 51(10): 1167-1171. DOI:10.1016/j.ajic.2023.04.007 |
| [26] |
Russotto V, Cortegiani A, Raineri SM, et al. Bacterial contamination of inanimate surfaces and equipment in the intensive care unit[J]. J Intensive Care, 2015, 3(1): 54. DOI:10.1186/s40560-015-0120-5 |
| [27] |
Megri Y, Arastehfar A, Boekhout T, et al. Candida tropicalis is the most prevalent yeast species causing candidemia in Algeria: the urgent need for antifungal stewardship and infection control measures[J]. Antimicrob Resist Infect Control, 2020, 9(1): 50. DOI:10.1186/s13756-020-00710-z |
| [28] |
Dancer SJ. How do we assess hospital cleaning? A proposal for microbiological standards for surface hygiene in hospitals[J]. J Hosp Infect, 2004, 56(1): 10-15. DOI:10.1016/j.jhin.2003.09.017 |
| [29] |
Schmidt MG, Attaway HH, Fairey SE, et al. Self-disinfecting copper beds sustain terminal cleaning and disinfection effects throughout patient care[J]. Appl Environ Microbiol, 2019, 86(1): e01886-19. |
| [30] |
Maillard JY, Centeleghe I. How biofilm changes our understanding of cleaning and disinfection[J]. Antimicrob Resist Infect Control, 2023, 12(1): 95. DOI:10.1186/s13756-023-01290-4 |
| [31] |
Vandini A, Temmerman R, Frabetti A, et al. Hard surface biocontrol in hospitals using microbial-based cleaning products[J]. PLoS One, 2014, 9(9): e108598. DOI:10.1371/journal.pone.0108598 |
| [32] |
Roux J, Nekkab N, Colomb-Cotinat M, et al. Time-series modelling for the quantification of seasonality and forecasting antibiotic-resistant episodes: application to carbapenemase-producing Enterobacteriaceae episodes in France over 2010-20[J]. J Antimicrob Chemother, 2021, 76(1): 226-232. DOI:10.1093/jac/dkaa388 |
| [33] |
Armbrister AJ, Finke AM, Long AM, et al. Turning up the volume to address biases in predicted healthcare-associated infections and enhance U.S. hospital rankings: a data-driven approach[J]. Am J Infect Control, 2022, 50(2): 166-175. DOI:10.1016/j.ajic.2021.08.014 |
| [34] |
Dos Santos RP, Silva D, Menezes A, et al. Automated healthcare-associated infection surveillance using an artificial intelligence algorithm[J]. Infect Prev Pract, 2021, 3(3): 100167. DOI:10.1016/j.infpip.2021.100167 |



