2. 东南大学生命科学与技术学院, 江苏 南京 210096;
3. 国家卫生健康委员会肠道病原微生物重点实验室江苏省疾病预防控制中心, 江苏 南京 210009
2. School of Life Science and Technology, Southeast University, Nanjing 210096, China;
3. National Health Commission Key Laboratory of Enteric Pathogenic Microbiology, Jiangsu Provincial Centre for Disease Control and Prevention, Nanjing 210009, China
铜绿假单胞菌(Pseudomonas aeruginosa)是一种常见的机会致病性革兰阴性杆菌[1],广泛分布在自然界的水、空气和土壤中,对外界环境具有非常强的适应能力,可在人、动物和环境中循环传播,不仅影响养殖业的发展,而且可定植在人类的皮肤表面、消化道和呼吸道等部位[2],是医院常见的感染病原体,尤其是烧伤、免疫受损患者和严重创伤患者感染的重要致病菌。
碳青霉烯类抗生素(carbapenem)、多黏菌素类抗生素(polymyxin)及替加环素(tigecycline)是临床最常用的治疗严重耐药细菌引起感染的三类抗生素[3],可显著缩短病程,降低疾病负担,减少死亡,是抗感染治疗的“最后一道防线”。然而近年来随着碳青霉烯类药物在临床的使用量增加,其耐药性越来越严重[4],世界卫生组织(World Health Organization, WHO)已将临床上发现的多重耐药(multidrug-resistant)铜绿假单胞菌列为“极为关注”的“重点耐药病原体”[5]。
细菌耐药性受自身以及环境等外界因素影响,极为复杂,传统药物敏感性分析方法费时费力,成本高,需要有经验的工作人员。细菌耐药基因的表达决定着细菌耐药表型,而近几年飞速发展的全基因组测序技术不但能够分析已知耐药机制[6-8],还可以通过计算机技术预测未知的潜在耐药机制,因此全基因组测序技术将会超越常规技术成为未来研究细菌耐药性的首选方法之一,并为监测和控制医院内菌株感染和传播提供重要的技术手段。为全面了解我省临床分离铜绿假单胞菌的耐药表型及基因分布特征,现对2016—2021年江苏省临床患者分离株进行药物敏感性试验和二代基因测序分析,评估菌株的耐药特征、耐药基因携带情况,阐明耐药与耐药基因和基因型的相关性,为铜绿假单胞菌感染的预防控制、调查溯源和诊断治疗提供科学依据。
1 对象与方法 1.1 菌株来源依托国家致病菌识别网监测平台,在全省13个区市设立26家致病菌哨点医院,2016—2021年收集分离自医院临床患者病原学标本(包括全血、痰、中段尿、胆汁、脓等)的铜绿假单胞菌菌株,剔除同一患者相同部位的重复菌株。铜绿假单胞菌的标准菌株ATCC 27853作为药物敏感性试验的质控菌株,购自中国药品生物制品检定所。
1.2 试剂与仪器含5%脱纤维羊血琼脂平板购自广州市迪景微生物科技有限公司,细菌核酸提取试剂(FastPure Bacteria DNA Isolation Mini Kit)购自南京诺唯赞生物科技股份有限公司,革兰阴性细菌鉴定卡(VITEC-2 GN Test kit)及全自动细菌生化鉴定仪(VETIC-2 System)为法国生物梅里埃公司生产,德国布鲁克公司生产的全自动细菌鉴定质谱仪(Microflex LT/SH smart MALDI TOF MS System),铜绿假单胞菌致病菌识别网定制药敏板(NMIC/ID-4),全自动微生物鉴定药敏分析系统(Phoenix M50)为美国BD公司生产,水套式恒温培养箱(美国热电公司),BSL-Ⅱ级生物安全柜(德国Baker公司),高速离心机(德国Eppendorf公司),-80℃冰箱(美国热电公司)。
1.3 铜绿假单胞菌鉴定按照国家致病菌识别网技术手册(2022版)用无菌接种环,四区划线法将菌株接种在含5%脱纤维羊血琼脂培养基上,37℃孵育20~24 h。挑取可疑菌落纯化放大后经系统生化鉴定和微生物质谱鉴定为铜绿假单胞菌。
1.4 药敏试验采用微量肉汤稀释法对本研究收集的铜绿假单胞菌进行抗菌药物最低抑菌浓度(minimal inhibitory concentration, MIC)分析,10类19种抗菌药物包括阿米卡星(AN)、阿莫西林/克拉维酸(AMC)、氨苄西林(AM)、氨苄西林/舒巴坦(SAM)、氨曲南(ATM)、头孢唑林(CZ)、头孢吡肟(FEP)、头孢噻肟(CTX)、头孢他啶(CAZ)、氯霉素(C)、环丙沙星(CIP)、庆大霉素(GM)、亚胺培南(IPM)、左氧氟沙星(LVX)、美罗培南(MEM)、哌拉西林(PIP)、哌拉西林/他唑巴坦(TZP)、四环素(TE)、复方磺胺甲口恶唑(SXT)。根据美国临床实验室标准化协会(Clinical and Laboratory Standard Institute, CLSI) M100-S31文件标准和中国疾控中心传染病预防控制所的《疾控系统药敏判读标准》判读结果,抗菌药物敏感性结果分为耐药(R)、中介(I)和敏感(S)三种。药敏试验质控菌株为铜绿假单胞菌ATCC 27853。
1.5 全基因组测序核酸提取:1.5 mL无菌EP管中加入200 μL无菌水,接种环挑取适量新鲜菌苔加入。使用试剂盒提取纯化细菌全基因组DNA,按说明书操作步骤进行。分光光度仪检测细菌dsDNA浓度,琼脂糖凝胶电泳(1%浓度的琼脂糖凝胶;150 V电压电泳40 min)检查核酸完整性,合格样品送北京诺禾致源科技股份有限公司进行建库(≤800 bp常规文库)和细菌全基因组重测序,测序平台为illumina novaseq x plus。
1.6 质控与组装利用CLC genomics workbench软件(Qiagen)对测序数据进行质控,并用Microbial Genomics Module模块对Clean data数据进行多个K-mer参数拼接,得到最优的contigs组装结果,随后进行局部组装和优化,形成scaffolds。
1.7 耐药基因预测所有菌株组装文件导入CLC软件Microbial Genomics Module模块在ResFinder (https://cge.cbs.dtu.dk/services/ResFinder/)和CARD (https://card.mcmaster.ca/)数据库进行耐药基因扫描比对。
1.8 多位点序列分型(multilocus sequence typing, MLST)分析MLST的7个等位基因通过NCBI在线数据库进行BLAST比对,确定每株菌的基因型(sequence type, ST),并将7个基因数字作为字符型数据,运用BioNumerics 8.0(applied maths, belgium)软件,非加权配伍组平均法(unweighted pair group method with arithmetic mean, UPGMA)进行相关ST型的聚类分析。
2 结果 2.1 菌株情况本实验室通过致病菌识别网各哨点医院在2016—2021年收集医院患者分离的疑似铜绿假单胞菌菌株,纯化后经生化和MALDI TOF MS鉴定,共101株铜绿假单胞菌。其中2019年南通收集的菌株最多,2021年较少。全省13个地级市,101株菌来源于其中12个地级市。见图 1。
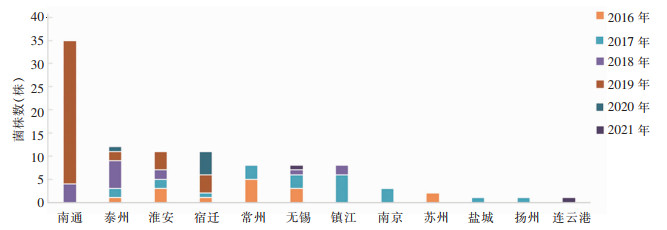 |
| 图 1 江苏省2016—2021年不同地区临床分离铜绿假单胞菌分布 Figure 1 Distribution of clinically isolated Pseudomonas aeruginosa from different area, Jiangsu Province, 2016-2021 |
铜绿假单胞菌存在固有耐药,本研究收集到的全部菌株对其中6类8种抗菌药物全部耐药,包括酰胺醇类抗生素氯霉素、磺胺类的复方磺胺甲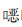
| 表 1 江苏省临床分离的101株铜绿假单胞菌对11种抗菌药物的药敏结果 Table 1 Antimicrobial susceptibility testing results of 101 strains of clinically isolated Pseudomonas aeruginosa to 11 kinds of antimicrobial agents, Jiangsu Province |

|
铜绿假单胞菌耐药模式多样,见表 2,共有35种耐药表型,其中1株菌对检测的19种抗菌药物均耐药,耐药谱为8种固有耐药抗菌药物的AMC-AM-SAM-CZ-CTX-C-TE-SXT菌株最多,占31.69%(32株)。耐药情况最严重的耐药物谱分别为19种抗菌药物(AN-AMC-AM-SAM-ATM-CZ-FEP-CTX-CAZ-C-CIP-GM-IPM-LVX- MEM-PIP- TZP-TE-SXT)和18种抗菌药物(AMC-AM-SAM-ATM-CZ-FEP-CTX-CAZ-C-CIP-GM-IPM-LVX- MEM- PIP-TZP-TE-SXT、AN-AMC-AM-SAM-CZ-FEP- CTX- CAZ-C-CIP-GM-IPM-LVX-MEM-PIP-TZP-TE-SXT,各1株)。
| 表 2 江苏省101株临床分离铜绿假单胞菌耐药谱 Table 2 Antimicrobial resistance spectrum of 101 strains of clinically isolated Pseudomonas aeruginosa, Jiangsu Province |

|
101株铜绿假单胞菌介导对β-内酰胺类等共9类18种抗菌药物耐药相关基因见表 3和图 2,分别是β-内酰胺酶基因的blaOXA和blaPAO;氨基糖苷类耐药基因aac、aad和aph;喹诺酮类相关耐药基因qnr和crpP;常见的四环素类耐药基因如tet;酰胺醇类相关耐药基因如floR、cmlA和cat;介导磺胺类的耐药基因如dfrA、qac和sul;针对利福霉素类抗生素的耐药基因arr;抗生素灭活基因fosA和抗生素外排泵基因qacE。结果显示所有菌株携带aph(3’)-IIb和fosA基因,同时发现大部分菌株携带有β-内酰胺酶相关基因blaOXA(99株,98.02%)和blaPAO(100株,99.01%),氨基糖苷类耐药基因aac和aad的携带率分别为11.88%(12株)和4.95%(5株)。此外,有43株菌株(42.57%)发现喹诺酮类抗菌药物耐药相关的关键基因crpP,同时这些菌株对萘啶酸及喹诺酮类药物均呈现耐药表型特性,耐药表型和crpP基因的携带情况完全匹配。
| 表 3 铜绿假单胞菌9类18种耐药基因分布 Table 3 Distribution of 18 kinds of 9 categories of antimicrobial resistance genes in Pseudomonas aeruginosa |
|
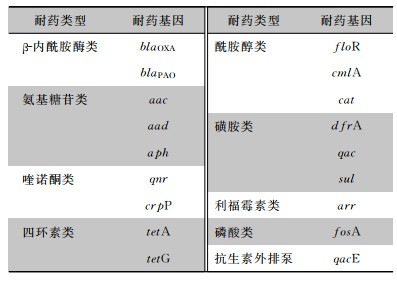
 |
| 图 2 江苏省101株铜绿假单胞临床分离株MLST聚类树图 Figure 2 Cluster tree of MIST of 101 strains of clinically isolated Pseudomonas aeruginosa, Jiangsu Province |
NCBI的在线平台pub-MLST数据库中鉴定每株菌的7个等位基因号和ST型。结果显示101株铜绿假单胞菌存在75个ST型,ST 244(5株)、ST 235(4株)、ST 319(3株)、ST 773(3株)和ST 1076(3株)等几个ST型的菌株最多。聚类图显示所有的ST型中,ST 262处于聚类图的中心点,11个亚型或分支从ST 262扩散,聚类图显示各血清型菌株的ST型相对集中。见图 3。
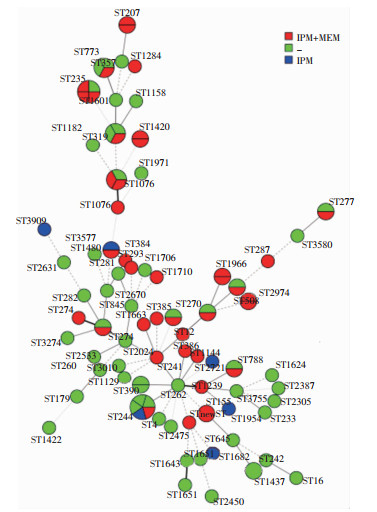 |
| 注:IPM+MEM为亚胺培南和美罗培南耐药;IPM为亚胺培南耐药;-为亚胺培南和美罗培南非耐药。 图 3 江苏省101株铜绿假单胞临床分离株MLST最小生成树图 Figure 3 Minimum spanning tree of 101 strains of clinically isolated Pseudomonas aeruginosa, Jiangsu Pro-vince |
医院获得性感染(healthcare-associated infection, HAI)又称为医院感染,是指患者在医院住院期间获得的感染,包括住院期间发生的感染以及出院后才表现出来的感染。铜绿假单胞菌对环境具有高度的适应性,同时具备产毒性和侵入性,易引起人体多部位感染,如呼吸道、肺部、尿路感染、烧伤、免疫受损、心脏瓣膜及手术等部位的感染,甚至会通过血液引起全身感染,是导致医院感染最重要的条件致病菌之一,已成为医院重点防控的病原菌[9]。调查收集的菌株来源于江苏省13个市中的12个市,具有一定的代表性。
本研究结果显示,江苏省临床分离的铜绿假单胞菌耐药情况严重,所有分离株对氯霉素、复方磺胺甲
碳青霉烯类抗生素(如亚胺培南、美罗培南、厄他培南等),是70年代研发的一种新型β-内酰胺类抗生素,通过干扰细胞壁的合成而抑制细菌复制,因具有广谱、强效和低不良反应,广泛应用于治疗由严重耐药革兰阴性菌引起的感染。但随着临床上的广泛应用,铜绿假单胞菌对亚胺培南等一线药物的耐药性出现上升趋势[11]。2017年,WHO将耐碳青霉烯类铜绿假单胞菌列为极其重要的、急需开发新型药物和治疗手段的细菌之一。本研究发现对亚胺培南和美罗培南两种抗生素的耐药率已分别达45.54%、39.60%,高于国内湖北和广州医院感染分离株的耐药率。
临床分离的铜绿假单胞菌多重耐药严重,本研究中收集的分离株全部为多重耐药菌,耐药种类在固有耐药(AMC-AM-SAM-CZ-CTX-C-TE-SXT)的基础上递增,甚至出现1株对所有抗菌药物耐药的超级耐药菌株,耐10种抗菌药物的菌株达63.37%。与国外药物敏感性监测结果[12](欧洲、美国、日本等医院菌株)比较,本次分离的菌株耐药率以及多重耐药程度较高,提示需密切关注铜绿假单胞菌重点抗菌药物耐药性的变化。
铜绿假单胞菌能通过水平基因转移获得耐药基因(antimicrobial resistance gene, ARG),从而产生耐药性并形成超级耐药细菌,一旦出现在医院中,危害性极大,可导致原来没有感染的患者因其他疾病住院后反而感染超级耐药菌,严重的可导致患者死亡。本专题研究利用生物信息分析方法,通过测序技术得到菌株基因组信息,再在ResFinder数据库里对已知的耐药基因全面扫描分析,大大提高了效率,节约了成本。通过比对发现了6类共18种介导抗菌药物耐药相关的基因。铜绿假单胞菌可携带β-内酰胺酶基因(blaOXA和blaPAO)[13],OXA为D类碳青霉烯酶,有多个亚型,能水解多种青霉素类和头孢菌素类抗生素,一般由质粒介导并扩散。本项研究的结果表明,大多数菌株携带一或两种此类抗性基因,并且对青霉素类抗生素氨苄西林和碳青霉烯类具有抗性,如对美罗培南具有一定的耐药性,耐药基因和耐药表型结果完全一致。此外43株菌株携带crpP基因,并与对喹诺酮类药物的耐药性呈现了100%的对应关系。
MLST技术可对细菌进行基因分型及遗传进化分析,是当前分子流行病研究中常用的工具之一。本研究101株菌被分为75个不同的ST型,表明本地区ST型丰富,感染来源和途径多样化,应加强各环节的消毒和感染控制。文献报道,全球多地的医院发现从患者体内分离泛耐药(extensively drug resistant, XDR)甚至是全耐药(pandrug-resistant, PDR)的铜绿假单胞菌[14],这些严重耐药甚至全耐药的分离株主要集中在几种特别的MLST型中,如ST 175、ST 235及ST 664等;携带这些基因型的菌株在临床治疗上无药可用,一旦感染极度凶险,这些ST型聚在一起形成的克隆簇常被称为高危克隆簇。ST 235分布广泛,本研究中发现4株ST 235基因型菌株,其中1株耐药严重,同时耐18种抗菌药物,因此需提高对该型菌株的警惕,如有暴发,周边医院或社区应提高重视,防范进一步的蔓延。
随着经济的发展,我国全面进入老龄化社会,本研究针对2016—2021年患者临床分离株进行药物敏感性试验和二代测序分析,结果显示江苏省临床分离的铜绿假单胞菌耐药情况严重,并有扩散的趋势,应引起高度重视。一方面要发展新的治疗手段,如新型抗菌药物或噬菌体治疗等;另一方面如空气、水龙头、门把手等医院内经常接触到的重点部位的消毒灭菌需加强,防止泛耐药铜绿假单胞菌医院内扩散感染。由于新型冠状病毒感染疫情等各种因素影响,不同年份各地区收集的菌株数差异较大,对结果分析及特征描述产生一定的影响,下一步将优化工作流程,增加相关培训。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
王雪玉, 田芳英, 赵明. 全球铜绿假单胞菌医院感染暴发事件的流行特征与应对策略[J]. 中国感染控制杂志, 2022, 21(12): 1171-1178. Wang XY, Tian FY, Zhao M. Epidemic characteristics and preventive strategies of worldwide outbreak of healthcare-associated infection caused by Pseudomonas aeruginosa[J]. Chinese Journal of Infection Control, 2022, 21(12): 1171-1178. DOI:10.12138/j.issn.1671-9638.20223388 |
| [2] |
Verdial C, Serrano I, Tavares L, et al. Mechanisms of antibio- tic and biocide resistance that contribute to Pseudomonas aeruginosa persistence in the hospital environment[J]. Biomedicines, 2023, 11(4): 1221. DOI:10.3390/biomedicines11041221 |
| [3] |
刘宇阳, 陈茶, 黄彬. 铜绿假单胞菌对碳青霉烯类抗生素异质性耐药的研究进展[J]. 中国感染控制杂志, 2021, 20(8): 763-768. Liu YY, Chen C, Huang B. Research progress of heteroresistance to carbapenems in Pseudomonas aeruginosa[J]. Chinese Journal of Infection Control, 2021, 20(8): 763-768. DOI:10.12138/j.issn.1671-9638.20217348 |
| [4] |
宋晓超, 金美娟, 丁蔚. 重症监护室与普通病房碳青霉烯类耐药铜绿假单胞菌医院感染分布与耐药性[J]. 中华医院感染学杂志, 2021, 31(22): 3397-3401. Song XC, Jin MJ, Ding W. Distribution and drug resistance of carbapenem-resistant Pseudomonas aeruginosa causing infection in intensive care unit and common wards[J]. Chinese Journal of Nosocomiology, 2021, 31(22): 3397-3401. |
| [5] |
World Health Organization. WHO publishes list of bacteria for which new antibiotics are urgently needed[EB/OL]. (2017-02-27)[2023-07-12]. https://www.who.int/news/item/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed.
|
| [6] |
Abdalhamid B, Reslane I, Mccutchen E, et al. Genotypic characterization of multidrug-resistant Pseudomonas aeruginosa using whole-genome sequencing[J]. Microbiol Resour Announc, 2021, 10(32): e0060621. DOI:10.1128/MRA.00606-21 |
| [7] |
Jácome PRLDA, Alves LR, Cabral AB, et al. Phenotypic and molecular characterization of antimicrobial resistance and virulence factors in Pseudomonas aeruginosa clinical isolates from Recife, State of Pernambuco, Brazil[J]. Rev Soc Bras Med Trop, 2012, 45(6): 707-712. DOI:10.1590/S0037-86822012000600010 |
| [8] |
Magalhães B, Valot B, Abdelbary MMH, et al. Combining standard molecular typing and whole genome sequencing to investigate Pseudomonas aeruginosa epidemiology in intensive care units[J]. Front Public Health, 2020, 8: 3. DOI:10.3389/fpubh.2020.00003 |
| [9] |
Cardoso O, Alves AF, Leitão R. Metallo-beta-lactamase VIM-2 in Pseudomonas aeruginosa isolates from a cystic fibrosis patient[J]. Int J Antimicrob Agents, 2008, 31(4): 375-379. DOI:10.1016/j.ijantimicag.2007.12.006 |
| [10] |
邱红美, 陆建红, 杨勇, 等. 常见固有耐药细菌的感染分布及药敏分析[J]. 中国卫生检验杂志, 2019, 29(2): 179-182. Qiu HM, Lu JH, Yang Y, et al. Infection distribution and susceptibility analysis of common inherently resistant bacteria[J]. Chinese Journal of Health Laboratory Technology, 2019, 29(2): 179-182. |
| [11] |
陈勇, 史利宁, 胡毓安, 等. 产KPC铜绿假单胞菌的耐药分子机制及其临床分布[J]. 医学研究生学报, 2021, 34(6): 575-579. Chen Y, Shi LN, Hu YA, et al. Molecular mechanism and clinical distribution of drug resistance of Pseudomonas aeruginosa KPC[J]. Journal of Medical Postgraduates, 2021, 34(6): 575-579. |
| [12] |
Snyder LA, Loman NJ, Faraj LA, et al. Epidemiological investigation of Pseudomonas aeruginosa isolates from a six-year-long hospital outbreak using high-throughput whole genome sequencing[J]. Euro Surveill, 2013, 18(42): 20611. |
| [13] |
杨菁菁, 艾效曼, 胡云建, 等. 泛耐药铜绿假单胞菌对β-内酰胺类抗生素的耐药机制研究[J]. 中国感染与化疗杂志, 2013, 13(1): 14-18. Yang JJ, Ai XM, Hu YJ, et al. Examination of the mechanism of β-lactam resistance in pan-drug resistant Pseudomonas aeruginosa[J]. Chinese Journal of Infection and Chemotherapy, 2013, 13(1): 14-18. |
| [14] |
Moloney EM, Deasy EC, Swan JS, et al. Whole-genome sequencing identifies highly related Pseudomonas aeruginosa strains in multiple washbasin U-bends at several locations in one hospital: evidence for trafficking of potential pathogens via wastewater pipes[J]. J Hosp Infect, 2020, 104(4): 484-491. DOI:10.1016/j.jhin.2019.11.005 |




 唑。
唑。