2. 国家老年疾病临床医学研究中心(湘雅医院),湖南 长沙 410008;
3. 中南大学湘雅三医院检验科,湖南 长沙 410013;
4. 湖南省细菌耐药监测网办公室,湖南 长沙 410008;
5. 浏阳市中医医院检验科,湖南 浏阳 410300;
6. 中南大学湘雅医院检验科,湖南 长沙 410008;
7. 湘潭市中心医院检验科,湖南 湘潭 411100;
8. 湖南中医药大学第一附属医院医学检验与病理中心,湖南 长沙 410011;
9. 长沙市中心医院检验科,湖南 长沙 410004;
10. 长沙市第一医院检验科,湖南 长沙 410005;
11. 张家界市人民医院检验科,湖南 张家界 427000;
12. 郴州市第一人民医院检验医学中心,湖南 郴州 423000;
13. 湖南省医院感染管理质量控制中心,湖南 长沙 410008;
14. 湖南省第二人民医院(湖南省临床检验质量控制中心),湖南 长沙 410007
2. National Clinical Research Center for Geriatric Disorders [Xiangya Hospital], Changsha 410008, China;
3. Department of Laboratory Medicine, The Third Xiangya Hospital of Central South University, Changsha 410013, China;
4. Hunan Province Antimicrobial Resistance Surveillance System Office, Changsha 410008, China;
5. Department of Laboratory Medicine, Liuyang Traditional Chinese Medicine Hospital, Liuyang 410300, China;
6. Department of Laboratory Medicine, Xiangya Hospital, Central South University, Changsha 410008, China;
7. Department of Laboratory Medicine, Xiangtan Central Hospital, Xiangtan 411100, China;
8. Medical Laboratory and Pathology Center, The First Hospital of Hunan University of Chinese Medicine, Changsha 410011, China;
9. Department of Laboratory Medicine, Changsha Central Hospital, Changsha 410004, China;
10. Department of Laboratory Medicine, The First Hospital of Changsha, Changsha 410005, China;
11. Department of Laboratory Medicine, Zhangjiajie People's Hospital, Zhangjiajie 427000, China;
12. Center for Laboratory Medicine, The First People's Hospital of Chenzhou, Chenzhou 423000, China;
13. Hunan Provincial Healthcare-associated Infection Management Quality Control Center, Changsha 410008, China;
14. The Second Hunan Provincial People's Hospital [Hunan Clinical Laboratory Quality Control Center], Changsha 410007, China
克雷伯菌属细菌是条件致病菌,临床感染中以肺炎克雷伯菌为主,可引起肺部感染,也可引起肺外感染,如肠炎、脑膜炎、泌尿道感染、败血症等[1]。碳青霉烯类抗生素是治疗克雷伯菌属细菌重症感染的重要药物。近年,耐碳青霉烯类克雷伯菌属细菌(CRO)不断增多[2-3],是世界各地卫生机构面临的紧迫问题。不同地区、不同时间克雷伯菌属细菌的耐药情况可能不同,为掌握湖南省克雷伯菌属细菌耐药的总体变迁情况,为抗菌药物合理使用提供实验室依据,现将2012—2021年湖南省细菌耐药监测网克雷伯菌属细菌的监测结果报告如下。
1 资料与方法 1.1 数据来源来自2012—2021年湖南省细菌耐药监测网经审核的数据。碳青霉烯类耐药菌株是指对碳青霉烯类药物(包括亚胺培南、美罗培南和厄他培南)中任一药物耐药的菌株。每例患者相同标本剔除重复菌株,统计第一株菌。
1.2 技术方案细菌鉴定方法、质控菌株选择及测试抗菌药物种类参照全国细菌耐药监测网(CARSS) 技术方案执行[4]。药敏试验结果按照美国临床实验室标准化协会(Clinical & Laboratory Standards Institute, CLSI) 推荐的抗微生物药物敏感性试验执行标准2022年版(M100第32版)进行判断[5]。其中头孢哌酮/舒巴坦无药敏解释折点,参照头孢哌酮折点判断[6-7]。替加环素采用美国食品药品监督管理局(Food and Drug Administration, FDA)推荐的折点[8]。多黏菌素B参考欧盟药敏试验标准委员会(European Committee on Antimicrobial Susceptibility Testing, EUCAST)推荐的折点[9]。其中新生儿(≤28 d)、儿童(29 d~14岁)、成人(15~ 65岁)、老年人(>65岁)均按照CARSS的标准划分。
1.3 统计分析数据统计分析应用WHONET 5.6软件和SPSS 27.0统计软件对数据进行统计分析,以P≤0.05为差异有统计学意义。
2 结果 2.1 细菌数量、种类及来源2012—2021年共分离361 539株克雷伯菌属细菌,其中肺炎克雷伯菌313 534株(占86.7%,包括肺炎克雷伯菌肺炎亚种、肺炎克雷伯菌鼻硬结亚种和肺炎克雷伯菌臭鼻亚种),其次是产气克雷伯菌(26 567株,占7.3%)、产酸克雷伯菌(21 216株,占5.9%),其他克雷伯菌属细菌(未鉴定到种属222株,占0.1%)。新生儿来源克雷伯菌属细菌5 309株(占1.5%),儿童患者来源克雷伯菌属细菌45 455株(占12.6%),成人患者来源克雷伯菌属细菌152 374株(占42.1%),老年患者来源克雷伯菌属细菌146 994株(占40.7%), 未完善年龄信息患者占3.1%(11 407株);标本主要来源呼吸道(66.5%),其次为尿(10.5%)、脓液和分泌物(8.3%)、血(5.4%)。其中血标本分离菌株从2012年的469株(占3.5%)逐渐上升到2021年的3 233株(占6.0%)。
2.2 克雷伯菌属细菌的药敏结果克雷伯菌属细菌对碳青霉烯类药物的耐药率相对稳定,2015—2021年对亚胺培南和美罗培南的耐药率为8.2%~10.3%;2012—2013年对替加环素的耐药率最高(7.1%), 2016—2021年耐药率均<5%;2012—2021年克雷伯菌属细菌对庆大霉素的耐药率为14.4%~20.1%,2020—2021年对庆大霉素的耐药率最低(14.4%);2012—2021年对头孢哌酮/舒巴坦的耐药率有所上升,由2012—2013年的4.8%上升至2020—2021年的13.3%。见表 1。
| 表 1 2012—2021年湖南省细菌耐药监测网克雷伯菌属细菌的药敏结果 Table 1 Antimicrobial susceptibility testing results of Klebsiella spp., Hunan Province Antimicrobial Resistance Surveillance System, 2012-2021 |
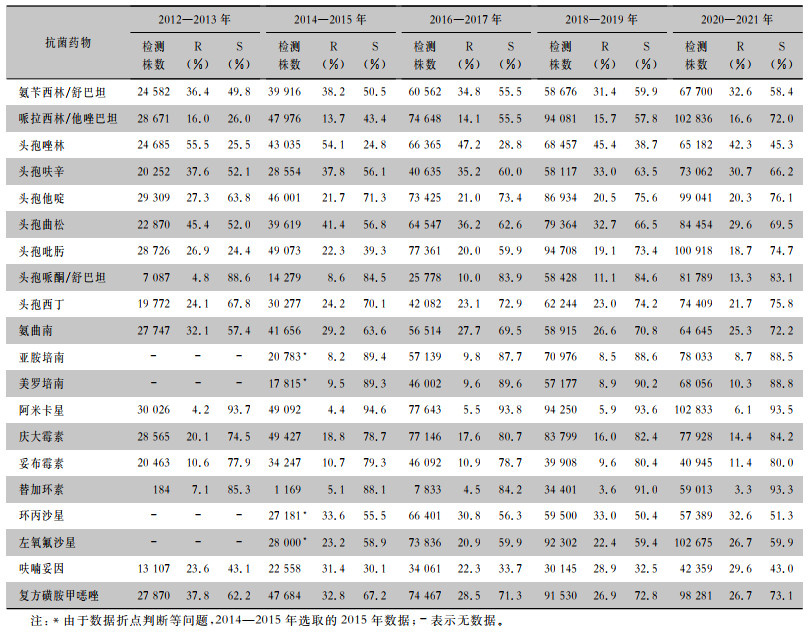
|
儿童患者分离的克雷伯菌属细菌对替加环素的耐药率较低,2012—2013年未出现对替加环素耐药的菌株,2014—2015年对替加环素的耐药率为3.8%,2016—2021年其耐药率均低于其余年份(均<2.0%);2012—2021年对第三代头孢菌素的耐药率下降,对头孢他啶和头孢曲松的耐药率2012—2013年分别为35.7%、57.3%,2020—2021年分别为16.7%、28.5%;对头孢哌酮/舒巴坦的耐药率较低(4.3%~9.0%);对碳青霉烯类药物的耐药率较低(均<10%),2015年对亚胺培南和美罗培南的耐药率分别为7.0%、7.7%,2020—2021年对两种药物的耐药率最低,分别为3.5%、3.6%;2012—2021年儿童患者分离的克雷伯菌属细菌对妥布霉素的耐药率在5%左右,对庆大霉素的耐药率有所下降,2020—2021年耐药率为8.1%;2012—2021年细菌对复方磺胺甲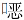
| 表 2 2012—2021年湖南省细菌耐药监测网儿童患者分离的克雷伯菌属细菌的药敏结果 Table 2 Antimicrobial susceptibility testing results of Klebsiella spp. from pediatric patients, Hunan Province Antimicrobial Resistance Surveillance System, 2012-2021 |
|
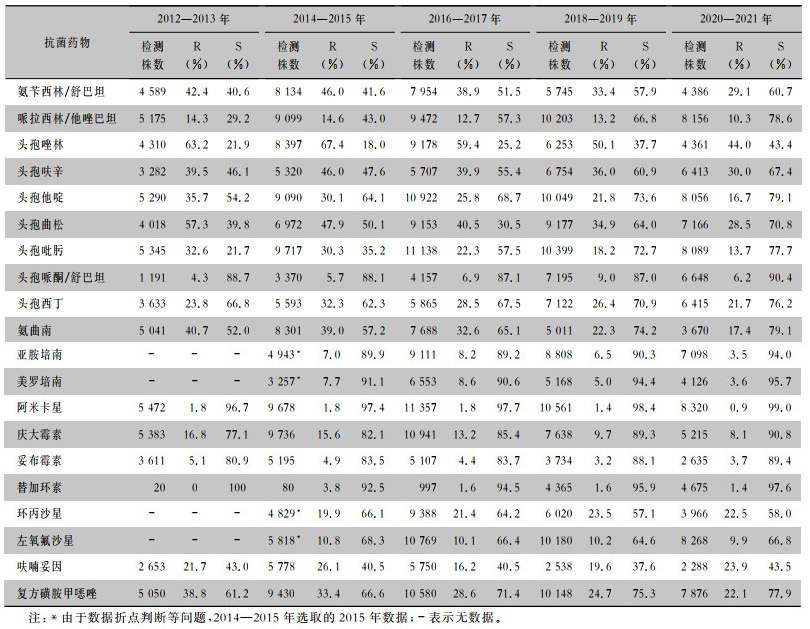
2015—2021年对克雷伯菌属细菌同时进行亚胺培南和美罗培南两种药物的药敏检测数据显示,共分离出耐亚胺培南或美罗培南菌株13 097株,2015—2021年对两种药物均耐药的菌株构成比均>80%,对亚胺培南耐药但对美罗培南敏感的菌株构成比为3.1%~8.6%;对亚胺培南敏感但对美罗培南耐药的菌株2015年构成比较高(占16.5%),2018—2019年较低(占2.9%),2015—2021年亚胺培南和美罗培南不同耐药组合构成比较,差异有统计学意义(χ2=339.9, P<0.001)。见表 3。
| 表 3 2014—2021年湖南省细菌耐药监测网克雷伯菌属细菌对亚胺培南和美罗培南耐药一致性情况 Table 3 Consistency of resistance of Klebsiella spp. to imipenem and meropenem, Hunan Province Antimicrobial Resistance Surveillance System, 2014-2021 |
|
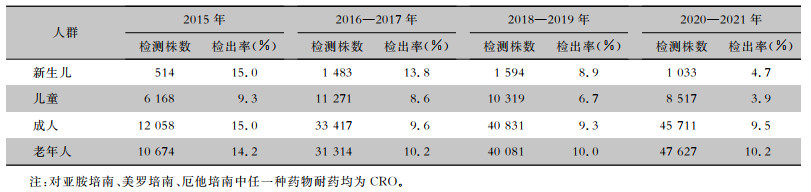
2015年新生儿和成人患者CRO检出率最高,均为15.0%,其次为2015年老年患者(检出率为14.2%);2015—2021年新生儿、儿童、成人患者的检出率稍有下降,2020—2021年检出率分别为4.7%、3.9%、9.5%;2015—2021年来自成人和老年患者的菌株明显增加,2020—2021年成人和老年患者分离的CRO分别为4 349、4 863株;2016—2021年老年患者CRO检出率相对稳定(均在10%左右),均高于同时期的儿童和成人患者的检出率。见表 4。
| 表 4 2015—2021年湖南省不同年龄组患者人群中CRO检出情况 Table 4 Detection of carbapenem-resistant organisms in patients in different age groups, Hunan Province Antimicrobial Resistance Surveillance System, 2015-2021 |
|
克雷伯菌属细菌是临床上重要的一类病原菌,可定植于人体肠道,在一定条件下引起人体严重感染。了解该类细菌的耐药性及流行病学特征,对临床抗感染治疗具有重要的指导价值。
2012—2021年湖南省临床分离的克雷伯菌属细菌主要为肺炎克雷伯菌,其中分离自儿童患者的菌株较少(占12.6%);标本类型主要为呼吸道标本(66.5%),血标本较少(5.4%),远低于中国细菌耐药监测网(CHINET)监测的血标本比率(14.4%)[10],但血标本的分离菌株缓慢上升,2021年为6.0%,未来还需要进一步提高血标本的送检率和检出率。
2012—2021年湖南省细菌耐药监测网克雷伯菌属细菌对碳青霉烯类药物的耐药率相对稳定,2015—2021年对亚胺培南和美罗培南的耐药率为8.2%~10.3%,与CARSS肺炎克雷伯菌的平均分离率(10.9%)接近[11], 比同时期CHINET[10]和中国细菌耐药监测(CARST)[12]研究报告的数据低,可能与被监测医院及地域不同有关。2012—2017年分离自儿童患者的克雷伯菌属细菌对头孢曲松的耐药率为40.5%~57.3%,2018—2021年的耐药率稍降低,2020—2021年的耐药率为28.5%,可能与儿童使用第三代头孢菌素较多有关[11]。2020—2021年儿童患者分离的克雷伯菌属细菌对亚胺培南和美罗培南的耐药率分别为3.5%、3.6%,低于付盼等[13]监测的全国儿童医院分离的肺炎克雷伯菌数据;这些菌株对氨基糖苷类的耐药率较低,可能由于这类药物有耳毒性、肾毒性等,临床使用较少有关。
近年耐碳青霉烯类肺炎克雷伯菌(CRKP)菌株不断增多,在全球流行且检出率不断上升[14-16],其迅速传播给人类健康造成极大威胁,2015—2021年对克雷伯菌属细菌同时进行亚胺培南和美罗培南两种药物的药敏检测,共分离出耐亚胺培南或美罗培南菌株13 097株,说明湖南地区CRO不断增多。CRKP感染明显增加了患者的病死率,特别对于入住重症监护病房(intensive care unit, ICU)、免疫力低下、既往使用过抗菌药物(尤其是碳青霉烯类、喹诺酮类、氨基糖苷类和替加环素)、住院时间长、有基础疾病、接受有创操作的患者,尤为明显[17-18]。2015—2021年来自成人和老年患者的菌株明显增加,2020—2021年成人和老年患者分离的CRO分别为4 349、4 863株;2016—2021年老年患者的CRO检出率相对稳定(均在10.0%左右),高于同时期的儿童和成人患者的检出率,估计与老年人年龄较大、基础疾病较多、抵抗力相对低有关。Huang等[19]对医院2017年分离的菌株进行分析,发现CRKP、碳青霉烯类药物敏感肺炎克雷伯菌感染患者粗住院病死率分别为14.61%、5.65%,且CRKP感染患者整个住院费用中位数比碳青霉烯类药物敏感肺炎克雷伯菌感染患者高11 207美元。肺炎克雷伯菌对碳青霉烯类药物耐药的主要原因是产生碳青霉烯酶,如KPC-2、NDM-1和OXA-48等[14, 20-21]。这些耐药基因可存在于质粒上,通过插入序列、转座子等可移动原件在不同菌株之间进行传播。同时,这些CRO菌株可能在患者诊疗和护理过程中被传播给其他患者、医务人员或污染病房环境,甚至导致医院感染暴发。2014年一所医院两例患者感染CRKP,随后15个月内医院暴发了相关感染,对所有接触的患者进行肛拭子检测,从38例患者分离出相关菌株[22]。法国一所医院有15株OXA-48基因阳性CRKP,涉及3次暴发,经同源性分析后发现有些患者先后住在同一病房,在房间的水槽中分离到同一型别菌株[23],给医院感染预防带来很大挑战。
2015—2021年对克雷伯菌属细菌同时进行亚胺培南和美罗培南两种药物药敏检测,同时对两种药物耐药的菌株11 404株(占87.1%),对亚胺培南耐药但对美罗培南敏感的菌株951株,对亚胺培南敏感但对美罗培南耐药的菌株742株,2020—2021年亚胺培南和美罗培南耐药性不一致的菌株占13.6%,2015—2021年克雷伯菌属细菌对亚胺培南和美罗培南不同耐药组合构成比较,差异有统计学意义。两种药物耐药性不同可能由于一些特殊的耐药机制,如肺炎克雷伯菌产OXA-232型碳青霉烯酶导致菌株对美罗培南耐药但对亚胺培南敏感[24]。
替加环素和多黏菌素是治疗耐碳青霉烯类克雷伯菌属的重要抗生素[25],而近年来克雷伯菌属细菌,特别是肺炎克雷伯菌已逐渐出现耐药菌株,应引起临床高度重视。本研究中克雷伯菌属细菌对替加环素的耐药率下降,2018—2021年的耐药率均<4%,分离自儿童患者的菌株耐药率2012—2021年均≤3.8%。细菌对替加环素耐药的机制主要是产生tet(A)基因或外排泵系统高表达引起[14]。也有文献报道出现对多黏菌素耐药的菌株, 其耐药主要由染色体基因phoQ和pmrB的突变以及mgrB的插入突变[20, 26]或质粒介导的MCR基因[27-29]引起。
综上所述,湖南地区2012—2021年克雷伯菌属细菌对碳青霉烯类药物耐药率较低。未来应继续加强抗菌药物合理使用和医院感染控制工作,减少耐药菌株的产生和克隆性传播[30]。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Mathur P, Malpiedi P, Walia K, et al. Health-care-associated bloodstream and urinary tract infections in a network of hospitals in India: a multicentre, hospital-based, prospective surveillance study[J]. Lancet Glob Health, 2022, 10(9): e1317-e1325. DOI:10.1016/S2214-109X(22)00274-1 |
| [2] |
Luterbach CL, Chen L, Komarow L, et al. Transmission of carbapenem-resistant Klebsiella pneumoniae in US hospitals[J]. Clin Infect Dis, 2023, 76(2): 229-237. DOI:10.1093/cid/ciac791 |
| [3] |
Chen T, Wang Y, Zhou YZ, et al. Recombination drives evolution of carbapenem-resistant Klebsiella pneumoniae sequence type 11 KL47 to KL64 in China[J]. Microbiol Spectr, 2023, 11(1): e0110722. DOI:10.1128/spectrum.01107-22 |
| [4] |
全国细菌耐药监测网. 《全国细菌耐药监测网技术方案(2022年版)》修订说明[EB/OL]. (2022-04-06)[2022-11-15]. https://www.carss.cn/Notice/Details/823. China Antimicrobial Resistance Surveillance System. Revision explanation of the technical plan for China Antimicrobial Resistance Surveillance System (2022 edition)[EB/OL]. (2022-04-06)[2022-11-15]. https://www.carss.cn/Notice/Details/823. |
| [5] |
Clinical and Laboratory Standards Institute. Methods for antimicrobial susceptibility testing for human mycoplasmas; app-roved guideline: M43-A[S]. Malvern, PA, USA: CLSI, 2011.
|
| [6] |
Barry AL, Jones RN. Criteria for disk susceptibility tests and quality control guidelines for the cefoperazone-sulbactam combination[J]. J Clin Microbiol, 1988, 26(1): 13-17. DOI:10.1128/jcm.26.1.13-17.1988 |
| [7] |
Jones RN, Barry AL, Packer RR, et al. In vitro antimicrobial spectrum, occurrence of synergy, and recommendations for dilution susceptibility testing concentrations of the cefoperazone-sulbactam combination[J]. J Clin Microbiol, 1987, 25(9): 1725-1729. DOI:10.1128/jcm.25.9.1725-1729.1987 |
| [8] |
U.S. Food and Drug Administration. Tigecycline-injection products[EB/OL]. (2023-01-26)[2023-08-04]. https://www.fda.gov/drugs/development-resources/tigecycline-injection-products.
|
| [9] |
Satlin MJ, Lewis JS Ⅱ, Weinstein MP, et al. Clinical and Laboratory Standards Institute and European Committee on Antimicrobial Susceptibility Testing position statements on polymyxin B and colistin clinical breakpoints[J]. Clin Infect Dis, 2020, 71(9): e523-e529. |
| [10] |
胡付品, 郭燕, 朱德妹, 等. 2021年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2022, 22(5): 521-530. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of antimicrobial resistance among the bacterial isolates in 2021[J]. Chinese Journal of Infection and Chemotherapy, 2022, 22(5): 521-530. |
| [11] |
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年耐碳青霉烯类肺炎克雷伯菌流行病学变迁[J]. 中国感染控制杂志, 2021, 20(2): 175-179. China Antimicrobial Resistance Surveillance System. Epidemiological change in carbapenem-resistant Klebsiella pneumoniae: surveillance report from China Antimicrobial Resistance Surveillance in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(2): 175-179. DOI:10.12138/j.issn.1671-9638.20216172 |
| [12] |
李耘, 郑波, 吕媛, 等. 中国细菌耐药监测(CARST)研究2019—2020革兰氏阴性菌监测报告[J]. 中国临床药理学杂志, 2022, 38(5): 432-452. Li Y, Zheng B, Lv Y, et al. Antimicrobial susceptibility of Gram-negative organisms: results from China antimicrobial resistance surveillance trial (CARST) program, 2019-2020[J]. The Chinese Journal of Clinical Pharmacology, 2022, 38(5): 432-452. |
| [13] |
付盼, 王传清, 俞蕙, 等. 中国儿童细菌耐药监测组2021年儿童细菌耐药监测[J]. 中国循证儿科杂志, 2022, 17(5): 355-362. Fu P, Wang CQ, Yu H, et al. Antimicrobial resistance profile of clinical strains isolated from children in China: a report from the ISPED program in 2021[J]. Chinese Journal of Evidence Based Pediatrics, 2022, 17(5): 355-362. |
| [14] |
Zhu XK, Yue CW, Geng HX, et al. Coexistence of tet(A) and blaKPC-2 in the ST11 hypervirulent tigecycline- and carba-penem-resistant Klebsiella pneumoniae isolated from a blood sample[J]. Eur J Clin Microbiol Infect Dis, 2023, 42(1): 23-31. DOI:10.1007/s10096-022-04512-6 |
| [15] |
Zhang FL, Li ZY, Liu XM, et al. Molecular characteristics of an NDM-4 and OXA-181 co-producing K51-ST16 carbapenem-resistant Klebsiella pneumoniae: study of its potential dissemination mediated by conjugative plasmids and insertion sequences[J]. Antimicrob Agents Chemother, 2023, 67(1): e0135422. DOI:10.1128/aac.01354-22 |
| [16] |
Huang JZ, Yi M, Yuan YL, et al. Emergence of a fatal ST11-KL64 tigecycline-resistant hypervirulent Klebsiella pneumoniae clone cocarrying blaNDM and blaKPC in plasmids[J]. Microbiol Spectr, 2022, 10(6): e0253922. DOI:10.1128/spectrum.02539-22 |
| [17] |
Lou T, Du XX, Zhang P, et al. Risk factors for infection and mortality caused by carbapenem-resistant Klebsiella pneumoniae: a large multicentre case-control and cohort study[J]. J Infect, 2022, 84(5): 637-647. DOI:10.1016/j.jinf.2022.03.010 |
| [18] |
Chen J, Ma H, Huang XM, et al. Risk factors and mortality of carbapenem-resistant Klebsiella pneumoniae bloodstream infection in a tertiary-care hospital in China: an eight-year retrospective study[J]. Antimicrob Resist Infect Control, 2022, 11(1): 161. DOI:10.1186/s13756-022-01204-w |
| [19] |
Huang WZ, Qiao F, Zhang YY, et al. In-hospital medical costs of infections caused by carbapenem-resistant Klebsiella pneumoniae[J]. Clin Infect Dis, 2018, 67(Suppl 2): S225-S230. |
| [20] |
Tang ML, Li J, Liu ZJ, et al. Clonal transmission of polymyxin B-resistant hypervirulent Klebsiella pneumoniae isolates coharboring blaNDM-1 and blaKPC-2 in a tertiary hospital in China[J]. BMC Microbiol, 2023, 23(1): 64. DOI:10.1186/s12866-023-02808-x |
| [21] |
Havan M, Kendirli T, Parlar ÖT, et al. Clinical management of a pandrug-resistant OXA-48 Klebsiella pneumoniae infection in the pediatric intensive care unit[J]. Microb Drug Resist, 2023, 29(6): 256-262. DOI:10.1089/mdr.2022.0247 |
| [22] |
Pirš M, Cerar Kišek T, Križan Hergouth V, et al. Successful control of the first OXA-48 and/or NDM carbapenemase-producing Klebsiella pneumoniae outbreak in Slovenia 2014-2016[J]. J Hosp Infect, 2019, 101(2): 142-149. DOI:10.1016/j.jhin.2018.10.022 |
| [23] |
Clarivet B, Grau D, Jumas-Bilak E, et al. Persisting transmission of carbapenemase-producing Klebsiella pneumoniae due to an environmental reservoir in a university hospital, France, 2012 to 2014[J]. Euro Surveill, 2016, 21(17): 30213. |
| [24] |
Yin DD, Dong D, Li K, et al. Clonal dissemination of OXA-232 carbapenemase-producing Klebsiella pneumoniae in neonates[J]. Antimicrob Agents Chemother, 2017, 61(8): e00385-17. |
| [25] |
丁丽, 陈佰义, 李敏, 等. 碳青霉烯类耐药革兰阴性菌联合药敏试验及报告专家共识[J]. 中国感染与化疗杂志, 2023, 23(1): 80-90. Ding L, Chen BY, Li M, et al. Expert consensus on antimicrobial synergy testing and reporting of carbapenem-resistant Gram-negative bacteria[J]. Chinese Journal of Infection and Chemotherapy, 2023, 23(1): 80-90. |
| [26] |
Li ZY, Liu XM, Lei ZC, et al. Genetic diversity of polymyxin-resistance mechanisms in clinical isolates of carbapenem-resistant Klebsiella pneumoniae: a multicenter study in China[J]. Microbiol Spectr, 2023, 11(2): e0523122. DOI:10.1128/spectrum.05231-22 |
| [27] |
Liu YY, Wang Y, Walsh TR, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study[J]. Lancet Infect Dis, 2016, 16(2): 161-168. DOI:10.1016/S1473-3099(15)00424-7 |
| [28] |
Lu JY, Dong N, Liu CC, et al. Prevalence and molecular epidemiology of mcr-1-positive Klebsiella pneumoniae in healthy adults from China[J]. J Antimicrob Chemother, 2020, 75(9): 2485-2494. DOI:10.1093/jac/dkaa210 |
| [29] |
Liu YY, Zhu XQ, Nang SC, et al. Greater invasion and persistence of mcr-1- bearing plasmids in Escherichia coli than in Klebsiella pneumoniae[J]. Microbiol Spectr, 2023, 11(2): e0322322. DOI:10.1128/spectrum.03223-22 |
| [30] |
杨启文, 吴安华, 胡必杰, 等. 临床重要耐药菌感染传播防控策略专家共识[J]. 中国感染控制杂志, 2021, 20(1): 1-14. Yang QW, Wu AH, Hu BJ, et al. Expert consensus on strategies for the prevention and control of spread of clinically important antimicrobial-resistant organisms[J]. Chinese Journal of Infection Control, 2021, 20(1): 1-14. DOI:10.12138/j.issn.1671-9638.20218124 |



