肺炎克雷伯菌属于肠杆菌目,随着碳青霉烯类药物的应用,耐碳青霉烯类肺炎克雷伯菌(carba-penem-resistant Klebsiella pneumoniae, CRKP)的分离率逐年上升。2022年全国细菌耐药监测网监测结果显示,CRKP分离率达26%~27.5%,远高于2005年(2.9%~3%)。我国临床分离株中碳青霉烯酶总体以肺炎克雷伯菌碳青霉烯酶(Klebsiella pneumoniae carbapenemase, KPC)为主,CRKP对替加环素、头孢他啶/阿维巴坦(ceftazidime/avibactam, CAZ/AVI)、黏菌素、多黏菌素B耐药率远低于其他抗菌药物[1],耐药率分别为6.1%、6.8%、7.2%、7.7%[2]。产KPC肺炎克雷伯菌(KPC-producing Klebsiella pneumoniae, KPC-KP)已成为一种在世界范围内造成严重感染的病原体[3]。KPC-KP目前虽对多黏菌素、CAZ/AVI较敏感,但多黏菌素肾毒性和神经毒性限制了其临床应用,且KPC-KP对多黏菌素和CAZ/AVI耐药的报道日益增加。2017—2019年中国福建的一项流行病学研究[3]发现,121株CRKP菌株中有23株(19.01%)对CAZ/AVI耐药。一项来自巴西的研究[4]探讨了CRKP对多黏菌素B的耐药性,研究纳入了3 085株肺炎克雷伯菌,碳青霉烯类耐药性显著增加(P<0.001),从6.8%(2011年)增加至35.5%(2015年);CRKP对多黏菌素B的耐药率呈明显上升趋势(P<0.001),从2010年的0上升至2014年的24.8%、2015年的27.1%;因可用于治疗KPC-KP感染的药物有限,且其对既往敏感药物耐药率逐渐升高,KPC-KP感染病死率较高。
1 KPC-KP流行病学首株KPC-KP于1996年在美国北卡罗来纳州被发现,之后KPC-KP逐渐蔓延到世界许多地方,在其他肠杆菌目细菌中发现了KPC基因。KPC基因传播机制除了耐碳青霉烯类肠杆菌在医院内的克隆性传播外,还可通过可移动的遗传元件和质粒进行水平传播[5]。目前尚无准确流行病学数据描述KPC-KP感染在世界范围内的发生情况。在中国和新加坡,大多数对碳青霉烯类耐药的高毒力肺炎克雷伯菌(carbapenem-resistant hypervirulent Klebsiella pneumoniae, CR-hvKp)菌株产KPC,而在美国、英国和日本,其他碳青霉烯酶如NDM、IMP、OXA-48等在CR-hvKp菌株中占主导地位[6]。回顾性分析爱尔兰一所三级医院2009—2020年产碳青霉烯酶肠杆菌(carbapenemase-producing Enterobacterales, CPE)分离患者的感染情况、危险因素及流行病学[7]发现,460例患者分离的CPE菌株中,KPC是最常见的碳青霉烯酶,占所有CPE酶的87.4%;住院时间长、使用过碳青霉烯类抗生素、透析、机械通气、输血和复杂的胸部病理是CPE获取KPC基因的危险因素。一项7个拉丁美洲国家11所医院的多中心观察性研究结果[8]显示,CPE感染是住院死亡相关的独立病死率预测因子。
2 KPC-KP治疗研究进展目前有效治疗KPC-KP感染的药物有多黏菌素、替加环素、CAZ/AVI、碳青霉烯类抗生素,但近年来KPC-KP对上述药物耐药的报道逐渐增加,美罗培南/法硼巴坦、亚胺培南/瑞来巴坦、头孢地尔等药物被发现抗菌效果较好。大量研究表明,联合用药可能较单一用药效果更佳,可作为单一用药效果不佳或耐药的替代治疗。
2.1 β-内酰胺酶抑制剂复合制剂 2.1.1 美罗培南/法硼巴坦法硼巴坦是一种新型的β-内酰胺酶抑制剂,单独使用无抗菌活性,但能明显提高美罗培南对A类β-内酰胺酶和头孢菌素酶的抑制活性[9]。目前被美国食品药品监督管理局(FDA)批准与美罗培南联合用于治疗复杂的尿路感染。体外研究[10-11]表明,美罗培南/法硼巴坦对含有KPC-2和KPC-3的病原菌具有很好的抑制活性。然而,美罗培南/法硼巴坦对OXA-48或金属β-内酰胺酶没有活性。
Huang等[12]对58株耐碳青霉烯类大肠埃希菌(carbapenem-resistant Escherichia coli, CREC)进行了最低抑菌浓度(MIC)值及基因型测定,其中50%产KPC的菌株对美罗培南/法硼巴坦敏感(MIC≤0.003/8 μg/mL)(见表 1)。Zhou等[13]采用肉汤微量稀释法,检测了美罗培南/法硼巴坦对分离的128株CPE的体外抗菌活性,结果显示美罗培南与法硼巴坦联合较单独美罗培南的MIC50、MIC90分别从4、8 μg/mL降至0.5、8 μg/mL,对肺炎克雷伯菌和大肠埃希菌的抑制率分别为76.6%、100%(表 1)。临床上,美罗培南/法硼巴坦可用于耐CAZ/AVI的KPC变异型CRKP感染的治疗。1例24岁肝移植失败受者,伴有膈下脓肿及KPC-KP感染,使用CAZ/AVI治疗出现耐药,而使用美罗培南/法硼巴坦治疗后感染逐步控制[14]。1例接受髋关节置换手术的68岁男性患者,感染产KPC-3肺炎克雷伯菌反复发生菌血症,停用CAZ/AVI后血培养回报肺炎克雷伯菌,对CAZ/AVI(MIC>8 μg/mL) 和头孢地洛(MIC为16 μg/mL)耐药,而恢复了对美罗培南的敏感性(MIC为2 μg/mL),应用美罗培南/法硼巴坦治疗后感染逐渐好转[15],其机制为KPC酶结构变异导致碳青霉烯酶活性降低,碳青霉烯类抗生素可重新发挥作用(见表 1)。一项前瞻性临床试验[16]研究了美罗培南/法硼巴坦与其他抗菌药物(厄他培南、美罗培南、亚胺培南、替加环素、阿米卡星、庆大霉素、妥布霉素、黏菌素、多黏菌素B和CAZ/AVI)在治疗严重CPE感染(如菌血症、医院获得性肺炎/呼吸机相关肺炎、复杂性泌尿系统感染和肾盂肾炎)患者中的疗效、安全性和耐受性,结果显示美罗培南/法硼巴坦治愈率更高(64.3% VS 33.3%,P=0.04),28天全因死亡率相对降低33.3% (P=0.03)。
| 表 1 抗菌药物对KPC-KP抗菌活性 |
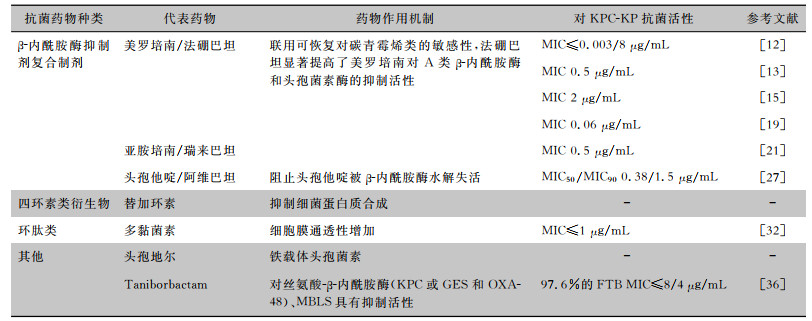
|
在动物试验中,研究表明美罗培南/法硼巴坦联用较美罗培南单用对KPC-KP感染小鼠抗感染作用更强,可能与法硼巴坦可恢复美罗培南对CPE的活性有关[17-18]。Weiss等[19]使用3株临床分离株感染小鼠模拟人体暴露,3株菌株(肺炎克雷伯菌UNT170-1、UNT171-1和大肠埃希菌UNT167-1)均对美罗培南耐药,MIC为32 μg/mL,且产KPC,加入法硼巴坦使美罗培南MIC降至0.06 μg/mL,从而使3株菌株对美罗培南均敏感;在感染后第4天和第5天肾脏细菌平均滴度分别为6.39、6.74对数值CFU;与对照组相比,可使肾脏的细菌负荷平均减少1.51对数值CFU(P=0.0015);美罗培南和法硼巴坦联用肾脏细菌滴度低于单独应用美罗培南(P<0.05)(见表 1)。Sabet等[20]评估美罗培南单独和联用法硼巴坦对CPE临床分离株诱导小鼠大腿和肺部感染模型的疗效,美罗培南与法硼巴坦联合使用对所有菌株均产生了杀灭作用;与对照组相比,杀灭细菌数更多(0.8~2.89对数值CFU,P<0.05)。
2.1.2 亚胺培南/瑞来巴坦亚胺培南/瑞来巴坦是一种新型碳青霉烯类抗生素与β-内酰胺酶抑制剂的复合制剂,瑞来巴坦对A类β-内酰胺酶如超广谱β-内酰胺酶(ESBLs)、KPCs和头孢菌素酶(如AmpC酶)显示出良好的体外抑制活性[21],并恢复亚胺培南对KPC的活性[21-22](见表 1)。瑞来巴坦使对亚胺培南不敏感的铜绿假单胞菌(n=477)敏感性从0增加至81%[23]。FDA建议,可使用亚胺培南/西司他丁/瑞来巴坦治疗成人慢性腹腔感染和慢性尿路感染(包括肾盂肾炎)。
西班牙对24所医院临床分离的401株CPE进行耐药基因及MIC值检测,结果显示所有菌株对黏菌素、亚胺培南/瑞来巴坦和CAZ/AVI的敏感率较高,分别为86.5%(MIC50/MIC90=0.12/8 μg/mL)、85.8%(MIC50/MIC90=0.5/4 μg/mL)、83.8%(MIC50/MIC90=1/256 μg/mL);产OXA-48和产KPC的菌株对CAZ/AVI和亚胺培南/雷巴坦的敏感率分别为97.7%(MIC50/MIC90=1/2 mg/L)、100%(MIC50/MIC90=0.25/1 μg/mL)[22]。另一项研究[24]评价了包括亚胺培南/瑞来巴坦在内的19种抗菌药物对106株主要表达KPC的CRE血流分离株和20株表达OXA-48的CRE分离株的体外抗菌活性,95%的CRE血液分离株对亚胺培南/瑞来巴坦敏感;CAZ/AVI对OXA-48 CRE菌株的体外抗菌活性高于亚胺培南/瑞来巴坦(敏感率为90% VS 15%)。Yang等[25]对472株碳青霉烯类不敏感的肺炎克雷伯菌(其中大部分产KPC)进行研究,采用琼脂稀释法评价亚胺培南单药和亚胺培南/瑞来巴坦联合的体外抗菌活性,显示联合药物敏感率更高(82.8% VS 18.9%),以上结果表明亚胺培南/瑞来巴坦对产KPC的CRE菌株抗菌活性更佳。
2.1.3 CAZ/AVICAZ/AVI由β-内酰胺酶抑制剂阿维巴坦和第三代头孢菌素头孢他啶组合而成,阿维巴坦可有效抑制KPC酶的活性,与头孢他啶联合使用时可恢复对KPC-KP感染菌株的杀菌作用。美国94个医学中心于2013—2016年对513株头孢他啶、美罗培南和哌拉西林/他唑巴坦(n=628)不敏感的菌株进行了CAZ/AVI的体外抗菌活性检测,结果显示71.8%的CPE分离株对CAZ/AVI敏感[26]。对30株产KPC临床分离株进行体外抗菌活性的检测,对其中4株菌株(2株为肺炎克雷伯菌)进行了多黏菌素、替加环素、阿米卡星、CAZ/AVI 96 h的体外药代动力学/药效学模型研究,结果显示97%的产KPC菌株对CAZ/AVI敏感,MIC50/MIC90为0.38/1.5 μg/mL;KPC-KP对CAZ/AVI高度敏感,CAZ/AVI可能是有效治疗此类感染的抗生素之一[27](见表 1)。
应用CAZ/AVI需要注意剂量问题。通过药敏试验、基因序列分析、时间杀灭试验[28-29]结果显示,对CAZ/AVI敏感的KPC-KP细胞,当CAZ/AVI浓度为20/3.75 μg/mL时不能达到杀菌活性,KPC-KP菌株出现再生长;当药物浓度≥40/7.5 μg/mL时,细胞平均杀灭率提高(5.42对数值CFU/mL),细胞再生长受到抑制,说明通过增加抗菌药物剂量可抵抗耐药性产生,可采取增加CAZ/AVI剂量的策略治疗对CAZ/AVI耐药的KPC-KP感染。然而,随着CAZ/AVI逐渐应用于临床治疗,不断出现KPC-KP对其耐药的报道[29-34],耐药机制多为KPC酶的结构变异,以KPC-2、KPC-3最为多见。
2.2 替加环素和多黏菌素替加环素为甘氨酰环素类抗生素,属于四环素类衍生物,通过抑制细菌蛋白质合成发挥广谱抑菌作用。Van等[30]研究替加环素单一疗法与美罗培南单一疗法在致死性大叶性肺炎-败血症大鼠模型中的治疗效果,以1株产ESBLs的肺炎克雷伯菌和1株KPC-KP为研究对象,用于诱导大鼠肺炎-败血症;替加环素或美罗培南在大鼠发生进行性感染时开始治疗,在产ESBLs肺炎克雷伯菌败血症大鼠中,美罗培南治疗24 h后细菌再生长,而所有KPC-KP败血症大鼠均可通过25 mg/kg·d的大剂量替加环素治疗而治愈,说明大剂量替加环素可作为治疗严重多重耐药细菌感染方案的药物。但替加环素与美罗培南可发生拮抗作用(部分抑菌浓度指数为8.5),临床上应避免此两种药物联合用于KPC-KP感染的治疗。
磷霉素,一种抑制肽聚糖合成的广谱抗生素。Wang等[31]在中国不同的医院收集了136株临床KPC-KP进行试验,发现磷霉素与替加环素联合使用可使磷霉素MIC90降至64 μg/mL,联合治疗使肾功能正常者累积有效率(CFR)值>80%,肾功能损伤者CFR值>90%。因此,经验性治疗KPC-KP感染可采用磷霉素和替加环素联合方案治疗。
多黏菌素是由多黏类芽孢杆菌产生的一组环肽类抗生素,FDA已经批准其用于治疗多重耐药的革兰阴性菌的严重感染,可用于治疗铜绿假单胞菌、肠杆菌目细菌以及鲍曼不动杆菌感染引起的尿路、中枢神经系统和血流感染。在一项前瞻性临床试验[32]中,血流KPC-KP感染患者经多黏菌素B治疗后KPC-KP被清除(多黏菌素B MIC≤1 μg/mL)(见表 1)。一项Meta分析结果[33]显示,以多黏菌素为基础联合疗法比单一疗法病死率低(OR值为2.04,P=0.0007),但有研究[34]表明KPC-KP对多黏菌素耐药率逐年增加,2011年为0,2014年为4.8%,2015年为27.1%。Conceição-Neto等[34]研究了502株肺炎克雷伯菌对多黏菌素E的耐药性及基因表达情况,结果显示在77%的分离株中发现KPC基因,肺炎克雷伯菌对多黏菌素E的耐药率为29.5% (148株);在对多黏菌素E耐药的菌株中,92.1%(47/51)菌株对CAZ/AVI敏感,可见CAZ/AVI可选择性用于对多黏菌素E耐药菌株感染的治疗。
2.3 其他头孢地尔是一种新的铁载体头孢菌素,对多重耐药的革兰阴性杆菌有很强的抗菌活性。1例成年严重H1N1流感男性患者,合并广泛耐药鲍曼不动杆菌和KPC-KP引起的呼吸机相关肺炎和血流感染,经CAZ/AVI、磷霉素、碳青霉烯类联合抗感染治疗仍反复发热,序贯器官衰竭(sequential organ failure assessment, SOFA)评分进展,试验性使用头孢地尔治疗后病情逐渐控制[35]。
Taniborbactam是一种双环硼酸酯,对丝氨酸-β-内酰胺酶(KPC或GES和OXA-48)、金属β-内酰胺酶(metallo-β-lactamases, MBLs)具有抑制活性。Hernández等[36]在西班牙8所医院前瞻性收集了来自不同标本来源的247株CPE和170株耐碳青霉烯类假单胞菌,评估了cefepime-taniborbactam(FTB)及其对照药物对以上菌株的体外活性;通过基因检测发现所有肠杆菌属分离株均产碳青霉烯酶;肠杆菌属细菌中FTB敏感性最高(97.6%的FTB对细菌MIC值≤8/4 μg/mL,MIC50为0.5/4 μg/mL,MIC90为4/4 μg/mL),其次是美罗培南/法硼巴坦(MIC50为1/8 μg/mL,MIC90为16/8 μg/mL)和阿米卡星(MIC50为0.5 μg/mL,MIC90为0.64 μg/mL)。FTB对KPC和OXA-48型菌株表现出良好的活性(敏感率分别为96%~100%、100%)(见表 1)。
香芹酚[2-甲基-5-(1-甲乙基)苯酚,百里香酚的异构体]是唇形科植物精油的重要成分,具有抗炎、抗氧化、抗肿瘤、镇痛、抗肝毒性、杀虫和抗微生物特性。香芹酚对产CTX-M-8、OXA-48、KPC和多黏菌素耐药肺炎克雷伯菌有明显的抑制作用,MIC/最低杀菌浓度(MBC)为130 μg/mL[37]。
2.4 联合用药经验Ojdana等[38]研究了CAZ/AVI、厄他培南、磷霉素和替加环素对KPC-KP的协同作用,所有受试菌株对厄他培南不敏感,CAZ/AVI与厄他培南、磷霉素和替加环素的所有受试组合之间存在协同作用,对产KPC菌株发挥协同作用的菌株比率分别为100%(8/8)、37.5%(3/8)、12.5% (1/8),结果表明CAZ/AVI与厄他培南联合治疗对KPC-KP的协同作用最强。这一结果在另一项研究中被证实,Romanelli等[2]采用E-test法评价了CAZ/AVI单药及与磷霉素和碳青霉烯类(亚胺培南、美罗培南、厄他培南)联合对KPC-KP临床分离株的体外抗菌活性,结果显示CAZ/AVI与磷霉素联用FIC值、MIC值高于与碳青霉烯类联用,说明CAZ/AVI与碳青霉烯类联用抗菌效果更好。一项病例报告表明CAZ/AVI与磷霉素、碳青霉烯联用即三联疗法也具有抗菌效果。Carannante等[39]描述了1例KPC-KP蜂窝织炎的患者,在接受10 d CAZ/AVI、美罗培南、磷霉素的联合治疗后,溃疡和直肠拭子的培养和分子检测结果均为阴性。此外,CAZ-AVI、黏菌素和替加环素联合可作为发热且病情危重的血液病患者的潜在治疗。1例65岁的白血病患者,粒细胞缺乏期间出现发热,血培养及药敏结果提示病原菌对CAZ/AVI敏感,应用CAZ/AVI联合庆大霉素抗感染治疗,虽血培养回报阴性,但病情尚未控制,予大剂量CAZ/AVI(2.5 g,q6h)、黏菌素和替加环素联合治疗后病情逐渐好转[37, 40],全基因组测序结果显示该菌株为产KPC型菌。1例革兰阴性杆菌脓毒症血栓形成的患者,在持续性血流感染和抗凝状态不佳的情况下,血培养药敏试验结果及体外抗菌活性检测显示,菌株对CAZ/AVI耐药,美罗培南与磷霉素联合具有很高的协同作用,联合应用美罗培南+磷霉素治疗,患者治愈[41]。
磷霉素和多黏菌素联用亦可作为潜在的治疗选择,Bulman等[42]在中空纤维感染模型中,探讨了多黏菌素B两种方案前负荷(3.33 mg/kg 1剂,12 h后开始,1.43 mg/kg,q12h)和负荷剂量(5.53 mg/kg,1剂,随后不再给药)联合磷霉素(4 g,q8h)对产KPC-2肺炎克雷伯菌ST258的作用;对KPCKp9A菌株,单药处理在3 h内杀灭≥3对数值CFU/mL,但在48 h内可使抗性亚群重新生长和增殖,多黏菌素B与磷霉素联合应用可迅速杀灭细菌(>6对数值CFU/mL);对于具有较高磷霉素MIC的KPC-KP24A菌株,多黏菌素B(5.53 mg/kg,1剂,随后不再给药)和磷霉素联合使用在1 h内可使菌量下降>6对数值CFU/mL。
多黏菌素、替加环素为治疗CPE感染的经典药物,一项关于小鼠KPC-KP感染的研究发现,两者联合利福平杀菌作用更强。Aye等[43]比较了多黏菌素单一疗法、双重和三联疗法(多黏菌素、替加环素联合利福平)对6株KPC-KP小鼠大腿感染模型的治疗效果,所有单一疗法(多黏菌素B、利福平、阿米卡星、美罗培南或米诺环素)均无效;不同的含多黏菌素B的二联用药对细菌的初始杀灭作用较强,但在大多数情况下,在24 h后基本恢复生长,多数含多黏菌素B的三联用药的杀菌效果和持续杀菌效果均优于二联用药,所有6株分离株在大腿的CFU均比开始接种前减少1.7对数值CFU。
3 总结展望我国CRKP耐药机制主要为产KPC,而越来越多的报道发现CRKP对CAZ/AVI的耐药性,且多数由KPC突变所致,KPC-KP对经典药物(如替加环素、多黏菌素等)耐药率逐年增加,且预示高病死率。目前对于KPC-KP感染的治疗,除经典药物外,美罗培南/法硼巴坦、亚胺培南/瑞来巴坦、CAZ/AVI等被证实抗菌效果较好,联合用药比单一用药在临床上用于严重感染效果更佳,目前研究较少的头孢地尔、cefepime-taniborbactam也有抗菌作用,但目前尚无大数据临床试验证实,临床安全性和有效性尚不明确,未来应继续深入研究治疗药物试验向临床的转化及探究KPC-KP耐药机制,同时应注意对目前药物敏感的细菌耐药性逐渐增加,故研发新药仍是未来重点方向。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年耐碳青霉烯类肺炎克雷伯菌流行病学变迁[J]. 中国感染控制杂志, 2021, 20(2): 175-179. China Antimicrobial Resistance Surveillance System. Epidemiological change in carbapenem-resistant Klebsiella pneumoniae: surveillance report from China Antimicrobial Resistance Surveillance in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(2): 175-179. |
| [2] |
Romanelli F, De Robertis A, Carone G, et al. In vitro activity of ceftazidime/avibactam alone and in combination with fosfomycin and carbapenems against KPC-producing Klebsiella pneumoniae[J]. New Microbiol, 2020, 43(3): 136-138. |
| [3] |
Chen D, Xiao L, Hong D, et al. Epidemiology of resistance of carbapenemase-producing Klebsiella pneumoniae to ceftazidime-avibactam in a Chinese hospital[J]. J Appl Microbiol, 2022, 132(1): 237-243. DOI:10.1111/jam.15166 |
| [4] |
Bartolleti F, Seco BMS, Capuzzo Dos Santos C, et al. Polymyxin B resistance in carbapenem-resistant Klebsiella pneumoniae, São Paulo, Brazil[J]. Emerg Infect Dis, 2016, 22(10): 1849-1851. DOI:10.3201/eid2210.160695 |
| [5] |
Hussein K, Geffen Y, Eluk O, et al. The changing epidemiology of carbapenemase-producing Enterobacterales[J]. Rambam Maimonides Med J, 2022, 13(1): e0004. DOI:10.5041/RMMJ.10461 |
| [6] |
Tian DX, Liu X, Chen WJ, et al. Prevalence of hypervirulent and carbapenem-resistant Klebsiella pneumoniae under divergent evolutionary patterns[J]. Emerg Microbes Infect, 2022, 11(1): 1936-1949. DOI:10.1080/22221751.2022.2103454 |
| [7] |
O'Connell NH, Gasior S, Slevin B, et al. Microbial epidemiology and clinical risk factors of carbapenemase-producing Enterobacterales amongst Irish patients from first detection in 2009 until 2020[J]. Infect Prev Pract, 2022, 4(3): 100230. DOI:10.1016/j.infpip.2022.100230 |
| [8] |
Villegas MV, Pallares CJ, Escandón-Vargas K, et al. Characterization and clinical impact of bloodstream infection caused by carbapenemase-producing Enterobacteriaceae in seven Latin American countries[J]. PLoS One, 2016, 11(4): e0154092. DOI:10.1371/journal.pone.0154092 |
| [9] |
殷晔, 张秀红. 美罗培南法硼巴坦的研究进展[J]. 中国新药与临床杂志, 2022, 41(3): 129-133. Yin Y, Zhang XH. Research progress of meropenem-vaborbactam[J]. Chinese Journal of New Drugs and Clinical Remedies, 2022, 41(3): 129-133. |
| [10] |
Griffith DC, Sabet M, Tarazi Z, et al. Pharmacokinetics/pharmacodynamics of vaborbactam, a novel beta-lactamase inhibitor, in combination with meropenem[J]. Antimicrob Agents Chemother, 2019, 63(1): e01659-18. |
| [11] |
Bhowmick T, Weinstein MP. Microbiology of meropenem-vaborbactam: a novel carbapenem beta-lactamase inhibitor combination for carbapenem-resistant Enterobacterales infections[J]. Infect Dis Ther, 2020, 9(4): 757-767. DOI:10.1007/s40121-020-00350-1 |
| [12] |
Huang N, Chen T, Chen LQ, et al. In vitro Activity of meropenem-vaborbactam versus other antibiotics against carbapenem-resistant Escherichia coli from Southeastern China[J]. Infect Drug Resist, 2021, 14: 2499-2507. DOI:10.2147/IDR.S315384 |
| [13] |
Zhou ML, Yang QW, Lomovskaya O, et al. In vitro activity of meropenem combined with vaborbactam against KPC-producing Enterobacteriaceae in China[J]. J Antimicrob Chemother, 2018, 73(10): 2789-2796. DOI:10.1093/jac/dky251 |
| [14] |
Athans V, Neuner EA, Hassouna H, et al. Meropenem-vaborbactam as salvage therapy for ceftazidime-avibactam-resistant Klebsiella pneumoniae bacteremia and abscess in a liver transplant recipient[J]. Antimicrob Agents Chemother, 2019, 63(1): e01551-18. |
| [15] |
Tiseo G, Falcone M, Leonildi A, et al. Meropenem-vaborbactam as salvage therapy for ceftazidime-avibactam-, cefiderocol-resistant ST-512 Klebsiella pneumoniae-producing KPC-31, a D179Y variant of KPC-3[J]. Open Forum Infect Dis, 2021, 8(6): ofab141. DOI:10.1093/ofid/ofab141 |
| [16] |
Wunderink RG, Giamarellos-Bourboulis EJ, Rahav G, et al. Effect and safety of meropenem-vaborbactam versus best-available therapy in patients with carbapenem-resistant Enterobacteriaceae infections: the TANGO Ⅱ randomized clinical trial[J]. Infect Dis Ther, 2018, 7(4): 439-455. DOI:10.1007/s40121-018-0214-1 |
| [17] |
Jorgensen SCJ, Rybak MJ. Meropenem and vaborbactam: stepping up the battle against carbapenem-resistant Enterobacteriaceae[J]. Pharmacotherapy, 2018, 38(4): 444-461. DOI:10.1002/phar.2092 |
| [18] |
Kinn PM, Chen DJ, Gihring TM, et al. In vitro evaluation of meropenem-vaborbactam against clinical CRE isolates at a tertiary care center with low KPC-mediated carbapenem resistance[J]. Diagn Microbiol Infect Dis, 2019, 93(3): 258-260. DOI:10.1016/j.diagmicrobio.2018.09.017 |
| [19] |
Weiss WJ, Pulse ME, Nguyen P, et al. Activity of meropenem-vaborbactam against carbapenem-resistant Enterobacteria-ceae in a murine model of pyelonephritis[J]. Antimicrob Agents Chemother, 2018, 62(1): e01439-17. |
| [20] |
Sabet M, Tarazi Z, Nolan T, et al. Activity of meropenem-vaborbactam in mouse models of infection due to KPC-producing carbapenem-resistant Enterobacteriaceae[J]. Antimicrob Agents Chemother, 2018, 62(1): e01446-17. |
| [21] |
Vázquez-Ucha JC, Seoane-Estévez A, Rodiño-Janeiro BK, et al. Activity of imipenem/relebactam against a Spanish nationwide collection of carbapenemase-producing Enterobacterales[J]. J Antimicrob Chemother, 2021, 76(6): 1498-1510. DOI:10.1093/jac/dkab043 |
| [22] |
马攀, 陈勇川. 新型碳青霉烯类抗菌药物亚胺培南/雷巴坦的研究进展[J]. 中国药房, 2020, 31(13): 1659-1664. Ma P, Chen YC. Research progress of new carbapenem antibiotics imipenem/relebactam[J]. China Pharmacy, 2020, 31(13): 1659-1664. |
| [23] |
Karlowsky JA, Lob SH, Kazmierczak KM, et al. In vitro activity of imipenem/relebactam against Gram-negative ESKAPE pathogens isolated in 17 European countries: 2015 SMART surveillance programme[J]. J Antimicrob Chemother, 2018, 73(7): 1872-1879. DOI:10.1093/jac/dky107 |
| [24] |
Canver MC, Satlin MJ, Westblade LF, et al. Activity of imipenem-relebactam and comparator agents against genetically characterized isolates of carbapenem-resistant Enterobacteriaceae[J]. Antimicrob Agents Chemother, 2019, 63(9): e00672-19. |
| [25] |
Yang TY, Hsieh YJ, Kao LT, et al. Activities of imipenem-relebactam combination against carbapenem-nonsusceptible Enterobacteriaceae in Taiwan[J]. J Microbiol Immunol Infect, 2022, 55(1): 86-94. DOI:10.1016/j.jmii.2021.02.001 |
| [26] |
Sader HS, Castanheira M, Shortridge D, et al. Antimicrobial activity of ceftazidime-avibactam tested against multidrug-resistant Enterobacteriaceae and Pseudomonas aeruginosa isolates from U.S. medical centers, 2013 to 2016[J]. Antimicrob Agents Chemother, 2017, 61(11): e01045-17. |
| [27] |
Barber KE, Pogue JM, Warnock HD, et al. Ceftazidime/avibactam versus standard-of-care agents against carbapenem-resistant Enterobacteriaceae harbouring blaKPC in a one-compartment pharmacokinetic/pharmacodynamic model[J]. J Antimicrob Chemother, 2018, 73(9): 2405-2410. DOI:10.1093/jac/dky213 |
| [28] |
Tam VH, Merlau PR, Hudson CS, et al. Optimal ceftazidime/avibactam dosing exposure against KPC-producing Klebsiella pneumoniae[J]. J Antimicrob Chemother, 2022, 77(11): 3130-3137. DOI:10.1093/jac/dkac294 |
| [29] |
Huang YQ, Wu T, Perez O, et al. In vitro optimization of ceftazidime/avibactam for KPC-producing Klebsiella pneumoniae[J]. Front Microbiol, 2021, 12: 618087. DOI:10.3389/fmicb.2021.618087 |
| [30] |
Van der Weide H, Ten Kate MT, Vermeulen-de Jongh DMC, et al. Successful high-dosage monotherapy of tigecycline in a multidrug-resistant Klebsiella pneumoniae pneumonia-septicemia model in rats[J]. Antibiotics (Basel), 2020, 9(3): 109. DOI:10.3390/antibiotics9030109 |
| [31] |
Wang GA, Yu W, Cui YS, et al. Optimal empiric treatment for KPC-2-producing Klebsiella pneumoniae infections in critically ill patients with normal or decreased renal function using Monte Carlo simulation[J]. BMC Infect Dis, 2021, 21(1): 307. DOI:10.1186/s12879-021-06000-2 |
| [32] |
Shi QY, Han RR, Guo Y, et al. Multiple novel ceftazidime-avibactam-resistant variants of blaKPC-2-positive Klebsiella pneumoniae in two patients[J]. Microbiol Spectr, 2022, 10(3): e0171421. DOI:10.1128/spectrum.01714-21 |
| [33] |
Hou SY, Wu D, Feng XH. Polymyxin monotherapy versus polymyxin-based combination therapy against carbapenem-resistant Klebsiella pneumoniae: a systematic review and Meta-analysis[J]. J Glob Antimicrob Resist, 2020, 23: 197-202. DOI:10.1016/j.jgar.2020.08.024 |
| [34] |
Conceição-Neto OC, da Costa BS, Pontes LDS, et al. Polymyxin resistance in clinical isolates of K. pneumoniae in Brazil: update on molecular mechanisms, clonal dissemination and relationship with KPC-producing strains[J]. Front Cell Infect Microbiol, 2022, 12: 898125. DOI:10.3389/fcimb.2022.898125 |
| [35] |
Trecarichi EM, Quirino A, Scaglione V, et al. Successful treatment with cefiderocol for compassionate use in a critically ill patient with XDR Acinetobacter baumannii and KPC-producing Klebsiella pneumoniae: a case report[J]. J Antimicrob Chemother, 2019, 74(11): 3399-3401. DOI:10.1093/jac/dkz318 |
| [36] |
Hernández-García M, García-Castillo M, Ruiz-Garbajosa P, et al. In vitro activity of cefepime-taniborbactam against carba-penemase-producing Enterobacterales and Pseudomonas aeru-ginosa isolates recovered in Spain[J]. Antimicrob Agents Chemother, 2022, 66(3): e0216121. DOI:10.1128/aac.02161-21 |
| [37] |
de Souza GHDA, Dos Santos Radai JA, Mattos Vaz MS, et al. In vitro and in vivo antibacterial activity assays of carvacrol: a candidate for development of innovative treatments against KPC-producing Klebsiella pneumoniae[J]. PLoS One, 2021, 16(2): e0246003. DOI:10.1371/journal.pone.0246003 |
| [38] |
Ojdana D, Gutowska A, Sacha P, et al. Activity of ceftazidime-avibactam alone and in combination with ertapenem, fosfomycin, and tigecycline against carbapenemase-producing Klebsiella pneumoniae[J]. Microb Drug Resist, 2019, 25(9): 1357-1364. DOI:10.1089/mdr.2018.0234 |
| [39] |
Carannante N, Pallotto C, Bernardo M, et al. Treatment of a Klebsiella pneumoniae KPC cellulitis and gut decolonization with ceftazidime/avibactam in a migrant from Libya[J]. J Chemother, 2018, 30(3): 183-184. DOI:10.1080/1120009X.2018.1424504 |
| [40] |
Gaibani P, Bussini L, Amadesi S, et al. Successful treatment of bloodstream infection due to a KPC-producing Klebsiella pneumoniae resistant to imipenem/relebactam in a hematological patient[J]. Microorganisms, 2022, 10(4): 778. DOI:10.3390/microorganisms10040778 |
| [41] |
Oliva A, Curtolo A, Volpicelli L, et al. Synergistic meropenem/vaborbactam plus fosfomycin treatment of KPC producing K. pneumoniae septic thrombosis unresponsive to ceftazidime/avibactam: from the bench to the bedside[J]. Antibiotics (Basel), 2021, 10(7): 781. DOI:10.3390/antibiotics10070781 |
| [42] |
Bulman ZP, Zhao M, Satlin MJ, et al. Polymyxin B and fosfomycin thwart KPC-producing Klebsiella pneumoniae in the hollow-fibre infection model[J]. Int J Antimicrob Agents, 2018, 52(1): 114-118. DOI:10.1016/j.ijantimicag.2018.02.010 |
| [43] |
Aye SM, Galani I, Yu HD, et al. Polymyxin triple combinations against polymyxin-resistant, multidrug-resistant, KPC-producing Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 2020, 64(8): e00246-20. |



