2. 广西医科大学第一附属医院重症医学科, 广西 南宁 530021
2. Department of Critical Care Medicine, The First Affilia-ted Hospital of Guangxi Medical University, Nanning 530021, China
脓毒症是由感染引起的全身性炎症反应综合征,随着病情进展会引起器官功能障碍而导致死亡,病死率较高,因此寻找可快捷、准确评估患者预后的指标对临床治疗及患者生存质量具有重要意义[1]。目前已有研究[2]表明,脓毒症患者普遍存在维生素D(vitamin D, VitD)缺乏情况,且患者更易发展为严重脓毒症,并出现器官功能障碍等并发症,其在脓毒症发生、发展中起到重要作用。铁蛋白(ferritin, FRT)是一种铁贮存蛋白,在多种心血管疾病及肝细胞损伤、炎症中起到重要作用,但在重症感染性疾病中的机制尚不清楚[3]。血清肝素结合性表皮生长因子(heparin-binding epidermal growth factor, HB-EGF)对血管稳定性起到重要作用,参与脓毒症炎性反应,可因为患者休克和多功能障碍等并发症,影响患者预后[4]。但关于脓毒症患者血清VitD、FRT、HB-EGF水平与预后相关性及其预后预测价值方面的研究较少[5]。基于此,本研究以某院重症监护病房(ICU)收治的86例脓毒症患者为研究对象,检测脓毒症和非脓毒症及不同预后患者血清VitD、FRT、HB-EGF水平,分析其表达水平与脓毒症患者预后的关系,旨在为脓毒症患者预后评估提供有价值的预测指标。
1 对象与方法 1.1 研究对象选取2021年1月—2022年1月ICU收治的86例脓毒症患者作为研究对象(病例组);并选择ICU中60例非脓毒症患者作为对照组。随访脓毒症患者1个月后预后情况,将患者分为存活组和死亡组。纳入标准:①符合美国重症医学会和欧洲重症医学会联合发布的脓毒症诊断标准[6],年龄>18岁;②无凝血功能异常或免疫功能缺陷;③患者或家属知情且签署知情同意书。排除标准:①合并慢性肝、肾及免疫性疾病者;②入院24 h内死亡;③近3个月内服用过糖皮质激素类药物者;④合并恶性肿瘤者。本研究获该院伦理委员会批准。
1.2 方法取患者外周血约3 mL,以3 000 r/min,离心15 min,取上清液,采用酶联免疫吸附法(ELISA)检测患者血清VitD、FRT水平,试剂盒分别购自德国D&G公司和上海西唐生物科技有限公司,相关操作严格按试剂盒说明书进行。采用MILLI-PLEX MAP Human Cytokine/Chemokine Magnetic BeadPanel(Millipore Corp)多重蛋白检测试剂盒测定血清HB-EGF水平。使用ELISA法检测血清肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-1β(interleukin-1β, IL-1β),试剂盒均购自Abcam公司。使用全自动生化分析仪检测白细胞计数、降钙素原(procalcitonin, PCT)、C反应蛋白(C reactive protein, CRP)。进入ICU后采用急性生理和慢性健康评分量表[7](acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)评分、序贯器官衰竭估计(sequential organ failure assessment, SOFA)[8]评分进行评估。
1.3 观察指标① 比较脓毒症和非脓毒症及不同预后患者APACHE Ⅱ评分、SOFA评分、白细胞计数、CRP、PCT、TNF-α、IL-6、IL-1β、FRT、VitD、HB-EGF等临床资料;②采用Pearson相关性分析血清VitD、FRT、HB-EGF表达与脓毒症相关指标的关系;③根据血清VitD、FRT、HB-EGF水平绘制受试者工作特征曲线(ROC曲线),以曲线下面积(AUC)评估脓毒症患者预后的预测价值,AUC越大,预测价值越高。
1.4 统计学方法应用统计学软件SPSS 19.0进行数据分析,计量资料均符合正态分布,采用(x±s)表示,组内比较采取配对样本t检验,组间比较采取独立样本t检验;相关性比较采用Spearman或Pearson分析,以P≤0.05为差异有统计学意义;并根据ROC曲线计算AUC,评估其准确性。
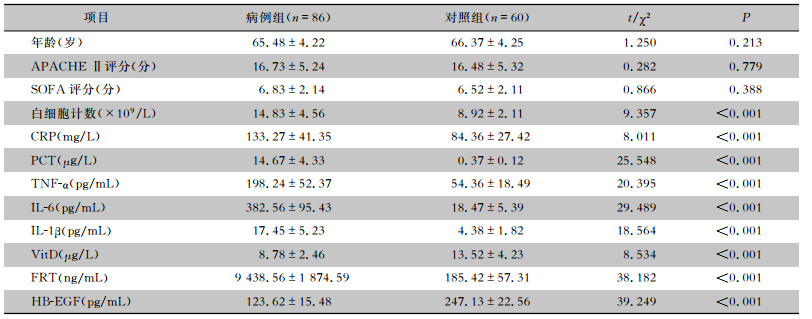
2 结果 2.1 基本情况86例脓毒症患者(病例组)中肺部感染32例,颅内感染9例,腹腔感染29例,泌尿系统感染16例;男性47例,女性39例。60例非脓毒症患者(对照组)中脑梗死36例,脑出血24例;男性33例,女性27例。病例组与对照组患者性别、年龄、APACHE Ⅱ评分、SOFA评分比较,差异均无统计学意义(均P>0.05);而病例组脓毒症患者白细胞计数、CRP、PCT、TNF-α、IL-6、IL-1β、FRT水平均高于对照组,VitD、HB-EGF水平低于对照组,差异均有统计学意义(均P<0.05)。见表 1。
| 表 1 两组患者基线资料比较(x±s) Table 1 Comparison of baseline data between two groups of patients (x±s) |
|
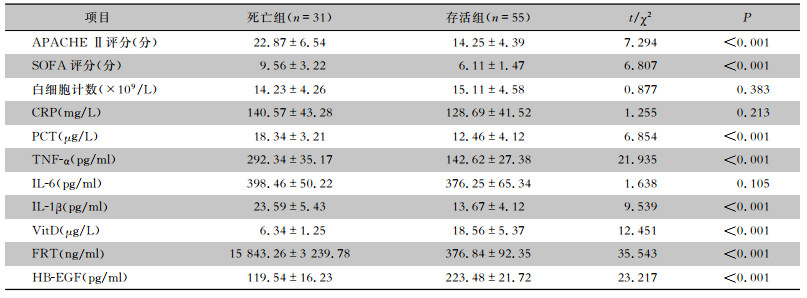
随访脓毒症患者1个月后预后情况,55例存活,31例死亡。存活组和死亡组患者白细胞计数、CRP、IL-6水平比较,差异均无统计学意义(均P>0.05);而死亡组患者APACHE Ⅱ评分、SOFA评分、PCT、TNF-α、IL-1β、FRT水平均高于存活组患者,VitD、HB-EGF水平低于存活组患者,差异均有统计学意义(均P<0.05)。见表 2。
| 表 2 不同预后患者临床资料比较(x±s) Table 2 Comparison of clinical data of patients of different prognosis (x±s) |
|
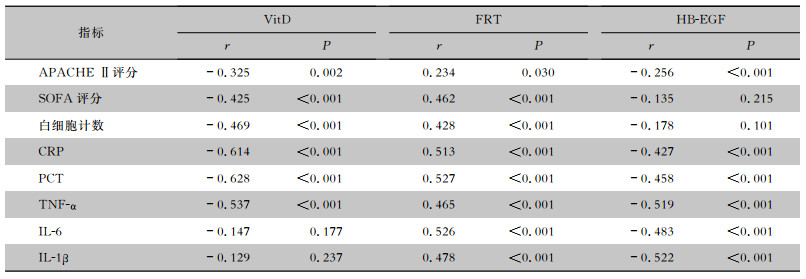
Pearson相关性分析结果显示,VitD与APACHE Ⅱ评分、SOFA评分、白细胞计数、CRP、PCT、TNF-α呈负相关关系(均P<0.05),与IL-6、IL-1β无相关性(均P>0.05);HB-EGF与APACHE Ⅱ评分、CRP、PCT、TNF-α、IL-6、IL-1β呈负相关关系(均P<0.05),与SOFA评分、白细胞计数无相关性(均P>0.05);FRT与APACHEⅡ评分、SOFA评分、白细胞计数、CRP、PCT、TNF-α、IL-6、IL-1β呈正相关关系(均P<0.05)。见表 3。
| 表 3 血清VitD、FRT、HB-EGF表达水平与脓毒症相关指标的相关性分析 Table 3 Correlation between serum VitD, FRT, HB-EGF expression levels and sepsis-related indicators |
|
当血清VitD截断值为21.45 μg/L时,预测脓毒症患者预后的AUC为0.69 (95%CI:0.53~0.73),灵敏度为72.36%,特异度为68.54%;当血清FRT截断值为10 354.62 ng/mL时,预测脓毒症患者预后的AUC为0.72(95%CI:0.55~0.76),灵敏度为75.68%,特异度为69.32%;当血清HB-EGF截断值为216.59 pg/mL时,预测脓毒症患者预后的AUC为0.75(95%CI:0.57~0.81),灵敏度为79.43%,特异度为69.52%;三者联合检测预测脓毒症患者预后的AUC为0.82(95%CI:0.72~0.86),灵敏度为84.39%,特异度为69.35%。见图 1。
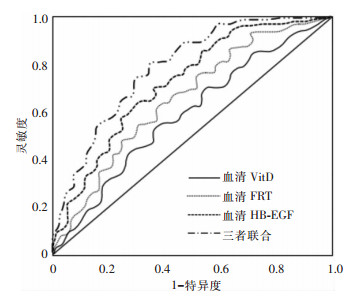 |
| 图 1 血清VitD、FRT、HB-EGF预测脓毒症患者预后的ROC曲线 Figure 1 ROC curve of serum VitD, FRT and HB-EGF in predicting prognosis of sepsis patients |
脓毒症因病情危急,在ICU患者死亡中占重要地位,炎症反应导致的感染程度与血管内皮损伤是脓毒症生理病理的重要过程[9]。研究[10]表明,了解脓毒症预后相关因素并进行干预治疗,对脓毒症患者具有积极意义。以往多采用一些感染指标评估患者机体感染情况及病情严重程度,早期灵敏度不高,随着对脓毒症患者预后的研究进展,发现VitD、FRT、HB-EGF可通过调节炎症、免疫反应,调控血管内皮细胞功能,在感染性疾病中具有重要评估作用[11]。本研究发现血清VitD、FRT、HB-EGF对脓毒症病情严重程度及预后评估具有重要意义。
本次研究结果显示,脓毒症患者白细胞计数、CRP、PCT、TNF-α、IL-6、IL-1β、FRT水平高于对照组非脓毒症患者,而VitD、HB-EGF水平低于非脓毒症患者,差异均有统计学意义(均P<0.05),说明炎症反应与脓毒症有关,且脓毒症机体存在炎症反应激活,这与脓毒症是一种全身性炎症反应综合征一致[12]。对不同预后患者进行比较发现,死亡组患者APACHE Ⅱ评分、SOFA评分、PCT、TNF-α、IL-1β、FRT高于存活组患者,而VitD、HB-EGF低于存活组患者,差异均有统计学意义(均P<0.05),说明脓毒症患者机体炎症反应程度与患者感染疾病严重程度有关,感染越严重,预后越差。Pearson相关分析结果显示,VitD与APACHE Ⅱ评分、SOFA评分、白细胞计数、CRP、PCT、TNF-α呈负相关关系(均P<0.05);HB-EGF与APACHE Ⅱ评分、CRP、PCT、TNF-α、IL-6、IL-1β呈负相关关系(均P<0.05);FRT与APACHE Ⅱ评分、SOFA评分、白细胞计数、CRP、PCT、TNF-α、IL-6、IL-1β呈正相关关系(均P<0.05),说明血清VitD、FRT、HB-EGF表达与脓毒症患者预后密切相关。究其原因,APACHE Ⅱ评分、SOFA评分是评估患者病情的指标,但在预后评估中具有滞后性[13]。IL-6、CRP、IL-1β、白细胞计数、PCT是评价感染的指标,但其在非感染性疾病中也会出现升高的情况,对于预后评估存在一定局限[13]。VitD是一种脂溶性维生素,在免疫、炎症调节、细胞增殖分化、心血管疾病等方面具有重要作用[14]。脓毒症患者因机体感染炎性免疫反应应答可导致过度炎症反应,炎性因子大量分泌,进而导致促炎与抗炎失衡,破坏机体组织、细胞,进而降低炎症因子级联释放及抑制抗菌肽表达[15]。同时,VitD代谢相关酶被破坏,使其无法转化为具有生物活性的25(OH)维生素D,VitD水平降低,导致抗炎作用降低,炎症反应加剧,感染加剧,进而参与疾病发生、发展[16]。FRT是一种铁贮存蛋白,机体感染时可诱导产生特异性细胞免疫反应,激活单核、巨噬细胞,导致组织炎症浸润,组织坏死,内皮细胞损伤,脏器功能受损,FRT转运能力降低,引起血清FRT增高[17]。因此,检测血清FRT水平可为脓毒症严重程度的早期评估提供重要参考[18]。血管内皮细胞活化是脓毒症发生的重要条件,血管生成时,在血管内皮细胞血管内皮生长因子A和TNF-α的刺激下分泌HB-EGF,HB-EGF可通过介导GF-β信号通路,发挥促炎及增加血管内皮渗透性的作用,参与脓毒症病理生理过程[19]。HB-EGF水平降低,可进一步诱导血管内皮细胞活化,进而导致脓毒症疾病进展[20]。脓毒症患者机体炎症反应可导致血管内皮细胞活化或功能损伤,炎性因子和多肽分泌,释放炎症介质,血管内皮渗透增加,炎症反应加剧[21]。因此,血清VitD、FRT、HB-EGF与脓毒症患者疾病严重程度密切相关,可通过观察其水平变化,评估患者疾病严重程度,进而为预后评估提供指导。
另外,经ROC曲线证实血清VitD、FRT、HB-EGF联合检测对预测脓毒症患者预后具有较好预测价值,灵敏度高达80%以上,准确性较高,具有较高临床应用价值。这主要是因为炎症介质在脓毒症发生、发展过程中起到重要作用,炎症介质作用炎性细胞,加重炎症反应,导致炎性反应失衡,最终引起患者机体多器官功能衰竭,影响患者预后[22]。脓毒症患者机体炎症反应程度与疾病严重程度密切相关,控制炎性反应对于患者预后具有重要意义[23]。血清VitD、FRT、HB-EGF水平可反映患者炎症反应情况,进而为预后评估提供指导,因此,血清VitD、FRT、HB-EGF可作为脓毒症预后评估的重要参考指标[24-25]。但由于本次研究样本量较少,且未对患者病情严重程度进行区分,可能对结果产生一定偏差,因此,还需扩大样本,对不同病情严重程度进行分析,以期为脓毒症预后评估提供可靠依据。
综上所述,脓毒症患者血清VitD、HB-EGF水平降低,血清FRT水平升高,其水平与患者预后密切相关,对脓毒症患者预后具有较好的预测价值,可作为脓毒症患者预后评估的重要指标,对于临床治疗及评估预后具有重要参考价值,值得临床借鉴。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
才让, 陈学梅, 祁蕙燕, 等. 脓毒症患者血清H2S、GDF-15、PTX-3水平与凝血功能、炎症指标及病情评分的相关性分析[J]. 现代生物医学进展, 2021, 21(7): 1365-1369. Cai R, Chen XM, Qi HY, et al. Correlation analysis of serum H2S, GDF-15 and PTX-3 levels with coagulation function, inflammation indexes and disease score in sepsis patients[J]. Progress in Modern Biomedicine, 2021, 21(7): 1365-1369. |
| [2] |
Hagag AA, El Frargy MS, Houdeeb HA. Therapeutic value of vitamin D as an adjuvant therapy in neonates with sepsis[J]. Infect Disord Drug Targets, 2020, 20(4): 440-447. |
| [3] |
Wang Y, Yang ZW, Gao L, et al. Effects of a single dose of vitamin D in septic children: a randomized, double-blinded, controlled trial[J]. J Int Med Res, 2020, 48(6): 300060520926890. |
| [4] |
胡限, 曾赛珍, 张兵, 等. 八例儿童重症腺病毒肺炎死亡病例分析[J]. 中国小儿急救医学, 2019, 26(10): 758-763. Hu X, Zeng SZ, Zhang B, et al. Analysis of eight fatal cases of severe adenovirus pneumonia in children[J]. Chinese Pedia-tric Emergency Medicine, 2019, 26(10): 758-763. |
| [5] |
Zavala S, Larson J, O'Mahony M, et al. Impact of insufficient admission vitamin D serum concentrations on sepsis incidence and clinical outcomes in patients with thermal injury[J]. Burns, 2020, 46(1): 172-177. DOI:10.1016/j.burns.2019.02.025 |
| [6] |
Saboute M, Yavar R, Kashaki M, et al. Investigation of association between maternal 25-OH vitamin D serum levels and neonatal early onset sepsis in newborns by evaluating key factors[J]. Lipids Health Dis, 2019, 18(1): 153. DOI:10.1186/s12944-019-1095-3 |
| [7] |
Shojaei M, Sabzeghabaei A, Valaei Barhagh H, et al. The correlation between serum level of vitamin D and outcome of sepsis patients; a cross-sectional study[J]. Arch Acad Emerg Med, 2019, 7(1): e1. |
| [8] |
徐静, 罗彦, 黄建会, 等. ICU危重症患者血清CRP、ALB水平与APACHE Ⅱ评分的相关性及联合检测对预后的预测价值[J]. 中国病案, 2020, 21(4): 109-112. Xu J, Luo Y, Huang JH, et al. Correlation between serum CRP and ALB levels and APACHE Ⅱ score in ICU critically ill patients and the predictive value of combined detection for prognosis[J]. Chinese Medical Record, 2020, 21(4): 109-112. DOI:10.3969/j.issn.1672-2566.2020.04.036 |
| [9] |
Zhang LM, Xu FS, Li SJ, et al. Influence of fluid balance on the prognosis of patients with sepsis[J]. BMC Anesthesiol, 2021, 21(1): 269. DOI:10.1186/s12871-021-01489-1 |
| [10] |
尹彦芬, 容维娜, 张霞, 等. 脓毒症患者血清降钙素原、C-反应蛋白与凝血功能、病情评分的关系及预后的影响因素分析[J]. 现代生物医学进展, 2021, 21(7): 1333-1337. Yin YF, Rong WN, Zhang X, et al. Analysis of the relationship between serum procalcitonin, C-reactive protein, coagulation function, disease score and prognostic factors in patients with sepsis[J]. Progress in Modern Biomedicine, 2021, 21(7): 1333-1337. |
| [11] |
Qu ZY, Zhu YB, Wang MP, et al. Prognosis and risk factors of sepsis patients in Chinese ICUs: a retrospective analysis of a cohort database[J]. Shock, 2021, 56(6): 921-926. DOI:10.1097/SHK.0000000000001784 |
| [12] |
Rao L, Giannico D, Leone P, et al. HB-EGF-EGFR signaling in bone marrow endothelial cells mediates angiogenesis associa-ted with multiple myeloma[J]. Cancers (Basel), 2020, 12(1): 173. DOI:10.3390/cancers12010173 |
| [13] |
刘静一, 杨世海, 孙旭, 等. 脓毒症患者降钙素原和C-反应蛋白与序贯器官衰竭估计评分的相关性及其影响因素分析[J]. 实用医学杂志, 2020, 36(23): 3241-3245. Liu JY, Yang SH, Sun X, et al. Correlation of procalcitonin and C-reactive protein with SOFA score in sepsis patients and its influencing factors[J]. The Journal of Practical Medicine, 2020, 36(23): 3241-3245. DOI:10.3969/j.issn.1006-5725.2020.23.015 |
| [14] |
Karakike E, Adami ME, Lada M, et al. Late peaks of HMGB1 and sepsis outcome: evidence for synergy with chro-nic inflammatory disorders[J]. Shock, 2019, 52(3): 334-339. DOI:10.1097/SHK.0000000000001265 |
| [15] |
Nandy A, Mondal T, Datta D, et al. Serum ferritin as a diagnostic biomarker for severity of childhood sepsis[J]. Indian Pediatr, 2021, 58(12): 1143-1146. DOI:10.1007/s13312-021-2396-y |
| [16] |
王雪慧, 刘虹, 王美霞, 等. 维生素D与脓毒症致器官功能障碍及预后的关系[J]. 中国新药与临床杂志, 2019, 38(8): 472-477. Wang XH, Liu H, Wang MX, et al. Relationship between vitamin D with organ dysfunction induced by sepsis and prognosis[J]. Chinese Journal of New Drugs and Clinical Remedies, 2019, 38(8): 472-477. |
| [17] |
Li YY, Ding SF. Serum 25-hydroxyvitamin D and the risk of mortality in adult patients with sepsis: a Meta-analysis[J]. BMC Infect Dis, 2020, 20(1): 189. DOI:10.1186/s12879-020-4879-1 |
| [18] |
Siyah Bilgin B, Gonulal D. Association between vitamin D le-vel and community-acquired late-onset neonatal sepsis[J]. Arch Argent Pediatr, 2020, 118(4): 265-272. |
| [19] |
McCullough K, Bolisetty S. Iron homeostasis and ferritin in sepsis-associated kidney injury[J]. Nephron, 2020, 144(12): 616-620. DOI:10.1159/000508857 |
| [20] |
侯婷婷, 侯惺, 李远, 等. 血清25-羟维生素D水平与脓毒症患儿凝血功能、炎性因子及预后的关系[J]. 现代生物医学进展, 2019, 19(1): 141-144, 170. Hou TT, Hou X, Li Y, et al. The relationship between se-rum 25-hydroxyvitamin D level and coagulation function, in flammatory factors and prognosis in children with sepsis[J]. Progress in Modern Biomedicine, 2019, 19(1): 141-144, 170. |
| [21] |
Awasthi PR, Angurana SK. Ferritin levels in children with sepsis in low-middle income countries: do we need lower threshold?[J]. Pediatr Crit Care Med, 2020, 21(10): 923. DOI:10.1097/PCC.0000000000002443 |
| [22] |
Zhou L, Zhou WQ, Joseph AM, et al. Group 3 innate lym-phoid cells produce the growth factor HB-EGF to protect the intestine from TNF-mediated inflammation[J]. Nat Immunol, 2022, 23(2): 251-261. DOI:10.1038/s41590-021-01110-0 |
| [23] |
王焕焕, 孙建荣, 刘文林. 脓毒症患者血清中内皮糖蛋白和肝素结合性表皮生长因子表达水平及其临床价值[J]. 内科急危重症杂志, 2020, 26(6): 494-496. Wang HH, Sun JR, Liu WL. Serum endoglin and HB-EGF levels and clinical value in patients with sepsis[J]. Journal of Critical Care in Internal Medicine, 2020, 26(6): 494-496. |
| [24] |
Ming YC, Chao HC, Chu SM, et al. Heparin-binding epidermal growth factor-like growth factor (HB-EGF) protected intestinal ischemia-reperfusion injury through JNK and p38/MAPK-dependent pathway for anti-apoptosis[J]. Pediatr Neonatol, 2019, 60(3): 332-336. DOI:10.1016/j.pedneo.2018.08.003 |
| [25] |
Shurygina IA, Shurygin МG, Rodionova LV, et al. Growth factors in the regulation of reparative response in the presence of peritoneal damage[J]. Pleura Peritoneum, 2020, 5(4): 20200114. DOI:10.1515/pp-2020-0114 |



