Response strategies for emerging highly pathogenic respiratory infectious diseases in mega-cities: a study based on transmission dynamics model
-
摘要:
目的 探索中国超大型城市应对新发突发高致病性呼吸道传染病暴发时不同干预策略的效果, 为有效应对新发突发呼吸道传染病提供决策依据。 方法 构建易感-潜伏-感染-移出(SEIR)传播动力学模型, 参考既往多种新发呼吸道传染病的致病性和传染性参数, 并将其进行组合。模拟低、中、高传染性的新发突发高致病性呼吸道传染病在中国1 000万人口超大型城市暴发的场景下, 比较实施不同非药物干预措施(NPIs)组合应对暴发后100 d内疫情的发展情况。 结果 高致病性新发呼吸道传染病暴发时, 如果其传染性较低(R0约为1.5), 无需采取严格的NPIs就可以控制疫情。若其传染性为中等(R0约为6), 则需要根据其已有的感染规模采取不同强度的NPIs: 在初始感染人数为50例时, 采取中等强度的NPIs, 100 d内可将感染及死亡比例控制在较低水平, 病例所需住院床位控制在全国平均储备水平以下; 但在已有感染规模超过100例时, 则需要采取高强度的NPIs才能控制疫情发展。在其传染性极强(R0约为10)的情况下, 无论感染规模如何, 应立即采取高强度NPIs才能有效控制疫情发展及感染、死亡规模。 结论 在面对新发高致病性呼吸道传染病暴发时, 尽早根据其流行病学特征及感染规模采取合适的NPIs, 才能最大限度降低其对人群健康的危害。 Abstract:Objective To explore the effectiveness of different intervention strategies in response to outbreaks of emerging highly pathogenic respiratory infectious diseases (RIDs) in mega-city in China, and provide decision-ma-king basis for effective response to emerging RIDs. Methods A susceptible-exposed-infectious-recovered (SEIR) transmission dynamics model was constructed, referencing to and combining the pathogenicity and infectivity para-meters of previous emerging RIDs. The outbreak of emerging highly pathogenic RIDs with low, moderate, and high infectivity in a mega-city with a population of 10 million in China was simulated, the development of the epidemic within 100 days after implementing different combinations of non-pharmaceutical interventions (NPIs) in response to the outbreak was compared. Results When highly pathogenic RIDs outbreak occurred, and if its infectivity was low (R0 was about 1.5), it was unnecessary to adopt strict NPIs to control epidemic. If its infectivity was moderate (R0 was about 6), different intensities of NPIs were needed based on its existing infection scale. When the initial number of infected cases was 50, moderate-intensity NPIs could keep the infection and death at a low level within 100 days, and the required bed number in hospital for cases could be kept below the national average reserve level. But when the scale of infection exceeded 100 cases, high-intensity NPIs were needed to control the development of the epidemic. In the case of extremely strong infectivity (R0 was about 10), regardless of the scale of infection, only immediate high-intensity NPIs could control the epidemic, infection and death scale. Conclusion In case of outbreaks of highly pathogenic RIDs, adopting appropriate NPIs as early as possible based on their epidemiological characteristics and infection scale is necessary to minimize the harm to the population. -
新发突发的急性呼吸道传染病可对人群健康、政治、经济和社会产生巨大危害[1]。20世纪以来,流行性感冒(流感) 病毒已经造成了4次大流行。1918年的流感大流行导致全球约5 000万人死亡[2],2009年甲型H1N1流感在全球大流行。2003年严重急性呼吸综合征(severe acute respiratory syndrome, SARS)在中国暴发[3],2012年中东呼吸综合征(middle east respiratory syndrome, MERS)在中东肆虐[4]。这些新发呼吸道传染病对人类健康产生严重威胁。特别是2019年底暴发的新型冠状病毒(新冠)感染大流行,其传播能力强,范围广,造成的损害空前绝后[5]。由于缺乏相应的抗病毒药物,新发呼吸道传染病给人类带来了巨大挑战[6],研究如何应对新发突发呼吸道传染病已经迫在眉睫。
面对新发呼吸道传染病,在缺乏疫苗和抗病毒药物的情况下,采取非药物干预措施(non-pharmaceutical interventions, NPIs)是控制病毒在人群中传播的唯一方法。已有多位学者通过建立传播动力学模型、贝叶斯模型等方法,对个人防护措施[7]、医院感染防控措施[8]、社交距离限制[9]和旅行限制[10]等NPIs的效果进行评价。评估NPIs的有效性对于未来应对新发呼吸道传染病至关重要,Haug等[11]量化了6 068项NPIs在79个地区实施对新冠的影响,结果表明适当的NPIs组合对于遏制病毒的传播是必要的。
为了研究未来如何有效应对新发高致病性呼吸道传染病的暴发,本研究建立了一个改进的易感-潜伏-感染-移出(susceptible-exposed-infectious-recovered, SEIR)传播动力学模型,参考既往多种新发呼吸道传染病的致病性和传染性参数,并进行组合,进而模拟低、中、高传染性新发突发高致病性呼吸道传染病在我国1 000万人口超大型城市暴发的场景下,采取不同NPIs组合时,疫情在100 d内的发展,从而提出应对不同场景下新发突发高致病性呼吸道传染病的策略建议。
1. 资料与方法
1.1 数据来源
本研究模拟我国假设的1 000万人口城市,城市居民年龄构成参考2020年第七次人口普查数据,即0~19、20~59、≥60岁人口构成比分别为23.1%、63.3%、13.5%。城市医疗资源参考2021年中国统计年鉴,即住院床位数为67.4张/万人,重症监护病房(ICU)床位为1.28张/万人。
1.2 传播动力学模型的构建
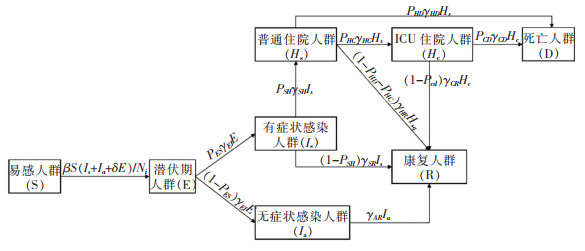
经典的SEIR模型将人群分为易感人群(S)、潜伏期人群(E)、感染人群(I)及移出人群(R)。根据抗击新冠大流行的经验,综合考虑NPIs措施,并实现对医疗资源需求的预测,对经典SEIR模型进行改进。将感染人群分为有症状感染(Is)和无症状感染(Ia)两类;有症状感染者可进一步发展为普通住院人群(Hs)和ICU住院人群(Hc);将移出人群分为死亡移出(D)和康复移出(R),共计8个人群,具体模型框架见图 1。
改进SEIR模型的基本假设如下:
(1) 暴发疫情的城市是封闭的,不考虑人员流动;(2)移出人群不会被再次感染;(3)未住院的有症状感染者及无症状感染者不会死亡,仅考虑住院患者及ICU患者的死亡;(4)住院人群及ICU住院人群处于隔离状态,不具有传染性。
根据以上假设,构建微分方程组如下:
$$ \left\{\begin{array}{l} \frac{d s_i}{d t}=-\beta S_i \sum\limits_{i=1}^n M_i\left(I_{s i}+I_{a i}+\delta E_i\right) / N_i \\ \frac{d s_i}{d t}=\beta S_i \sum\limits_{i=1}^n M_i\left(I_{s i}+I_{a i}+\delta E_i\right) / N_i-\gamma_{E I} E_i \\ \frac{d I s_i}{d t}=\left(1-q_1\right) P_{E S i} \gamma_{E I} E_i-P_{S H i} \gamma_{S H} I_{s i}-\left(1-P_{S H i}\right) \gamma_{S R} I_{S i} \\ \frac{d I a_i}{d t}=\left(1-q_2\right)\left(1-P_{E S i}\right) \gamma_{E I} E_i-\gamma_{A R} I_{a i} \\ \frac{d H_{s i}}{d t}=P_{S H i} \gamma_{S H} I_{s i}-P_{H C i} \gamma_{H C} H_{s i}-P_{H D i} \gamma_{H D} H_{s i}\left(1-P_{H D i}-P_{H C i}\right) \gamma_{H R} H_{s i} \\ \frac{d H_{c i}}{d t}=P_{H C i} \gamma_{H C} H_{s i}-P_{C D i} \gamma_{C D} H_{c i}-\left(1-P_{C D i}\right) \gamma_{C R} H_{c i} \\ \frac{d D_i}{d t}=P_{H D i} \gamma_{H D} H_{s i}+P_{C D i} \gamma_{C D} H_{c i} \\ \frac{d R_i}{d t}=\left(1-P_{S H i}\right) \gamma_{A R} I_{a i}+\left(1-P_{H D i}-P_{H C i}\right) \gamma_{H R} H_{s i}+\left(1-P_{C D i}\right) \gamma_{C R} H_{c i} \end{array}\right. $$ 1.3 参数设置
1.3.1 流行病学参数
收集既往各类呼吸道传染病的流行病学参数,包括早期新冠、季节性流感、甲型流感、SARS、MERS、新冠Delta变异株、新冠Omicron变异株等。考虑到高致病性呼吸道传染病的危害最为突出,本研究仅对其进行讨论。采用病死率高达20%的MERS作为模拟新发突发高致病性呼吸道传染病的致病性参数来源,见表 1。甲型流感、新冠Delta和Omicron变异株的基本再生数R0分别为1.5(1.2~2.3)、6.5(5.5~7.5)、10(8~12)[12-13],将其分别作为模拟低、中、高传染性新发突发呼吸道传染病的参数,分别模拟三种传染病在超大型城市暴发的场景,并讨论不同场景下实施不同强度干预措施时相应呼吸道传染病的疫情发展趋势及医疗资源需求。
表 1 改进SEIR模型致病性参数设置*Table 1 Setting of pathogenicity parameters for the improved SEIR model参数 含义 取值# 参数来源 Ps 有症状感染者比率(%) 95 经验取值 Ph 住院比率(%) 22.49 Al-Jasser等[14] Phd 住院死亡比率(%) 39.1(37.2 ~41.1) Matsuyama等[15] Phc 入住ICU比率(%) 78.2 (73.5~82.9) Matsuyama等[15] Pcd ICU死亡比率(%) 75 Garout等[16] 1/γe 潜伏期日数(d) 5.5~6.5 Kesheh等[17] 1/γsh 有症状到住院日数(d) 4 Chafekar等[18] 1/γsr 有症状到恢复日数(d) 41 (8~96) Arabi等[19] 1/γar 无症状到恢复日数(d) 13.17 Al-Jasser等[14] 1/γhc 住院到ICU日数(d) 2 Azhar等[20] 1/γhd 住院到死亡日数(d) 7.5 Chafekar等[18] 1/γhr 住院到恢复日数(d) 41 (8~96) Arabi等[19] 1/γcd 入住ICU到死亡日数(d) 7.5 Chafekar等[18] 1/γcr 入住ICU到恢复日数(d) 30 (7~103) Arabi等 [19] 注:*表示致病性相关参数来自MERS;#表示数值为中位数、中位数及95%置信区间或最大值及最小值。 1.3.2 干预措施相关参数
在新发突发呼吸道传染病暴发的早期阶段,由于其疫苗和特效药物尚未研发,故本研究不考虑疫苗接种及药物治疗等措施,仅考虑NPIs进行疫情防控。参考世界卫生组织(WHO)及美国疾病控制与预防中心(CDC)流感大流行应对措施及相关研究结果[11, 21-22],制定在呼吸道传染病流行时,应对低、中、高传染性的场景可以采取的相关NPIs,见表 2。采取低、中、高强度NPIs时,疫情传播可分别降低约18%[23]、40%~60%[24]、77%[25],因此,根据流感及新冠相关研究中较为相似的NPIs组合[23-25],本文假定其有效接触率分别降低为初始值的80%、50%、20%。考虑到措施实施的实际时机及感染规模不同,设置初始感染人数分别为50、100、500、1 000例来代表采取防控措施决策时已感染人群的规模。
表 2 应对低、中、高传染性呼吸道传染病可采取的NPIsTable 2 NPIs taken in response to respiratory infectious diseases of low, moderate, and high infectivity措施 低强度 中强度 高强度 个人防护措施 手清洁 手清洁 手清洁 自愿佩戴口罩 公共场所佩戴口罩 公共场所佩戴口罩 病例相关措施 患者自愿居家隔离 病例隔离 病例追踪 - - 病例隔离 - - 追踪并隔离接触者 环境措施 适当通风 公共场所及物品消毒 公共场所及物品消毒 - 适当通风 适当通风 社交距离相关措施 - 减少聚集性活动 禁止聚集性活动 - 中小学响应式停课 关闭学校 - 关闭部分娱乐场所 关闭工作及娱乐场所 旅行限制相关措施 - 交通限流 交通限制 - - 出入境监测 - - 必要时居家 注:-表示情况不存在。 1.4 统计分析
传播动力学模型的评价采用文献[26]报告的2020年1月1—22日的新冠感染病例数进行拟合验证。使用下一代矩阵法[27]对有效接触率进行初步估计,后采用马尔科夫链蒙特卡罗(Markov chain Monte Carlo, MCMC)算法对其进行拟合矫正。计算累计确诊病例数的模型预测值与实际值之间的相关系数(R2)对模型进行拟合优度评价。
在确认模型有效后,设置低、中、高传染性新发突发高致病性呼吸道传染病暴发的场景。模拟实施不同强度NPIs时,100 d内疫情的发展情况。每种情况模拟1 000次并计算均值及95%CI,单次模拟周期为100 d,初始感染人数代表感染规模及决策时机。应用R 4.2.2统计软件进行分析建模。
2. 结果
基于2020年1月1—22日早期新冠累计病例数,采用下一代矩阵法对有效接触率进行初步估计,后采用MCMC算法对参数进行拟合矫正,得到R2=0.98的拟合优度,证明模型可靠。
在发生低传染性(R0约为1.5)的高致病性呼吸道传染病时,初始感染人数不超过1 000例的情况下,在100 d内无论是否采取NPIs,人群感染比率均低于0.5%,病死率均低于0.15%,且普通住院床位数和ICU住院床位数需求均 < 0.5张/万人, 低于全国平均储备水平。因此,在发生低传染性的高致病性呼吸道传染病时,不需要采取严格的NPIs。
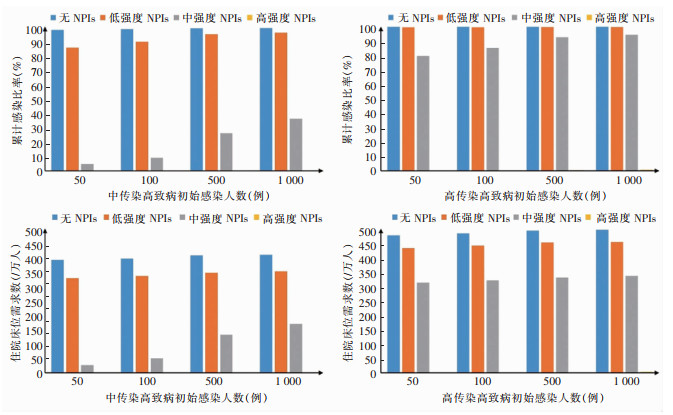
在发生中传染性(R0约为6)的高致病性呼吸道传染病时,若不采取合适强度的NPIs,人群感染比率高达85%,病死率超过30%。在初始感染人数为50例时,采取中等强度的NPIs,100 d内感染、病死率分别降至4.83%、0.71%,住院床位数需求约为27张/万人,低于全国平均储备水平。但在已有感染规模超过100例时,则需要采取高强度的NPIs才能控制疫情发展。
在发生高传染性(R0约为10)的高致病性呼吸道传染病时,无论感染规模如何,均只有立即采取高强度NPIs才能有效控制疫情发展,控制感染及死亡规模。在已有感染规模不超过1 000例时采取高强度NPIs,可使感染、病死率分别降至0.07%、0.03%。部分结果见图 2。
3. 讨论
为有效应对未来可能的新发突发高致病性呼吸道传染病在我国超大型城市的暴发,本研究基于传播动力学模型,模拟在1 000万人口的城市新发高致病性呼吸道传染病,根据其传播能力采取不同强度NPIs时疫情100 d内的发展情况。研究发现,在面对新发高致病性呼吸道传染病暴发时,尽早根据其流行病学特征及感染规模采取合适的NPIs,可以最大限度降低其对人群健康的危害。
高致病性新发呼吸道传染病暴发时,如果其传染性较低,无需采取严格的NPIs,仅采取戴口罩等个人防护措施就可以控制疫情。Pasquini-Descomps等[28]回顾2009年甲型H1N1流感干预措施的成本效果评价研究发现,对于甲型H1N1流感来说,医院隔离感染者具有较高的成本效益,但是学校停课、社交隔离等严格的NPIs可能不具有成本效益。因此,应在新发呼吸道传染病早期对其传染性进行评估,若其传染性较低,则不需要采取NPIs,或仅采取戴口罩等个人防护措施即可。
若其传染性为中等,则需要根据其已有的规模采取不同程度的NPIs。初始感染人数为50例时,采取中等强度的NPIs,在100 d内可将感染及死亡比例控制在较低水平,病例所需住院床位控制在全国平均储备水平以下。但在已有感染规模超过100例时,则需要采取高强度的NPIs才能控制疫情发展。虽然NPIs可以有效控制疫情发展,但会对社会经济产生巨大影响[29]。因此,若能在疫情早期采取强度合适的干预措施,不仅可以减少对人类健康的威胁,也能够减小对社会经济造成的不利影响。
在传染性极强的情况下,无论感染规模如何,均只有立即采取高强度NPIs才能有效控制疫情发展,控制感染及死亡规模。研究[30]显示,较早实施高强度NPIs的地区,新冠感染的发病率和病死率大幅降低。
在面对新发突发呼吸道传染病暴发时,首先要采取的措施为个人防护措施及环境消毒措施。勤洗手[31]、佩戴口罩[32]、家居消毒[33]等个人环境防护措施可以有效降低呼吸道传染病的传播,在该病传染性较低的情况下,即可控制其流行。若传染性较强,需要增加更严格的NPIs。保持社交距离[34],减少聚集性活动[35],隔离病例[36],关闭学校、娱乐、工作场所[32, 37]等NPIs可以有效控制呼吸道传染病的传播。但这些措施会对社会经济产生影响,应根据实际情况酌情使用。尽管关闭城市可以降低81%的传染病传播[38],但其对社会民生经济产生的影响巨大,因此非必要不建议采取该措施。在新发呼吸道传染病时,必须在早期通过流行病学现场调查工作,对该传染病的传染性、致病性进行评估,根据传染性的强弱,迅速采取合适的NPIs,并做好危重患者的救治工作,争取早发现,早调查,早防控,从而实现对未来新发呼吸道传染病的有效应对。
本模型具有一定的局限性。首先,本研究中拟合的传播动力学模型为封闭模型,没有考虑人员的流入流出。其次,本模型纳入的参数较多且干预措施参考流感大流行应对制定,其效果评估基于既往对流感及新冠感染的相关研究得出。而在实际情况中,由于疾病流行病学特征、社会环境等的差异,能够采取的干预措施及其干预效果可能存在较大差异。在实际使用过程中应根据新发传染病的特点、估计的感染规模、社会舆论的接受程度等进行综合评估,才能采取更为合适的措施控制疫情发展。最后,本研究仅对高致病性呼吸道传染病这种对人类健康威胁较大的新发传染病进行讨论,未涉及其他致病性新发呼吸道传染病暴发的情形。但本研究提供了一个应对新发突发呼吸道传染病的分析思路,今后可根据疫情实际情况,动态修订参数对疫情发展进行评估,进而采取合适的NPIs,控制疫情进展。
综上所述,在面对新发高致病性呼吸道传染病暴发时,尽早根据其流行病学特征及感染规模,采取合适的应对策略,才能最大限度降低其危害。
利益冲突:所有作者均声明不存在利益冲突。
-
表 1 改进SEIR模型致病性参数设置*
Table 1 Setting of pathogenicity parameters for the improved SEIR model
参数 含义 取值# 参数来源 Ps 有症状感染者比率(%) 95 经验取值 Ph 住院比率(%) 22.49 Al-Jasser等[14] Phd 住院死亡比率(%) 39.1(37.2 ~41.1) Matsuyama等[15] Phc 入住ICU比率(%) 78.2 (73.5~82.9) Matsuyama等[15] Pcd ICU死亡比率(%) 75 Garout等[16] 1/γe 潜伏期日数(d) 5.5~6.5 Kesheh等[17] 1/γsh 有症状到住院日数(d) 4 Chafekar等[18] 1/γsr 有症状到恢复日数(d) 41 (8~96) Arabi等[19] 1/γar 无症状到恢复日数(d) 13.17 Al-Jasser等[14] 1/γhc 住院到ICU日数(d) 2 Azhar等[20] 1/γhd 住院到死亡日数(d) 7.5 Chafekar等[18] 1/γhr 住院到恢复日数(d) 41 (8~96) Arabi等[19] 1/γcd 入住ICU到死亡日数(d) 7.5 Chafekar等[18] 1/γcr 入住ICU到恢复日数(d) 30 (7~103) Arabi等 [19] 注:*表示致病性相关参数来自MERS;#表示数值为中位数、中位数及95%置信区间或最大值及最小值。 表 2 应对低、中、高传染性呼吸道传染病可采取的NPIs
Table 2 NPIs taken in response to respiratory infectious diseases of low, moderate, and high infectivity
措施 低强度 中强度 高强度 个人防护措施 手清洁 手清洁 手清洁 自愿佩戴口罩 公共场所佩戴口罩 公共场所佩戴口罩 病例相关措施 患者自愿居家隔离 病例隔离 病例追踪 - - 病例隔离 - - 追踪并隔离接触者 环境措施 适当通风 公共场所及物品消毒 公共场所及物品消毒 - 适当通风 适当通风 社交距离相关措施 - 减少聚集性活动 禁止聚集性活动 - 中小学响应式停课 关闭学校 - 关闭部分娱乐场所 关闭工作及娱乐场所 旅行限制相关措施 - 交通限流 交通限制 - - 出入境监测 - - 必要时居家 注:-表示情况不存在。 -
[1] 杨津, 冯录召, 赖圣杰, 等. 急性呼吸道传染病症状监测及预警技术的现状与展望[J]. 中华流行病学杂志, 2023, 44(1): 60-66. Yang J, Feng LZ, Lai SJ, et al. Syndrome surveillance and early warning technology for acute respiratory infectious diseases: current status and future development[J]. Chinese Journal of Epidemiology, 2023, 44(1): 60-66. [2] Short KR, Kedzierska K, van de Sandt CE. Back to the future: lessons learned from the 1918 influenza pandemic[J]. Front Cell Infect Microbiol, 2018, 8: 343. doi: 10.3389/fcimb.2018.00343 [3] Rui J, Qu HM, Zhang S, et al. Assessment of transmissibility and measures effectiveness of SARS in 8 regions, China, 2002-2003[J]. Front Cell Infect Microbiol, 2023, 13: 1212473. doi: 10.3389/fcimb.2023.1212473 [4] 徐锐, 李广林, 唐晓凤, 等. 中东呼吸综合征(MERS)和严重急性呼吸综合征(SARS)间流行病学及其病原体间分子进化的比较研究[J]. 中华疾病控制杂志, 2015, 19(7): 647-650, 750. Xu R, Li GL, Tang XF, et al. A comparative study of epidemiology and molecular evolution between MERS and SARS[J]. Chinese Journal of Disease Control & Prevention, 2015, 19(7): 647-650, 750. [5] 张佳琦, 刘国华, 黄建安. 新冠病毒奥密克戎变异株的特点与防控措施[J]. 中国感染控制杂志, 2022, 21(8): 816-822. doi: 10.12138/j.issn.1671-9638.20222937 Zhang JQ, Liu GH, Huang JA. Characteristics, prevention and control measures of SARS-CoV-2 Omicron variant[J]. Chinese Journal of Infection Control, 2022, 21(8): 816-822. doi: 10.12138/j.issn.1671-9638.20222937 [6] Ma QH, Chen RH, Zeng J, et al. Investigating the effects of Liushen capsules on the metabolome of seasonal influenza: a randomized clinical trial[J]. Front Pharmacol, 2022, 13: 968182. doi: 10.3389/fphar.2022.968182 [7] Teslya A, Pham TM, Godijk NG, et al. Impact of self-imposed prevention measures and short-term government-imposed social distancing on mitigating and delaying a COVID-19 epidemic: a modelling study[J]. PLoS Med, 2020, 17(7): e1003166. doi: 10.1371/journal.pmed.1003166 [8] 赵霏, 周威龙, 范培杨, 等. 应用中断时间序列设计评估某三甲专科医院强化感控措施对医院感染发病率的影响[J]. 中国感染控制杂志, 2023, 22(11): 1364-1369. doi: 10.12138/j.issn.1671-9638.20232306 Zhao F, Zhou WL, Fan PY, et al. Effect of enhanced infection prevention and control measures on incidence of healthcare-associated infection in a tertiary first-class specialty hospital: an interrupted time-series analysis[J]. Chinese Journal of Infection Control, 2023, 22(11): 1364-1369. doi: 10.12138/j.issn.1671-9638.20232306 [9] Anderson SC, Edwards AM, Yerlanov M, et al. Quantifying the impact of COVID-19 control measures using a Bayesian model of physical distancing[J]. PLoS Comput Biol, 2020, 16(12): e1008274. doi: 10.1371/journal.pcbi.1008274 [10] Chinazzi M, Davis JT, Ajelli M, et al. The effect of travel restrictions on the spread of the 2019 novel coronavirus (COVID-19) outbreak[J]. Science, 2020, 368(6489): 395-400. doi: 10.1126/science.aba9757 [11] Haug N, Geyrhofer L, Londei A, et al. Ranking the effectiveness of worldwide COVID-19 government interventions[J]. Nat Hum Behav, 2020, 4(12): 1303-1312. doi: 10.1038/s41562-020-01009-0 [12] Boëlle PY, Ansart S, Cori A, et al. Transmission parameters of the A/H1N1 (2009) influenza virus pandemic: a review[J]. Influenza Other Respir Viruses, 2011, 5(5): 306-316. doi: 10.1111/j.1750-2659.2011.00234.x [13] Burki TK. Omicron variant and booster COVID-19 vaccines[J]. Lancet Respir Med, 2022, 10(2): e17. doi: 10.1016/S2213-2600(21)00559-2 [14] Al-Jasser FS, Nouh RM, Youssef RM. Epidemiology and predictors of survival of MERS-CoV infections in Riyadh region, 2014-2015[J]. J Infect Public Health, 2019, 12(2): 171-177. doi: 10.1016/j.jiph.2018.09.008 [15] Matsuyama R, Nishiura H, Kutsuna S, et al. Clinical determinants of the severity of Middle East respiratory syndrome (MERS): a systematic review and Meta-analysis[J]. BMC Public Health, 2016, 16(1): 1203. doi: 10.1186/s12889-016-3881-4 [16] Garout MA, Jokhdar HAA, Aljahdali IA, et al. Mortality rate of ICU patients with the Middle East respiratory syndrome-Coronavirus infection at King Fahad Hospital, Je-ddah, Saudi Arabia[J]. Cent Eur J Public Health, 2018, 26(2): 87-91. doi: 10.21101/cejph.a4764 [17] Kesheh MM, Hosseini P, Soltani S, et al. An overview on the seven pathogenic human coronaviruses[J]. Rev Med Virol, 2022, 32(2): e2282. doi: 10.1002/rmv.2282 [18] Chafekar A, Fielding BC. MERS-CoV: understanding the la-test human coronavirus threat[J]. Viruses, 2018, 10(2): 93. doi: 10.3390/v10020093 [19] Arabi YM, Arifi AA, Balkhy HH, et al. Clinical course and outcomes of critically ill patients with Middle East respiratory syndrome coronavirus infection[J]. Ann Intern Med, 2014, 160(6): 389-397. [20] Azhar EI, Hui DSC, Memish ZA, et al. The Middle East respiratory syndrome (MERS)[J]. Infect Dis Clin North Am, 2019, 33(4): 891-905. doi: 10.1016/j.idc.2019.08.001 [21] WHO. Non-pharmaceutical public health measures for mitigating the risk and impact of epidemic and pandemic influenza[EB/OL]. (2019-09-19)[2024-02-10]. https://www.who.int/publications-detail-redirect/non-pharmaceutical-public-health-measuresfor-mitigating-the-risk-and-impact-of-epidemic-and-pandemic-influenza. [22] Qualls N, Levitt A, Kanade N, et al. Community mitigation guidelines to prevent pandemic influenza-United States, 2017[J]. MMWR Recomm Rep, 2017, 66(1): 1-34. doi: 10.15585/mmwr.rr6601a1 [23] Jefferson T, Del Mar CB, Dooley L, et al. Physical interventions to interrupt or reduce the spread of respiratory viruses[J]. Cochrane Database Syst Rev, 2020, 11(11): CD006207. [24] Zhang JJ, Litvinova M, Liang YX, et al. Changes in contact patterns shape the dynamics of the COVID-19 outbreak in China[J]. Science, 2020, 368(6498): 1481-1486. doi: 10.1126/science.abb8001 [25] Zhang JJ, Litvinova M, Liang YX, et al. The impact of relaxing interventions on human contact patterns and SARS-CoV-2 transmission in China[J]. Sci Adv, 2021, 7(19): eabe2584. doi: 10.1126/sciadv.abe2584 [26] Hao XJ, Cheng SS, Wu DG, et al. Reconstruction of the full transmission dynamics of COVID-19 in Wuhan[J]. Nature, 2020, 584(7821): 420-424. doi: 10.1038/s41586-020-2554-8 [27] Diekmann O, Heesterbeek JAP, Roberts MG. The construction of next-generation matrices for compartmental epidemic models[J]. J R Soc Interface, 2010, 7(47): 873-885. doi: 10.1098/rsif.2009.0386 [28] Pasquini-Descomps H, Brender N, Maradan D. Value for money in H1N1 influenza: a systematic review of the cost-effectiveness of pandemic interventions[J]. Value Health, 2017, 20(6): 819-827. doi: 10.1016/j.jval.2016.05.005 [29] Chen S, Igan DO, Pierri N, et al. Tracking the economic impact of COVID-19 and mitigation policies in Europe and the United States[EB/OL]. (2020-07-10)[2024-02-10]. https://www.imf.org/en/Publications/WP/Issues/2020/07/10/Tracking-the-Economic-Impact-of-COVID-19-and-Mitigation-Policies-in-Europe-and-the-United-49553. [30] Ragonnet-Cronin M, Boyd O, Geidelberg L, et al. Genetic evidence for the association between COVID-19 epidemic severity and timing of non-pharmaceutical interventions[J]. Nat Commun, 2021, 12(1): 2188. doi: 10.1038/s41467-021-22366-y [31] Lio CF, Cheong HH, Lei CI, et al. Effectiveness of personal protective health behaviour against COVID-19[J]. BMC Public Health, 2021, 21(1): 827. doi: 10.1186/s12889-021-10680-5 [32] Liu XS, Xu X, Li GQ, et al. Differential impact of non-pharmaceutical public health interventions on COVID-19 epidemics in the United States[J]. BMC Public Health, 2021, 21(1): 965. doi: 10.1186/s12889-021-10950-2 [33] Wang Y, Tian HY, Zhang L, et al. Reduction of secondary transmission of SARS-CoV-2 in households by face mask use, disinfection and social distancing: a cohort study in Beijing, China[J]. BMJ Glob Health, 2020, 5(5): e002794. doi: 10.1136/bmjgh-2020-002794 [34] Guo C, Chan SHT, Lin CQ, et al. Physical distancing implementation, ambient temperature and COVID-19 containment: an observational study in the United States[J]. Sci Total Environ, 2021, 789: 147876. doi: 10.1016/j.scitotenv.2021.147876 [35] Li Y, Campbell H, Kulkarni D, et al. The temporal association of introducing and lifting non-pharmaceutical interventions with the time-varying reproduction number (R) of SARS-CoV-2: a modelling study across 131 countries[J]. Lancet Infect Dis, 2021, 21(2): 193-202. doi: 10.1016/S1473-3099(20)30785-4 [36] Vaman RS, Valamparampil MJ, Varghese B, et al. Quarantine practices and COVID-19 transmission in a low-resource setting: experience of Kerala, India[J]. J Family Med Prim Care, 2021, 10(2): 1003-1008. doi: 10.4103/jfmpc.jfmpc_2034_20 [37] Auger KA, Shah SS, Richardson T, et al. Association between statewide school closure and COVID-19 incidence and mortality in the US[J]. JAMA, 2020, 324(9): 859-870. doi: 10.1001/jama.2020.14348 [38] Di Domenico L, Pullano G, Sabbatini CE, et al. Impact of lockdown on COVID-19 epidemic in Île-de-France and possible exit strategies[J]. BMC Med, 2020, 18(1): 240. doi: 10.1186/s12916-020-01698-4

 下载:
下载: