Comparison of in vitro and in vivo antimicrobial activity of ceftazidime/avibactam alone or in combination with aztreonam against carbapenem-resistant Enterobacterales
-
摘要:
目的 了解头孢他啶/阿维巴坦(CZA)单用或与氨曲南(ATM)联合用药对耐碳青霉烯类肠杆菌目细菌(CRE)的体内、外抗菌活性,为临床抗感染治疗提供依据。 方法 采用微量肉汤稀释法对某院2018—2022年临床分离的52株非重复CRE进行CZA及ATM最低抑菌浓度(MIC)测定,采用棋盘稀释法进行联合药敏试验。时间-杀菌曲线和大蜡螟感染模型检测CZA单用或与ATM联合使用的杀菌效果。 结果 23株产KPC酶的CRE菌株中91.3%(21株)对CZA的MIC≤4 μg/mL,8.7%(2株)的菌株对CZA的MIC≥128 μg/mL。产NDM、IMP、KPC+IMP、KPC+NDM等酶型的29株CRE对CZA的MIC值均≥128 μg/mL。31株CZA耐药的菌株中93.5%(29株)的CZA与ATM联合FIC值<0.5,6.5%(2株)的FIC在0~1。时间-杀菌曲线表明CZA对产KPC酶的菌株具有杀菌效果,CZA联合ATM对耐CZA菌株有杀菌效果。与单药组相比,CZA联合ATM处理组CRE感染大蜡螟生存率显著提高(中位生存时间120 h,P=0.001)。 结论 CZA对产KPC酶的细菌有较好的抗菌作用。CZA与ATM联用对CZA耐药的菌株具有协同抑菌作用。 -
关键词:
- 头孢他啶/阿维巴坦 /
- 氨曲南 /
- 耐碳青霉烯类肠杆菌目细菌 /
- 抗菌活性
Abstract:Objective To investigate the in vivo and in vitro antimicrobial activity of ceftazidime/avibactam (CZA) alone or in combination with aztreonam (ATM) against carbapenem-resistant Enterobacterales (CRE), and provide evidence for clinical anti-infective therapy. Methods The minimum inhibitory concentrations (MICs) of CZA and ATM against 52 clinically isolated non-repetitive CRE strains in a hospital from 2018 to 2022 were determined with microbroth dilution method, and the combined antimicrobial susceptibility testing was performed with the chessboard dilution method. Time-killing curve and Galleria mellonella infection model were used to test the bactericidal effect of CZA alone or in combination with ATM. Results Among the 23 KPC-producing CRE strains, 91.3% (n=21) had MIC ≤4 μg/mL for CZA, and 8.7% (n=2) had MIC ≥128 μg/mL for CZA. MIC of CZA to 29 CRE strains (strains producing NDM, IMP, KPC+IMP, and KPC+NDM) were all ≥128 μg/mL. Of the 31 CZA-resistant strains, 93.5% (n=29) strains had fractional inhibitory concentration (FIC) < 0.5 for combination of CZA and ATM, while 6.5% (n=2) had FIC of 0-1. The time-killing curve showed that CZA had bactericidal effect on KPC-producing strains, and CZA combined with ATM had bactericidal effect on CZA-resistant strains. Compared with the monotherapy group, CZA combined with ATM treatment significantly improved the survival rate of CRE-infected Galleria mellonella (median survival time 120 hour, P=0.001). Conclusion CZA has good antimicrobial activity against KPC-producing bacteria. The combination of CZA and ATM had synergistic bacteriostatic effect on CZA-resistant strains. -
碳青霉烯类抗生素抗菌谱广泛,常用于耐药革兰阴性杆菌引起临床感染的治疗。然而,随着其在临床的广泛应用,耐碳青霉烯类肠杆菌目(carbapenem-resistant Enterobacterales, CRE)菌株逐年增多,已在全球范围内流行[1]。目前针对CRE菌株感染的治疗,可选择的抗菌药物十分有限,编码碳青霉烯酶质粒的传播,有助于CRE的广泛流行,CRE感染的高发病率和病死率已成为全球公共卫生的主要威胁[2]。碳青霉烯类抗生素耐药的主要机制是产碳青霉烯酶,常见碳青霉烯酶主要包括KPC、NDM、IMP、VIM和OXA-48,其中最常见的是由blaKPC编码的A类丝氨酸类酶KPC(Klebsiella pneumoniae carbapenemase)[3-5]。由于碳青霉烯类抗生素耐药机制不同,不同抗菌药物对CRE菌株抗菌效果存在差异。本试验采用肉汤法测定最低抑菌浓度(MIC),棋盘法进行联合药敏试验,时间-杀菌曲线和药物治疗菌株感染动物的试验方法,评价单用头孢他啶/阿维巴坦(CZA)及其与氨曲南(ATM)联合用药的体外杀菌效果和体内抗菌效果,为临床用药提供可靠依据。
1. 材料与方法
1.1 材料
1.1.1 菌株来源
收集2018—2022年蚌埠医科大学第一附属医院临床标本中分离的52株CRE(剔除同一患者相同部位分离的重复菌株),包括29株肺炎克雷伯菌、20株大肠埃希菌、2株阴沟肠杆菌及1株黏质沙雷菌。主要分离自痰、血、脑脊液及尿标本,分布在重症监护病区、神经外科及呼吸科等。质控菌株大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853来自国家卫生健康委临检中心。
1.1.2 仪器与试剂
菌株鉴定和药敏试验采用VITEK MS飞行时间质谱仪和VITEK 2全自动鉴定及药敏分析系统(法国梅里埃公司)。CZA(北京拉索生物科技有限公司),ATM(上海源叶生物科技有限公司)。碳青霉烯酶检测试剂盒(天津一瑞生物科技股份有限公司),MH琼脂及MH肉汤(英国Oxoid公司)。大蜡螟(中国天津惠裕德生物科技有限公司),长度(20±5)mm,重量(250±50) mg。
1.2 方法
1.2.1 碳青霉烯酶检测
采用碳青霉烯酶检测试剂盒检测5种酶型:KPC、OXA-48、VIM、IMP和NDM。将纯培养菌株和样品处理液在EP管中充分混合,加载50 μL到检测条上。室温下放置15 min后,结果判读依据操作说明书,质控线(C线)区域一条红线,检测区域任何酶型出现一条或多条,即为标本含有相应的碳青霉烯酶。
1.2.2 MIC测定及联合药敏
采用微量肉汤稀释法测定CZA和ATM对52株CRE的MIC。棋盘稀释法检测联合药敏的分级抑菌浓度(FIC),FIC=联合药物A的MIC/单独药物A的MIC+联合药物B的MIC/单独药物B的MIC,协同效应为FIC≤0.5,相加效应为0.5 < FIC≤1,无关效应为1 < FIC≤2,拮抗效应为FIC>2[6]。结果判定根据2022版美国临床实验室标准化协会(CLSI)指南推荐的标准和折点。CZA的浓度范围为0.25/4~128/4 μg/mL(阿维巴坦的浓度固定为4 μg/mL),ATM的浓度为0.06~128 μg/mL。
1.2.3 时间-杀菌曲线
选取9、19、37号对CZA敏感产KPC的肺炎克雷伯菌,根据CZA对产KPC菌的MIC,采用时间杀灭法检测CZA在0.5、1、2、4和8倍MIC时的杀菌效果。根据CZA与ATM联合药敏试验结果及文献推荐的方法[7],选取27、39、47号对CZA耐药产NDM大肠埃希菌,取对数生长期细菌,用无菌M-H肉汤配制浓度为1.0×106 CFU/mL的菌悬液。细菌的M-H肉汤与单一或组合抗菌剂混合,并在35℃下连续振摇孵育过夜。不含抗菌药物的相同肉汤作为生长对照。在0、4、8、12和24 h对肉汤样品进行10倍系列稀释,每个稀释样本取100 μL接种在M-H琼脂平板上,重复试验3次,35℃过夜培养,进行菌落计数,取平均值。每毫升菌液计数表示为Nt,数据换算为Log10 Nt。使用GraphPad Prism 5软件分析数据并绘图。
1.2.4 大蜡螟毒力试验
选取16、22、30号对CZA耐药产金属酶的菌株,以M-H肉汤中孵育的对数生长期细菌制备菌悬液,稀释为3个浓度梯度(1.0×107、1.0×106、1.0×105 CFU/mL),将大蜡螟幼虫随机分为5组,每组20只幼虫,其中1~3组分别使用微量注射器注射相应浓度菌液10 μL,第4组为PBS对照组,注射PBS溶液10 μL,第5组为空白对照组,不做任何处理。将注射后的幼虫置于37℃培养箱孵育120 h,每24 h观察幼虫存活量。试验重复3次,计算每株菌的LD80。
1.2.5 大蜡螟感染模型建立
根据毒力试验得到的结果,配制每株菌的80%致死剂量对应的菌液浓度,以此浓度配制菌液感染大蜡螟幼虫。试验分为5组,每组20只幼虫,第1、2、3组注射相应浓度菌液10 μL,第4组为PBS对照组,注射PBS溶液10 μL,第5组为空白对照组,不做任何处理。注射完毕后将幼虫置于37℃培养箱中孵育2 h,然后对试验组幼虫模拟人体剂量一次性给予10 μL的抗菌药物(CZA和ATM的人体剂量分别为50、100 mg/kg)。给第1组幼虫注射相应浓度的CZA 10 μL,给第2组幼虫注射相应浓度的ATM 10 μL,给第3组幼虫注射相应浓度的CZA和ATM联合药物10 μL,给第4组幼虫注射PBS溶液10 μL,第5组幼虫不做任何处理。将注射后的幼虫置于37℃培养箱继续孵育120 h,每24 h观察并记录每组幼虫死亡数量,比较存活率。
1.3 统计学方法
应用SPSS 22.0软件进行统计学分析,对于生存率曲线比较,使用Log-rank (Mantel-Cox)检验分析结果。P≤0.05为差异有统计学意义。
2. 结果
2.1 52株CRE碳青霉烯酶酶型及CZA的MIC值
52株CRE共检出产KPC酶23株,产NDM酶24株,产IMP酶1株,产KPC+NDM菌3株,产KPC+IMP酶1株。23株产KPC酶菌中91.3%(21株)对CZA的MIC≤4 μg/mL,另外8.7%(2株)的菌株对CZA的MIC≥128 μg/mL。29株产金属β-内酰胺酶(MBL)的菌株对CZA的MIC值均≥128 μg/mL。见表 1。
表 1 52株CRE对CZA、ATM的药敏测定结果Table 1 CZA and ATM susceptibility testing results of 52 strains of CRE菌株编号 菌株 酶型 CZA的MIC (μg/mL) ATM的MIC (μg/mL) 菌株编号 菌株 酶型 CZA的MIC (μg/mL) ATM的MIC (μg/mL) 1 大肠埃希菌 NDM >128 64 14 肺炎克雷伯菌 KPC 1 >128 2 肺炎克雷伯菌 KPC 0.5 >128 15 肺炎克雷伯菌 KPC 1 >128 3 肺炎克雷伯菌 KPC 1 >128 16 大肠埃希菌 NDM >128 >128 4 肺炎克雷伯菌 KPC 1 >128 17 肺炎克雷伯菌 KPC 0.5 >128 5 肺炎克雷伯菌 KPC 0.5 >128 18 肺炎克雷伯菌 KPC 2 >128 6 肺炎克雷伯菌 KPC 0.25 >128 19 肺炎克雷伯菌 KPC 1 >128 7 肺炎克雷伯菌 KPC >128 >128 20 肺炎克雷伯菌 KPC 1 >128 8 肺炎克雷伯菌 KPC 1 >128 21 肺炎克雷伯菌 KPC 0.5 >128 9 肺炎克雷伯菌 KPC 0.5 >128 22 阴沟肠杆菌 IMP >128 >128 10 肺炎克雷伯菌 KPC 2 >128 23 大肠埃希菌 NDM >128 >128 11 肺炎克雷伯菌 KPC 4 >128 24 大肠埃希菌 NDM >128 2 12 肺炎克雷伯菌 KPC 0.5 64 25 大肠埃希菌 NDM >128 >128 13 肺炎克雷伯菌 KPC 128 >128 26 大肠埃希菌 NDM >128 64 27 大肠埃希菌 NDM >128 >128 40 大肠埃希菌 NDM >128 >128 28 大肠埃希菌 NDM >128 >128 41 大肠埃希菌 NDM >128 >128 29 黏质沙雷菌 KPC 1 32 42 大肠埃希菌 NDM 128 >128 30 肺炎克雷伯菌 KPC+NDM >128 >128 43 肺炎克雷伯菌 NDM >128 1 31 肺炎克雷伯菌 KPC+NDM >128 >128 44 大肠埃希菌 NDM >128 >128 32 肺炎克雷伯菌 KPC+IMP >128 >128 45 肺炎克雷伯菌 NDM >128 >128 33 肺炎克雷伯菌 KPC+NDM >128 >128 46 大肠埃希菌 NDM >128 >128 34 大肠埃希菌 NDM >128 4 47 大肠埃希菌 NDM >128 128 35 阴沟肠杆菌 NDM >128 >128 48 肺炎克雷伯菌 NDM >128 >128 36 肺炎克雷伯菌 KPC 0.5 >128 49 大肠埃希菌 NDM >128 >128 37 肺炎克雷伯菌 KPC 1 >128 50 大肠埃希菌 NDM >128 >128 38 大肠埃希菌 NDM >128 32 51 大肠埃希菌 NDM >128 128 39 大肠埃希菌 NDM >128 >128 52 肺炎克雷伯菌 KPC 1 >128 2.2 31株CZA耐药菌株的联合药敏结果
选择对CZA耐药的31株菌进行CZA与ATM联合药敏试验,结果表明,93.5%(29株)的FIC值<0.5,6.5%(2株)的FIC在0.5~1,显示出良好的协同和相加效应。见表 2。
表 2 CZA与ATM联合对31株CZA耐药菌株的作用效果Table 2 Effect of combination of CZA and ATM on 31 CZA-resistant strains菌株编号 菌株 酶型 FIC 作用 菌株编号 菌株 酶型 FIC 作用 1 大肠埃希菌 NDM 0.125 协同 35 阴沟肠杆菌 NDM 0.188 协同 7 肺炎克雷伯菌 KPC 0.156 协同 38 大肠埃希菌 NDM 0.125 协同 13 肺炎克雷伯菌 KPC 0.125 协同 39 大肠埃希菌 NDM 0.094 协同 16 大肠埃希菌 NDM 0.188 协同 40 大肠埃希菌 NDM 0.094 协同 22 阴沟肠杆菌 IMP 0.094 协同 41 大肠埃希菌 NDM 0.188 协同 23 大肠埃希菌 NDM 0.188 协同 42 大肠埃希菌 NDM 0.156 协同 24 大肠埃希菌 NDM 0.563 相加 43 肺炎克雷伯菌 NDM 0.281 协同 25 大肠埃希菌 NDM 0.094 协同 44 大肠埃希菌 NDM 0.156 协同 26 大肠埃希菌 NDM 0.313 协同 45 肺炎克雷伯菌 NDM 0.063 协同 27 大肠埃希菌 NDM 0.156 协同 46 大肠埃希菌 NDM 0.125 协同 28 大肠埃希菌 NDM 0.078 协同 47 大肠埃希菌 NDM 0.266 协同 30 肺炎克雷伯菌 KPC+NDM 0.188 协同 48 肺炎克雷伯菌 NDM 0.156 协同 31 肺炎克雷伯菌 KPC+NDM 0.047 协同 49 大肠埃希菌 NDM 0.094 协同 32 肺炎克雷伯菌 KPC+IMP 0.125 协同 50 大肠埃希菌 NDM 0.188 协同 33 肺炎克雷伯菌 KPC+NDM 0.063 协同 51 大肠埃希菌 NDM 0.188 协同 34 大肠埃希菌 NDM 0.625 相加 2.3 不同浓度CZA对产KPC酶菌株的杀菌效果及CZA联合ATM对产NDM酶菌株的杀菌效果
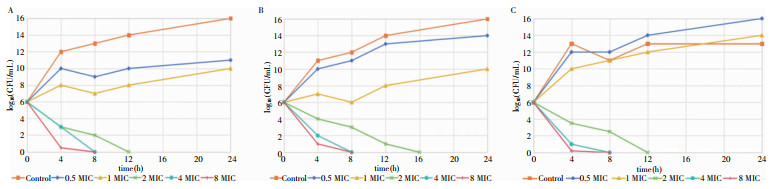
CZA处理9、19、37号产KPC酶菌株,9号菌株经药物处理,在12 h后检测到显著杀菌功效。此外,用2、4和8倍MIC CZA处理,在培养24 h后,9号菌株未检测到菌落生长。19号菌株经过药物处理,在12 h后检测到显著杀菌功效,用4和8倍MIC CZA处理,8 h后细菌数为0。37号菌株用0.5倍MIC和1倍MIC CZA处理,细菌数无明显变化,用2、4和8倍MIC CZA处理12 h后细菌数为0。见图 1。CZA联合ATM的时间-杀菌曲线显示CZA和ATM的组合对27号、39号、47号产NDM酶的菌株显示出显著的杀菌功效,孵育8~12 h后未检测到菌落生长。见图 2。
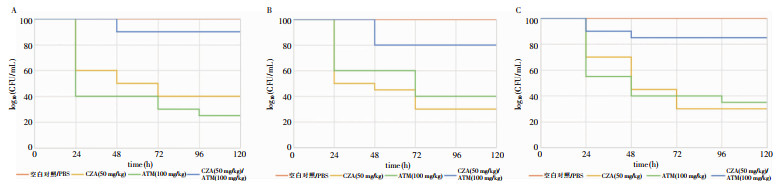
2.4 CZA单用及联合ATM对感染大蜡螟生存的影响
16、30号菌株的LD80为1.0×106 CFU/mL,22号菌株的LD80为1.0×107 CFU/mL。CZA联合ATM对CRE感染的幼虫具有保护作用,两药联合48 h后,幼虫的存活率稍有下降,但仍然保持在80%~90%的水平,比使用单药时的存活率(中位生存时间120 h)有大幅度提高,差异具有统计学意义(P=0.001)。见图 3。
3. 讨论
CRE对临床常见抗菌药物大多数耐药,可选择的抗感染治疗药物有限,成为临床棘手的问题[8]。目前研究显示,CRE的耐药机制主要是产碳青霉烯酶,孔道蛋白缺失或表达降低而导致的外膜通透性降低,外排泵高度表达等,其中以产碳青霉烯酶在临床上最常见[9-10]。
本研究中52株CRE菌株产碳青霉烯酶情况分析显示,肺炎克雷伯菌是以产A类丝氨酸碳青霉烯酶KPC型为主,少数菌株产B类NDM型金属酶。20株大肠埃希菌及2株阴沟肠杆菌均为产NDM型碳青霉烯酶,与我国的流行情况一致[5]。酶抑制剂在临床治疗中起着非常重要的作用,阿维巴坦是一种新型β-内酰胺酶抑制剂,能有效、可逆的结合碳青霉烯酶中的A类丝氨酸酶及部分D类苯唑西林酶,已被应用于临床,是临床治疗CRE感染的一线选择[11]。本研究中,23株产KPC菌株中91.3%对CZA敏感,8.7%对CZA耐药,与相关报道[12]相近。产KPC菌株对CZA大多数敏感,但耐药菌的出现仍值得关注,耐药菌株多出现在CZA治疗后,甚至没有药物暴露史。产KPC酶的菌株对CZA耐药机制主要由blaKPC-2中的氨基酸取代和缺失介导,突变为其他亚型,如KPC-3型等[13]。此外,外排和孔蛋白突变增强,CTX-M或AmpC的突变也可导致CZA耐药[12, 14]。29株产金属酶的菌株对CZA耐药,MIC值≥128 μg/mL。对于CZA耐药菌株的治疗,应考虑其他有效的抗菌药物或CZA与其他抗菌药物的组合。CZA联合ATM的主要机制是阿维巴坦能保护ATM免受ESBLs、AmpC酶水解,使ATM维持抗菌活性。国外已有研究[15-16]表明,ATM联合CZA的组合能够治疗肺炎克雷伯菌(产NDM-1和OXA-48)、铜绿假单胞菌(产NDM-1和AmpC)以及阴沟肠杆菌(产NDM-1和KPC-4)引起的感染,并取得良好疗效。因携带一种或多种ESBLs,94.7%的CRE菌株对ATM耐药,但在联合阿维巴坦之后,96.9%ATM耐药菌株CZA-ATM的MIC≤1 μg/mL[17]。在本研究中,CZA对KPC酶产生菌株表现出良好的体外杀菌效果,CZA对91.3%的菌株MIC值≤4 μg/mL。然而,其对29株MBL菌株的MIC值均≥128 μg/mL。CZA和ATM两种药物联合后,MIC值可降低至各自的敏感范围内,FIC值均<1,表明具有良好的协同或相加效应。时间杀菌试验显示,9号菌株在0.5和1倍MIC的CZA处理后8 h,产KPC酶的菌株出现反弹生长。在2倍MIC的CZA下,菌株在处理的前4 h内稳定减少。处理12 h后未检测到菌落。对于4和8倍MIC,在处理8 h后未检测到菌落,表明适当剂量的CZA对KPC产生菌具有良好的杀菌效果。对于产NDM酶菌株,与CZA和ATM组合孵育8~12 h后未检测到菌落生长,表明该组合具有良好的杀菌功效。因此,CZA联合ATM方案可用于临床治疗NDM酶产生的CRE菌株。CZA联合ATM对CRE感染的幼虫具有保护作用,两药联合可以提高大蜡螟幼虫的生存率,16号菌株CZA单药组24 h后感染大蜡螟存活率仅为60%,而联合用药组,感染大蜡螟的存活率仍然保持100%,120 h后,CZA单药组感染大蜡螟的存活率仅为40%,而联合用药组48 h后,感染幼虫的存活率稍有下降,但仍然保持在90%的水平,并一直维持到120 h,比使用单药时的存活率大幅提高。结果表明,CZA联合ATM可延长产NDM菌感染大蜡螟的寿命并降低其死亡率。
综上所述,CZA对于产KPC的菌株具有良好的杀菌作用,并且当与ATM联合时,对基因型为blaNDM、blaIMP、blaKPC+blaIMP和blaKPC+blaNDM的细菌具有良好的协同杀菌作用。因此,在临床CZA或CZA联合ATM可以作为CRE感染的早期治疗选择。本研究收集的临床菌株来源于单中心,样本量较少,尤其是非产酶菌株以及除NDM外其他产金属酶菌株更少,缺乏对这部分菌株的研究结果,因此结果存在着一定的局限性。以后的工作中,扩大样本量,加大对不同耐药机制碳青霉烯类抗生素耐药菌株的深入研究,能够更好为临床抗感染联合用药提供可靠的实验室依据。
利益冲突:所有作者均声明不存在利益冲突。
-
表 1 52株CRE对CZA、ATM的药敏测定结果
Table 1 CZA and ATM susceptibility testing results of 52 strains of CRE
菌株编号 菌株 酶型 CZA的MIC (μg/mL) ATM的MIC (μg/mL) 菌株编号 菌株 酶型 CZA的MIC (μg/mL) ATM的MIC (μg/mL) 1 大肠埃希菌 NDM >128 64 14 肺炎克雷伯菌 KPC 1 >128 2 肺炎克雷伯菌 KPC 0.5 >128 15 肺炎克雷伯菌 KPC 1 >128 3 肺炎克雷伯菌 KPC 1 >128 16 大肠埃希菌 NDM >128 >128 4 肺炎克雷伯菌 KPC 1 >128 17 肺炎克雷伯菌 KPC 0.5 >128 5 肺炎克雷伯菌 KPC 0.5 >128 18 肺炎克雷伯菌 KPC 2 >128 6 肺炎克雷伯菌 KPC 0.25 >128 19 肺炎克雷伯菌 KPC 1 >128 7 肺炎克雷伯菌 KPC >128 >128 20 肺炎克雷伯菌 KPC 1 >128 8 肺炎克雷伯菌 KPC 1 >128 21 肺炎克雷伯菌 KPC 0.5 >128 9 肺炎克雷伯菌 KPC 0.5 >128 22 阴沟肠杆菌 IMP >128 >128 10 肺炎克雷伯菌 KPC 2 >128 23 大肠埃希菌 NDM >128 >128 11 肺炎克雷伯菌 KPC 4 >128 24 大肠埃希菌 NDM >128 2 12 肺炎克雷伯菌 KPC 0.5 64 25 大肠埃希菌 NDM >128 >128 13 肺炎克雷伯菌 KPC 128 >128 26 大肠埃希菌 NDM >128 64 27 大肠埃希菌 NDM >128 >128 40 大肠埃希菌 NDM >128 >128 28 大肠埃希菌 NDM >128 >128 41 大肠埃希菌 NDM >128 >128 29 黏质沙雷菌 KPC 1 32 42 大肠埃希菌 NDM 128 >128 30 肺炎克雷伯菌 KPC+NDM >128 >128 43 肺炎克雷伯菌 NDM >128 1 31 肺炎克雷伯菌 KPC+NDM >128 >128 44 大肠埃希菌 NDM >128 >128 32 肺炎克雷伯菌 KPC+IMP >128 >128 45 肺炎克雷伯菌 NDM >128 >128 33 肺炎克雷伯菌 KPC+NDM >128 >128 46 大肠埃希菌 NDM >128 >128 34 大肠埃希菌 NDM >128 4 47 大肠埃希菌 NDM >128 128 35 阴沟肠杆菌 NDM >128 >128 48 肺炎克雷伯菌 NDM >128 >128 36 肺炎克雷伯菌 KPC 0.5 >128 49 大肠埃希菌 NDM >128 >128 37 肺炎克雷伯菌 KPC 1 >128 50 大肠埃希菌 NDM >128 >128 38 大肠埃希菌 NDM >128 32 51 大肠埃希菌 NDM >128 128 39 大肠埃希菌 NDM >128 >128 52 肺炎克雷伯菌 KPC 1 >128 表 2 CZA与ATM联合对31株CZA耐药菌株的作用效果
Table 2 Effect of combination of CZA and ATM on 31 CZA-resistant strains
菌株编号 菌株 酶型 FIC 作用 菌株编号 菌株 酶型 FIC 作用 1 大肠埃希菌 NDM 0.125 协同 35 阴沟肠杆菌 NDM 0.188 协同 7 肺炎克雷伯菌 KPC 0.156 协同 38 大肠埃希菌 NDM 0.125 协同 13 肺炎克雷伯菌 KPC 0.125 协同 39 大肠埃希菌 NDM 0.094 协同 16 大肠埃希菌 NDM 0.188 协同 40 大肠埃希菌 NDM 0.094 协同 22 阴沟肠杆菌 IMP 0.094 协同 41 大肠埃希菌 NDM 0.188 协同 23 大肠埃希菌 NDM 0.188 协同 42 大肠埃希菌 NDM 0.156 协同 24 大肠埃希菌 NDM 0.563 相加 43 肺炎克雷伯菌 NDM 0.281 协同 25 大肠埃希菌 NDM 0.094 协同 44 大肠埃希菌 NDM 0.156 协同 26 大肠埃希菌 NDM 0.313 协同 45 肺炎克雷伯菌 NDM 0.063 协同 27 大肠埃希菌 NDM 0.156 协同 46 大肠埃希菌 NDM 0.125 协同 28 大肠埃希菌 NDM 0.078 协同 47 大肠埃希菌 NDM 0.266 协同 30 肺炎克雷伯菌 KPC+NDM 0.188 协同 48 肺炎克雷伯菌 NDM 0.156 协同 31 肺炎克雷伯菌 KPC+NDM 0.047 协同 49 大肠埃希菌 NDM 0.094 协同 32 肺炎克雷伯菌 KPC+IMP 0.125 协同 50 大肠埃希菌 NDM 0.188 协同 33 肺炎克雷伯菌 KPC+NDM 0.063 协同 51 大肠埃希菌 NDM 0.188 协同 34 大肠埃希菌 NDM 0.625 相加 -
[1] 胡付品, 郭燕, 朱德妹, 等. 2021年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2022, 22(5): 521-530. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of antimicrobial resistance among the bacterial isolates in 2021[J]. Chinese Journal of Infection and Chemotherapy, 2022, 22(5): 521-530. [2] Seo H, Lee SC, Chung H, et al. Clinical and microbiological analysis of risk factors for mortality in patients with carbapenem-resistant Enterobacteriaceae bacteremia[J]. Int J Antimicrob Agents, 2020, 56(4): 106126. doi: 10.1016/j.ijantimicag.2020.106126 [3] Ma JY, Song XR, Li MC, et al. Global spread of carbapenem-resistant Enterobacteriaceae: epidemiological features, resistance mechanisms, detection and therapy[J]. Microbiol Res, 2023, 266: 127249. doi: 10.1016/j.micres.2022.127249 [4] 王珍珍, 赵战勤, 常永超, 等. 耐碳青霉烯革兰阴性杆菌耐药性及耐药基因blaKPC的分子特征[J]. 中国感染控制杂志, 2020, 19(10): 857-863. https://www.zggrkz.com/zggrkzzz/article/abstract/2020-10-857?st=search Wang ZZ, Zhao ZQ, Chang YC, et al. Drug resistance of carbapenem-resistant Gram-negative bacilli and molecular characteristics of drug resistance gene blaKPC[J]. Chinese Journal of Infection Control, 2020, 19(10): 857-863. https://www.zggrkz.com/zggrkzzz/article/abstract/2020-10-857?st=search [5] 刘志武, 张甜甜, 徐腾飞, 等. 某医院2020—2021年CRE耐药性及碳青霉烯酶基因分析[J]. 中国抗生素杂志, 2023, 48(7): 806-812. Liu ZW, Zhang TT, Xu TF, et al. Analysis of drug resistance and carbapenemase gene of carbapenem-resistant Enterobacteriaceae in a hospital from 2020 to 2021[J]. Chinese Journal of Antibiotics, 2023, 48(7): 806-812. [6] Adaleti R, Nakipoǧlu Y, Ar1c1 N, et al. Evaluation of in vitro efficacy of meropenem/colistin and meropenem/fosfomycin combinations on multidrug resistant Gram-negative bacilli[J]. Mikrobiyol Bul, 2023, 57(3): 365-377. doi: 10.5578/mb.20239930 [7] Aubry R, Buyck J, Prouvensier L, et al. An improved PKPD modeling approach to characterize the pharmacodynamic interaction over time between ceftazidime/avibactam and colistin from in vitro time-kill experiments against multidrug-resistant Klebsiella pneumoniae isolates[J]. Antimicrob Agents Chemother, 2023, 67(10): e0030123. doi: 10.1128/aac.00301-23 [8] Rebold N, Lagnf AM, Alosaimy S, et al. Risk factors for carbapenem-resistant Enterobacterales clinical treatment failure[J]. Microbiol Spectr, 2023, 11(1): e0264722. doi: 10.1128/spectrum.02647-22 [9] Gao F, Xiong ZL, Liang BS, et al. Molecular characterization and epidemiology of carbapenem-resistant Enterobacteriaceae isolated from pediatric patients in Guangzhou, southern China[J]. Can J Infect Dis Med Microbiol, 2023, 2023: 4762143. [10] 沈芳, 全晶晶, 刘炉香, 等. 碳青霉烯耐药肠杆菌目细菌耐药性及耐药传播机制研究[J]. 中华微生物学和免疫学杂志, 2021, 41(9): 679-686. Shen F, Quan JJ, Liu LX, et al. Resistance and transmission mechanisms of carbapenem-resistant Enterobacterales[J]. Chinese Journal of Microbiology and Immunology, 2021, 41(9): 679-686. [11] Sader HS, Mendes RE, Duncan L, et al. Ceftazidime-avibactam, meropenem-vaborbactam, and imipenem-relebactam activities against multidrug-resistant Enterobacterales from United States Medical Centers (2018-2022)[J]. Diagn Microbiol Infect Dis, 2023, 106(2): 115945. [12] Cui QZ, Wang C, Wang QC, et al. Ceftazidime/avibactam resistance in carbapenemase-producing Klebsiella pneumoniae[J]. Emerg Infect Dis, 2023, 29(11): 2398-2400. [13] Bongiorno D, Bivona DA, Cicino C, et al. Omic insights into various ceftazidime-avibactam-resistant Klebsiella pneumoniae isolates from two southern Italian regions[J]. Front Cell Infect Microbiol, 2023, 12: 1010979. [14] Xiong LY, Wang Y, Wang XT, et al. Mechanisms of ceftazidime/avibactam resistance in drug-naïve bacteraemic Enterobacterales strains without metallo-beta-lactamase production: associated with ceftazidime impedance[J]. Int J Antimicrob Agents, 2023, 62(2): 106877. [15] Bocanegra-Ibarias P, Camacho-Ortiz A, Garza-González E, et al. Aztreonam plus ceftazidime-avibactam as treatment of NDM-1-producing Klebsiella pneumoniae bacteraemia in a neutropenic patient: last resort therapy?[J]. J Glob Antimicrob Resist, 2020, 23: 417-419. [16] Yasmin M, Fouts DE, Jacobs MR, et al. Monitoring ceftazidime-avibactam and aztreonam concentrations in the treatment of a bloodstream infection caused by a multidrug-resistant Enterobacter sp. carrying both Klebsiella pneumoniae carbapenemase-4 and New Delhi metallo-β-lactamase-1[J]. Clin Infect Dis, 2020, 71(4): 1095-1098. [17] Zhang BY, Zhu ZC, Jia W, et al. In vitro activity of aztreonam-avibactam against metallo-β-lactamase-producing Enterobacteriaceae-a multicenter study in China[J]. Int J Infect Dis, 2020, 97: 11-18.

 下载:
下载: