2. 遵义医科大学第三附属医院 遵义市第一人民医院骨科, 贵州 遵义 563000
2. Department of Orthope- dics, The Third Affiliated Hospital of Zunyi Medical University, First People's Hospital of Zunyi, Zunyi 563000, China
化脓性脊柱炎是椎间盘和邻近椎体的一种感染。据报道,发达国家化脓性脊柱炎的发病率为每年0.2/10万~2.4/10万[1-2],其发病率较高,最常与血行播散、手术后软组织感染或局部感染直接延伸有关。最常见的病原体是金黄色葡萄球菌或革兰阴性杆菌。厌氧菌感染占所有脊柱感染的3%~4%,其中大多数病例为拟杆菌、胃链球菌和丙酸杆菌感染[3-5],但在厌氧菌感染引起的脊柱炎病例中血培养阳性较少[6]。中间普雷沃菌是口腔菌群中一种天然的厌氧菌,引起的脊柱感染极为罕见。本文报告1例临床诊断为中间普雷沃菌引起脊柱感染的病例,结合文献分析探讨中间普雷沃菌引起脊柱感染的临床特征、诊疗及预后,以提高对此病的认识。
1 病历资料 1.1 病史患者50岁,男性,因“腰痛伴双下肢疼痛2个月”于2022年3月8日入院。患者2个月前出现腰痛伴有双下肢疼痛,疼痛放射至大腿后侧;考虑“腰椎间盘突出症”予以口服药物、针灸、理疗等保守治疗。上述症状逐渐加重并出现下肢麻木,行走困难,咳嗽或体位改变可诱发疼痛加重。自诉近2个月低热、盗汗,来我院就诊。既往史无特殊。
1.2 入院体格检查及诊断体格检查:体温37℃、心率76次/min、呼吸20次/min、血压140/86 mmHg;脊柱未见明显侧弯及畸形,腰背局部皮温不高,皮肤轻微发红,无破溃、窦道。棘突、棘突旁压痛及叩击痛明显,改变体位时疼痛加重。双小腿外侧、内踝皮肤针刺感觉减退;双下肢关键肌肌力Ⅳ级。膝反射、跟腱反射对称存在,巴彬斯基征阴性。双侧直腿抬高试验45°阳性,加强试验阳性。双足皮温正常,足背动脉搏动良好。入院诊断:腰椎4~5(L4~5)骨质破坏查因。
1.3 影像学检查患者腰椎MRI平扫结果显示,L4~5椎体及附件见斑片状长T1、长T2信号并部分骨缺损;椎管内见梭形长T2信号肿物,信号不均匀;椎管前后径最窄处约3.5 mm。见图 1A。腰椎增强MRI结果显示,L4~5椎体及附件病变组织明显强化。考虑:(1)淋巴瘤或浆细胞瘤;(2)腰椎结核。见图 1B。腰椎CT结果显示,腰4/5椎间隙塌陷,腰4~5椎体及附件骨骨质破坏并椎旁软组织肿胀。见图 1C。腰椎X正侧位见腰椎骨质密度减低;L4/5、L5骶1(S1)间隙变窄,椎体前缘骨质增生。见图 1D。正电子发射计算机断层显像(PET-CT)示L4、L5椎体骨质破坏,代谢明显增高,倾向于特殊感染(结核)。
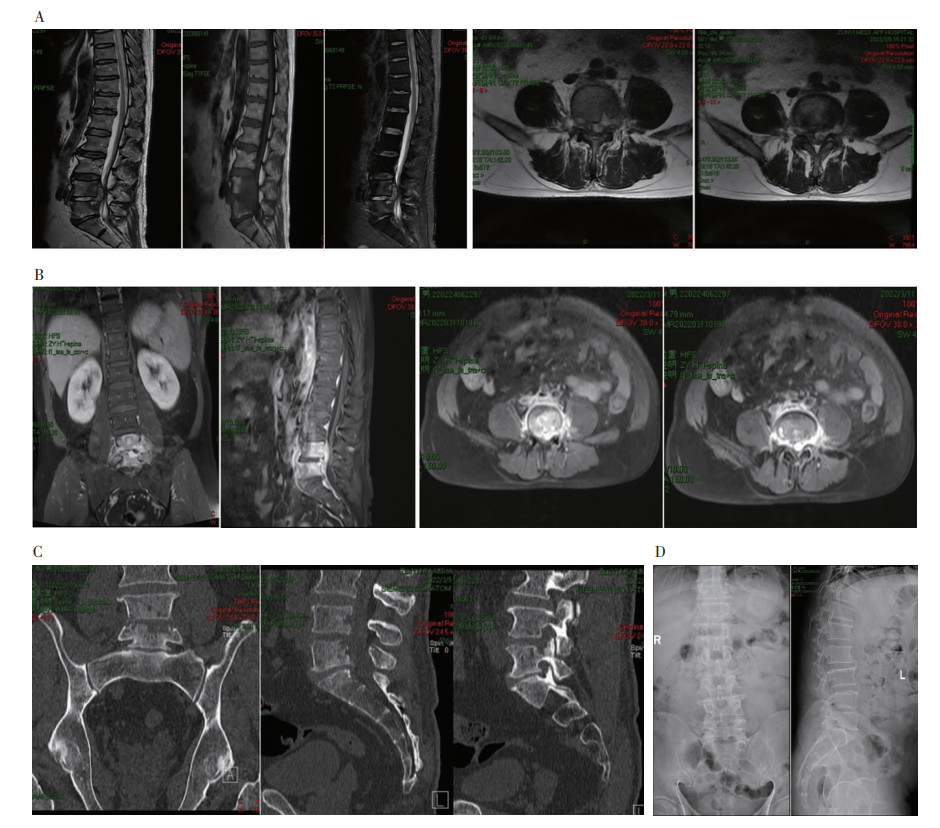 |
| 注:A为MRI平扫;B为增强MRI;C为CT;D为X线正侧位。 图 1 患者腰椎影像学检查结果 Figure 1 Imaging examination results of lumbar vertebra of patient |
血白细胞计数11.42×109/L、中性粒细胞百分比81%,血沉78 mm/h,C反应蛋白70.38 mg/L;白细胞介素-4(IL-4)3.11 pg/mL(参考值:0.1~2.8 pg/mL),白细胞介素-6(IL-6)18.49 pg/mL (参考值:1.18~3 pg/mL);结核分枝杆菌感染T细胞检测(T-SPOT)阳性,术区标本培养见正常咽喉部杂菌生长。肝肾功能、碱性磷酸酶、布氏杆菌凝集试验、乙型肝炎病毒、梅毒、人类免疫缺陷病毒(HIV)抗体检测、结核菌素(PPD)试验、肿瘤相关抗原均未见异常;多次血培养(厌氧+有氧)、多次抗酸染色及涂片阴性。心、肺、腹部检查未见异常。
1.5 诊疗经过结合患者病史,考虑患者结核分枝杆菌感染可能性大,于2022年3月9日开始予以抗结核治疗(异烟肼300 mg/d、利福平450 mg/d、吡嗪酰胺1 500 mg/d、乙胺丁醇750 mg/d),经抗结核治疗期间患者16:00~20:00间断低热,最高体温37.6℃。为进一步明确诊断、排除肿瘤,于3月14日行“L5椎体穿刺活检”并送培养、染色等检查。术后病理检查结果示:组织呈急慢性炎症改变。于是加用头孢曲松钠(2 g/d,静脉滴注)抗感染,患者体温维持在36.8~37.3℃。抗感染约2周后,患者疼痛症状缓解不明显并出现下肢肌力减弱。3月22号实验室检查:白细胞计数8.74×109/L,中性粒细胞百分比71%,血沉120 mm/h,C反应蛋白141.97 mg/L,降钙素原0.15 ng/mL。经讨论后于3月24日行“后路腰椎病灶清除、减压、自体骨移植融合内固定+术区引流管对口冲洗术”。手术过程:术中见L4~5椎管内脓肿,椎间隙明显狭窄,L4椎下部、L5椎上部及L4/5椎间盘严重破坏,覆有肉芽组织及土黄灰色脓液。彻底清除椎间隙、椎管内病灶组织;骨微动力系统辅助下打磨死腔内残存的硬化骨质边缘,备好植骨床。大量双氧水、淡碘伏及生理盐水反复冲洗。将混有链霉素的自体髂骨植入L4~5椎体间,摆放引流管和冲洗管各一根,手术结束。术后送组织病理检查示:化脓性炎症伴脓肿形成,未见明确结核病变表现。3月25日术中病灶送宏基因组二代测序(metagenomic next-generation sequencing, mNGS)示:革兰阴性菌(中间普雷沃菌),无药敏试验结果。并于当日停用抗结核药物,调整治疗方案为甲硝唑(0.5 g,bid)、头孢曲松钠(2 g,qd),奥硝唑生理盐水持续低流量冲洗7 d。经治疗后患者疼痛症状缓解,体温维持在36.2~36.8℃。术后10 d:血白细胞计数6.51×109/L,中性粒细胞百分比68%,血沉86 mm/h,C反应蛋白8.48 mg/L,降钙素原0.03 ng/mL。患者于2022年4月19日出院,嘱患者出院后继续静脉滴注头孢曲松钠、甲硝唑1个月,口服甲硝唑1个月。术后3个月血沉为18 mm/h,其余检验均正常。
术后腰椎X线片示,L4~S1内固定位良好、无松动,见图 2A。术后2个月腰椎MRI示,腰背部软组织见部分长T2信号,水肿信号较前减轻,椎管内通畅,未见明显脓肿,见图 2B。术后2个月腰椎CT检查见部分骨质生长,见图 2C。
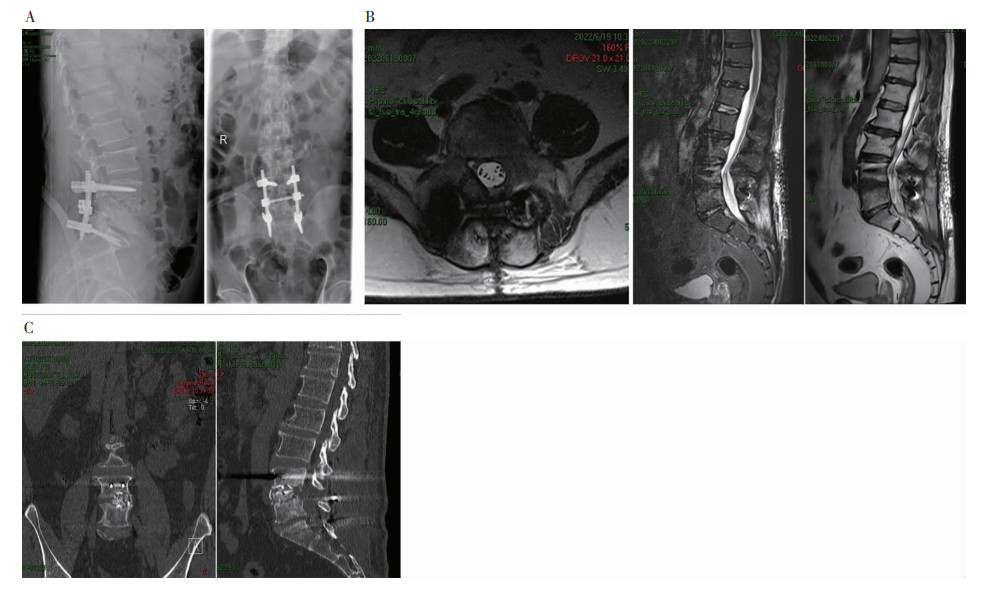 |
| 注:A为X线;B为MRI;C为CT。 图 2 患者术后2个月腰椎影像学检查结果 Figure 2 Imaging examination results of lumbar vertebra of patient two months after surgery |
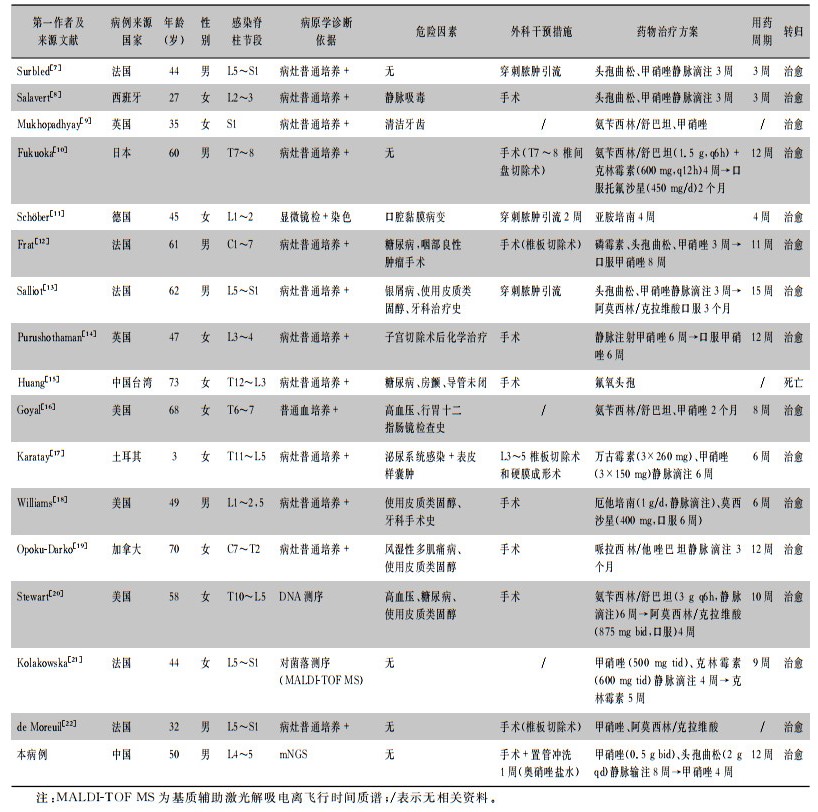
检索万方中文数据库、中国知网建库至今,以及PubMed英文数据库1990年至今关于中间普雷沃菌引起脊柱感染的相关文献。中文检索关键词为中间普雷沃菌,英文检索关键词为Prevotella intermedia、vertebral osteomyelitis、anaerobes,共检索出16篇文献[7-22],均为英文文献,加上本文报告的患者共17例,文献类型包括病例报告和回顾性分析。根据病例特点按发病年龄、性别、危险因素、受累节段、病原学诊断依据、治疗方案、预后转归等临床资料进行描述性分析,见表 1。
| 表 1 普雷沃菌脊柱炎患者临床特征及治疗转归 Table 1 Clinical characteristics of patients with Prevotella spondylitis |
|
17例患者中男性7例,女性10例,平均年龄48.7(3~73)岁。除5例患者无基础疾病外,其余12例患者均有不同危险因素。(1)糖尿病,共3例;(2)使用皮质类固醇:共4例,其中1例合并糖尿病;(3)口腔操作史:共6例,其中1例清洁牙齿,1例口腔溃疡,1例咽部手术史合并糖尿病,2例行牙科手术并长期使用皮质类固醇;1例经口行胃肠镜检查;(4)其他因素3例,静脉吸毒史、泌尿系统感染、子宫切除后化学治疗各1例。最常见的侵犯部位为腰椎:分别为L1 5例,L2 6例,L3 5例,L4 4例,L5 8例;胸椎6例,骶椎5例,颈椎2例。17例患者中,10例出现神经功能损伤表现,其中截瘫1例,手术后因其他并发症死亡;1例术后残留部分偏瘫症状,其余8例均获得良好恢复。所有患者均行血培养检查,其中血培养阳性仅1例。
17例患者均为确诊病例,其中12例通过病灶组织或脓液培养阳性;1例通过血培养阳性;直接染色镜检阳性者1例,分子学检测阳性者3例。3例分子学检测阳性者中应用MALDI-TOF MS法检测、DNA测序及mNGS检测各1例。
17例患者在诊断普雷沃菌感染后给予了抗厌氧菌药物治疗,其中14例联合手术治疗。最常用的抗厌氧菌药物是甲硝唑(10例)、头孢曲松(5例)、氨苄西林/舒巴坦(4例)、阿莫西林/克拉维酸(3例)、克林霉素(2例),哌拉西林/他唑巴坦、磷霉素、万古霉素、氟氧头孢、厄他培南、亚胺培南、莫西沙星各1例。单药治疗5例,其中亚胺培南治疗1个月,甲硝唑治疗3个月,氟氧头孢、哌拉西林/他唑巴坦治疗3个月,氨苄西林/舒巴坦6周转为阿莫西林/克拉维酸4周各1例。联合2种及以上药物治疗12例(头孢曲松钠+甲硝唑4例,氨苄西林/舒巴坦或阿莫西林/克拉维酸+甲硝唑3例,甲硝唑+克林霉素、莫西沙星+厄他培南、万古霉素+甲硝唑、氨苄西林/舒巴坦+克林霉素、磷霉素+头孢曲松+甲硝唑各1例)。17例患者接受了抗厌氧菌治疗,其中14例联合手术治疗;1例死亡,病死率为5.9%,5例存在部分神经功能损伤,致残率为29.4%。抗厌氧菌治疗联合手术者生存率92.8%(13/14),3例单独抗厌氧菌治疗未行手术者均治愈。
3 讨论普雷沃菌(Prevotella)自1990年以来被研究者从拟杆菌属(Bacteroides)中分出,包括产黑色素拟杆菌组成的一个新菌属,为革兰阴性短球杆菌,专性厌氧菌。在临床标本中分离时,这种细菌通常被认为是正常的共生菌而非致病菌[23]。骨髓炎的主要厌氧菌为拟杆菌属、胃链球菌属、梭杆菌属和梭菌属,以及痤疮拟杆菌。易引起骨感染的条件有血管疾病、咬伤、连续感染、周围神经病变、血行播散和创伤[24]。普雷沃菌属主要在颅骨和咬伤感染中分离,通常定植在人体的黏膜表面,如口腔、胃肠道和阴道。普雷沃菌属引起的常见感染包括牙周病、吸入性肺部感染、女性生殖道感染和腹腔内脓肿、男性泌尿系统感染[25-27]。此外,还可引起皮肤软组织、关节及颅内感染等[24, 28-29]。通过既往文献总结,共检索出16例由普雷沃菌引起的脊柱化脓性感染。其中男女比例为3 ∶5,除4例患者无基础疾病外,其余12例患者均有不同的危险因素。本文报告的该例患者,无基础疾病,缓慢起病。在静脉吸毒者中,肠道细菌、铜绿假单胞菌和念珠菌可引起化脓性关节炎,特别是在胸锁关节和椎间盘间隙[30]。17例病例中的27岁西班牙女性患者长期静脉吸毒。儿童骨与关节感染很少见厌氧菌感染,但Feigin等[31]报道了2例由梭状芽孢杆菌引起的化脓性关节炎患儿。本文综述的文献中,除土耳其报道了1例3岁女性患儿,普雷沃菌脊柱感染行L3~5椎板切除术和硬膜成形术联合万古霉素、甲硝唑治疗6周后好转外,其余16例患者均为成年人。一项为期10年的研究从138例骨和关节感染患者中分离出厌氧微生物,仅4例患者分离出普雷沃菌,累及颅骨(2例)、椎体(1例)和长骨(1例)。主要的诱因包括创伤、既往手术、假体和连续感染[32]。目前普雷沃菌导致的脊柱感染在骨科领域罕见报道。
脊柱感染通常最早出现非特异性背部或颈部疼痛,伴或不伴有发热[33]。1/3的病例存在神经功能障碍,包括腿部无力、感觉障碍、神经根病和括约肌无力等[34]。本文报告的该患者早期以腰疼痛为主,起病缓慢,开始被认为腰椎间盘突出症;随着病程的发展患者症状加重并出现下肢神经根性损伤的表现。总结文献报道的16例病患均有不同程度的病变部位局部疼痛症状;10例出现神经功能损伤表现,其中截瘫1例,偏瘫1例。罗伟刚等[35]报道脊柱化脓性感染中除局部症状外,最常见的典型表现为病程时间短,并伴有发热和寒战。本文统计从疼痛症状加重或者神经损伤就医并诊断为感染,发病时间>3周6例,≤3周9例,未描述时间2例;体温>38℃ 10例,37.3~38℃ 3例,<37.3℃ 2例,未描述体温2例。急性发病及体温升高仍是普雷沃菌脊柱感染的主要临床表现。但以上病例血培养阳性仅1例,血培养阳性率极低。比较既往普雷沃菌化脓性脊柱炎病例发现,有血液生化检验数据10例;白细胞计数>12×109/L 8例,中性粒细胞百分比>80% 2例,血沉>20 mm/h 6例,C反应蛋白>100 mg/L 8例。本文报告的患者入院时白细胞计数11.42×109/L,中性粒细胞百分比81%,血沉78 mm/h,C反应蛋白70.38 mg/L。当时因为考虑结核分枝杆菌感染可能,予以抗结核治疗约2周后白细胞计数8.74×109/L,中性粒细胞百分比71%,血沉120 mm/h,C反应蛋白141.97 mg/L,降钙素原0.15 ng/mL。血沉及C反应蛋白不降反而明显升高,提示重症感染,抗结核的诊断性治疗方案对普雷沃菌感染无明显作用。结合所有生化结果分析普雷沃菌感染的化脓性脊柱炎具有一般细菌感染的实验室检查表现,通过实验室生化结果对鉴别诊断相对困难。
张立华等[36]报道脊柱淋巴瘤和浆细胞瘤MRI表现可累及椎体、椎弓附件,浆细胞瘤和淋巴瘤在脊柱的信号异常形态呈弥漫性或局灶斑片、膨隆状改变,增强扫描见强化。李碧君等[37]报道其骨质破坏在CT上以虫噬样溶骨性改变为主,骨硬化或骨破坏与骨硬化同时存在,部分骨破坏不明显。据报道[38],此可能与淋巴瘤呈浸润性生长相关,易同时累及脊柱旁及硬膜外间隙呈梭形的软组织纵向生长,病情进展快,很快产生根痛或脊髓压迫症状。本例患者MRI可见椎体及附件呈弥漫性异常信号,椎管内占位性改变,增强扫描明显强化。CT见椎间隙塌陷、椎体后缘及椎弓根附件虫噬样溶骨改变,边界清楚。该病例与淋巴瘤影像学存在很大相同之处,本例行CT引导下穿刺活检,病理检查提示急慢性炎性改变,未见肿瘤细胞。布氏杆菌CT特征改变为相邻椎体局灶性边缘性骨质破坏,椎体破坏同时伴有明显的骨质增生硬化,呈“花边椎”,无脊柱畸形。周边有明显的增生硬化带,新生骨中又见新破坏灶[39]。患者布氏杆菌血清凝集试验阴性,明确无牛羊接触史。急性化脓性脊柱炎主要累及椎体;进展迅速,2~4周出现骨质破坏并有死骨,进而出现骨质硬化、显著骨质增生及骨桥形成;临床症状重,血白细胞计数显著升高[40]。本例患者为贵州省偏远村镇居民,贵州又是结核病的高发区。患者入院时存在低热、盗汗等结核中毒表现,多次血、痰、尿培养均阴性,结核T-spot阳性。住院后行影像学检查,结合患者病情最后误诊为结核病。本例患者通过影像学及实验室检查很难将其与肿瘤、布氏杆菌、结核病等相鉴别,导致患者延治。厌氧菌的病原学检查很难获得阳性结果,培养阳性结果相对时间较长,本例患者通过mNGS技术检出普雷沃菌属序列数10 490,其中中间普雷沃菌占80%。根据结果加抗厌氧菌治疗后好转。随着技术的发展,mNGS技术对病原菌的检测将更敏感、更快捷,在厌氧菌感染或者不常见的病原菌感染的精准化诊断方面具有优势。mNGS技术结合经验性用药有着非常重要的临床意义。
mNGS即是用二代测序技术,又称深度测序或者高通量测序对标本中存在的每一段基因序列进行测序。该方法可以同时检测样本中几乎所有的DNA或者RNA信息,不需要对引起感染的病原体类型有预先的猜测或假设,克服了聚合酶链式反应(PCR)、培养、免疫标志物等靶向诊断方法的局限性,因此能够发现新的和意想不到的病原体[41-43]。随着分子诊断技术的不断进步,mNGS因在感染领域呈现的突出作用而倍受关注。殷楚强等[44]报道了mNGS技术在脊柱感染病原微生物诊断中的应用,通过mNGS检测发现了脆弱拟杆菌、微小微单胞菌等少见病原微生物。mNGS在种水平与临床最终诊断的一致性为82.61%,在属水平的一致性为95.65%。微生物培养阳性率为42.86%,mNGS检测阳性率为94.29%。mNGS检测的灵敏度为91.43%,特异度为90.91%。郭超峰等[45]报道mNGS检测脊柱感染病原体的阳性率为86.59%,高于微生物培养(18.99%)和降钙素原检测(30.23%)。mNGS技术相比于微生物培养和降钙素原检测,mNGS检测脊柱感染病原体具有高效、准确、灵敏度更高等特点;与经验用药相比,根据mNGS检测结果针对性使用抗菌药物有更好疗效。本例患者根据mNGS检测结果调整使用抗菌药物后,患者获得良好治疗,最后治愈。针对普雷沃菌感染,临床很难与其他感染或者肿瘤鉴别,mNGS检测可为临床治疗提供帮助。
通过综述17例普雷沃菌脊柱炎的治疗,笔者发现最常用的抗厌氧菌药物是甲硝唑,头孢曲松,阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林/他唑巴坦,克林霉素或磷霉素,以上药物对普雷沃菌脊柱感染治疗有效。单药治疗5例,联合2种及以上药物治疗12例(头孢曲松钠+甲硝唑4例,氨苄西林/舒巴坦或阿莫西林/克拉维酸+甲硝唑3例,甲硝唑+克林霉素、莫西沙星+厄他培南、万古霉素+甲硝唑、氨苄西林/舒巴坦+克林霉素、磷霉素+头孢曲松+甲硝唑各1例)。Boyanova等[46]报道了普雷沃菌的药敏试验结果:青霉素、克林霉素和甲硝唑的总耐药率分别为43.2%、10.9%、0,对四环素的耐药率为29.1%。从2003—2004年到2007—2009年,青霉素耐药率增加了约4倍。对克林霉素的耐药率保持稳定,对四环素的不敏感率下降,甲硝唑对普雷沃菌活性达99%。希腊学者[47]报道甲硝唑和β-内酰胺酶抑制剂对绝大多数普雷沃菌敏感。多药耐药模式以氨苄西林、克林霉素和莫西沙星耐药为主 [47-48]。本文中17例患者的治疗方案与上述研究基本相符。通过文献分析对脊柱感染的治疗,建议联合用药,达到有效抗菌作用,减少因发生耐药导致脊柱炎症加重、致残等并发症。针对化脓性脊柱炎,单纯抗感染治疗有时难以达到治愈,当出现神经功能损伤,脊柱不稳,抗感染治疗效果不佳时可考虑行手术清除病灶,重建脊柱稳定性,保护神经功能也是可考虑的选择。本文分析的17例患者接受了抗厌氧菌治疗,其中14例联合手术治疗,1例死亡,因截瘫合并心脏病死亡,其余均取得了良好疗效。
综上所述,对常用抗厌氧药物如克林霉素和青霉素等耐药率增高;面对不明原因脊柱感染时,为避免盲目使用抗菌药物导致耐药性增加,笔者建议除传统检测方法外,尽早送检病灶组织进行mNGS检测,提高对病原体的判断,早期快速的诊断和针对性治疗对改善预后有重大意义。对β-内酰胺酶抑制剂、碳青霉烯类和甲硝唑治疗厌氧菌或普雷沃菌时需要定期监测耐药性趋势,最重要的是进行完整的菌种鉴定和药敏试验。通过基因分析确定耐药基因,后续可通过基因检测耐药性,快速指导临床用药。针对脊柱深部感染及时清创,重建脊柱稳定性也均为有效治疗措施。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Jung N, Seifert H, Siewe J, et al. Vertebral osteomyelitis[J]. Internist (Berl), 2013, 54(8): 945-953. DOI:10.1007/s00108-012-3142-2 |
| [2] |
Cheung WY, Luk KDK. Pyogenic spondylitis[J]. Int Orthop, 2012, 36(2): 397-404. DOI:10.1007/s00264-011-1384-6 |
| [3] |
McHenry MC, Easley KA, Locker GA. Vertebral osteomyelitis: long-term outcome for 253 patients from 7 Cleveland-area hospitals[J]. Clin Infect Dis, 2002, 34(10): 1342-1350. DOI:10.1086/340102 |
| [4] |
Sapico FL, Montgomerie JZ. Pyogenic vertebral osteomyelitis: report of nine cases and review of the literature[J]. Rev Infect Dis, 1979, 1(5): 754-776. DOI:10.1093/clinids/1.5.754 |
| [5] |
Perrotti PP, Corrales JL, Popescu BM. Pyogenic vertebral osteomyelitis[J]. Orthopedics, 1997, 8(5): 504. |
| [6] |
Lewis RP, Sutter VL, Finegold SM. Bone infections involving anaerobic bacteria[J]. Medicine (Baltimore), 1978, 57(4): 279-305. DOI:10.1097/00005792-197807000-00001 |
| [7] |
Surbled M, Perrier-Creach C, Rabouille Y, et al. Spondylodiscitis caused by Bacteroides melaninogenicus[J]. Presse Med, 1992, 21(39): 1870-1871. |
| [8] |
Salavert M, Navarro V, Roig P, et al. Vertebral osteomyelitis by Prevotella melaninogenica, Candida albicans and Mycobacterium tuberculosis in a intravenous drug addict[J]. Enferm Infecc Microbiol Clin, 1997, 15(2): 117-119. |
| [9] |
Mukhopadhyay S, Rose F, Frechette V. Vertebral osteomyelitis caused by Prevotella (Bacteroides) melaninogenicus[J]. South Med J, 2005, 98(2): 226-228. DOI:10.1097/01.SMJ.0000140855.39444.07 |
| [10] |
Fukuoka M, Aita K, Aoki Y, et al. Pyogenic vertebral osteomyelitis caused by Prevotella intermedia[J]. J Infect Chemother, 2002, 8(2): 182-184. DOI:10.1007/s101560200032 |
| [11] |
Schöber W, Horger M, Niehues D, et al. One case of Gram-negative anaerobic spondylodiscitis with Prevotella intermedia[J]. Arch Orthop Trauma Surg, 2003, 123(8): 436-438. DOI:10.1007/s00402-003-0567-z |
| [12] |
Frat JP, Godet C, Grollier G, et al. Cervical spinal epidural abscess and meningitis due to Prevotella oris and Peptostreptococcus micros after retropharyngeal surgery[J]. Intensive Care Med, 2004, 30(8): 1695. |
| [13] |
Salliot C, Lavie F, Azria A, et al. Retroperitoneal fibrosis secondary to spondylodiscitis after infection with Prevotella[J]. J Rheumatol, 2005, 32(5): 957-958. |
| [14] |
Purushothaman B, Lakshmanan P, Gatehouse S, et al. Spondylodiscitis due to Prevotella associated with ovarian mass-a rare case report and review of literature[J]. World Neurosurg, 2010, 73(2): 119-122. DOI:10.1016/j.surneu.2009.07.003 |
| [15] |
Huang CR, Lu CH, Chuang YC, et al. Clinical characteristics and therapeutic outcome of Gram-negative bacterial spinal epidural abscess in adults[J]. J Clin Neurosci, 2011, 18(2): 213-217. DOI:10.1016/j.jocn.2010.05.015 |
| [16] |
Goyal H, Arora S, Mishra S, et al. Vertebral osteomyelitis and epidural abscesses caused by Prevotella oralis: a case report[J]. Braz J Infect Dis, 2012, 16(6): 594-596. DOI:10.1016/j.bjid.2012.10.008 |
| [17] |
Karatay M, Koktekir E, Celik H, et al. Spinal intradural abscess caused by hematogenous spread of Prevotella oralis in a 3-year-old child with an asymptomatic congenital spinal abnormality[J]. Spinal Cord, 2015, 53(Suppl 1): S13-S15. |
| [18] |
Williams A, Kerkering T. Prevotella osteomyelitis after den-tal capping procedure[J]. IDCases, 2017, 8: 32-33. DOI:10.1016/j.idcr.2017.01.005 |
| [19] |
Opoku-Darko M, Jacobs WB. Spondylodiscitis caused by Prevotella intermedia: a case report and literature review[J]. Interdiscip Neurosur, 2017, 10: 57-61. DOI:10.1016/j.inat.2017.07.003 |
| [20] |
Stewart L, Sinha S, Madsen PJ, et al. Spinal epidural abscess caused by Gardnerella vaginalis and Prevotella amnii[J]. Infect Dis Clin Pract (Baltim Md), 2018, 26(4): 237-239. DOI:10.1097/IPC.0000000000000565 |
| [21] |
Kolakowska A, El Alaoui F, Ben Alba H, et al. Vaginal microbiota as an unusual cause of spondylodiscitis[J]. Arch Gynecol Obstet, 2022, 306(1): 109-114. DOI:10.1007/s00404-022-06432-4 |
| [22] |
de Moreuil C, Surgers L, Miquel A, et al. Prevotella is not so kind[J]. Joint Bone Spine, 2013, 80(3): 338. DOI:10.1016/j.jbspin.2012.09.021 |
| [23] |
Shah HN, Collins DM. Prevotella, a new genus to include Bacteroides melaninogenicus and related species formerly classified in the genus Bacteroides[J]. Int J Syst Bacteriol, 1990, 40(2): 205-208. DOI:10.1099/00207713-40-2-205 |
| [24] |
Brook I. Microbiology and management of joint and bone infections due to anaerobic bacteria[J]. J Orthop Sci, 2008, 13(2): 160-169. DOI:10.1007/s00776-007-1207-1 |
| [25] |
曹媛, 闫佳佳, 吴海燕, 等. 1例洛氏普雷沃菌的抗感染治疗病例分析[J]. 中国药学杂志, 2016, 51(3): 239-241. Cao Y, Yan JJ, Wu HY, et al. Analysis of anti-infection treatment for a case of Prevotella loescheii infection[J]. Chinese Pharmaceutical Journal, 2016, 51(3): 239-241. |
| [26] |
李青, 袁有华. 双路普雷沃菌致阴囊脓肿及血流感染2例[J]. 实验与检验医学, 2019, 37(5): 978-980. Li Q, Yuan YH. Double-way Prevo bacteria caused scrotal abscess and bloodstream infection: 2 cases[J]. Experimental and Laboratory Medicine, 2019, 37(5): 978-980. |
| [27] |
曾桂星, 蔡兴东, 刘升明. 宏基因二代测序鉴定普雷沃菌肺部感染一例[J]. 海南医学, 2021, 32(2): 267-268. Zeng GX, Cai XD, Liu SM. Identification of pulmonary infection by metallgene next-generation sequencing in Prevorella[J]. Hainan Medical Journal, 2021, 32(2): 267-268. |
| [28] |
Mehmood M, Jaffar NA, Nazim M, et al. Bacteremic skin and soft tissue infection caused by Prevotella loescheii[J]. BMC Infect Dis, 2014, 14: 162. DOI:10.1186/1471-2334-14-162 |
| [29] |
Mo SY, Wei LH, Chen HM, et al. A Chinese case of Prevotella intermedia and Streptococcus constellatus intracranial mixed infection[J]. Metab Brain Dis, 2018, 33(1): 161-166. DOI:10.1007/s11011-017-0142-x |
| [30] |
Bisbe J, Miro JM, Latorre X, et al. Disseminated candidiasis in addicts who use brown heroin: report of 83 cases and review[J]. Clin Infect Dis, 1992, 15(6): 910-923. DOI:10.1093/clind/15.6.910 |
| [31] |
Feigin RD, Pickering LK, Anderson D, et al. Clindamycin treatment of osteomyelitis and septic arthritis in children[J]. Pediatrics, 1975, 55(2): 213-223. DOI:10.1542/peds.55.2.213 |
| [32] |
Brook I, Frazier EH. Anaerobic osteomyelitis and arthritis in a military hospital: a 10-year experience[J]. Am J Med, 1993, 94(1): 21-28. DOI:10.1016/0002-9343(93)90115-6 |
| [33] |
Khanna K, Sabharwal S. Spinal tuberculosis: a comprehensive review for the modern spine surgeon[J]. Spine J, 2019, 19(11): 1858-1870. DOI:10.1016/j.spinee.2019.05.002 |
| [34] |
Waheed G, Soliman MAR, Ali AM, et al. Spontaneous spondylodiscitis: review, incidence, management, and clinical outcome in 44 patients[J]. Neurosurg Focus, 2019, 46(1): E10. DOI:10.3171/2018.10.FOCUS18463 |
| [35] |
罗伟刚, 尹园园, 任慧玲. 原发性脊柱感染的分析和治疗[J]. 临床荟萃, 2022, 37(6): 525-529. Luo WG, Yin YY, Ren HL. Analysis and treatment of primary spinal infection[J]. Clinical Focus, 2022, 37(6): 525-529. |
| [36] |
张立华, 杨琼, 袁惠书, 等. 脊柱淋巴瘤和浆细胞瘤的影像表现对比分析[J]. 临床放射学杂志, 2019, 38(4): 689-694. Zhang LH, Yang Q, Yuan HS, et al. Comparative appea-rances of lymphoma and plasmocytoma in spine[J]. Journal of Clinical Radiology, 2019, 38(4): 689-694. |
| [37] |
李碧君, 张浩, 曹丹, 等. 原发性脊柱淋巴瘤CT和MRI特征[J]. 临床放射学杂志, 2020, 39(4): 751-756. Li BJ, Zhang H, Cao D, et al. CT and MRI features of primary spinal lymphoma[J]. Journal of Clinical Radiology, 2020, 39(4): 751-756. |
| [38] |
Mascalchi M, Torselli P, Falaschi F, et al. MRI of spinal epidural lymphoma[J]. Neuroradiology, 1995, 37(4): 303-307. DOI:10.1007/BF00588341 |
| [39] |
张鹏, 杨军妍, 丁世斌, 等. 布氏杆菌性脊柱炎的MRI、CT表现[J]. 中国临床医学影像杂志, 2016, 27(4): 278-281. Zhang P, Yang JY, Ding SB, et al. MRI and CT findings of brucellar spondylitis[J]. Journal of China Clinic Medical Imaging, 2016, 27(4): 278-281. |
| [40] |
张霞, 王军峰, 张德增, 等. 脊柱化脓性感染的影像学诊断与鉴别诊断[J]. 医学影像学杂志, 2020, 30(8): 1539-1542. Zhang X, Wang JF, Zhang DZ, et al. Imaging diagnosis and differential diagnosis of pyogenic infection of spine[J]. Journal of Medical Imaging, 2020, 30(8): 1539-1542. |
| [41] |
Forbes JD, Knox NC, Peterson CL, et al. Highlighting clinical metagenomics for enhanced diagnostic decision-making: a step towards wider implementation[J]. Comput Struct Biotechnol J, 2018, 16: 108-120. |
| [42] |
Naccache SN, Federman S, Veeraraghavan N, et al. A cloud-compatible bioinformatics pipeline for ultrarapid pathogen identification from next-generation sequencing of clinical samples[J]. Genome Res, 2014, 24(7): 1180-1192. |
| [43] |
Chiu CY, Miller SA. Clinical metagenomics[J]. Nat Rev Ge-net, 2019, 20(6): 341-355. |
| [44] |
殷楚强, 王海龙, 任宪锋, 等. 宏基因组二代测序技术在脊柱感染病原微生物诊断中的应用[J]. 中国脊柱脊髓杂志, 2022, 32(2): 141-148. Yin CQ, Wang HL, Ren XF, et al. Pathogenic detection by metagenomic next-generation sequencing in spinal infections[J]. Chinese Journal of Spine and Spinal Cord, 2022, 32(2): 141-148. |
| [45] |
郭超峰, 张广, 胡小江, 等. 宏基因二代测序技术对脊柱感染的诊断效率及预后的影响[J]. 中南大学学报(医学版), 2022, 47(7): 865-871. Guo CF, Zhang G, Hu XJ, et al. Diagnostic efficiency of meta- genomic next-generation sequencing on spinal infection and prognosis[J]. Journal of Central South University(Medical Science), 2022, 47(7): 865-871. |
| [46] |
Boyanova L, Kolarov R, Gergova G, et al. Trends in antibio-tic resistance in Prevotella species from patients of the University Hospital of Maxillofacial Surgery, Sofia, Bulgaria, in 2003-2009[J]. Anaerobe, 2010, 16(5): 489-492. |
| [47] |
Maraki S, Mavromanolaki VE, Stafylaki D, et al. Surveillance of antimicrobial resistance in recent clinical isolates of Gram-negative anaerobic bacteria in a Greek University Hospital[J]. Anaerobe, 2020, 62: 102173. |
| [48] |
Jamal W, Al Hashem G, Rotimi VO. Antimicrobial resistance among anaerobes isolated from clinical specimens in Kuwait hospitals: comparative analysis of 11-year data[J]. Anaerobe, 2015, 31: 25-30. |



