2. 陆军军医大学陆军特色医学中心疾病预防控制科, 重庆 400042;
3. 重庆大学附属涪陵医院感染管理科, 重庆 408099;
4. 重庆医科大学附属永川医院感染管理科, 重庆 402160;
5. 重庆市秀山县人民医院感染管理科, 重庆 409999;
6. 重庆市开州区人民医院感染管理科, 重庆 405400;
7. 重庆市南川区人民医院院感科, 重庆 408400;
8. 成都市蒲江县人民医院感染管理科, 四川 成都 611630;
9. 重庆大学附属三峡医院感染管理科, 重庆 404000;
10. 重庆市璧山区人民医院感染管理科, 重庆 402760;
11. 重庆市綦江区人民医院感染管理科, 重庆 401420;
12. 重庆市长寿区人民医院感染管理科, 重庆 401220;
13. 重庆大学附属江津医院感染管理科, 重庆 402260
2. Department of Disease Prevention and Control, Army Medical Center, Army Medical University, Chongqing 400042, China;
3. Department of Infection Management, Chongqing University Fuling Hospital, Chongqing 408099, China;
4. Department of Infection Management, The Affiliated Yongchuan Hospital of Chongqing Medical University, Chongqing 402160, China;
5. Department of Infection Management, People's Hospital of Xiushan County, Chongqing 409999, China;
6. Department of Infection Management, The People's Hospital of Kaizhou District, Chongqing 405400, China;
7. Department of Infection, The People's Hosptital of Nanchuan, Chongqing 408400, China;
8. Department of Infection Management, Pujiang People's Hospital, Chengdu 611630, China;
9. Department of Infection Management, Chongqing University Three Gorges Hospital, Chongqing 404000, China;
10. Department of Infection Management, The People's Hospital of Bishan, Chongqing 402760, China;
11. Department of Infection Management, The People's Hospital of Qijiang, Chongqing 401420, China;
12. Department of Infection Management, People's Hospital of Changshou Chongqing, Chongqing 401220, China;
13. Department of Infection Management, Chongqing University Jiangjin Hospital, Chongqing 402260, China
鲍曼不动杆菌(Acinetobacter baumannii, AB)与医院感染密切相关,可在医院墙面、地面、床单元、呼吸机等各种非生物体表面存活,生存时间可长达5个月[1-2],也可以暂时存在于医务人员手和患者皮肤上,作为重要的定植菌存在。AB在医院物体表面、医务人员手和患者皮肤生存期间可通过直接或间接接触的传播方式感染住院患者,是医院感染的重要病原菌之一,常引起肺部感染(尤其是呼吸机相关肺炎)、皮肤感染、脑膜炎、血流感染和泌尿道感染等,增加患者住院日数和经济负担[3-4]。AB对多种常见的抗菌药物耐药,多重耐药菌比例较高,几乎涵盖了所有细菌的耐药机制,耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistant Acinetobacter bauma-nnii, CRAB)是国内重点监测的5种耐药菌之一。AB感染患者病死率较高,常高于20%,甚至可达50%以上[5-7]。AB因高发现率、高传播性、高耐药性和高病死率的特点成为医疗机构感染防控和诊疗的难点,尤其是高病死率,体现了AB感染预后极差。医疗机构基于感染控制的需要,或为了降低患者病死率,需使用大量抗菌药物进行抗感染治疗,但这些患者大多伴随严重的基础疾病,难以区分是由基础疾病还是AB感染引起的死亡,故不能只使用一般的病死率来评估AB感染预后,应排除基础疾病等其他混杂因素的影响。归因危险度(AR)反映了单纯由研究因素引起的死亡风险,更适合评估AB感染预后。但AB感染患者病情复杂,混杂因素较多,对AB感染AR的研究面临很大困难,国内基本没有AB感染AR的研究,国外亦缺乏多中心大样本的研究[8]。从微生物学角度评估,AB侵袭力不高,是一种医学界公认的低毒力细菌[9],这与其表现的预后极差不相符。因此,本研究用AR评估AB的致病力和预后,采取多中心研究,并将感染菌株限制为无菌体液标本来源来探索AB感染的AR。
1 对象与方法 1.1 研究方法采取多中心回顾性队列研究,邀请市内35所二级甲等及以上医院参加项目培训,内容包括研究目的、方法、AB感染定义、非感染组患者的选择和随访等。参与医院必须符合以下条件:二级甲等及以上综合医院、设置重症监护病房(intensive care unit, ICU)且有10张以上床位、有同一质控体系下的微生物室及感染控制专职人员保障随访患者结局等。调取符合以上条件的医院微生物室2016—2022年血、胸腔积液、腹腔积液、脑脊液等无菌体液培养出AB的记录。
1.2 研究对象研究人群为ICU内的重症患者,暴露因素为AB感染。感染组为无菌体液(包括血、脑脊液、胸腔积液、腹腔积液、导管尖端和其他无菌体液)感染AB的重症患者。纳入标准:(1)由微生物室、ICU医生判断所有阳性标本临床意义,排除污染菌,确认患者为AB感染;(2)AB血流感染至少有1瓶血培养阳性,且有发热(>38℃)、寒战或低血压等全身感染表现;(3)AB导管相关血流感染,导管和外周血培养必须都是阳性,或者至少外周血培养阳性,且有发热(>38℃)、寒战或低血压等全身感染表现。排除标准:(1)仅导管血培养阳性,外周血培养为阴性则排除导管相关血流感染;(2)排除所有粒细胞缺乏的危重患者(中性粒细胞计数<500/mL)。非感染组为没有AB感染证据的重症患者。每例感染组患者配对同期、同一ICU内2个非AB感染患者,配对的非AB感染患者作为非感染组。非感染组患者是本研究的关键,感染组与非感染组除AB感染外的其他死亡危险因素应尽可能一致。纳入标准:(1)必须做过血培养且培养为阴性;(2)同一ICU内;(3)同期(不超过3个月);(4)急性生理与慢性健康评分Ⅱ(APACHE Ⅱ)评分接近(±5分);(5)入住ICU的主要诊断相似或相同。排除标准:(1)任何部位标本,包括非无菌部位标本培养出AB或其他病原体均排除;(2)排除所有粒细胞缺乏的危重患者(中性粒细胞计数<500/mL)。
1.3 结局随访患者入院开始即可能感染AB,故随访从感染组和非感染组患者入院开始计算,以患者出院或死亡为观察终点,但对明确放弃治疗的患者进行出院后1周内电话随访,记录生存时间。统计感染组和非感染组的住院病死率,感染控制专职人员随访患者住院期间的病死率。AB感染的AR由感染组病死率减去非感染组病死率确定。
1.4 设计患者信息调查表包括姓名、性别、年龄、联系方式、病历号等基本信息,住院时间、入住ICU时间、ICU主要诊断、合并症、APACHEⅡ评分,呼吸机(含机械通气时间)、中心静脉置管、手术、血液净化等各种侵入性操作和治疗手段等。
1.5 统计分析连续变量用均数±标准差(x ± s)表示,感染组和非感染组比较采用t检验或χ2检验,AR采用95%置信区间(CI)报告,CI=AR±
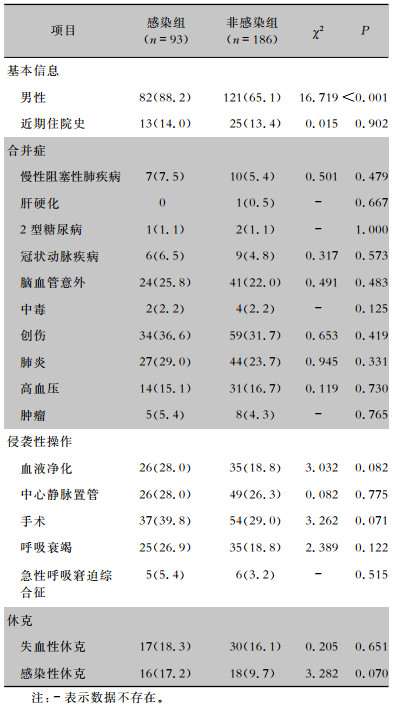
13所综合医院参与多中心研究,其中11所为三级甲等综合医院。研究期间共52 373例ICU患者,其中,1 360例患者各类标本培养出AB,仅289例患者无菌体液标本培养出AB。排除细菌污染、定植及匹配等原因,共确定93例无菌体液AB感染患者。经同一时期、同一ICU、主要诊断一致和APACHE Ⅱ评分1 ∶2配对,共确定186例未感染AB患者。56对患者(60.2%)的APACHE Ⅱ评分差值≤3分,没有一对患者的差值>5分。感染组患者从入院到首次培养AB阳性的中位日数为8(5~13)d。139例(74.7%)非感染组患者的住院时间>相匹配的感染患者从入院到首次培养AB阳性的时间。感染组、非感染组平均年龄分别为(57±17.6)、(61±18.2)岁,差异无统计学意义(P=0.136);感染组、非感染组APACHE Ⅱ评分分别为(22±6.9)、(22±8.1)分,差异无统计学意义(P=0.960)。除性别外,感染组与非感染组在患者基本特征、合并症、侵入性操作、呼吸衰竭、急性呼吸窘迫综合征和休克等方面差异均无统计学意义,见表 1。尽管AB对常见抗菌药物耐药率较高,88.2%(82/93)的患者在24 h内接受了敏感抗菌药物的治疗,73.1%(68/93)使用了两联或以上抗菌药物。
| 表 1 感染组和非感染组患者临床特征[例(%)] Table 1 Clinical characteristics of patients in AB infected and non-infected groups (No. of cases [%]) |
|
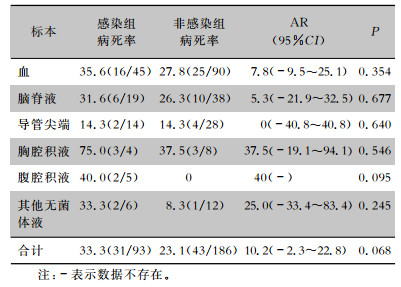
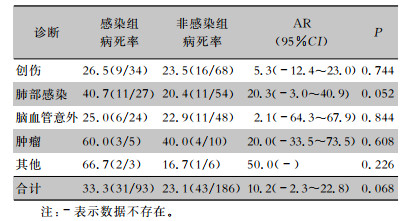
93例AB感染患者主要为血流感染(48.4%,45例),其次是脑脊液感染(20.4%,19例)和血管导管相关血流感染(15.1%,14例),其余患者主要从胸腔积液和腹腔积液中检出AB。从病死率看,血流感染AB患者的病死率最高(排除标本量较少的胸、腹腔积液和其他标本),其次是脑脊液感染。感染组和非感染组每类标本来源的病死率差异无统计学意义(均P>0.05),但AB引起的血流感染的AR高于脑脊液和导管相关血流感染。见表 2。93例AB感染患者主要为创伤患者(36.6%,34例),其余为肺部感染(29.0%,27例)、脑血管意外(25.8%,24例)和肿瘤等。病死率最高的是肺部感染患者(排除样本量较少的肿瘤和其他),其次为创伤和脑血管意外患者。诊断为肺部感染的ICU患者感染AB后AR最高,达20.3%,但不同诊断患者感染组和非感染组病死率比较,差异无统计学意义(均P>0.05)。见表 3。
| 表 2 不同类型标本来源AB感染的病死率与AR(%) Table 2 Mortality and attributable risk of AB infection from different types of specimens (%) |
|
| 表 3 不同诊断的患者AB感染的病死率与AR(%) Table 3 Mortality and attributable risk of AB infection in patients with different diagnoses (%) |
|
AB感染患者住院病死率为33.3%,非感染组患者的住院病死率为23.1%,AR为10.2%(95%CI:-2.3%~22.8%)。感染组和非感染组患者住院病死率差异无统计学意义(P=0.068)。采用kaplan-meier法分析AB感染生存曲线,感染组和非感染组生存曲线有交叉,Log-rank检验显示P=0.519,见图 1。
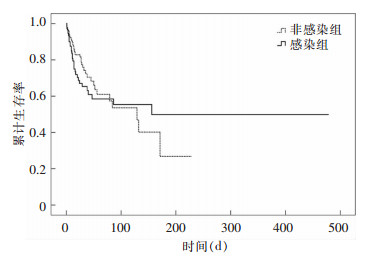 |
| 图 1 ICU患者生存曲线 Figure 1 Survival curve of ICU patients |
AB医院内传播能力强,不但能通过污染的环境和医务人员手传播,还可能通过空气传播[10-12]。AB在医院内各类环境中检出率高,是医院感染控制较困难的细菌之一。AB对常见抗菌药物耐药率高,对亚胺培南和美罗培南的耐药率>80%,且已有耐替加环素AB菌株的报道[13],因此,相应的抗感染治疗非常困难。本研究近90%的患者培养出AB后都使用了敏感抗菌药物治疗,且>70%的患者使用了两联药物,积极的抗感染治疗基本能排除抗菌药物治疗对AB感染患者病死率的影响[14-16]。
本研究将标本限制在血、脑脊液、胸腔积液和腹腔积液等无菌体液中,排除了呼吸道、泌尿道、皮肤等部位的标本。这些感染部位或暴露于外环境,或作为人体自然腔道与外界相通,从这些部位采集的标本易通过各种环节和途径污染。此外,AB是最容易定植的细菌之一,可在以上部位长期定植、生长和繁殖,但并不致病。定植与感染不易区分,即使在有AB易感因素的患者中,AB定植的比例也远高于感染,从这些部位检出的AB极有可能并不是引起感染的“责任”菌[17-18]。包括血在内的人体无菌体液正常情况下无菌,相对于呼吸道和泌尿道等标本容易排除污染,细菌也不太可能定植于这些部位。血、导管尖端、脑脊液、胸腔积液和腹腔积液等无菌体液标本一旦培养出AB,只要排除污染就可以准确断定AB感染。然而,我国医疗机构无菌体液标本占所有标本数量的比例较低,据2020年中国CHINET[19]显示,无菌体液标本比率仅为15%,且AB在这些标本中不易检出,这也是本研究使用多所医院无菌体液标本进行多中心研究的重要原因。
本研究中,AB感染组的病死率为33.3%,与李冲等[17]报道的病死率(36.8%)相近,低于其他研究[20-24]的数据(41.9%~60.9%),无菌体液感染的病死率鲜有报道无法比较。血流感染的病死率高于其他无菌体液感染,推测血流感染的细菌可通过血液循环引起全身系统和器官的炎症反应,继而造成多器官的实质性病变,而其他无菌体液在生理屏障阻隔下仍是局部感染,如脑脊液感染。主要诊断为肺部感染的重症患者感染AB后的病死率和AR都较其他诊断分组高,包括创伤患者。通常认为创伤患者正常皮肤黏膜屏障遭到破坏,更易感染AB,预后更差,然而Livermore等[25]对伦敦地区多重耐药AB感染患者临床结局回顾性调查中采用单变量和多变量分析,显示肺部感染或菌血症患者的预后较差,而创伤患者的预后明显好于一般患者。本研究中创伤患者的AR低于肺部感染患者,与上述研究一致,提示AB对肺部有疾患的患者更具攻击性,导致预后不良。本研究感染组和非感染组总体和各个标本来源的病死率差异均无统计学意义,总体AR为10.2%(95%CI:-2.3%~22.8%),该结果在Falagas等[26]研究的AB感染AR范围(7.8%~23%)内。值得注意的是,6项将感染组定义为AB感染的研究中,仅1项感染组和非感染组的病死率差异有统计学意义;而将感染组定义为获得性AB(患者标本培养出AB,不区分定植与感染)的研究中,感染组和非感染组的病死率差异均有统计学意义[25],可见区分AB感染和定植对AR的研究非常必要。本研究与Sunenshine等[27]的研究结论一致,显示感染组和非感染组病死率差异无统计学意义,但与同期发表的4篇文献[28-31]结论不同,其原因除了没有区分细菌定植和感染,还有感染组患者的标本来源不同的影响。有些研究虽以AB感染为感染组,但没有限制标本来源。对非血液或非无菌体液的标本(如最常分离出AB的痰标本),有的通过定量检测鉴别定植和感染,有的使用C反应蛋白、降钙素原等指标判断,但这些方法的有效性仍存在争议[32]。此外,非感染组的匹配条件也是影响结论的重要原因。Blot等[33]和Grupper等[28]的研究均以AB血流感染作为感染组,前者AR为7.8%,且感染组和非感染组病死率差异没有统计学意义,后者由于没有对病情严重程度进行匹配,AR高达36.5%。因此,将APACHE Ⅱ评分作为匹配条件,可以对ICU患者病情严重程度进行科学评估,判断其预后,这是排除患者由于本身疾病引起死亡的重要匹配条件。本研究发现,重症患者感染AB后并未增加病死率,与先前AB感染和高病死率相关性的研究[34-35]结论相悖,但在心脏手术患者中开展的队列研究[36]显示,AB感染并不影响患者病死率。AB作为条件致病菌,不产生明胶酶,蹭行能力较弱,生物被膜形成能力不强,一直被认为是低毒力细菌[37],然而,其病死率却高于微生物上被认定为强致病力的细菌,这显然是矛盾的。但就细菌感染的AR而言,爱尔兰一项研究[38]显示,粪肠球菌、大肠埃希菌的AR分别为18.1%、13.6%,高于本研究的AB感染的AR,更符合AB作为低毒力细菌的特性。
综上所述,本研究采取标本限制的方法反映真正的AB感染,用AR评估AB感染的严重性,认为AB感染预后被严重高估。AB感染伴随的高病死率主要由于医院环境广泛存在AB,重症患者进行有创或无创的侵袭性操作(使用呼吸机、留置导尿管、中心静脉置管等)较多,特别容易感染AB,而其病死率又较高,因此,与其说AB感染导致了患者的高病死率,不如说是患者病情严重或濒死状态诱发了AB的高感染率。患者无菌标本检出AB提示存在医院内传播和感染,也是患者病情严重和高病死率的标志物,但不能说明AB感染是重症患者死亡的主要原因。通过匹配消除因患者本身病情严重而导致的死亡风险后,AB感染并不明显增加患者死亡率。本研究结论有助于提醒医疗机构和临床医生正确对待AB感染的预后,科学评估AB的致病力,对AB感染的个体应积极进行治疗,无需过分强调细菌学上的清除,应更加关注患者的基础疾病和控制AB医院感染。通过物理隔离设置行为隔离屏障,实施主动监测、手卫生、环境的清洁和消毒等感染控制措施,阻止AB在医院内,特别是在ICU内的传播,避免误判AB感染的严重性,是当前医疗机构的重要任务。本研究仍存在一定缺陷:虽然进行了多中心研究,但样本量仍有待提高,可通过与死因管理登记部门和医院合作开展更广泛的AR调查,以获得更确切的AR。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Giannouli M, Antunes LCS, Marchetti V, et al. Virulence-related traits of epidemic Acinetobacter baumannii strains belonging to the international clonal lineages Ⅰ-Ⅲ and to the emerging genotypes ST25 and ST78[J]. BMC Infect Dis, 2013, 13: 282. DOI:10.1186/1471-2334-13-282 |
| [2] |
Kramer A, Schwebke I, Kampf G. How long do nosocomial pathogens persist on inanimate surfaces? A systematic review[J]. BMC Infect Dis, 2006, 6: 130. DOI:10.1186/1471-2334-6-130 |
| [3] |
Dijkshoorn L, Nemec A, Seifert H. An increasing threat in hospitals: multidrug-resistant Acinetobacter baumannii[J]. Nat Rev Microbiol, 2007, 5(12): 939-951. DOI:10.1038/nrmicro1789 |
| [4] |
Munoz-Price LS, Weinstein RA. Acinetobacter infection[J]. N Engl J Med, 2008, 358(12): 1271-1281. DOI:10.1056/NEJMra070741 |
| [5] |
Maragakis LL, Perl TM. Acinetobacter baumannii: epidemiology, antimicrobial resistance, and treatment options[J]. Clin Infect Dis, 2008, 46(8): 1254-1263. DOI:10.1086/529198 |
| [6] |
Kanafani ZA, Zahreddine N, Tayyar R, et al. Multi-drug resistant Acinetobacter species: a seven-year experience from a tertiary care center in Lebanon[J]. Antimicrob Resist Infect Control, 2018, 7: 9. DOI:10.1186/s13756-017-0297-6 |
| [7] |
Liu CP, Shih SC, Wang NY, et al. Risk factors of mortality in patients with carbapenem-resistant Acinetobacter baumannii bacteremia[J]. J Microbiol Immunol Infect, 2016, 49(6): 934-940. DOI:10.1016/j.jmii.2014.10.006 |
| [8] |
陈佰义, 何礼贤, 胡必杰, 等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中国医药科学, 2012, 2(8): 3-8. Chen BY, He LX, Hu BJ, et al. Expert consensus on the dia-gnosis, treatment and control of Acinetobacter baumannii infection in China[J]. China Medicine and Pharmacy, 2012, 2(8): 3-8. |
| [9] |
Moisoiu A, Ionitã M, Sarbu L, et al. Antibiotic resistance of Acinetobacter baumannii strains isolated from clinical specimens in the "Marius Nasta" Pneumology Institute, Bucharest[J]. Pneumologia, 2014, 63(2): 109-111. |
| [10] |
Yakupogullari Y, Otlu B, Ersoy Y, et al. Is airborne transmission of Acinetobacter baumannii possible: a prospective molecular epidemiologic study in a tertiary care hospital[J]. Am J Infect Control, 2016, 44(12): 1595-1599. DOI:10.1016/j.ajic.2016.05.022 |
| [11] |
Munoz-Price LS, Fajardo-Aquino Y, Arheart KL, et al. Aerosolization of Acinetobacter baumannii in a trauma ICU[J]. Crit Care Med, 2013, 41(8): 1915-1918. DOI:10.1097/CCM.0b013e31828a39c0 |
| [12] |
Shimose LA, Doi Y, Bonomo RA, et al. Contamination of ambient air with Acinetobacter baumannii on consecutive inpatient Days[J]. J Clin Microbiol, 2015, 53(7): 2346-2348. DOI:10.1128/JCM.00198-15 |
| [13] |
Sun JR, Perng CL, Lin JC, et al. AdeRS combination codes differentiate the response to efflux pump inhibitors in tigecycline-resistant isolates of extensively drug-resistant Acinetobacter baumannii[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(12): 2141-2147. DOI:10.1007/s10096-014-2179-7 |
| [14] |
Jamulitrat S, Arunpan P, Phainuphong P. Attributable mortality of imipenem-resistant nosocomial Acinetobacter bauma-nnii bloodstream infection[J]. J Med Assoc Thai, 2009, 92(3): 413-419. |
| [15] |
Park SY, Lee EJ, Kim T, et al. Early administration of appropriate antimicrobial agents to improve the outcome of carbapenem-resistant Acinetobacter baumannii complex bacteraemic pneumonia[J]. Int J Antimicrob Agents, 2018, 51(3): 407-412. DOI:10.1016/j.ijantimicag.2017.10.018 |
| [16] |
Yang SS, Sun JD, Wu XN, et al. Determinants of mortality in patients with nosocomial Acinetobacter baumannii bacteremia in Southwest China: a five-year case-control study[J]. Can J Infect Dis Med Microbiol, 2018, 2018: 3150965. |
| [17] |
李冲, 赵云, 王昊, 等. ICU鲍曼不动杆菌血流感染临床特征及预后危险因素分析[J]. 医学信息, 2020, 33(13): 54-56, 68. Li C, Zhao Y, Wang H, et al. Clinical characteristics and prognostic risk factors of bloodstream infection of Acinetobac-ter baumannii in ICU[J]. Medical Information, 2020, 33(13): 54-56, 68. |
| [18] |
Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: emergence of a successful pathogen[J]. Clin Microbiol Rev, 2008, 21(3): 538-582. DOI:10.1128/CMR.00058-07 |
| [19] |
胡付品, 郭燕, 朱德妹, 等. 2020年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2021, 21(4): 377-387. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of bacterial resistance: results of 2020[J]. Chinese Journal of Infection and Chemotherapy, 2021, 21(4): 377-387. |
| [20] |
Dijkshoorn L, Nemec A, Seifert H. An increasing threat in hospitals: multidrug-resistant Acinetobacter baumannii[J]. Nat Rev Microbiol, 2007, 5(12): 939-951. DOI:10.1038/nrmicro1789 |
| [21] |
王南菲. 鲍曼不动杆菌血流感染患者死亡危险因素及流行特征分析[D]. 杭州: 浙江大学, 2017. Wang NF. Analysis of risk factors of mortality and epidemic characteristics of Acinetobacter baumannii bloodstream infections[D]. Hangzhou: Zhejiang University, 2017. |
| [22] |
梁亮, 刘晓春, 陈杏春, 等. 鲍曼不动杆菌血流感染预后危险因素分析[J]. 华西医学, 2021, 36(1): 76-81. Liang L, Liu XC, Chen XC, et al. Prognostic risk factors associated with bloodstream infections caused by Acinetobacter baumannii[J]. West China Medical Journal, 2021, 36(1): 76-81. |
| [23] |
张银维, 周华, 蔡洪流, 等. 鲍曼不动杆菌血流感染临床特征和死亡危险因素分析[J]. 中华内科杂志, 2016, 55(2): 121-126. Zhang YW, Zhou H, Cai HL, et al. Analysis of clinical manifestations and risk factors of mortality in Acinetobacter baumannii bloodstream infection[J]. Chinese Journal of Internal Medicine, 2016, 55(2): 121-126. |
| [24] |
张银维. 鲍曼不动杆菌血流感染临床特征和死亡危险因素研究[D]. 杭州: 浙江大学, 2016. Zhang YW. Analysis of clinical manifestations and risk factors of mortality of Acinetobacter baumannii bloodstream infection[D]. Hangzhou: Zhejiang University, 2016. |
| [25] |
Livermore DM, Hill RL, Thomson H, et al. Antimicrobial treatment and clinical outcome for infections with carbapenem- and multiply-resistant Acinetobacter baumannii around London[J]. Int J Antimicrob Agents, 2010, 35(1): 19-24. DOI:10.1016/j.ijantimicag.2009.09.014 |
| [26] |
Falagas ME, Bliziotis IA, Siempos II. Attributable mortality of Acinetobacter baumannii infections in critically ill patients: a systematic review of matched cohort and case-control studies[J]. Crit Care, 2006, 10(2): R48. DOI:10.1186/cc4869 |
| [27] |
Sunenshine RH, Wright MO, Maragakis LL, et al. Multidrug-resistant Acinetobacter infection mortality rate and length of hospitalization[J]. Emerg Infect Dis, 2007, 13(1): 97-103. DOI:10.3201/eid1301.060716 |
| [28] |
Grupper M, Sprecher H, Mashiach T, et al. Attributable mortality of nosocomial Acinetobacter bacteremia[J]. Infect Control Hosp Epidemiol, 2007, 28(3): 293-298. DOI:10.1086/512629 |
| [29] |
Playford EG, Craig JC, Iredell JR. Carbapenem-resistant Acinetobacter baumannii in intensive care unit patients: risk factors for acquisition, infection and their consequences[J]. J Hosp Infect, 2007, 65(3): 204-211. DOI:10.1016/j.jhin.2006.11.010 |
| [30] |
Kwon KT, Oh WS, Song JH, et al. Impact of imipenem resistance on mortality in patients with Acinetobacter bacteraemia[J]. J Antimicrob Chemother, 2007, 59(3): 525-530. DOI:10.1093/jac/dkl499 |
| [31] |
Robenshtok E, Paul M, Leibovici L, et al. The significance of Acinetobacter baumannii bacteraemia compared with Klebsiella pneumoniae bacteraemia: risk factors and outcomes[J]. J Hosp Infect, 2006, 64(3): 282-287. |
| [32] |
王朔, 曹兴建, 曹照明, 等. 下呼吸道多药耐药鲍曼不动杆菌定植与感染诊断方法评价[J]. 检验医学与临床, 2014, 11(4): 504-506. Wang S, Cao XJ, Cao ZM, et al. Evaluation of colonization and infection diagnosis methods of multidrug resistant Acinetobacter baumannii in lower respiratory tract[J]. Laboratory Medicine and Clinic, 2014, 11(4): 504-506. |
| [33] |
Blot S, Vandewoude K, Colardyn F. Nosocomial bacteremia involving Acinetobacter baumannii in critically ill patients: a matched cohort study[J]. Intensive Care Med, 2003, 29(3): 471-475. |
| [34] |
Tan YF, Zhou K, Tang X, et al. Bacteremic and non-bacteremic pneumonia caused by Acinetobacter baumannii in ICUs of South China: a Clinical and Microbiological Study[J]. Sci Rep, 2017, 7(1): 15279. |
| [35] |
Martín-Aspas A, Guerrero-Sánchez FM, García-Colchero F, et al. Differential characteristics of Acinetobacter baumannii colonization and infection: risk factors, clinical picture, and mortality[J]. Infect Drug Resist, 2018, 11: 861-872. |
| [36] |
Pierri MD, Crescenzi G, Capestro F, et al. Risk factors and impact on clinical outcome of multidrug-resistant Acinetobacter baumannii acquisition in cardiac surgery patients[J]. J Cardiothorac Vasc Anesth, 2016, 30(3): 680-686. |
| [37] |
刘彩霞. 医院感染鲍曼不动杆菌耐药机制与毒力因子的研究[D]. 温州: 温州医学院, 2009. Liu CX. Study on drug resistance mechanism and virulence factors of Acinetobacter baumannii in hospital infection[D]. Wenzhou: Wenzhou Medical College, 2009. |
| [38] |
Brady M, Oza A, Cunney R, et al. Attributable mortality of hospital-acquired bloodstream infections in Ireland[J]. J Hosp Infect, 2017, 96(1): 35-41. |



