2. 青岛中西医结合医院护理部, 山东 青岛 266000;
3. 青岛大学附属青岛市海慈医院(青岛市中医医院)肺病科, 山东 青岛 266000;
4. 青岛阜外心血管病医院急诊科, 山东 青岛 266000
2. Nursing Department, Qingdao Integrated Traditional Chinese and Western Medicine Hospital, Qingdao 266000, China;
3. Department of Pulmonary Diseases, Qingdao Hiser Hospital Affiliated to Qingdao University [Qingdao Traditional Chinese Medicine Hospital], Qingdao 266000, China;
4. Department of Emergency, Qingdao Fuwai Cardiovascular Disease Hospital, Qingdao 266000, China
新型冠状病毒(简称新冠病毒)感染(COVID -19)是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)经呼吸道侵入人体后引起的一系列症状,急性期主要表现为发热和呼吸道感染症状,重症患者甚至可出现呼吸衰竭和多脏器损伤。尽管大部分COVID -19患者可在两周内自愈,但有部分患者的乏力、头痛、心悸、气短以及睡眠障碍等症状可迁延数月不愈[1]。“长新冠”(Long COVID)一词源自2020年5月一位新冠病毒感染患者用来描述SARS-CoV-2急性感染期后仍存在各种不适的情况[2]。随后这一名词开始在国外广泛应用。2020年9月,国际疾病分类(International Classification of Diseases-10, ICD-10)以“新冠病毒感染后状态(Post-COVID -19 condition)的疾病名称将这一病症纳入诊疗目录。2020年10月英国国家健康与护理卓越研究所(National Institute for Health and Care Excellence, NICE)根据新冠病毒感染急性期后的不适症状持续时程,分为“迁延症状新冠病毒感染(ongoing symptomatic COVID -19)”(急性期过后3~12周仍有症状)和“新冠病毒感染后综合征(Post COVID -19 syndrome)”(急性期过后12周仍有症状)[3]。2021年10月世界卫生组织(World Health Organization, WHO)发布专家共识,对新冠病毒感染后状态的症状特点和诊断标准进行了描述。共识主要包括三项内容:首先,不适症状在感染SARS-CoV-2三个月内发生的;其次,症状一般持续两个月以上;再次,症状不能用其他诊断解释[4]。虽然WHO已将“新冠病毒感染后状态”用来描述新冠病毒感染急性期后各种不适的正式名称,但在相关资料中,“长新冠”“新冠病毒感染后状态”和“新冠病毒感染后综合征”的概念仍都在使用,且既往文献中“长新冠”最为多见,而近期则以“新冠病毒感染后综合征”最为常用。
1 新冠病毒感染后综合征的流行病学研究随着SARS-CoV-2不断出现新的变异株,全球范围内的感染病例仍在持续增加,因此新冠病毒感染后综合征的发病率难以准确估算。据部分统计,2020年和2021年全球已有1.44亿人(包括无症状感染者、轻症居家观察者和重症住院治疗者)受到新冠病毒感染后综合征的困扰[5]。一项来自美国的研究[6]调查273 618例新冠病毒感染患者,结果显示发生不同程度新冠病毒感染后综合征的比率为42.34%。德国的类似研究[7]则认为新冠病毒感染后综合征的发生率为50%~70%。我国人口基数庞大,在2023年初国家疫情防控政策调整后,短时期内出现了全国范围内的大规模感染。目前,国内新冠病毒感染的急性期救治工作已基本结束,是否会出现大量的新冠病毒感染后综合征患者需要引起国内医疗保健机构的关注。
2 新冠病毒感染后综合征的病理生理机制新冠病毒感染后综合征的病理生理机制目前尚不清楚,一般认为是低载荷病毒的持续存在、病毒蛋白所致的异常免疫反应、继发自身免疫性疾病,以及微血栓形成等因素引起的多系统损伤,导致这一病症的发生和发展。
2.1 神经系统SARS-CoV-2感染导致中枢神经系统损伤和周围神经系统损伤均可遗留长期后遗症[8-9]。病毒可通过局部蔓延和血源性播散两种途径侵犯神经系统,继而激活小胶质细胞和自身免疫反应,最终导致中枢神经及周围神经的炎性病变[10-11]。
复旦大学附属华山医院Lu等[12]研究发现COVID -19患者的双侧嗅觉皮层、海马、岛回和侧扣带回的灰质体积较正常人明显增大。另一项华中科技大学附属同济医院Qin等[13]研究显示,COVID -19患者额叶和边缘系统皮层变薄、白质微结构改变以及脑血流量下降,这些改变与嗅觉、记忆、情感有密切的联系。新冠病毒感染后综合征主要表现为疲劳和认知功能障碍(脑雾),患者呈低脑代谢状态[14],患者肌肉中线粒体的功能存在一定程度的障碍[15]。Lee等[16]对COVID -19死亡患者的尸体进行解剖,研究结果进一步证实了脑神经炎性病变的存在,三叉神经和脊神经根的炎性病变被认为与头痛和躯体疼痛有关[17], 味觉和嗅觉的丧失则与病毒侵犯味蕾和嗅神经中的神经上皮细胞引发的炎症反应有关[18],自主神经受累则可引起心血管系统功能紊乱。
2.2 心血管系统目前大部分研究者认为SARS-CoV-2主要通过以下几个途径对心脏造成损伤:(1)结合血管紧张素转换酶2受体(angiotensin-converting enzyme 2 receptor, ACE2)后直接侵犯心肌细胞和破坏肾素-血管紧张素-醛固酮(renin-angiotensin-aldosterone, RAS)系统,导致心肌受损[19];(2)引起心肌内血管内皮炎症和微血栓形成,造成心肌细胞缺血、缺氧,继发受损[20-22];(3)诱发自身抗原抗体反应,释放毒性细胞因子损伤心肌细胞[23];(4)低氧血症和应激性心肌损伤[24]。
慢性心肌炎和长期心肌缺血缺氧均可造成心肌细胞的坏死和纤维变性,继发引起心脏重构,使心肌的心电传导功能和兴奋收缩功能遭到不同程度的破坏。自主神经功能障碍及自身免疫反应产生的抗儿茶酚胺受体抗体和抗血管紧张素2受体抗体可引起体位性低血压(orthostatic hypotension, OH)或体位性心动过速综合征(postural orthostatic tachycardia syndrome, POTS)[25-26]。
2.3 呼吸系统SARS-CoV-2感染后出现肺纤维化是呼吸系统慢性并发症(呼吸困难)的主要病理基础[27-28]。Tanni等[29]研究发现,重症肺炎患者长期氧疗形成的肺内高氧化应激状态对于炎性反应的慢性化和肺组织的纤维化起到了一定的促进作用。Dhawan等[30]分析SARS-CoV-2造成的微血管损伤对继发性肺循环高压和肺纤维化的潜在作用。另有多个COVID -19死亡患者的尸解结果表明,此类患者的肺内同时存在着纤维增殖性损伤、血管内皮损伤和血管再生性改变几种情况[31-33]。另有部分SARS-CoV-2感染后没有发生肺部病变的患者也存在呼吸困难的情况,分析其原因,与病毒造成的自主神经功能障碍引起的肺通气调节功能紊乱有关,肺通气功能的自主神经传导通路是从大脑皮层到脑干,再到周围神经,直至胸内压力反射感受器,该通路病变可导致肺通气功能紊乱并产生呼吸困难[34]。
Taverne等[35]发现,功能性呼吸功能障碍/过度通气综合征(hyperventilation syndrome, HVS)在COVID -19患者中的发生率很高,是呼吸困难的重要原因之一。HVS的发生机制目前尚不清楚,考虑与焦虑、抑郁等精神创伤有一定的关系[36]。据此,有人提出COVID -19对个体健康和社会经济的巨大冲击给部分患者带来精神和心理压力成为感染后HVS的发生基础。
2.4 免疫系统越来越多的证据表明,免疫系统功能紊乱对新冠病毒感染后综合征的发生起到重要作用。研究[37-38]发现COVID -19造成的免疫力低下所继发的持续性真菌感染可引发各种慢性不适;新冠病毒感染后综合征可能与肥大细胞活化综合征相关[39-40];持续免疫系统紊乱伴随的长期轻度炎症和自身免疫反应可导致多器官功能障碍[41-42]。
Gaebler团队[43]的研究成果发现,在部分无症状感染患者的下消化道中新冠病毒仍存在数月,提示各脏器组织中残存的病毒蛋白或许是免疫反应持续活化的基础;而多器官持续免疫应答性炎症造成的多器官功能损伤已被多个研究证实[44-45]。
2.5 其他系统肾小球足突状细胞、近端肾小管、胰腺β细胞、甲状腺细胞、垂体和下丘脑因共同表达ACE2受体, 可被SARS-CoV-2入侵而遭到直接损伤,导致肾功能损伤和内分泌紊乱[46-47];血管内皮损伤所继发的微血栓形成和早期炎症反应引起的细胞因子风暴也会导致这些脏器的间接损伤[48]。另外,SARS-CoV-2传播速度快,患者大批量出现而临床缺乏治疗经验,由于经验不足带来的对疗效的不确定,以及疫情防控政策中的隔离所造成的孤独和被遗弃感,均会引发部分易感患者的精神和心理问题,继而导致各种精神症状和躯体器官功能性障碍的发生。
3 新冠病毒感染后综合征的症状特点及与其他病毒感染后综合征的比较 3.1 症状新冠病毒感染后综合征的症状复杂多样,呼吸系统主要表现为慢性咳嗽、呼吸困难,心血管系统主要表现为心悸、胸痛、体位性低血压和血栓形成,神经系统主要表现为头痛、焦虑、抑郁、慢性疲劳、睡眠障碍、认知障碍、味觉和嗅觉丧失,内分泌系统则主要表现为糖尿病、甲状腺炎、月经紊乱,肾脏受损严重者可出现肾衰竭等[49-51](见图 1)。
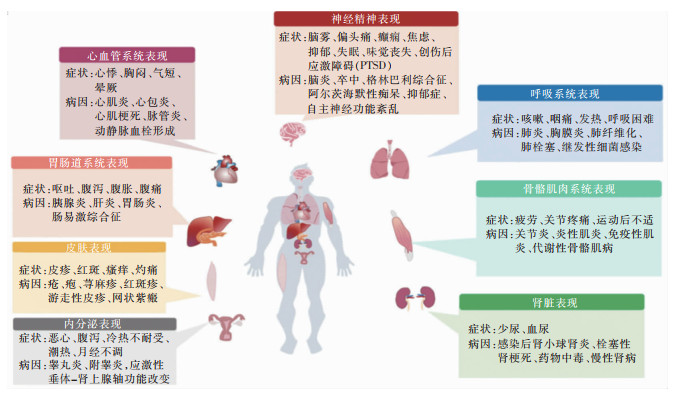 |
| 图 1 新冠病毒感染后综合征的常见受累脏器及相应症状[50] |
Taquet等[6]研究273 618份COVID -19患者的电子健康记录后发现,在SARS-CoV-2感染3~6个月之后最常出现的症状是焦虑/抑郁、呼吸困难、胃肠不适、疲劳、胸痛、头痛、肌痛、关节疼痛及认知障碍(脑雾)这9种症状,且无论是在症状的发生频率还是发生数量上都要远高于普通流感病毒感染。Taquet等[8]进一步分析这9种症状在不同患者群体中的发生率,发现女性患者发生头痛、肌痛、胃肠不适的比例更高,而男性患者更易发生呼吸困难和认知功能障碍;需要住院治疗和老年患者较不需要住院治疗和年轻患者更容易发生疲劳、呼吸困难和认知功能障碍,发生头痛和肌痛的情况则相对较少;已注射疫苗患者较未注射疫苗患者除了出现疲劳和肌痛的情况较少外,其他症状的发生率均无明显差异。
3.3 肌痛性脑脊髓炎/慢性疲劳综合征(myalgic encephalomyelitis/chronic fatigue syndrome, ME/CFS)Poenaru等[52]研究发现,新冠病毒感染后综合征在发生时程、受累人群和主要症状等方面与ME/CFS有很多相似之处;二者都发生于有前驱病毒感染史的健康人群,症状主要表现为疲劳、认知功能障碍(脑雾)和运动后不适[53]。Tran等[54]调查发现,相当一部分COVID -19患者的不适症状可持续1年以上,这种类ME/CFS症状严重影响患者的生活质量。
ME/CFS至今没有明确的诊断标准,临床对ME/CFS的诊断基本采用排除法,治疗方面亦缺乏有效措施,而新冠病毒感染后综合征的诊疗目前也面临类似情况。深入对比和研究二者之间的异同,或许有助于探索新冠病毒感染后综合征和ME/CFS的发病机制和制定诊治措施。
4 新冠病毒感染后综合征的诊疗新冠病毒感染后综合征的诊断主要依靠病史和临床症状,在出现上述症状并排除其他疾病的基础上即可诊断。新冠病毒感染后综合征尚无标准治疗方案,鉴于免疫系统紊乱在疾病发生过程中发挥了重要作用,免疫调节治疗成为临床应用较多的治疗方式。为减轻过度免疫反应对脏器的损伤,急性期一般首选用类固醇抗炎药,慢性期可酌情选用其他类型免疫抑制剂[55-56]。对于一些症状严重的患者可考虑应用血浆置换和静脉注射免疫球蛋白[57]。抗凝药物可抑制微血栓形成,对一些继发于血栓性缺血的并发症有一定的帮助。
运动疗法,尤其是分级有氧运动和适度力量训练对减轻疼痛,增加体力,提高心肺功能和改善生活质量有显著作用[58]。运动疗法对自主神经紊乱的治疗机制目前虽不明确,但已有多个研究证实适当运动可以有效促进自主神经系统恢复其正常功能[59]。对新冠病毒感染后综合征的治疗,运动疗法或许是一个不错的选择;但对于主要表现为类ME/CFS症状和持续性疲劳的患者,运动疗法则有加重症状的可能。
整合医疗路径(integrated care pathways, ICP)治疗由Campbell等[60]于1998年提出,其核心内容是通过多学科持续合作的方法为一些慢性病症提供长期高质量医疗服务。相较于传统的临床路径,ICP涵盖的学科范围更加广泛,因而对一些症状复杂的综合征疗效更好;其缺点是对参与治疗的学科间的配合度要求较高,否则会造成医疗资源的大量浪费。英国国家健康研究所(National Institute for Health Research, NIHR)资助的“Long-COVID”ICP项目,将向临床医务人员、疾病研究人员和诊疗指南决策者们传授相关知识,以便更好地对新冠病毒感染后综合征进行诊治。ICP未来有望成为治疗新冠病毒感染后综合征的主要方式。
5 展望自2019年12月暴发以来,新冠病毒感染引起的疾病已席卷全球,受累人数仍在不断增加。对新冠病毒感染急性期的处置目前已形成了一套相对成熟的规范化诊疗措施,而其恢复期出现的新冠病毒感染后综合征的病理生理机制仍不明确,诊疗策略处于探索阶段。我国因独特的疫情防控政策使人民群众大规模感染SARS-CoV-2的时间晚于其他国家,因此,对新冠病毒感染后综合征的认识也相对落后。
鉴于我国实行的积极有效的疫情防控政策,以及中医药疗法在急性期治疗中的大量运用,我国医务工作者对新冠病毒感染后综合征的探索应着重于以下几点:(1)我国民众大规模感染时的新冠病毒为奥密克戎毒株,其致死率和重症率较其他国家流行的原始毒株和德尔塔毒株明显下降。(2)我国民众大规模感染时的疫苗接种率远高于国外同期水平且所接种的疫苗种类不同。(3)我国民众大规模感染时的急性期治疗过程中我国特有的中医药疗法运用较多。受以上三种因素影响,我国新冠病毒感染后综合征的流行病学特点和症状特点与国外研究可能有一些差异。(4)中医药疗法对新冠病毒感染急性期的治疗效果已得到临床证实,对感染后综合征的治疗是否也会有突出效果有待进一步研究证实。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Higgins V, Sohaei D, Diamandis EP, et al. COVID -19: from an acute to chronic disease? Potential long-term health consequences[J]. Crit Rev Clin Lab Sci, 2021, 58(5): 297-310. DOI:10.1080/10408363.2020.1860895 |
| [2] |
Lechner-Scott J, Levy M, Hawkes C, et al. Long COVID or post COVID -19 syndrome[J]. Mult Scler Relat Disord, 2021, 55: 103268. DOI:10.1016/j.msard.2021.103268 |
| [3] |
Venkatesan P. NICE guideline on long COVID[J]. Lancet Respir Med, 2021, 9(2): 129. DOI:10.1016/S2213-2600(21)00031-X |
| [4] |
Soriano JB, Murthy S, Marshall JC, et al. A clinical case definition of post-COVID -19 condition by a Delphi consensus[J]. Lancet Infect Dis, 2022, 22(4): e102-e107. DOI:10.1016/S1473-3099(21)00703-9 |
| [5] |
Global Burden of Disease Long COVID Collaborators, Wulf Hanson S, Abbafati C, et al. Estimated global proportions of individuals with persistent fatigue, cognitive, and respiratory symptom clusters following symptomatic COVID -19 in 2020 and 2021[J]. JAMA, 2022, 328(16): 1604-1615. DOI:10.1001/jama.2022.18931 |
| [6] |
Taquet M, Dercon Q, Luciano S, et al. Incidence, co-occurrence, and evolution of long-COVID features: a 6-month re-trospective cohort study of 273, 618 survivors of COVID -19[J]. PLoS Med, 2021, 18(9): e1003773. DOI:10.1371/journal.pmed.1003773 |
| [7] |
Chan AT, Drew DA, Nguyen LH, et al. The coronavirus pandemic epidemiology (COPE) consortium: a call to action[J]. Cancer Epidemiol Biomarkers Prev, 2020, 29(7): 1283-1289. DOI:10.1158/1055-9965.EPI-20-0606 |
| [8] |
Taquet M, Dercon Q, Harrison PJ. Six-month sequelae of post-vaccination SARS-CoV-2 infection: a retrospective cohort study of 10, 024 breakthrough infections[J]. Brain Behav Immun, 2022, 103: 154-162. DOI:10.1016/j.bbi.2022.04.013 |
| [9] |
Ren AL, Digby RJ, Needham EJ. Neurological update: COVID -19[J]. J Neurol, 2021, 268(11): 4379-4387. DOI:10.1007/s00415-021-10581-y |
| [10] |
Baig AM. Deleterious outcomes in long-hauler COVID -19: the effects of SARS-CoV-2 on the CNS in chronic COVID syndrome[J]. ACS Chem Neurosci, 2020, 11(24): 4017-4020. DOI:10.1021/acschemneuro.0c00725 |
| [11] |
Gasmi A, Tippairote T, Mujawdiya PK, et al. Neurological involvements of SARS-CoV2 infection[J]. Mol Neurobiol, 2021, 58(3): 944-949. DOI:10.1007/s12035-020-02070-6 |
| [12] |
Lu YP, Li XX, Geng DY, et al. Cerebral micro-structural changes in COVID -19 patients-an MRI-based 3-month follow-up study[J]. EClinicalMedicine, 2020, 25: 100484. DOI:10.1016/j.eclinm.2020.100484 |
| [13] |
Qin YY, Wu JF, Chen T, et al. Long-term microstructure and cerebral blood flow changes in patients recovered from COVID -19 without neurological manifestations[J]. J Clin Invest, 2021, 131(8): e147329. DOI:10.1172/JCI147329 |
| [14] |
Guedj E, Campion JY, Dudouet P, et al. 18F-FDG brain PET hypometabolism in patients with long COVID[J]. Eur J Nucl Med Mol Imaging, 2021, 48(9): 2823-2833. DOI:10.1007/s00259-021-05215-4 |
| [15] |
Wood E, Hall KH, Tate W. Role of mitochondria, oxidative stress and the response to antioxidants in myalgic encephalomyelitis/chronic fatigue syndrome: a possible approach to SARS-CoV-2' long-haulers'?[J]. Chronic Dis Transl Med, 2021, 7(1): 14-26. |
| [16] |
Lee MH, Perl DP, Nair G, et al. Microvascular injury in the brains of patients with COVID -19[J]. N Engl J Med, 2021, 384(5): 481-483. DOI:10.1056/NEJMc2033369 |
| [17] |
Attal N, Martinez V, Bouhassira D. Potential for increased prevalence of neuropathic pain after the COVID -19 pandemic[J]. Pain Rep, 2021, 6(1): e884. DOI:10.1097/PR9.0000000000000884 |
| [18] |
de Melo GD, Lazarini F, Levallois S, et al. COVID -19-related anosmia is associated with viral persistence and inflammation in human olfactory epithelium and brain infection in hamsters[J]. Sci Transl Med, 2021, 13(596): eabf8396. DOI:10.1126/scitranslmed.abf8396 |
| [19] |
Doyle ME, Appleton A, Liu QR, et al. Human type Ⅱ taste cells express angiotensin-converting enzyme 2 and are infected by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2)[J]. Am J Pathol, 2021, 191(9): 1511-1519. DOI:10.1016/j.ajpath.2021.05.010 |
| [20] |
Østergaard L. SARS CoV-2 related microvascular damage and symptoms during and after COVID -19: consequences of capillary transit-time changes, tissue hypoxia and inflammation[J]. Physiol Rep, 2021, 9(3): e14726. |
| [21] |
Evans PC, Rainger GE, Mason JC, et al. Endothelial dysfunction in COVID -19: a position paper of the ESC working group for atherosclerosis and vascular biology, and the ESC council of basic cardiovascular science[J]. Cardiovasc Res, 2020, 116(14): 2177-2184. DOI:10.1093/cvr/cvaa230 |
| [22] |
Roberts KA, Colley L, Agbaedeng TA, et al. Vascular manifestations of COVID -19-thromboembolism and microvascular dysfunction[J]. Front Cardiovasc Med, 2020, 7: 598400. DOI:10.3389/fcvm.2020.598400 |
| [23] |
Wallukat G, Hohberger B, Wenzel K, et al. Functional autoantibodies against G-protein coupled receptors in patients with persistent long-COVID -19 symptoms[J]. J Transl Autoimmun, 2021, 4: 100100. DOI:10.1016/j.jtauto.2021.100100 |
| [24] |
Rali AS, Ranka S, Shah Z, et al. Mechanisms of myocardial injury in coronavirus disease 2019[J]. Card Fail Rev, 2020, 6: e15. DOI:10.15420/cfr.2020.10 |
| [25] |
Blitshteyn S, Whitelaw S. Postural orthostatic tachycardia syndrome (POTS) and other autonomic disorders after COVID -19 infection: a case series of 20 patients[J]. Immunol Res, 2021, 69(2): 205-211. DOI:10.1007/s12026-021-09185-5 |
| [26] |
Goldstein DS. The possible association between COVID -19 and postural tachycardia syndrome[J]. Heart Rhythm, 2021, 18(4): 508-509. DOI:10.1016/j.hrthm.2020.12.007 |
| [27] |
Ojo AS, Balogun SA, Williams OT, et al. Pulmonary fibrosis in COVID -19 survivors: predictive factors and risk reduction strategies[J]. Pulm Med, 2020, 2020: 6175964. |
| [28] |
P KM, Sivashanmugam K, Kandasamy M, et al. Repurposing of histone deacetylase inhibitors: a promising strategy to combat pulmonary fibrosis promoted by TGF-β signalling in COVID -19 survivors[J]. Life Sci, 2021, 266: 118883. DOI:10.1016/j.lfs.2020.118883 |
| [29] |
Tanni SE, Fabro AT, de Albuquerque A, et al. Pulmonary fibrosis secondary to COVID -19: a narrative review[J]. Expert Rev Respir Med, 2021, 15(6): 791-803. DOI:10.1080/17476348.2021.1916472 |
| [30] |
Dhawan RT, Gopalan D, Howard L, et al. Beyond the clot: perfusion imaging of the pulmonary vasculature after COVID -19[J]. Lancet Respir Med, 2021, 9(1): 107-116. DOI:10.1016/S2213-2600(20)30407-0 |
| [31] |
Carsana L, Sonzogni A, Nasr A, et al. Pulmonary post-mortem findings in a series of COVID -19 cases from northern Italy: a two-centre descriptive study[J]. Lancet Infect Dis, 2020, 20(10): 1135-1140. DOI:10.1016/S1473-3099(20)30434-5 |
| [32] |
De Michele S, Sun Y, Yilmaz MM, et al. Forty postmortem examinations in COVID -19 patients[J]. Am J Clin Pathol, 2020, 154(6): 748-760. DOI:10.1093/ajcp/aqaa156 |
| [33] |
Schaller T, Hirschbühl K, Burkhardt K, et al. Postmortem examination of patients with COVID -19[J]. JAMA, 2020, 323(24): 2518-2520. DOI:10.1001/jama.2020.8907 |
| [34] |
Dani M, Dirksen A, Taraborrelli P, et al. Autonomic dysfunction in 'long COVID': rationale, physiology and management strategies[J]. Clin Med (Lond), 2021, 21(1): e63-e67. |
| [35] |
Taverne J, Salvator H, Leboulch C, et al. High incidence of hyperventilation syndrome after COVID -19[J]. J Thorac Dis, 2021, 13(6): 3918-3922. DOI:10.21037/jtd-20-2753 |
| [36] |
Howell JB. The hyperventilation syndrome: a syndrome under threat?[J]. Thorax, 1997, 52(Suppl 3): S30-S34. |
| [37] |
Schultheiβ C, Willscher E, Paschold L, et al. The IL-1β, IL-6, and TNF cytokine triad is associated with post-acute sequelae of COVID -19[J]. Cell Rep Med, 2022, 3(6): 100663. DOI:10.1016/j.xcrm.2022.100663 |
| [38] |
Jacobs JJL. Persistent SARS-2 infections contribute to long COVID -19[J]. Med Hypotheses, 2021, 149: 110538. DOI:10.1016/j.mehy.2021.110538 |
| [39] |
Afrin LB, Weinstock LB, Molderings GJ. COVID -19 hyperinflammation and post-COVID -19 illness may be rooted in mast cell activation syndrome[J]. Int J Infect Dis, 2020, 100: 327-332. DOI:10.1016/j.ijid.2020.09.016 |
| [40] |
Kazama I. Stabilizing mast cells by commonly used drugs: a novel therapeutic target to relieve post-COVID syndrome?[J]. Drug Discov Ther, 2020, 14(5): 259-261. DOI:10.5582/ddt.2020.03095 |
| [41] |
Yong SJ. Long COVID or post-COVID -19 syndrome: putative pathophysiology, risk factors, and treatments[J]. Infect Dis (Lond), 2021, 53(10): 737-754. DOI:10.1080/23744235.2021.1924397 |
| [42] |
Galeotti C, Bayry J. Autoimmune and inflammatory diseases following COVID -19[J]. Nat Rev Rheumatol, 2020, 16(8): 413-414. DOI:10.1038/s41584-020-0448-7 |
| [43] |
Gaebler C, Wang ZJ, Lorenzi JCC, et al. Evolution of antibody immunity to SARS-CoV-2[J]. Nature, 2021, 591(7851): 639-644. DOI:10.1038/s41586-021-03207-w |
| [44] |
Dennis A, Wamil M, Alberts J, et al. Multiorgan impairment in low-risk individuals with post-COVID -19 syndrome: a prospective, community-based study[J]. BMJ Open, 2021, 11(3): e048391. DOI:10.1136/bmjopen-2020-048391 |
| [45] |
Bai Y, Xu JL, Chen LJ, et al. Inflammatory response in lungs and extrapulmonary sites detected by [18F] fluorodeoxyglucose PET/CT in convalescing COVID -19 patients tested negative for coronavirus[J]. Eur J Nucl Med Mol Imaging, 2021, 48(8): 2531-2542. DOI:10.1007/s00259-020-05083-4 |
| [46] |
Raman B, Cassar MP, Tunnicliffe EM, et al. Medium-term effects of SARS-CoV-2 infection on multiple vital organs, exer- cise capacity, cognition, quality of life and mental health, post-hospital discharge[J]. EClinicalMedicine, 2021, 31: 100683. DOI:10.1016/j.eclinm.2020.100683 |
| [47] |
Le Stang MB, Desenclos J, Flamant M, et al. The good treatment, the bad virus, and the ugly inflammation: pathophysio-logy of kidney involvement during COVID -19[J]. Front Phy-siol, 2021, 12: 613019. DOI:10.3389/fphys.2021.613019 |
| [48] |
Gentile S, Strollo F, Mambro A, et al. COVID -19, ketoacidosis and new-onset diabetes: are there possible cause and effect relationships among them?[J]. Diabetes Obes Metab, 2020, 22(12): 2507-2508. DOI:10.1111/dom.14170 |
| [49] |
Silva Andrade B, Siqueira S, de Assis Soares WR, et al. Long-COVID and post-COVID health complications: an up-to-date review on clinical conditions and their possible molecular mechanisms[J]. Viruses, 2021, 13(4): 700. DOI:10.3390/v13040700 |
| [50] |
Raman B, Bluemke DA, Lüscher TF, et al. Long COVID: post-acute sequelae of COVID -19 with a cardiovascular focus[J]. Eur Heart J, 2022, 43(11): 1157-1172. DOI:10.1093/eurheartj/ehac031 |
| [51] |
顾宫, 康昊男, 车超群, 等. 武汉雷神山医院部分病区320例COVID -19患者康复期随访研究[J]. 中国感染控制杂志, 2022, 21(8): 729-741. Gu G, Kang HN, Che CQ, et al. A follow-up study of 320 patients with COVID -19 during rehabilitation period after discharge from Wuhan Lei Shen Shan Hospital[J]. Chinese Journal of Infection Control, 2022, 21(8): 729-741. |
| [52] |
Poenaru S, Abdallah SJ, Corrales-Medina V, et al. COVID -19 and post-infectious myalgic encephalomyelitis/chronic fatigue syndrome: a narrative review[J]. Ther Adv Infect Dis, 2021, 8: 20499361211009385. |
| [53] |
Singh I, Joseph P, Heerdt PM, et al. Persistent exertional intolerance after COVID -19: insights from invasive cardiopulmonary exercise testing[J]. Chest, 2022, 161(1): 54-63. DOI:10.1016/j.chest.2021.08.010 |
| [54] |
Tran VT, Porcher R, Pane I, et al. Course of post COVID -19 disease symptoms over time in the ComPaRe long COVID prospective e-cohort[J]. Nat Commun, 2022, 13(1): 1812. DOI:10.1038/s41467-022-29513-z |
| [55] |
Thakur M, Datusalia AK, Kumar A. Use of steroids in COVID -19 patients: a Meta-analysis[J]. Eur J Pharmacol, 2022, 914: 174579. DOI:10.1016/j.ejphar.2021.174579 |
| [56] |
Kim JS, Lee JY, Yang JW, et al. Immunopathogenesis and treatment of cytokine storm in COVID -19[J]. Theranostics, 2021, 11(1): 316-329. DOI:10.7150/thno.49713 |
| [57] |
Pourahmad R, Moazzami B, Rezaei N. Efficacy of plasmaphe-resis and immunoglobulin replacement therapy (IVIG) on patients with COVID -19[J]. SN Compr Clin Med, 2020, 2(9): 1407-1411. DOI:10.1007/s42399-020-00438-2 |
| [58] |
Andrade A, Dominski FH. Infographic. Effects of exercise in patients with fibromyalgia: an umbrella review[J]. Br J Sports Med, 2021, 55(5): 279-280. DOI:10.1136/bjsports-2020-102330 |
| [59] |
Goldsmith RL, Bloomfield DM, Rosenwinkel ET. Exercise and autonomic function[J]. Coron Artery Dis, 2000, 11(2): 129-135. DOI:10.1097/00019501-200003000-00007 |
| [60] |
Campbell H, Hotchkiss R, Bradshaw N, et al. Integrated care pathways[J]. BMJ, 1998, 316(7125): 133-137. DOI:10.1136/bmj.316.7125.133 |



