2. 河北省人民医院泌尿外科, 河北 石家庄 050000
2. Department of Urology, Hebei People's Hospital, Shijiazhuang 050000, China
假体隆乳术经历了四十多年的发展,现已成为美容外科比较常见的手术方式[1]。隆乳术作为重塑女性形体的重要手段,不仅提高女性社会心理的幸福指数,也提升对身材形象的满意度,还可降低女性饮食失调和抑郁症的发生率[2]。随着手术量的不断增加,术后假体周围发生感染的情况也逐渐变多,感染通常以双峰方式出现,分别在亚急性期及晚期发作[3]。隆乳术后假体周围发生感染可能会导致包膜挛缩、手术失败,甚至有患者发生感染性休克,通常会进行第二次手术来将假体取出,除对生活和健康的影响外,还增加了医疗花费,给患者带来极大的心理压力及经济负担[4-5]。因此,探寻隆乳术后假体周围发生感染的危险因素尤为重要。Toll样受体2(toll-like receptor 2, TLR-2)可促进炎性反应,诱导获得性免疫,TLR-2信号通路激活引起的炎性反应直接参与感染性疾病[6-7]。白介素-6(interleukin-6, IL-6)作为调节炎性反应的重要细胞因子,在炎性启动介质作用下,由单核巨噬细胞释放,参与急性期炎性反应[8-9]。但目前关于血清IL-6、TLR-2水平对隆乳术后假体周围感染影响的相关研究较少。因此,本研究基于血清IL-6、TLR-2水平和临床病理参数构建预测隆乳术后假体周围感染列线图模型,分析术后假体周围发生感染的危险因素,以期为临床治疗提供相应参考。
1 对象与方法 1.1 研究对象选取某院2019年2月—2022年2月行隆乳术的446例患者为研究对象。纳入标准:(1)研究对象为女性;(2)经检查,符合手术指征;(3)无乳房整形美容手术史。排除标准:(1)瘢痕体质者;(2)恶性肿瘤疾病和放射治疗、化学治疗者;(3)临床资料不全或配合度较低者。本研究所有患者本人或家属均知情同意并签署知情同意书。
1.2 研究方法 1.2.1 资料收集收集患者一般资料及临床病历资料,包括患者年龄、身体质量指数(body mass index, BMI)、婚姻情况、孕次、产次、吸烟史、饮酒史、糖尿病史、乳腺炎病史、免疫抑制史、乳腺手术史、术前有无合并活动性皮炎、手术时间、手术入路、假体形状、是否联合乳房悬吊、假体类型、术后应用抗菌药物时间、术后是否接受潜在感染手术及术后是否发生乳房碰撞等。患者术后第3天清晨空腹(禁食8~12 h)采血5 mL,离心(3 000 r/min, 15 min)分离血清,检测总胆固醇(total cholesterol, TC)、三酰甘油(triacylglycerol, TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、空腹血糖(fasting plasma glucose/fasting blood glucose, FPG)、C反应蛋白(C reactive protein, CRP)、白细胞计数(white blood cell count, WBC)及血小板计数(Platelet count, PLT)并记录用于本次研究。
1.2.2 手术方法患者均采用全身麻醉,取仰卧位,上臂90°外展,常规消毒铺巾后,使手术区充分显露,建立手术切口,依次切开患者皮肤及皮下组织,分离至胸大肌下间隙或乳腺后间隙,沿手术切口置入假体并调整,然后以同样的方法将另一侧乳房假体置入,满意后根据手术实际情况判断引流管是否留置,逐层缝合,常规加压包扎,术后预防性应用抗菌药物,其中284例≤2 d、162例>2 d。
1.2.3 患者血清IL-6、TLR-2水平测定患者于术后第3天空腹状态下,抽取5 mL肘静脉血,离心分离后,取血清待测;采用FACSVerse流式细胞仪检测单核细胞表面TLR-2,Synergy H1MFDG多功能酶标仪以酶联免疫吸附法测定血清IL-6水平,酶标仪波长设定为450 nm,严格按照试剂盒使用说明及仪器操作说明进行指标测定。
1.2.4 随访及感染诊断术后每月随访1次记录患者假体周围感染情况,随访12个月以上,随访截止时间为2023年2月。根据美国疾病控制与预防中心(CDC)的标准诊断隆乳术后假体周围感染,包括术后出现手术切口脓性渗出,手术切口处的无菌液体或组织培养物中分离出微生物。此外,至少出现以下其中1种情况,乳房局部或弥漫性肿胀、疼痛、压痛或红斑,或由主治医师诊断为假体周围感染。术后6周内发生感染为急性,术后6周至6个月发生感染为亚急性,术后6个月以后发生感染为迟发性。
1.3 统计学分析应用SPSS 22.0软件进行统计学分析。计量资料采用均数±标准差表示,组间比较采用t检验,计数资料采用例数(百分比)表示,组间比较采用χ2检验,将具有统计学意义的因素纳入多因素logistic分析,有统计学意义(P<0.05)的变量为独立危险因素,并引入赤池信息准则(Akaike information criterion, AIC)筛选构建列线图模型的危险因素。将筛选出的危险因素引入R3.6.3软件及rms程序包,构建隆乳术后假体周围感染风险列线图模型。采用Bootstrap法重复抽样1 000次内部验证该模型,列线图模型的校准度以校准曲线中的平均绝对误差(mean absolute error, MAE)进行评估,列线图模型的区分度以受试者工作特征(ROC)曲线下面积(AUC)进行判断。
2 结果 2.1 两组一般资料比较共纳入2019年2月—2022年2月行隆乳术患者446例,年龄21~35岁,平均年龄(28.50±3.39)岁。其中感染组42例,占9.42%;未感染组404例,占90.58%。两组患者一般资料比较,年龄、BMI、婚姻状态、孕次、产次及饮酒史比较,差异均无统计学意义(均P>0.05),感染组有吸烟史的患者比例高于未感染组,差异有统计学意义(P<0.001)。见表 1。
| 表 1 感染组与未感染组一般资料比较 Table 1 Comparison of general data between infected group and non-infected group |
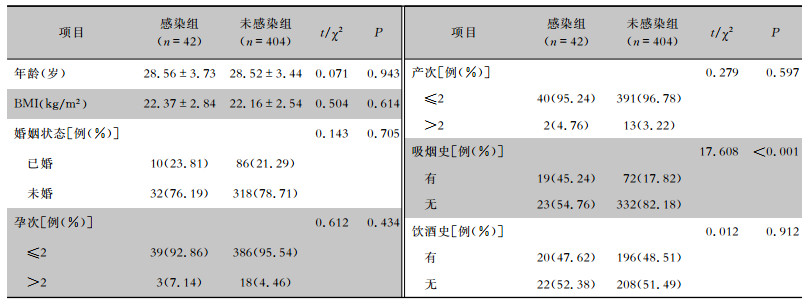
|
比较两组临床资料可知,感染组患者中有合并糖尿病、免疫抑制史及乳腺炎病史的人数占比高于未感染组;感染组术后接受潜在感染手术和发生乳房碰撞的人数占比高于未感染组;感染组患者CRP、WBC、IL-6及TLR-2水平高于未感染组;差异均有统计学意义(均P<0.05)。见表 2。
| 表 2 两组患者术后血清IL-6、TLR-2水平及临床资料比较 Table 2 Comparison of post-operative serum levels of IL-6, TLR-2 as well as clinical data between the two groups of patients |
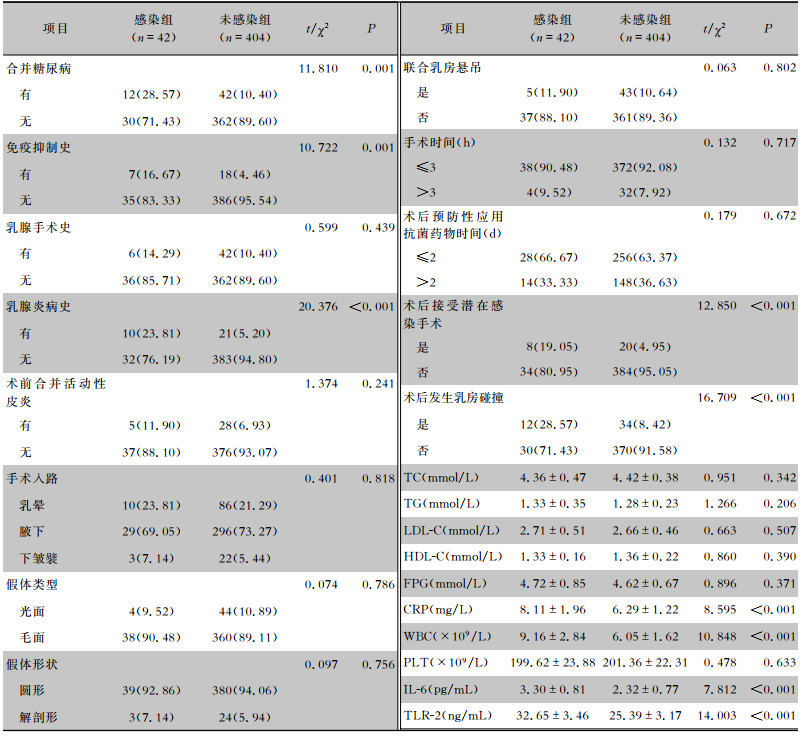
|
将隆乳术后假体周围是否发生感染作为因变量,将单因素分析结果筛选出的指标:吸烟史(无=0,有=1)、合并糖尿病(无=0,有=1)、乳腺炎病史(无=0,有=1)、免疫抑制史(无=0,有=1)、术后接受潜在感染手术(否=0,是=1)、术后发生乳房碰撞(否=0,是=1)、CRP、WBC、IL-6、TLR-2作为自变量。多因素logistic回归分析结果显示,合并糖尿病、乳腺炎病史、CRP、WBC、IL-6及TLR-2水平是患者隆乳术后假体周围发生感染的独立危险因素(均P<0.05)。见表 3。
| 表 3 隆乳术后假体周围感染的多因素logistic回归分析 Table 3 Multivariate logistic regression analysis on peri-prosthetic infection after mammoplasty |
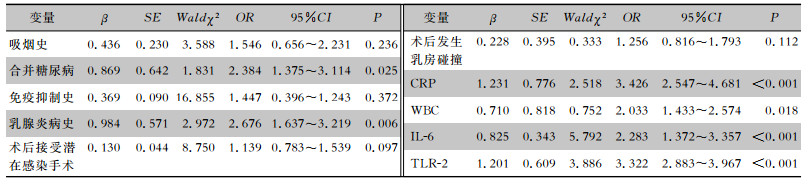
|
为了进一步对隆乳术后假体周围感染的危险因素进行筛选,将6个危险因素纳入逐步AIC回归分析,根据AIC对影响因素进行排序,比较AIC最小值,发现影响隆乳术后假体周围感染前4位的因素为CRP、WBC、IL-6及TLR-2水平,见图 1A。根据CRP、WBC、IL-6及TLR-2水平建立的列线图模型具有最大的一致性指数(concordance index, C指数),其C指数为0.758,见图 1B。表明CRP、WBC、IL-6及TLR-2水平4个危险因素组成的列线图模型对隆乳术后假体周围感染风险评估具有较好的表现。
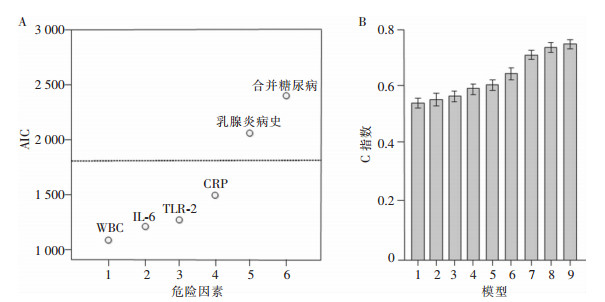 |
| 注:A.临床危险因素AIC分布;B.不同危险因素构建模型的C指数,其中横坐标1表示合并糖尿病,2表示合并乳腺炎病史,3表示CRP,4表示TLR-2,5表示IL-6,6表示WBC,7表示WBC/IL-6,8表示WBC/IL-6/TLR-2,9表示WBC/IL-6/TLR-2/CRP。 图 1 构建列线图模型的危险因素筛选 Figure 1 Risk factor screening for constructing a nomogram model |
将筛选出的4个独立危险因素作为预测因子构建列线图模型,根据列线图读出赋分结果,预测隆乳术后假体周围感染风险率,以李某为例,有合并糖尿病赋分46.21分,有乳腺炎病史赋分50.52分,CRP为8.51 mg/L赋分42.34分,WBC为8.89×109/L赋分46.55分,血清IL-6水平为2.93 pg/mL赋分30.98分,血清TLR-2水平为32.30 ng/mL赋分35.84分,所得总分155.71分对应的概率即为列线图模型预测隆乳术后假体周围感染患者预后不良的概率82.37%。见图 2。
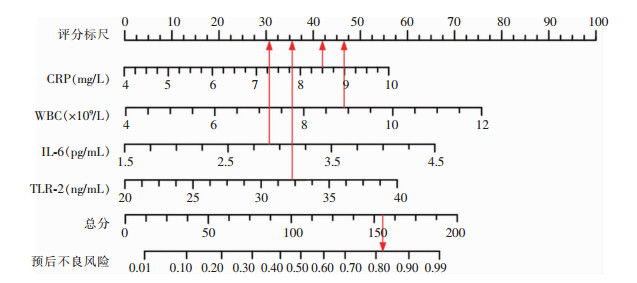 |
| 图 2 预测隆乳术后假体周围感染风险的列线图模型 Figure 2 Nomogram model for predicting the risk of peri-prosthetic infection after mammoplasty |
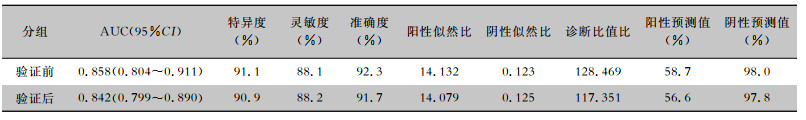
采用Bootstrap法重复抽样1 000次内部验证该模型,列线图模型预测发生假体周围感染风险作为检验变量,患者实际发生假体周围感染作为状态变量,构建列线图模型预测隆乳术后假体周围感染发生的ROC曲线和校准曲线,列线图模型的校准度以校准曲线中的平均绝对误差(Mean absolute error, MAE)进行评估,由分析结果可知,内部验证前后AUC分别为0.858(95%CI:0.804~0.911)、0.842(95%CI:0.799~0.890),切点值为0.56,内部验证前后灵敏度分别为88.1%、88.2%,特异度分别为91.1%、90.9%,MAE均为0.017,表明列线图预测模型区分度、校准度、灵敏度及特异度良好。见表 4、图 3。
| 表 4 Bootstrap内部验证前后模型区分度指标比较 Table 4 Comparison of model differentiation indexes before and after internal validation in Bootstrap |
|
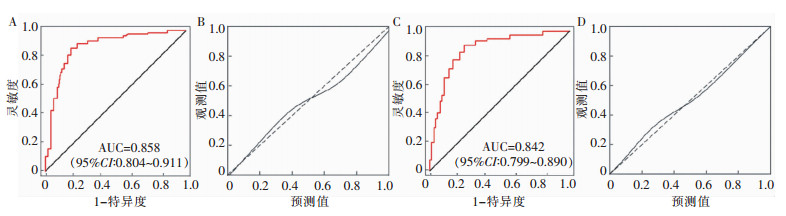 |
| 注:A、B为验证前;C、D为验证后。 图 3 内部验证前后列线图预测模型的ROC曲线和校准曲线 Figure 3 ROC curve and calibration curve of the nomogram model before and after internal validation |
根据列线图,对研究人群的6个危险因素进行赋分并求和。该线性预测模型总分共300分,446例患者的分数范围是43.28~189.37分。使用X-Tile软件确定最佳临界值(43.28、189.37分,图 4B),可将患者分为三个风险组。依据不同的评分,对患者进行危险分层,依次为≥43.28且<91.64分(低危)、≥91.64且<136.74分(中危)、≥136.74且<189.37分(高危)。不同风险组对应的生存曲线表明,总分越高则患者术后假体周围发生感染的风险越高(P<0.05),见图 4C。
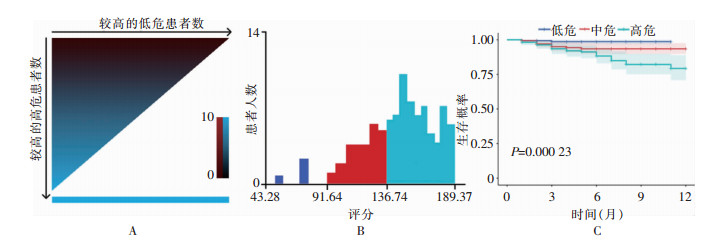 |
| 注:A.患者分布热点图;B.不同分数患者分布柱状图;C.不同危险分层患者生存曲线。 图 4 不同危险分层患者的分布情况和生存曲线 Figure 4 Distribution and survival curves of patients at different risk stratifications |
随着医学水平的发展,人们的生活品质和消费水平的提高,美容消费也随之提升。隆乳术作为一种较为成熟且安全的外科整形手术,可通过植入假体实现女性身材曲线的改善,据统计,每年全球总计行假体隆乳术超过一百万例[10]。我国医美行业仍是快速发展阶段,很多制度还在逐渐完善,急速扩展的市场伴随着医疗美容市场的混杂,这就使得研究和术后感染控制任重道远。隆乳术后假体周围发生感染受到医疗整形团队经验和技术水平、手术场地卫生条件及医疗设备的影响,患者自身的体质、生活习惯及个体差异也会影响术后感染的发生[11]。因此,寻找隆乳术后假体周围感染的相关指标尤为必要。
在假体周围感染临床实验室检查中WBC等炎症指标可提高诊断准确性,但因患者在低度感染时WBC经常处于正常范围[12]。IL-6是机体受炎性反应刺激后,细胞因子由内皮细胞、淋巴细胞及单核巨噬细胞等分泌的细胞因子,调节炎性反应进而诱导形成浆细胞,并诱导产生主要急性期蛋白质。IL-6还可将急性期T细胞激活,调节B细胞成熟,激活中性粒细胞,参与全身炎症反应,其水平可用于判断机体感染[13-15]。本次研究表明IL-6对隆乳术后假体周围感染造成显著影响,Tian等[16]2020年在IL-6对假体周围感染的诊断作用相关研究中也有类似的结论。
TLR-2配体广泛,可识别脂多肽、脂蛋白、脂壁酸及酵母多糖等,介导对宿主的免疫反应,低识别病原体具有特异性[17-18]。TLR-2信号通路作为重要炎性反应通路,导致疾病恶化[19-20]。在本次研究中发现,感染组的血清TLR-2水平高于未感染组。相关研究[21-22]表明,TLR-2可识别和抵御各种病原微生物及其产物,可在假体周围感染的发生及发展中发挥重要作用。
本研究多因素logistic回归分析结果显示,糖尿病是发生假体周围感染的独立危险因素,与既往报道[5]一致。研究中还发现乳腺炎病史也是术后假体周围感染的独立危险因素,但相关研究较少,可能与隆乳术患者中乳腺炎病史人数较少有关。基于血清IL-6、TLR-2水平和临床资料对隆乳术后假体周围感染的研究,筛选出合并糖尿病、乳腺炎病史、CRP、WBC、IL-6和TLR-2水平6个影响因素,构建预测隆乳术后假体周围感染列线图模型。列线图内部验证前后AUC值分别为0.858(95%CI:0.804~0.911)、0.842(95%CI:0.799~0.890),灵敏度分别为88.1%、88.2%,特异度分别为92.3%、91.7%,该模型具有良好的预测价值。但本研究的样本数量具有一定局限性,研究中模型构建及验证均在同一医学中心,且感染组纳入对象数量较少,结果难免存在一定偏倚,在未来的研究中将扩大样本数量,尽可能补足欠缺之处,以期为隆乳术后假体周围感染的防治提供更加精准的数据支持。
综上所述,合并糖尿病、乳腺炎病史,CRP、WBC、IL-6和TLR-2水平对隆乳术后假体周围感染具有较强的预测能力。基于这些危险因素构建的列线图预测隆乳术后假体周围感染风险,可帮助临床医生为患者提供定制化的临床治疗方案,降低术后感染风险。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
中华医学会整形外科学分会乳房整形美容学组. 硅胶乳房假体隆乳术临床技术指南(2020版)[J]. 中华整形外科杂志, 2020, 36(11): 1180-1186. Committee of Aesthetic and Reconstructive Breast Surgery, Chinese Society of Plastic Surgery. Clinical guideline in augmentation mammaplasty with silicone implant (version 2020)[J]. Chinese Journal of Plastic Surgery, 2020, 36(11): 1180-1186. DOI:10.3760/cma.j.cn114453-20201010-00525 |
| [2] |
von Soest T, Torgersen L, Kvalem IL. Mental health and psychosocial characteristics of breast augmentation patients[J]. J Health Psychol, 2020, 25(9): 1270-1284. DOI:10.1177/1359105318754645 |
| [3] |
Kanapathy M, Faderani R, Arumugam V, et al. Management of periprosthetic breast infection: a systematic review and Meta-analysis[J]. J Plast Reconstr Aesthet Surg, 2021, 74(11): 2831-2845. DOI:10.1016/j.bjps.2021.05.070 |
| [4] |
Kunutsor SK, Barrett MC, Whitehouse MR, et al. Incidence, temporal trends and potential risk factors for prosthetic joint infection after primary total shoulder and elbow replacement: systematic review and Meta-analysis[J]. J Infect, 2020, 80(4): 426-436. DOI:10.1016/j.jinf.2020.01.008 |
| [5] |
Wang K, Li W, Liu HY, et al. Progress in prevention, diagnosis, and treatment of periprosthetic joint infection[J]. Evid Based Complement Alternat Med, 2021, 2021: 3023047. |
| [6] |
Bahia W, Soltani I, Haddad A, et al. Links between SNPs in TLR-2 and TLR-4 and idiopathic recurrent pregnancy loss[J]. Br J Biomed Sci, 2020, 77(2): 64-68. DOI:10.1080/09674845.2019.1687151 |
| [7] |
赵丽洁, 林丽红. 病原菌分布特征及血清Toll样受体2水平对宫颈癌伴阴道混合感染的预测价值[J]. 中国病原生物学杂志, 2021, 16(6): 715-719. Zhao LJ, Lin LH. The distribution characteristics of vaginal pathogens and serum TLR2 levels in patients with cervical cancer predicting development of a mixed vaginal infection[J]. Journal of Parasitic Biology, 2021, 16(6): 715-719. |
| [8] |
邓东阳, 陈蓉, 李学会. 妊娠晚期B族溶血性链球菌宫内感染血清IL-6和TNF-α表达水平与妊娠结局[J]. 中华医院感染学杂志, 2020, 30(9): 1389-1392. Deng DY, Chen R, Li XH. Correlation between levels of se-rum IL-6 and TNF-alpha and pregnancy outcomes of pregnant women with intrauterine infection of group B hemolytic Streptococcus in third trimester of pregnancy[J]. Chinese Journal of Nosocomiology, 2020, 30(9): 1389-1392. |
| [9] |
陈仙芳, 毛伟君, 吴燕飞, 等. 磷酸肌酸钠对心衰伴肺部感染患者VEGF、IL-6、TNF-α及心功能影响[J]. 中华医院感染学杂志, 2020, 30(8): 1234-1239. Chen XF, Mao WJ, Wu YF, et al. Effects of sodium creatine phosphate on VEGF, IL-6, TNF-α levels and cardiac function in patients with heart failure and pulmonary infection[J]. Chinese Journal of Nosocomiology, 2020, 30(8): 1234-1239. |
| [10] |
Perry D, Frame JD. The history and development of breast implants[J]. Ann R Coll Surg Engl, 2020, 102(7): 478-482. DOI:10.1308/rcsann.2020.0003 |
| [11] |
梁灵刚, 任召强, 李亚杰, 等. 不同类型乳房假体隆乳术后常见并发症发生率比较[J]. 中国医疗美容, 2022, 12(11): 32-35. Liang LG, Ren ZQ, Li YJ, et al. Comparison of common complications after augmentation mammaplasty with different types of breast implants[J]. China Medical Cosmetology, 2022, 12(11): 32-35. |
| [12] |
商广前, 项帅, 郭璀璀, 等. 血小板相关指标对慢性关节假体周围感染诊断价值的研究[J]. 中华外科杂志, 2021, 59(9): 764-769. Shang GQ, Xiang S, Guo CC, et al. Diagnostic value of platelet associated biomarkers in chronic periprosthetic joint infection[J]. Chinese Journal of Surgery, 2021, 59(9): 764-769. |
| [13] |
王小虎, 赵波, 喻少敏, 等. 开放性骨折患者术后血清TLR-2、MCP-1、IL-6水平与感染的关系[J]. 疑难病杂志, 2023, 22(3): 305-310. Wang XH, Zhao B, Yu SM, et al. The relationship between serum TLR-2, MCP-1, IL-6 levels and infection in patients with open fracture after operation[J]. Chinese Journal of Difficult and Complicated Cases, 2023, 22(3): 305-310. |
| [14] |
董晓玉, 马晴晴, 殷俊, 等. 血清IL-6与中性粒细胞表型及吞噬力关系在脓毒症分期中的诊断价值[J]. 安徽医科大学学报, 2020, 55(8): 1265-1270. Dong XY, Ma QQ, Yin J, et al. The diagnostic value of se-rum interleukin-6 in relation to neutrophil phenotypes and phagocytosis in clinical staging of patients with sepsis[J]. Acta Universitatis Medicinalis Anhui, 2020, 55(8): 1265-1270. |
| [15] |
汤文, 许慧, 黄成姣, 等. 连续血液净化对脓毒症患儿血清肌钙蛋白、纤维蛋白原及炎性因子表达的影响[J]. 疑难病杂志, 2022, 21(9): 961-965. Tang W, Xu H, Huang CJ, et al. Effects of continuous blood purification on the expressions of serum troponin, fibrinogen and inflammatory factors in children with sepsis[J]. Chinese Journal of Difficult and Complicated Cases, 2022, 21(9): 961-965. |
| [16] |
Tian BZ, Cui LW, Jiang WH. The diagnostic effect of α-defensin, D-dimer, and IL-6 in periprosthetic joint infection: a systematic review and diagnostic Meta-analysis[J]. J Orthop Surg (Hong Kong), 2020, 28(3): 2309499020971861. |
| [17] |
Feng TT, Yang XY, Hao SS, et al. TLR-2-mediated metabolic reprogramming participates in polyene phosphatidylcholine-mediated inhibition of M1 macrophage polarization[J]. Immunol Res, 2020, 68(1): 28-38. |
| [18] |
孙姗姗, 李培军, 李博, 等. 脓毒症心肌损伤中Toll样受体4和JNK信号通路对细胞凋亡的作用[J]. 中国中西医结合急救杂志, 2020, 27(2): 151-156. Sun SS, Li PJ, Li B, et al. Effect of TLR4 and JNK signaling pathway on apoptosis in septic myocardial injury[J]. Chinese Journal of Integrated Traditional and Western Medicine in Intensive and Critical Care, 2020, 27(2): 151-156. |
| [19] |
Ye TT, Xiong DFF, Chen LB, et al. Effect of Danshen on TLR2-triggered inflammation in macrophages[J]. Phytomedicine, 2020, 70: 153228. |
| [20] |
Fortingo N, Melnyk S, Sutton SH, et al. Innate immune system activation, inflammation and corneal wound healing[J]. Int J Mol Sci, 2022, 23(23): 14933. |
| [21] |
徐秋霞, 关红琼, 许琳. Toll样受体-2和Toll样受体-4、单核细胞趋化蛋白-1与绒毛膜羊膜炎的相关性研究[J]. 中华医院感染学杂志, 2020, 30(8): 1260-1264. Xu QX, Guan HQ, Xu L. Study on the correlation between toil-like receptor-2 and toll-like receptor-4, monocyte chemoattractant protein-1 and chorioamnionitis[J]. Chinese Journal of Nosocomiology, 2020, 30(8): 1260-1264. |
| [22] |
Gamrekelashvili J, Kapanadze T, Sablotny S, et al. Notch and TLR signaling coordinate monocyte cell fate and inflammation[J]. Elife, 2020, 9: e57007. |



