外科手术是目前治疗胃癌与结直肠癌的主要治疗手段,但术后并发症仍然是目前临床面临的一个重要问题。手术部位感染(surgical site infection, SSI)是胃肠道手术后最常见的感染并发症。SSI延长住院时间,增加医疗费用,降低患者生活质量[1-4],并可延迟术后辅助化学治疗的启动,对胃癌和结直肠癌患者长期预后造成不良影响。按照解剖部位,SSI可进一步分为体表、深层和器官/腔隙感染三种类型。随着围手术期预防性抗菌药物的应用与腹腔镜等微创手术技术的不断推广,体表SSI的发生率已明显下降,但器官/腔隙SSI并未减少[5-6]。器官/腔隙SSI已成为SSI的主要类型,了解胃肠癌术后SSI的风险因素对预防术后并发症,降低计划外再入院与医院内病死率具有重要意义。
器官/腔隙SSI与体表SSI的风险因素截然不同,既往研究已对体表SSI的风险因素有所研究,但关于胃癌、结直肠癌手术后器官/腔隙SSI风险因素的识别依然有限。本研究分析胃癌与结直肠癌手术后器官/腔隙SSI发生率及危险因素,旨在提供一个简单的患者风险分层,以帮助外科医生早期识别术后器官/腔隙SSI风险,制定针对性的预防措施。
1 对象与方法 1.1 研究对象选取2018年1月—2022年10月某院因胃癌或结直肠癌接受手术的患者为研究对象。纳入标准:①接受根治性切除手术及淋巴结清扫,经术后病理证实为胃癌或结直肠癌者;②美国麻醉医师协会(American Society of Anesthesio-logists, ASA)分级为Ⅰ~Ⅲ者;③年龄>18岁;④临床资料完整。排除标准:①伴有其他系统恶性肿瘤者;②合并严重心、肺、肝、肾等器官功能不全,凝血功能异常或自身免疫性疾病者;③姑息性手术(如回肠/结肠造瘘、胃旁路手术等),或因梗阻、出血、穿孔等并发症行急诊手术者;④术前存在感染性疾病者。本研究经机构审查委员会批准,研究方案符合《赫尔辛基宣言》的伦理准则,临床数据的收集与用途已获得所有患者的书面知情同意。
1.2 围手术期管理所有患者入院后完善相关检查,评估肿瘤临床分期和患者的一般状况,选择恰当的手术切除方式或新辅助放射治疗、化学治疗方案。术前通过肠内营养支持强化患者营养状态,在充分的术前准备后,进行限期手术。术前使用聚维酮碘消毒剂常规消毒手术区,并于术前30 min预防性使用抗菌药物,常用方案为头孢呋辛1.5 g静脉滴注,手术时间超过3 h者术中加用一次,有青霉素、头孢类过敏史者使用克林霉素代替[7]。术后常规留置腹腔引流管并预防性使用抗菌药物,相关程序符合合理使用抗菌药物的相关规定,每日监测腹腔引流量、颜色及性状特征等。患者恢复口进食后,引流液无任何异常,考虑拔除引流管。术后恢复良好者拔管时间通常为术后5~7 d。
1.3 资料收集从医院病历信息系统收集患者的临床资料,包括年龄、性别、身体质量指数(body mass index, BMI)、既往史(如吸烟史、腹部手术史、糖尿病、高血压等)、术前ASA分级、新辅助化学治疗情况、术前贫血和低蛋白血症情况、肿瘤病理学肿瘤-淋巴结-转移(tumor node metastasis, TNM)分期、手术方式、切除范围、淋巴结清扫范围、消化道吻合方式、是否联合脏器切除、手术时间、术中估计失血量等。
1.4 相关定义器官/腔隙SSI参照美国疾病控制与预防中心(Centers for Disease Control and Prevention, CDC) 及其医院感染监测网(National Noso- comial Infection Surveillance, NNIS)的诊断标准定义器官/腔隙SSI[8],即感染涉及手术切口以外的任何器官或腔隙,术后30 d内(本研究纳入的患者手术部位均无植入物)至少出现以下任何情况之一:①腹腔引流管见脓性液体引出;②从器官/腔隙中收集的液体培养物中分离获得病原菌;③经影像学检查,介入穿刺或再次手术证实涉及腹、盆腔器官/腔隙的脓肿、脓性液体聚集或其他感染证据。贫血根据世界卫生组织(World Health Organization, WHO)的标准定义,即男性血红蛋白值(hemoglobin, Hb) < 13 g/dL,女性 < 12 g/dL。低蛋白血症是指术前血清清蛋白 < 35.0 g/L。TNM分期根据美国癌症联合会(American Joint Committee on Cancer, AJCC)第8版胃癌、结直肠癌分期系统记录。
1.5 统计学方法应用R软件(4.2.1版)进行数据统计。符合正态分布的连续变量以均数±标准差表示,否则以中位数和四分位数间距(interquartile range, IQR)描述,基于数据分布采用独立样本t检验或Mann-Whitney U检验。采用二元logistic回归模型筛选胃肠癌术后器官/腔隙SSI的风险因素,根据中位数或已知的共识标准将连续变量转换为二分类变量,单因素分析中有统计学意义(P < 0.05)的变量进一步纳入多因素分析,采用向后逐步选择法确定器官/腔隙SSI的独立预测因素,结果以优势比(Odds ratio, OR)和95%置信区间(confidence interval, CI)表示。基于筛选的独立风险因素分别构建胃癌、结直肠癌术后器官/腔隙SSI的列线图模型,Bootstrap内部验证计算一致性指数(concor-dance index, C-index),评估模型的预测能力。绘制校准曲线评价列线图预测概率与实际风险的一致性,决策曲线评估预测模型的临床实用性。双侧检验P≤0.05认为差异具有统计学意义。
2 结果 2.1 一般特征共纳入356例胃癌和305例结直肠癌患者。356例胃癌患者,平均年龄(65.8±12.5)岁,中位手术时间208.0(IQR: 155.0~298.0)min,中位住院日数13.0(IQR: 9.0~15.0)d,30例患者发生器官/腔隙SSI,发生率为8.4%。305例结直肠癌患者,平均年龄(61.6±11.3)岁,中位手术时间190.0(IQR: 165.0~226.0)min,中位住院日数11.0(IQR: 8.0~14.0)d,29例患者术后发生器官/腔隙SSI,发生率为9.5%。器官/腔隙SSI患者住院时间长于非器官/腔隙SSI患者,差异有统计学意义[胃癌:12.0(IQR: 9.0~14.0)d VS 25.0 (IQR: 20.0~31.0)d,Z=10.559, P < 0.001;结直肠癌:10.0(IQR: 8.0~14.0)d VS 21.0(IQR: 16.0~25.0)d,Z=7.390, P < 0.001)]。59例器官/腔隙SSI患者共检出74株病原菌,其中44例为单一菌感染,15例为混合感染(2种及以上病原菌)。74株病原菌中革兰阴性菌54株,革兰阳性菌17株,真菌3株,见表 1。
| 表 1 胃肠癌术后器官/腔隙SSI的病原菌分布 Table 1 Distribution of pathogens in organ/space surgical site infection after gastric and colorectal cancer surgery |
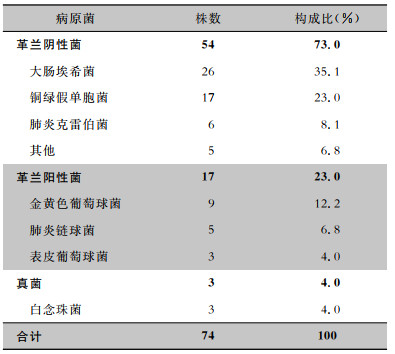
|
单变量分析结果显示,性别、BMI、ASA分级、联合脏器切除和术中失血量与胃癌术后器官/腔隙SSI相关(均P<0.05),见表 2。多变量logistic分析结果显示,男性(OR=5.203, 95%CI: 1.167~23.193, P=0.031)、术前ASA Ⅲ级(OR=5.078, 95%CI: 2.047~12.598, P<0.001)、联合脏器切除(OR=3.479, 95%CI: 1.261~9.546, P=0.016)及术中失血量≥100 mL(OR=3.629, 95%CI: 1.577~8.350, P=0.002)为胃癌术后器官/腔隙SSI的独立风险因素,见表 3。
| 表 2 胃癌患者器官/腔隙SSI单因素分析结果[例(%)] Table 2 Univariate analysis results of organ/space surgical site infection in gastric cancer patients (No. of cases [%]) |
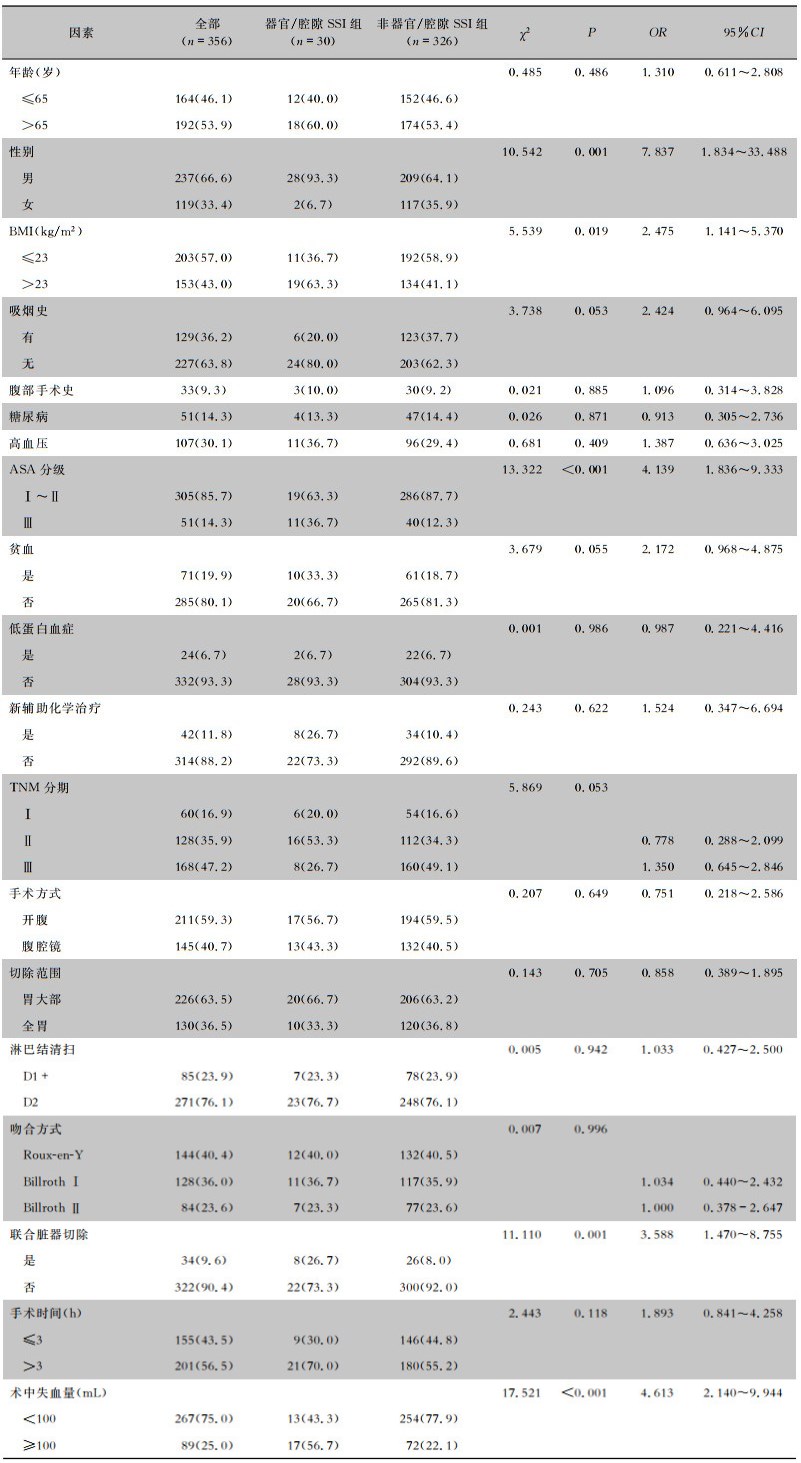
|
| 表 3 胃癌术后器官/腔隙SSI风险因素的多变量logistic回归分析 Table 3 Multivariate logistic regression analysis on risk factors for organ/space surgical site infection after gastric cancer surgery |
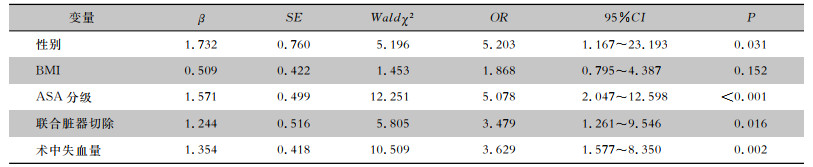
|
单变量分析结果显示,ASA分级、低蛋白血症、联合脏器切除及手术时间是结直肠癌术后器官/腔隙SSI的潜在风险因素(均P<0.05),见表 4。多变量logistic分析结果显示,ASA分级(OR=3.128, 95%CI: 1.334~7.337, P=0.007)、联合脏器切除(OR=3.442, 95%CI: 1.292~9.168, P=0.013)及手术时间(OR=3.091, 95%CI: 1.367~6.991, P=0.007)是结直肠癌术后器官/腔隙SSI的独立风险因素,见表 5。
| 表 4 结直肠癌患者器官/腔隙SSI单因素分析结果[例(%)] Table 4 Univariate analysis results of organ/space surgical site infection in colorectal cancer patients (No. of cases [%]) |
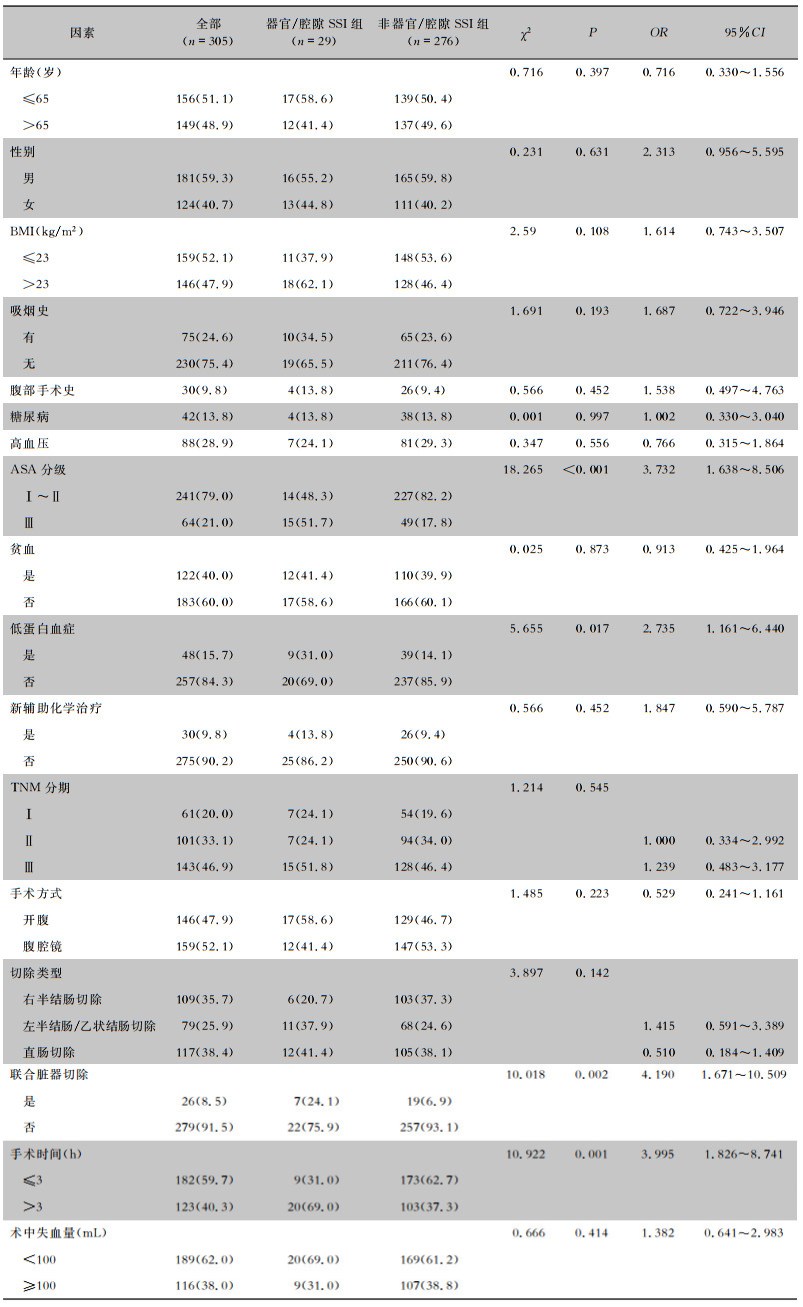
|
| 表 5 结直肠癌术后器官/腔隙SSI风险因素的多变量logistic回归分析 Table 5 Multivariate logistic regression analysis on risk factors for organ/space surgical site infection after colorectal cancer surgery |
|
根据多变量分析筛选出的独立风险因素分别构建预测胃癌、结直肠癌术后器官/腔隙SSI的列线图模型,C-index分别为0.808(95%CI:0.722~0.894)、0.763(95%CI:0.674~0.852),见图 1。校准曲线表明模型预测曲线与理想参考线具有良好一致性,可用于胃肠癌术后器官/腔隙SSI的风险预测与分层,见图 2。决策曲线分析显示,使用该预测模型能够获得较多的净收益,表明构建的列线图可以用来作出临床决策,见图 3。
 |
| 注:A为胃癌;B为结直肠癌。 图 1 预测器官/腔隙SSI风险的列线图模型 Figure 1 Nomogram models for predicting the risk of organ/space surgical site infection |
 |
| 注:A为胃癌;B为结直肠癌。 图 2 列线图模型的校准曲线图 Figure 2 Calibration curves of the nomogram models |
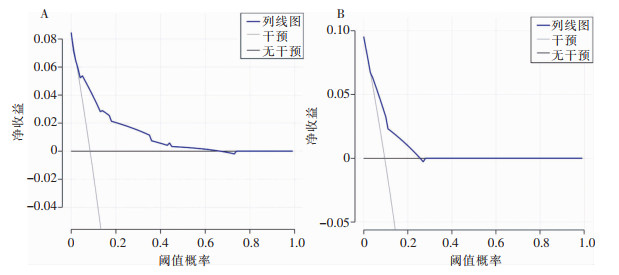 |
| 注: A为胃癌; B为结直肠癌。 图 3 列线图模型的决策曲线评估结果 Figure 3 Decision curve evaluation of the nomogram models |
器官/腔隙SSI的预防是胃癌、结直肠癌患者围手术期管理的关键问题。既往研究[9-14]结果表明,胃癌、结直肠癌手术后器官/腔隙SSI的发生率分别为4.1%~8.6%、5.6%~19.9%。本研究中,胃癌和结直肠癌术后器官/腔隙SSI的发生率分别为8.4%、9.5%,表明其仍然是术后值得关注的常见并发症。
通过多变量logistic回归分析发现,胃癌术后器官/腔隙SSI的独立风险因素是男性、术前ASA分级Ⅲ、联合脏器切除及术中失血量≥100 mL,而ASA Ⅲ级、联合脏器切除及手术时间则与结直肠癌术后器官/腔隙SSI风险有关。性别是术后SSI的独立风险因素[10],可能与男性内脏脂肪面积和性激素对免疫系统的影响有关,这些因素增加了感染风险[15]。手术时间延长和术中失血量增加是腹部手术后器官/腔隙SSI的危险因素[9, 11, 16]。术中失血量和手术时间是唯一可能通过外科医生控制,降低器官/腔隙SSI风险的因素。提示术中应注意谨慎操作,减少术中出血量,在尽可能保证手术安全的前提下,缩短手术时间,以降低术后器官/腔隙SSI的发生率。
本研究结果显示,联合脏器切除分别使胃癌、结直肠癌患者术后器官/腔隙SSI风险增加2.479倍和2.442倍。对于胃癌手术,联合脏器切除,特别是预防性脾切除术一直存在一些争议。然而,由于术后高并发症率和低生存收益,很多外科医生对预防性脾切除术在胃癌中的作用持保留意见[17-18]。一项多中心临床队列研究[19]结果表明,对于侵犯脾门区的大弯侧近端胃癌,保留脾脏者的总体预后并不劣于接受脾切除者。Kinoshita等[20]研究表明,保留脾脏的脾门淋巴结清扫在进展期近端胃癌手术治疗中是安全可行的,与患者更好的生存质量相关。因此,对于胃癌患者,外科医生应该严格把握联合脏器切除的适应证,避免盲目扩大手术范围。
除了手术技术外,外科医生也需要认识到患者自身相关因素对术后器官/腔隙SSI的影响。本研究中,术前ASA评分与胃癌、结直肠癌患者术后器官/腔隙SSI均明显相关。ASA分类是术前评估患者基本健康状况的重要工具,尽管存在一定主观性,但已有研究[21-22]证实,ASA评分越高,患者术后SSI风险性越高。针对此项不易在短期内改变的因素,及早给予术前干预改善患者一般状况,是降低术后SSI的有效措施之一。
列线图可以直观地显示每个风险因素对术后器官/腔隙SSI发生的影响程度,实现对患者的个体化预测[23-24]。本研究基于以上讨论的风险因素,分别构建预测胃癌与结直肠癌术后器官/腔隙SSI的列线图模型。结果显示,两种模型对胃癌、结直肠癌术后器官/腔隙SSI均具有较好的预测效能,可为临床医生识别高风险个体提供一种简单、有效的工具。
本研究也存在一定局限性。首先,单中心、回顾性设计一定程度上限制了基线变量的选择,无法忽视其他未知因素对术后器官/腔隙SSI的潜在影响。其次,尽管对胃肠癌患者术后器官/腔隙SSI的风险因素与预测模型进行了初步探索,但尚未在更广泛的人群中得到验证。因此,未来仍需要通过大规模、多中心、前瞻性队列研究进一步提高预测模型的准确性与可信度。
综上所述,本研究的结果表明,性别、ASA分级、联合脏器切除与术中失血量是胃癌术后器官/腔隙SSI的独立风险因素,而ASA分级、联合脏器切除和手术时间则与结直肠癌术后器官/腔隙SSI风险相关。基于以上风险因素,成功建立了胃癌、结直肠癌术后器官/腔隙SSI的预测模型,将有助于临床医生准确识别高风险个体,并针对性地进行干预。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Ban KA, Minei JP, Laronga C, et al. American college of surgeons and surgical infection society: surgical site infection guidelines, 2016 update[J]. J Am Coll Surg, 2017, 224(1): 59-74. DOI:10.1016/j.jamcollsurg.2016.10.029 |
| [2] |
Dégbey C, Kpozehouen A, Coulibaly D, et al. Prevalence and factors associated with surgical site infections in the university clinics of traumatology and urology of the National University Hospital Centre Hubert Koutoukou Maga in Cotonou[J]. Front Public Health, 2021, 9: 629351. DOI:10.3389/fpubh.2021.629351 |
| [3] |
Kamboj M, Childers T, Sugalski J, et al. Risk of surgical site infection (SSI) following colorectal resection is higher in patients with disseminated cancer: an NCCN member cohort study[J]. Infect Control Hosp Epidemiol, 2018, 39(5): 555-562. DOI:10.1017/ice.2018.40 |
| [4] |
姚雪, 卢冉冉, 刘雪燕, 等. 中老年胃癌手术器官/腔隙感染危险因素及直接经济负担[J]. 中华医院感染学杂志, 2021, 31(18): 2855-2859. Yao X, Lu RR, Liu XY, et al. Risk factors for organ/space infection in middle-age and elderly patients undergoing gastric cancer surgery and direct economic burden[J]. Chinese Journal of Nosocomiology, 2021, 31(18): 2855-2859. |
| [5] |
Seidelman JL, Mantyh CR, Anderson DJ. Surgical site infection prevention: a review[J]. JAMA, 2023, 329(3): 244-252. DOI:10.1001/jama.2022.24075 |
| [6] |
Liu ZM, Dumville JC, Norman G, et al. Intraoperative interventions for preventing surgical site infection: an overview of Cochrane reviews[J]. Cochrane Database Syst Rev, 2018, 2(2): CD012653. |
| [7] |
陶一明, 王志明. 《外科手术部位感染的预防指南(2017)》更新解读[J]. 中国普通外科杂志, 2017, 26(7): 821-824. Tao YM, Wang ZM. Interpretation of update in guideline for the prevention of surgical site infection, 2017[J]. Chinese Journal of General Surgery, 2017, 26(7): 821-824. |
| [8] |
Berríos-Torres SI, Umscheid CA, Bratzler DW, et al. Centers for disease control and prevention guideline for the prevention of surgical site infection, 2017[J]. JAMA Surg, 2017, 152(8): 784-791. DOI:10.1001/jamasurg.2017.0904 |
| [9] |
Tu RH, Huang CM, Lin JX, et al. A scoring system to predict the risk of organ/space surgical site infections after laparoscopic gastrectomy for gastric cancer based on a large-scale re-trospective study[J]. Surg Endosc, 2016, 30(7): 3026-3034. DOI:10.1007/s00464-015-4594-y |
| [10] |
Kosuga T, Ichikawa D, Komatsu S, et al. Clinical and surgical factors associated with organ/space surgical site infection after laparoscopic gastrectomy for gastric cancer[J]. Surg Endosc, 2017, 31(4): 1667-1674. DOI:10.1007/s00464-016-5156-7 |
| [11] |
Ushiku H, Hosoda K, Yamashita K, et al. A risk model for surgical site infection in the gastric cancer surgery using data of 790 patients[J]. Dig Surg, 2015, 32(6): 472-479. DOI:10.1159/000440703 |
| [12] |
Chen KA, Joisa CU, Stem JM, et al. Improved prediction of surgical-site infection after colorectal surgery using machine learning[J]. Dis Colon Rectum, 2023, 66(3): 458-466. DOI:10.1097/DCR.0000000000002559 |
| [13] |
吴秀文, 张旭飞, 阳怡羽, 等. 2018—2020年中国结直肠术后手术部位感染现状研究[J]. 中华胃肠外科杂志, 2022, 25(9): 804-811. Wu XW, Zhang XF, Yang YY, et al. Surgical site infection after colorectal surgery in China from 2018 to 2020[J]. Chinese Journal of Gastrointestinal Surgery, 2022, 25(9): 804-811. |
| [14] |
Leaper DJ, Holy CE, Spencer M, et al. Assessment of the risk and economic burden of surgical site infection following colorectal surgery using a US longitudinal database: is there a role for innovative antimicrobial wound closure technology to reduce the risk of infection?[J]. Dis Colon Rectum, 2020, 63(12): 1628-1638. DOI:10.1097/DCR.0000000000001799 |
| [15] |
Beery TA. Sex differences in infection and sepsis[J]. Crit Care Nurs Clin North Am, 2003, 15(1): 55-62. DOI:10.1016/S0899-5885(02)00028-X |
| [16] |
Xu ZH, Qu H, Kanani G, et al. Update on risk factors of surgical site infection in colorectal cancer: a systematic review and Meta-analysis[J]. Int J Colorectal Dis, 2020, 35(12): 2147-2156. DOI:10.1007/s00384-020-03706-8 |
| [17] |
Sano T, Sasako M, Mizusawa J, et al. Randomized controlled trial to evaluate splenectomy in total gastrectomy for proximal gastric carcinoma[J]. Ann Surg, 2017, 265(2): 277-283. DOI:10.1097/SLA.0000000000001814 |
| [18] |
Li ZY, Lian B, Chen J, et al. Systematic review and Meta-analysis of splenectomy in gastrectomy for gastric carcinoma[J]. Int J Surg, 2019, 68: 104-113. DOI:10.1016/j.ijsu.2019.06.018 |
| [19] |
Sato S, Kunisaki C, Kondo H, et al. Is prophylactic splenectomy necessary for proximal advanced gastric cancer invading the greater curvature with clinically negative splenic hilar lymph node metastasis? A multi-institutional cohort study (YCOG2003)[J]. Ann Surg Oncol, 2022, 29(9): 5885-5891. DOI:10.1245/s10434-022-11939-w |
| [20] |
Kinoshita T, Sato R, Akimoto E, et al. Can laparoscopic spleen-preserving splenic hilar lymph node dissection replace prophylactic splenectomy for proximal advanced gastric cancers that invade the greater curvature?[J]. Eur J Surg Oncol, 2021, 47(6): 1466-1472. DOI:10.1016/j.ejso.2020.11.133 |
| [21] |
Tresson P, Quiquandon S, Rivoire E, et al. American Society of Anesthesiologists-physical status classification as an independent risk factor of surgical site infection after infra-inguinal arterial bypass[J]. Ann Surg, 2023, 277(5): e1157-e1163. |
| [22] |
Xu ZH, Qu H, Gong ZZ, et al. Risk factors for surgical site infection in patients undergoing colorectal surgery: a Meta-analysis of observational studies[J]. PLoS One, 2021, 16(10): e0259107. |
| [23] |
de Campos-Lobato LF, Wells B, Wick E, et al. Predicting organ space surgical site infection with a nomogram[J]. J Gastrointest Surg, 2009, 13(11): 1986-1992. |
| [24] |
Chen ZH, Zhong MC, Xu ZQ, et al. Development and validation of a nomogram based on geriatric nutritional risk index to predict surgical site infection among gynecologic oncology patients[J]. Front Nutr, 2022, 9: 864761. |



