2. 福建省立医院检验科,福建 福州 350001
2. Department of Laboratory Medicine, Fujian Provincial Hospital, Fuzhou 350001, China
纹带棒状杆菌(Corynebacterium striatum)是一种革兰阳性需氧无芽孢杆菌,与干燥棒状杆菌、溃疡棒状杆菌、假白喉棒状杆菌等统称为类白喉棒状杆菌,常定植在人类鼻腔、口腔黏膜和皮肤等部位。纹带棒状杆菌曾长期被认为是人体正常微生物群的一部分,但近年来发现其为一种条件致病菌,可引起免疫力低下或接受侵入性治疗人群的感染。纹带棒状杆菌不仅可引起皮肤、软组织感染,还可以引起呼吸道、泌尿道感染和伤口感染,甚至引起严重的败血症、骨髓炎、心内膜炎和脑膜炎等疾病,单纯的菌血症或人工瓣膜相关心内膜炎数量远超其他部位的感染,是其感染的主要类型[1-4]。随着相关研究的深入和微生物检测技术的进步,纹带棒状杆菌的检出率越来越高,其他部位的感染亦有报道。广谱抗菌药物的滥用,介入性医疗设备的使用,以及患者长期住院等因素可导致纹带棒状杆菌医院感染的暴发[5-6]。此外,纹带棒状杆菌的耐药率不断增长,耐药问题日益严峻。由于纹带棒状杆菌耐药严重而导致的临床抗菌药物治疗失败和病程迁延,可能产生严重的公共卫生问题[7]。分析纹带棒状杆菌感染的临床特征,可为避免医院感染提供参考,而分析其耐药情况、检测耐药基因可为控制该菌耐药性增长提供依据。本文对福建省某医院住院患者临床标本中分离的49株纹带棒状杆菌进行特征分析和耐药基因检测,可为该院和福建地区该菌所致疾病的治疗提供参考。
1 材料与方法 1.1 试验仪器和材料 1.1.1 试验仪器LightCycler480实时荧光定量PCR仪(瑞士罗氏公司),VITEK-MS质谱鉴定仪(法国生物梅里埃公司),电泳仪,温箱。
1.1.2 试验材料哥伦比亚血琼脂平板(郑州贝瑞特公司);纹带棒状杆菌药敏板(温州康泰生物科技有限公司),产品编号DZ1174,药物的浓度范围分别为:青霉素0.125~32 μg/mL,庆大霉素0.5~128 μg/mL,利福平0.125~32 μg/mL,头孢曲松0.25~32 μg/mL,美罗培南0.064~8 μg/mL,红霉素0.25~32 μg/mL,环丙沙星0.25~32 μg/mL,四环素0.25~32 μg/mL,克林霉素0.25~32 μg/mL,复方磺胺甲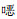
收集2020年8月—2021年3月福建某医院住院患者各类临床标本分离的纹带棒状杆菌非重复株50株,编号“W1~W50”。按《全国临床检验操作规程(第4版)》[8]要求行细菌培养,取单个菌落经VITEK-MS质谱仪鉴定菌种。
1.2.2 临床资料分析通过该院检验科微生物检验信息系统(LIS系统)收集W1~W50号菌株感染患者的相关临床资料并使用Excel软件进行统计分析。
1.2.3 药敏试验复苏保存于-70℃的菌株,在羊血琼脂平板上培养并转种到第二代进行药敏试验。药敏方法采用微量肉汤稀释法,按药敏板说明书检测不同药物对49株纹带棒状杆菌的最低抑菌浓度(MIC)。菌悬液为0.5麦氏单位,与液体培养基按1 ∶200的比例稀释后每孔加入100 μL,35℃大气环境孵育24~48 h后判读结果。孔内培养液澄清表示未生长,培养液变浑浊或显色则表示生长。在检测菌生长良好的前提下,由低浓度向高浓度观察,不生长孔指示的最低药物浓度即为MIC。药物敏感度判读标准参照美国临床实验室标准化协会(CLSI)M45-ED3[9]。
1.2.4 耐药基因检测 1.2.4.1 菌株DNA提取取细菌培养物悬液1~5 mL (106~108个细菌,不超过2×109个)于离心管中,13 400 g离心1 min,弃上清后加入180 μL Enzymatic Lysis Buffer重悬菌体,37℃孵育30 min;加入20 μL Proteinase K,震荡混匀后加入200 μL Buffer GL,震荡混匀,56℃孵育30 min。
加入200 μL无水乙醇震荡混匀,将所得溶液(包括形成的沉淀)加入已装入收集管的吸附柱(Spin Columns DM),13 400 g离心1 min,弃收集管废液,将吸附柱重新放回收集管中;吸附柱中加入500 μL Buffer GW1(使用前检查是否已加入无水乙醇),13 400 g离心1 min,弃收集管废液后放回;向吸附柱中加入500 μL Buffer GW2(使用前检查是否已加入无水乙醇),13 400 g离心1 min,弃收集管废液后放回。13 400 g离心2 min,弃收集管中废液,将吸附柱置于室温数分钟彻底晾干。将吸附柱置于新离心管中,向柱中间部位悬空加入50~200 μL Buffer GE,室温放置2~5 min,13 400 g离心1 min,收集DNA溶液,-20℃保存。
1.2.4.2 荧光定量PCR(qPCR)扩增25 μL反应体系:SYBR Mixture 12.5 μL,ddH2O 10.5 μL,cDNA 1.0 μL,正向引物0.5 μL,反向引物0.5 μL。引物序列见表 1。两步法扩增循环程序:预变性95℃ 10 min;变性95℃ 15 s;退火(延伸)60℃ 60 s,40个循环。熔解曲线60~95℃,每5 s采集一次荧光。扩增产物于-20℃冰箱保存。
| 表 1 耐药基因引物序列及扩增产物大小 Table 1 Primer sequences and amplification product sizes of antimicrobial resistance genes |
|
配制2.0%琼脂糖凝胶,电泳槽中添加1×TAE电泳缓冲液至没过胶板1~2 mm。点样板上混合PCR扩增产物(5 μL)和6×SuperStain Loading Buffer(1.0 μL)作为样本,分别将样本、DNA Marker及阴性对照加入样本槽后电泳,稳压模式120 V,电泳40 min。采用全自动紫外与可见光分析装置拍照保存。
1.2.4.4 测序阳性产物送测序公司进行测序,结果行Blast比对。
2 结果 2.1 临床资料分析 2.1.1 标本来源临床共收集非重复纹带棒状杆菌50株,其中,W47号菌株复苏培养后在血平板上的菌落不是纹带棒状杆菌,经鉴定证实后舍弃。余49株菌中,痰31株(63.27%),尿8株(16.33%),支气管分泌物4株(8.16%),血3株(6.12%),胸腔积液、切口分泌物、切口引流液各1株(各占2.04%),来自呼吸道标本的菌株数量远超其他部位的标本。
2.1.2 患者年龄分布49株纹带棒状杆菌中,标本来源患者59岁以下4株(8.16%),≥60岁的45株(91.84%)。其中,35岁1株,50~59岁3株,60~69岁8株,70~79岁9株,80~89岁16株,90~97岁12株。
2.1.3 标本科室来源标本来自11个临床科室,其中,重症医学科(ICU)18株(36.73%),干部特诊科13株(26.53%),神经科8株(16.33%),呼吸科3株(6.12%),消化科、血液科、急诊内科、胸外科、肿瘤内科、全科医学科、整形烧伤科各1株(各占2.04%)。
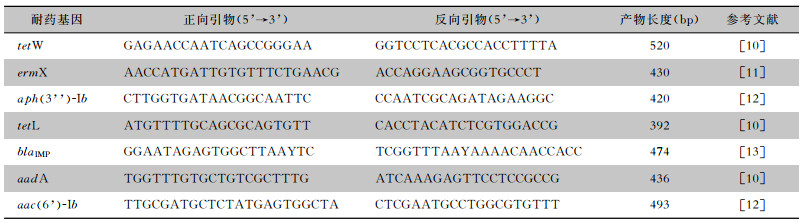
2.2 药敏试验结果纹带棒状杆菌对青霉素、头孢曲松、美罗培南、红霉素、环丙沙星、克林霉素的耐药形势较为严峻。其中,对头孢曲松、红霉素、环丙沙星的耐药率达100%,对庆大霉素、利福平的耐药率较低,分别为8.16%、12.24%,未发现对利奈唑胺或万古霉素耐药的菌株。见表 2。
| 表 2 49株纹带棒状杆菌的药敏试验结果 Table 2 Antimicrobial susceptibility test results of 49 C. striatum strains |
|
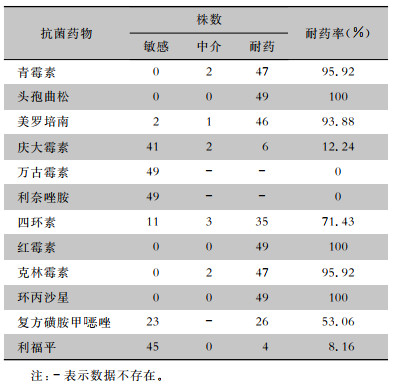
通过qPCR扩增,49株纹带棒状杆菌均检出tetL、ermX基因,69.39%检出tetW基因,aph(3’’)-Ib、aac(6’)-Ib基因检出率低(<20%),未检出blaIMP、aadA基因,见表 3。其中aadA基因Ct值均在30~33之间,需进一步验证。扩增产物电泳结果显示:tetW、ermX、aph(3’’)-Ib、tetL、aac(6’)-Ib基因条带明显,均为阳性;aadA基因无明显条带,需测序验证。见图 1。
| 表 3 49株纹带棒状杆菌耐药基因检测结果 Table 3 Detection results of antimicrobial resistance genes of 49 C. striatum strains |
|
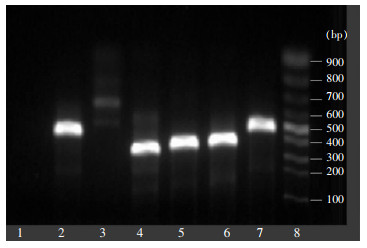 |
| 注:1为阴性对照;2为aac(6’)-Ib;3为aadA;4为tetL;5为aph(3’’)-Ib;6为ermX;7为tetW;8为Marker。 图 1 qPCR扩增阳性产物电泳图谱 Figure 1 Electrophoresis map of positive qPCR products |
tetW、ermX、aph(3’’)-Ib、tetL、aac(6’)-Ib基因扩增产物序列分别与Blast标准序列比对后均完全一致。测序未检测到aadA基因扩增产物的序列。
3 讨论棒状杆菌属革兰阳性杆菌,临床常见,种类多样,主要包括纹带棒状杆菌、白喉棒状杆菌、溃疡棒状杆菌、假白喉棒状杆菌、干燥棒状杆菌等。纹带棒状杆菌曾被认为对人体不致病,是正常菌群的一部分,但近年来在各类临床标本中检出率越来越高,引起的感染越来越常见,目前已将其归为条件致病菌,尤其容易感染免疫力较低或者伴有严重基础疾病的老年患者[14]。
从标本类型上看,纹带棒状杆菌多来自于痰标本,但不同研究中痰标本所占比例不同:王雪冰等[7]纳入研究的197株纹带棒状杆菌中,188株来自痰标本,比率高达95.43%;赵智凝等[10]收集的42株菌中有35株(83.33%)来自下呼吸道;而陈万贞等[15]报道74株纹带棒状杆菌分离自痰的仅33株(44.59%),差异较为明显。本研究49株纹带棒状杆菌中,来自痰、支气管分泌物等呼吸道标本共35株,占71.43%,远超其他部位标本,说明该菌主要感染呼吸道上皮细胞。从患者年龄上看,60岁以上老年患者远多于其他年龄段的患者。陈万贞等[15]的研究显示,60岁以上老人49例,占66.20%;赵智凝等[10]研究发现,患者年龄为36~89岁,平均65岁。本研究中,91.84%的菌株分离自≥60岁的患者,与前述研究基本一致,证实该菌主要感染免疫力较弱的老年人群。从科室分布上看,多数研究[7, 10, 15-16]显示,来自ICU和老年病科的标本居多。该院的情况与此相仿,来自ICU的标本最多,其次是干部特诊科,两者共计63.27%,再加上神经科的16.33%,接近80%。ICU患者免疫力普遍较弱,干部特诊病房多是离退休干部,年龄均较大。年迈患者包括免疫功能在内的整体机能较差,往往同时患有基础疾病,作为条件致病菌的纹带棒状杆菌更容易感染此类人群。本研究中大部分患者均存在深部感染等严重基础疾病,符合条件致病菌感染的临床特征。
本研究发现,纹带棒状杆菌对临床常用的多种抗菌药物耐药严重,对青霉素、头孢曲松、美罗培南、红霉素、环丙沙星、克林霉素的耐药率均>90%,对四环素、复方磺胺甲
菌株耐药性与耐药基因密切相关。纹带棒状杆菌耐药基因中,核糖体甲基化酶(ermX)基因的相关研究较多,被认为与红霉素等大环内酯类药物的耐药性有关。本研究菌株中,ermX基因的阳性率为100%,对红霉素的耐药率亦为100%,两者相符。王雪冰等[7]的研究中,对红霉素及克林霉素耐药的菌株ermX基因的阳性率高达88.3%,也较为一致。曹俊敏等[19]发现纹带棒状杆菌对大环内酯类和四环素类抗生素耐药是由于菌体携带ermX、tetW基因。李科[20]进一步证实了携带ermX是多重耐药纹带棒状杆菌对红霉素耐药的主要原因,即红霉素因无法作用于被甲基化的核糖体蛋白而降低了药物作用。对其他大环内酯类、林可酰胺类和链阳菌素B交叉耐药(MLSB)也与此机制有关。
对克林霉素和多西环素耐药的菌株中必然检测到tetL基因[7]。tetL基因和tetW基因均属于Mosaic四环素耐药基因[21],二者控制着四环素耐药相关蛋白的表达。本研究中,这两个基因的阳性率差异较大:49株菌tetL基因阳性,阳性率为100%;34株tetW基因阳性,阳性率仅为69.39%。在对四环素耐药的35株纹带棒状杆菌中,34株携带tetW基因,阳性率为97.14%;35株携带tetL基因,阳性率为100%。但对四环素敏感的菌株亦全部携带tetL基因,仅有1株携带tetW基因,阳性率为6.67%。因此,判断纹带棒状杆菌对四环素耐药性时,tetW基因比tetL基因特异性更高。Mosaic四环素耐药基因包括tetO、tetW、tet32、tetM、tetS等,本研究中1株未检测出tetW基因的菌株可能由于携带其他种类的Mosaic四环素耐药基因而对四环素耐药。
aph(3’’)-Ib、aac(6’)-Ib和aadA基因是氨基糖苷类药物的耐药基因[13]。本研究中,aph(3’’)-Ib的阳性率为18.37%,庆大霉素耐药率为12.24%,然而,对庆大霉素耐药的6株菌却均未检测到aph(3’’)-Ib基因, 仅1株检测到了aac(6’)-Ib基因,49株纹带棒状杆菌均未检出aadA基因,耐药基因检出情况与耐药性不一致。王雪冰等[7]的研究中,庆大霉素耐药菌株aph(3’’)-Ib基因的检出率为89.3%,aac(6’)-Ib、aadA基因的检出率分别是57.3%、4.0%[7],可见不同地区、不同研究中耐药基因的检出率存在较大差别。
携带blaIMP基因的菌株可水解青霉素类、头孢菌素类、碳青霉烯类抗生素,但主要存在于革兰阴性菌[11]。本研究blaIMP基因阳性率为0,49株纹带棒状杆菌均不含此耐药基因。
综上所述,深入掌握纹带棒状杆菌的临床特征,了解其耐药情况,并检测相关耐药基因,对预防和控制纹带棒状杆菌的医院感染,以及遏制该菌耐药性的增长具有重要意义。鉴于目前国内外尚未形成针对纹带棒状杆菌感染治疗的共识,本研究可为该院和福建地区纹带棒状杆菌所致疾病的治疗提供有益参考。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Savini V, Gherardi G, Favaro M, et al. About a bloodstream Corynebacterium striatum isolate[J]. Folia Microbiol (Praha), 2013, 58(6): 451-453. DOI:10.1007/s12223-013-0227-9 |
| [2] |
McMullen AR, Anderson N, Wallace MA, et al. When good bugs go bad: epidemiology and antimicrobial resistance profiles of Corynebacterium striatum, an emerging multidrug-resis-tant, opportunistic pathogen[J]. Antimicrob Agents Chemo-ther, 2017, 61(11): e01111-17. |
| [3] |
Ishiwada N, Watanabe M, Murata S, et al. Clinical and bacteriological analyses of bacteremia due to Corynebacterium striatum[J]. J Infect Chemother, 2016, 22(12): 790-793. DOI:10.1016/j.jiac.2016.08.009 |
| [4] |
Shariff M, Aditi A, Beri K. Corynebacterium striatum: an emerging respiratory pathogen[J]. J Infect Dev Ctries, 2018, 12(7): 581-586. DOI:10.3855/jidc.10406 |
| [5] |
Verroken A, Bauraing C, Deplano A, et al. Epidemiological investigation of a nosocomial outbreak of multidrug-resistant Corynebacterium striatum at one Belgian university hospital[J]. Clin Microbiol Infect, 2014, 20(1): 44-50. DOI:10.1111/1469-0691.12197 |
| [6] |
Wang XB, Zhou HJ, Chen DK, et al. Whole-genome sequencing reveals a prolonged and persistent intrahospital transmission of Corynebacterium striatum, an emerging multidrug-resistant pathogen[J]. J Clin Microbiol, 2019, 57(9): e00683-19. |
| [7] |
王雪冰, 陈东科, 董爱英, 等. 纹带棒状杆菌临床分离株分子分型和耐药性分析[J]. 中国抗生素杂志, 2019, 44(4): 471-477. Wang XB, Chen DK, Dong AY, et al. Molecular typing and drug resistance analysis on Corynebacterium striatum isolated from inpatients[J]. Chinese Journal of Antibiotics, 2019, 44(4): 471-477. |
| [8] |
尚红, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 4版. 北京: 人民卫生出版社, 2015: 634. Shang H, Wang YS, Shen ZY. National guide to clinical laboratory procedures[M]. 4th ed. Beijing: People's Medical Publishing House, 2015: 634. |
| [9] |
Clinical and Laboratory Standards Institute. M45: methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria: 3rd edition[EB/OL]. [2022-08-27]. https://webstore.ansi.org/preview-pages/CLSI/preview-CLSI+M45-Ed3.pdf#:~:text=Clinical%20and%20Laboratory%20Standards%20Institute%20document%20M45%E2%80%94Methods%20for, series%20of%20procedures%20designed%20to%20standardize%20test%20performance.
|
| [10] |
赵智凝, 黄黎明, 李鹏. 纹带棒状杆菌感染临床特征及耐药性分析[J]. 现代检验医学杂志, 2019, 34(5): 106-108, 114. Zhao ZN, Huang LM, Li P. Clinical distribution and drug resistance of Corynebacterium striatum[J]. Journal of Modern Laboratory Medicine, 2019, 34(5): 106-108, 114. |
| [11] |
Nordmann P, Naas T, Poirel L. Global spread of carbapenemase-producing Enterobacteriaceae[J]. Emerg Infect Dis, 2011, 17(10): 1791-1798. DOI:10.3201/eid1710.110655 |
| [12] |
Navas J, Fernández-Martínez M, Salas C, et al. Susceptibility to aminoglycosides and distribution of aph and aac(3)-XI genes among Corynebacterium striatum clinical isolates[J]. PLoS One, 2016, 11(12): e0167856. DOI:10.1371/journal.pone.0167856 |
| [13] |
Gomila M, Renom F, Gallegos MDC, et al. Identification and diversity of multiresistant Corynebacterium striatum clinical isolates by MALDI-TOF mass spectrometry and by a multigene sequencing approach[J]. BMC Microbiol, 2012, 12: 52. DOI:10.1186/1471-2180-12-52 |
| [14] |
魏孔娇, 王嘉正, 邱小彤, 等. 纹带棒状杆菌耐药特征研究[J]. 微生物与感染, 2021, 16(6): 384-390. Wei KJ, Wang JZ, Qiu XT, et al. Research on drug resistance characteristics of Corynebacterium striatum[J]. Journal of Microbes and Infections, 2021, 16(6): 384-390. |
| [15] |
陈万贞, 李格非, 姚宗会, 等. 河南地区纹带棒状杆菌感染的临床特点及耐药性分析[J]. 检验医学, 2019, 34(11): 984-986. Chen WZ, Li GF, Yao ZH, et al. Clinical characteristics and drug resistance of Corynebacterium striatum in Henan[J]. Laboratory Medicine, 2019, 34(11): 984-986. |
| [16] |
林冬玲, 龙一飞, 叶依, 等. 61株纹带棒状杆菌耐药表型与分子流行病学[J]. 中华医院感染学杂志, 2020, 30(19): 2927-2930. Lin DL, Long YF, Ye Y, et al. Drug-resistant phenotypes and molecular epidemiology of 61 strains of Corynebacterium striatum[J]. Chinese Journal of Nosocomiology, 2020, 30(19): 2927-2930. |
| [17] |
Alibi S, Ferjani A, Boukadida J, et al. Occurrence of Corynebacterium striatum as an emerging antibiotic-resistant nosocomial pathogen in a Tunisian hospital[J]. Sci Rep, 2017, 7(1): 9704. |
| [18] |
Noussair L, Salomon E, El Sayed F, et al. Monomicrobial bone and joint infection due to Corynebacterium striatum: li-terature review and amoxicillin-rifampin combination as treatment perspective[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(7): 1269-1278. |
| [19] |
曹俊敏, 杨雪静, 王原. 棒杆菌属细菌分类鉴定的方法学比较及对四环素与大环内酯类抗菌药物耐药机制的研究[J]. 中华医院感染学杂志, 2013, 23(2): 241-244. Cao JM, Yang XJ, Wang Y. Methodology of identification of Corynebacterium and the drug resistant mechanisms to tetracycline and macrolides antibiotics[J]. Chinese Journal of Nosocomiology, 2013, 23(2): 241-244. |
| [20] |
李科. 多重耐药纹带棒状杆菌的亲缘性分析及耐药机理研究[D]. 重庆: 重庆医科大学, 2014. Li K. Research on affinity analysis and drug-resistnce mechanism of the multidrug-resistant Corynebacterium striatum[D]. Chongqing: Chongqing Medical University, 2014. |
| [21] |
Warburton PJ, Amodeo N, Roberts AP. Mosaic tetracycline resistance genes encoding ribosomal protection proteins[J]. J Antimicrob Chemother, 2016, 71(12): 3333-3339. |



