鹦鹉热是由鹦鹉热衣原体引起的人畜共患传染性疾病。鹦鹉热衣原体是一种胞内革兰阴性病原体,广泛寄生在鸟类(尤其是鹦鹉、鸽子)及哺乳类动物体内[1-2]。受感染的鹦鹉、鸽子等鸟类羽毛及禽类排泄物可形成气溶胶,人类经呼吸道吸入肺部从而致病,引起鹦鹉热衣原体肺炎,是社区获得性肺炎的病因之一[3]。
临床上常规方法检测鹦鹉热衣原体的敏感性及特异性较低,容易误诊误治。宏基因组二代测序技术(metagenomic next-generation sequencing, mNGS)目前广泛应用于临床病原学检测,24~48 h内能得到结果,结果准确、迅速,大大提高了鹦鹉热衣原体感染的检出率。本研究回顾性分析某院2018年3月—2022年3月经mNGS确诊的43例鹦鹉热衣原体肺炎病例的临床资料,分析其临床特征,为诊断及治疗提供参考。
1 对象与方法 1.1 研究对象收集2018年3月1日—2022年3月31日在某院住院治疗的43例鹦鹉热衣原体肺炎病例的临床资料。本研究已通过该院伦理委员会审批通过(审批文件号:2022ZDSYLL203-P01)。
1.2 诊断标准鹦鹉热衣原体肺炎诊断标准:(1)符合社区获得性肺炎的诊断标准;(2)通过血、肺泡灌洗液行mNGS检测检出鹦鹉热衣原体序列的确诊病例。重症肺炎按照美国感染病协会(IDSA)/美国胸科协会(ATS)联合制定的标准,包括2项主要标准和9项次要标准,呼吸衰竭的标准为氧合指数(OI) < 300 mmHg[4]。
1.3 研究方法采用回顾性研究方法,对入选病例的人口学资料、临床资料、实验室检查、影像学资料、纤维支气管镜检查、病理学结果、mNGS结果、治疗方案、住院时间、治疗转归等进行分析。
1.4 统计学分析应用SPSS 26.00软件进行统计学分析,计数资料以频数和构成比描述,符合正态分布的连续变量资料以(x±s)描述,非正态分布的连续变量以中位数(四分位间距)描述。
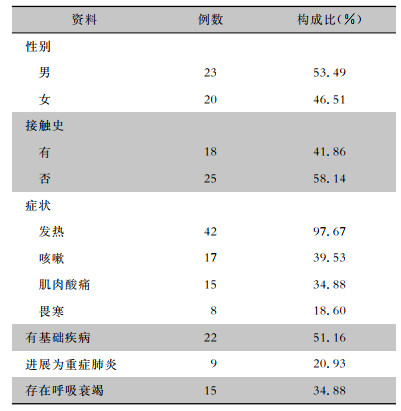
2 结果 2.1 基本信息共纳入43例患者,平均年龄(55.80±12.11)岁,其中,男性23例(53.49%),女性20例(46.51%)。43例患者中,有明确禽类接触史者18例(41.86%),包括饲养鹦鹉或鸽子、接触或宰杀活禽,25例(58.14%)患者否认明确的禽类接触史,见表 1。从发病月份来看,以冬、春季为主(集中在12、1、2月),见表 1、图 1。
| 表 1 43例鹦鹉热衣原体肺炎患者的基本信息 Table 1 Basic information of 43 patients with C. psittaci pneumonia |
|
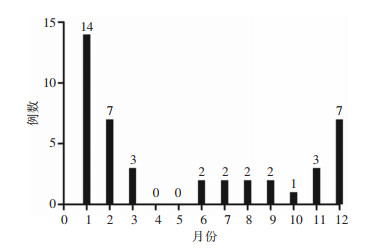 |
| 图 1 43例患者发病月份统计 Figure 1 Statistics of the onset months of 43 patients |
42例患者主诉症状主要为发热(97.67%),平均体温为39.30℃(中位数39.20℃),部分患者存在咳嗽(39.53%)、肌肉酸痛(34.88%)、畏寒(18.60%) 症状。22例(51.16%)有基础疾病,15例(34.88%)存在呼吸衰竭(氧合指数平均值为296 mmHg),9例符合重症肺炎的诊断标准,病程中曾在重症监护病房(intensive care unit, ICU)接受治疗,其中1例因病情危重接受体外膜肺氧合治疗。见表 1。
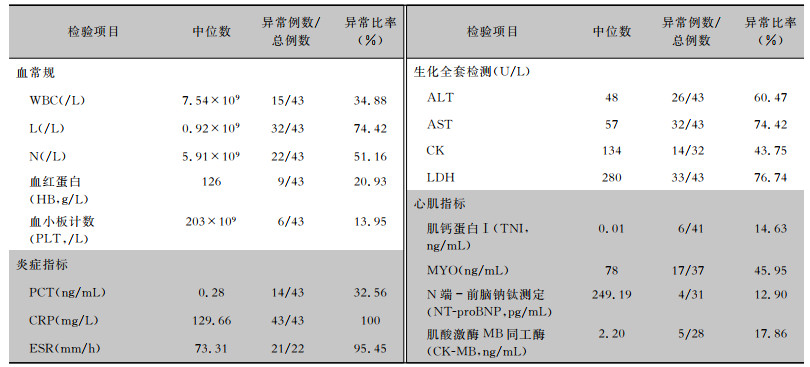
2.2 实验室检查结果43例患者血常规中白细胞计数(white blood cell, WBC)大多正常,中性粒细胞计数(neutrophil, N)超过半数升高,淋巴细胞计数(leukomonocyte, L)降低,尤其在9例重症患者中更为明显。炎症指标C反应蛋白(C-reactive protein, CRP)、红细胞沉降率(erythrocyte sedimentation rate, ESR)异常比率分别为100%、95.45%,35.56%(14/43)的患者降钙素原(procalcitonin, PCT)>0.50。生化指标中,大部分患者血清丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、肌酸激酶(creatine kinase, CK)、乳酸脱氢酶(lactic dehydrogenase, LDH)升高。心肌损伤指标以肌红蛋白(myohemoglobin, MYO)升高为主。见表 2。
| 表 2 鹦鹉热衣原体肺炎患者的实验室检查结果 Table 2 Laboratory examination results of 43 patient with C. psittaci pneumonia |
|
43例患者入院前或入院后第一次胸部高分辨率计算机体层成像(high-resolution computed tomography, HRCT)资料显示,24例(55.81%)表现为实变影,19例(44.19%)表现为磨玻璃影样渗出,见图 2。13例(30.23%) 表现为合并胸腔积液,多为少量胸腔积液,单侧为主,30例(69.77%)无胸腔积液征象;39例(90.70%)患者肺部病灶局限于单侧肺,22例(51.16%)累及右肺,25例(58.14%)累及肺下叶,仅有4例(9.30%)累及双侧肺叶。见表 3。
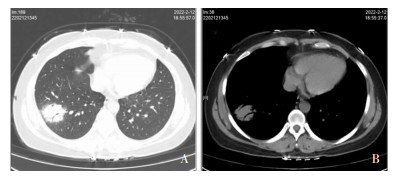 |
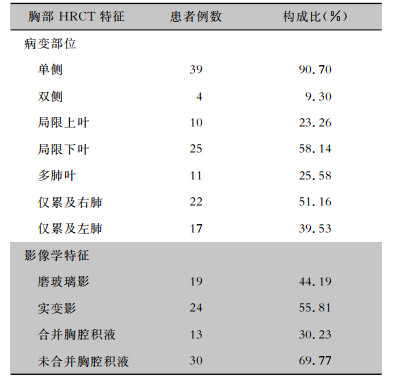
| 注:病例36,女性,36岁,因“发热5 d”于2022年2月15日入院,有饲养鹦鹉史。胸部HRCT影像显示右肺下叶团片状实变影,边缘模糊,内可见支气管充气征。A为胸部肺窗,B为胸部纵隔窗。 图 2 病例36胸部HRCT影像 Figure 2 Chest HRCT images of case 36 |
| 表 3 43例鹦鹉热衣原体肺炎患者胸部HRCT影像特征 Table 3 Chest HRCT imaging features of 43 patients with C. psittaci pneumonia |
|
共41例患者住院期间接受气管镜检查,2例患者因病情危重或状态较差,未接受气管镜检查。鹦鹉热衣原体肺炎患者气管镜下表现多为患侧气管黏膜充血水肿,30例(73.17%) 患者镜下只可见少量分泌物,11例(26.83%)患者可见中等量到大量黄白色分泌物,2例(4.88%)患者镜下表现为血性分泌物。见图 3。
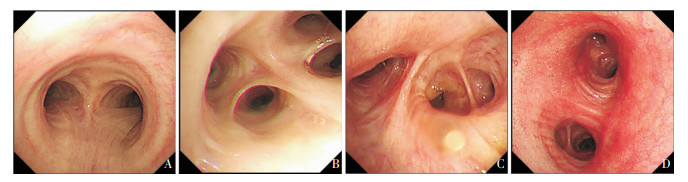 |
| 注:气管黏膜光滑,分泌物少,病变部位可见黏膜充血水肿。A为气管隆突;B为右肺上叶;C为中间支气管;D为左主支气管,可见局部黏膜充血水肿,少量白色分泌物。 图 3 鹦鹉热衣原体肺炎气管镜下表现 Figure 3 Manifestations of C. psittaci pneumonia under tracheoscope |
行气管镜检查的41例患者中,29例(70.73%)患者接受了经支气管镜肺活检,典型病理改变为肺泡间隔增宽伴纤维组织增生,可见淋巴浆细胞及中性粒细胞浸润,肺泡上皮增生活跃,肺泡腔内见炎性渗出及组织细胞聚集,部分肺泡腔可见出血,符合肺泡炎改变。5例(12.20%)患者气管镜病理提示Masson小体形成,符合机化性肺炎表现。见图 4。
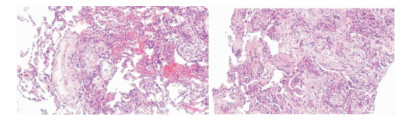 |
| 注:肺泡间隔增宽伴淋巴细胞浸润,肺泡上皮增生;部分肺泡腔内见组织细胞聚集;支气管周围见炎症细胞浸润,肺组织内可见多个纤维化病灶(Masson小体)。 图 4 气管镜下肺活检标本病理表现 Figure 4 Pathological findings of lung biopsy specimens under bronchoscope |
43例患者中,41例接受气管镜检查,同时行经支气管镜肺泡灌洗,标本送检mNGS,其余2例为外周血标本送检mNGS。43例患者mNGS检查出鹦鹉热衣原体序列数范围为1~21 269(中位数为56);9例重症肺炎患者序列数更高(中位数为882)。2例外周血标本检测出的鹦鹉热衣原体的序列数分别为34、88。所有患者在行气管镜检查或抽取血标本前均已接受抗菌药物治疗。
2.7 治疗方案及转归入院后初始抗感染治疗中,40例(93.02%)患者接受过含有莫西沙星或左氧氟沙星的抗感染方案,其中,4例(9.30%)病程中单用莫西沙星直至好转出院;15例(34.88%)病程初期接受了抗病毒治疗,包括帕拉米韦、阿比多尔、更昔洛韦和奥司他韦;27例(62.79%)在明确病原学后调整为包含多西环素、米诺环素或替加环素的抗感染方案;9例(20.93%)抗感染治疗方案中包含碳青霉烯类抗生素,包括比阿培南、亚胺培南/西司他丁、美罗培南。3例(6.98%)患者病程中有短期静脉糖皮质激素使用,包括氢化可的松和甲强龙。
43例患者住院时间中位数为13.00 d,其中,9例重症肺炎患者的住院时间中位数为21.00 d。9例(20.93%)重症肺炎患者均曾入住ICU进一步治疗,4例初诊即入住ICU,5例为病情加重转入ICU继续治疗;9例均接受气管插管及呼吸机辅助通气,1例接受体外膜氧合治疗;1例因脱机困难行气管切开术后出院,余8例均病情好转,转入普通病房治疗后出院。
鹦鹉热衣原体肺炎患者大多预后良好,未观察到死亡病例。轻症患者肺部病灶吸收良好,见图 5;重症肺炎患者复查胸部CT可见肺部遗留纤维条索样病灶,见图 6。
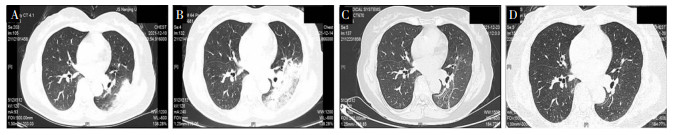 |
| 注:A为门诊胸部HRCT,左肺下叶胸膜下渗出伴实变;B为入院2 d后胸部HRCT提示左肺下叶病灶进展;C为治疗后复查胸部HRCT,左肺下叶病灶明显吸收;D为出院后复查胸部HRCT,左肺病灶基本吸收。 图 5 病例8胸部HRCT影像学变化 Figure 5 Chest HRCT images of case 8 |
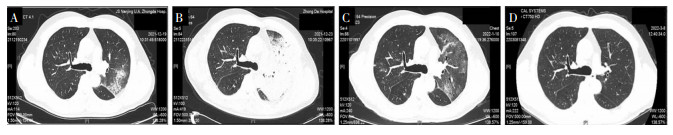 |
| 注:A为急诊胸部CT提示左肺上叶舌段实变;B为复查胸部CT提示左肺上叶尖后段、舌段实变,炎症实变较前进展范围增大;C为治疗后复查胸部CT提示双肺间质性渗出伴部分实变、纤维化,较前片明显吸收;D为出院后复查胸部CT提示双肺渗出实变较前明显吸收,双肺多发条索灶,左肺为著。 图 6 病例9胸部HRCT影像学变化 Figure 6 Chest HRCT images of case 9 |
自2021年11月份以来,江苏南京多所医院相继报道了鹦鹉热衣原体感染病例,多为散发。该院自2021年11月—2022年3月共收治26例鹦鹉热衣原体肺炎患者,多数患者初诊就诊于呼吸与危重症医学科和感染科,部分重症病例初诊为急诊科,随后收入ICU进一步诊治,可见鹦鹉热衣原体防治形势十分严峻。
鹦鹉热衣原体实验室常用的检测方法有:(1)病原体分离鉴定技术,包括细胞接种、鸡胚接种或者动物接种等不同方法培养增殖;(2)免疫学检测技术,包括补体结合试验、免疫荧光法、间接血凝试验、酶联免疫吸附试验等;(3)分子生物学检测技术,包括常规聚合酶链式反应(polymerase chain reaction, PCR)、多重PCR、荧光PCR等,其他还包括环介导等温扩增技术、重组酶介导链替换核酸扩增技术、胶体金等[5-7]。然而以上检测手段对实验室生物安全条件要求高,时间长,且不易分离到病原体,操作步骤繁琐,结果容易出现偏差,成本相对较高,很多医院未常规开展。mNGS检测利用基因组学方法研究标本中所有微生物的种类和含量,实现人源和病原体核酸的相对定量,结果可靠,且检测速度快,一般24~48 h内获得结果,在感染性疾病中的应用越来越广泛[8-10]。
鹦鹉热衣原体肺炎患者大多有禽类(鹦鹉、鸽子、鸡、鸭、鹅等)接触史。本研究43例患者中,有2例为夫妻,均有家禽接触史,其余均为散发病例,未见聚集性发病,未观察到人与人之间的传播,但如果人群接触感染的禽类,仍有聚集性疫情暴发的可能[11-14]。根据江苏省卫生健康委员会苏卫疾控(2022)2号文件要求,自2022年2月1日起,将鹦鹉热纳入丙类传染病报告管理,要求各级医疗机构做好传染病监测上报,发现符合鹦鹉热的疑似病例或者确诊病例,参照法定丙类传染病的报告要求,于24 h内上报,防止疫情扩散和蔓延。
鹦鹉热衣原体主要通过呼吸道传播。人体上皮细胞、巨噬细胞、NK细胞、树突状细胞等均可成为宿主细胞。鹦鹉热衣原体在细胞内迅速转入线粒体和高尔基体繁殖,进而在宿主细胞间传播,可引起全身多系统感染,轻症表现为社区获得性肺炎的体征,重症可引起多器官功能衰竭[15-18]。鹦鹉热衣原体引起肺部感染最为常见。本研究中,患者临床主要表现为发热,其他临床症状包括咳嗽、肌肉酸痛、畏寒、胸闷气喘、头痛、咳痰、乏力,与文献[19-20]报道结果一致。患者初期症状大多和病毒感染类似(发热、肌肉酸痛、头痛等),咳痰相对少见,因此,在疾病早期,对17例患者给予了经验性抗病毒治疗,包括帕拉米韦、奥司他韦、阿比多尔和更昔洛韦。鹦鹉热衣原体肺炎的临床表现类似于病毒感染,容易误诊,及时的病原学诊断有助于制定精准的治疗方案。
鹦鹉热衣原体肺炎的实验室检查包括:(1)血常规。疾病早期患者血常规白细胞多在正常范围内,淋巴细胞计数降低(本研究中9例重症肺炎患者的淋巴细胞计数均有降低),与机体免疫功能受损相关,当炎症控制、病情好转时淋巴细胞计数逐步恢复到正常水平。(2)炎症指标。CRP、ESR明显升高。(3)生化全套检查。大多数患者合并转氨酶(包括ALT、AST)、LDH的异常,部分患者CK升高,此类患者常主诉肌肉酸痛,异常升高的CK可能是重症鹦鹉热衣原体肺炎的重要危险因素[21]。(4)心肌指标。45.90%患者心肌指标中肌红蛋白升高,提示鹦鹉热衣原体可引起心肌损伤。
本研究中,鹦鹉热衣原体肺炎患者胸部HRCT特征显示,病变主要局限在单侧、下叶,超过半数仅累及右肺;影像学特征主要表现为实变影,病灶周围模糊,磨玻璃影相对较少;此外,大部分患者胸部CT未合并有胸腔积液,即便存在胸腔积液,也是少量胸腔积液。气管镜检查镜下表现特点为黏膜充血水肿,分泌物少见,与患者临床症状中咳痰少见一致,主要表现为病变部位的炎性改变。29例患者接受经气管镜肺活检,术后病理提示肺泡炎改变,部分患者病理提示呈机化性肺炎表现,与普通肺炎相比没有明显特异性。气管镜检查的必要性在于获取肺泡灌洗液标本,明确感染的病原体,以及鉴别其他非感染性疾病。大部分患者在行气管镜前已接受抗菌药物治疗,对后续mNGS检查结果会有所影响。若能在接受经验性抗菌药物治疗之前完成气管镜检查,可更精准地选择治疗方案。对于不能耐受气管镜检查的患者,也可选择外周血标本、痰标本,以及脑脊液标本,后者相对来说阳性率会降低[9, 22]。
鹦鹉热衣原体肺炎治疗首选四环素类抗生素,如多西环素,其次为米诺环素。本研究统计的43例患者获得病原学结果前的初始治疗以喹诺酮类抗菌药物最常见(单用或联合用药),均没有选择四环素类抗生素。4例患者整个治疗过程单用莫西沙星抗感染,病情也得到缓解。病原学结果回报后,多数患者调整为含有多西环素、米诺环素的治疗方案,病情得到控制。随着对鹦鹉热衣原体感染认识的深入及病原学检测手段时效性的提高,精准迅速地制定抗感染方案有望实现,从而避免抗菌药物的过度使用。
综上所述,鹦鹉热衣原体感染多以急性发热起病,一般有禽类接触史,血白细胞大多正常,CRP、ESR明显升高,可合并有肝肾功能及心肌指标异常,胸部CT大多表现为单侧下肺实变影。气管镜检查是获取病原学结果的重要手段,联合mNGS能快速、准确地检出病原体。四环素类抗生素为首选,部分患者喹诺酮类抗菌药物治疗亦有效。少数患者可能会进展为重症病例,总体预后良好。预防的主要措施是避免接触鸟类,尤其是鹦鹉、鸽子及家禽。勤洗手,保持个人卫生,可在一定程度上预防该病的发生。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
El-Jakee J, El-Hariri MD, El-Shabrawy MA, et al. Efficacy of a prepared tissue culture-adapted vaccine against Chlamydia psittaci experimentally in mice[J]. Vet World, 2020, 13(11): 2546-2554. DOI:10.14202/vetworld.2020.2546-2554 |
| [2] |
Liu SY, Li KP, Hsieh MK, et al. Prevalence and genotyping of Chlamydia psittaci from domestic waterfowl, companion birds, and wild birds in Taiwan[J]. Vector Borne Zoonotic Dis, 2019, 19(9): 666-673. DOI:10.1089/vbz.2018.2403 |
| [3] |
Cillóniz C, Torres A, Niederman M, et al. Community-acquired pneumonia related to intracellular pathogens[J]. Intensive Care Med, 2016, 42(9): 1374-1386. DOI:10.1007/s00134-016-4394-4 |
| [4] |
Metlay JP, Waterer GW, Long AC, et al. Diagnosis and treatment of adults with community-acquired pneumonia. an official clinical practice guideline of the American Thoracic Society and Infectious Diseases Society of America[J]. Am J Respir Crit Care Med, 2019, 200(7): e45-e67. DOI:10.1164/rccm.201908-1581ST |
| [5] |
孙翔翔, 张培培, 刘蒙达, 等. 鹦鹉热衣原体荧光环介导等温扩增(LAMP)检测方法的建立[J]. 中国动物检疫, 2020, 37(9): 101-105. Sun XX, Zhang PP, Liu MD, et al. Establishment of a loop-mediated isothermal amplification method for Chlamydia psittaci[J]. China Animal Health Inspection, 2020, 37(9): 101-105. |
| [6] |
王建忠, 唐泰山, 姚火春, 等. 鹦鹉热衣原体病原学检测技术分析[J]. 中国家禽, 2014, 36(17): 56-57. Wang JZ, Tang TS, Yao HC, et al. Analysis of etiological detection techniques for chamdia psittcai[J]. China Poultry, 2014, 36(17): 56-57. |
| [7] |
Pang YL, Cong F, Zhang XH, et al. A recombinase polymera-se amplification-based assay for rapid detection of Chlamydia psittaci[J]. Poult Sci, 2021, 100(2): 585-591. DOI:10.1016/j.psj.2020.11.031 |
| [8] |
中华医学会检验医学分会临床微生物学组, 中华医学会微生物学与免疫学分会临床微生物学组, 中国医疗保健国际交流促进会临床微生物与感染分会. 宏基因组高通量测序技术应用于感染性疾病病原检测中国专家共识[J]. 中华检验医学杂志, 2021, 44(2): 107-120. Clinical Microbiology Group of Chinese Society of Laboratory Medicine, Clinical Microbiology Group of Chinese Society of Microbiology and Immunology, Society of Clinical Microbiology and Infection of China International Exchange and Promotion Association for Medical and Healthcare. Chinese expert consensus on metagenomics next-generation sequencing application on pathogen detection of infectious diseases[J]. Chinese Journal of Laboratory Medicine, 2021, 44(2): 107-120. |
| [9] |
Yin XW, Mao ZD, Zhang Q, et al. Clinical metagenomic sequencing for rapid diagnosis of pneumonia and meningitis caused by Chlamydia psittaci[J]. World J Clin Cases, 2021, 9(26): 7693-7703. DOI:10.12998/wjcc.v9.i26.7693 |
| [10] |
赵仁淹, 柴海娜, 郑瑞强. 病原体二代测序辅助诊断鹦鹉热衣原体重症肺炎一例[J]. 中华内科杂志, 2020, 59(12): 989-991. Zhao RY, Chai HN, Zheng RQ. A case report of critical psittaci pneumonia diagnosed by next-generation sequencing[J]. Chinese Journal of Internal Medicine, 2020, 59(12): 989-991. DOI:10.3760/cma.j.cn112138-20200229-00157 |
| [11] |
Vorimore F, Thébault A, Poisson S, et al. Chlamydia psittaci in ducks: a hidden health risk for poultry workers[J]. Pathog Dis, 2015, 73(1): 1-9. |
| [12] |
Lagae S, Kalmar I, Laroucau K, et al. Emerging Chlamydia psittaci infections in chickens and examination of transmission to humans[J]. J Med Microbiol, 2014, 63(Pt 3): 399-407. |
| [13] |
Kozuki E, Arima Y, Matsui T, et al. Human psittacosis in Japan: notification trends and differences in infection source and age distribution by gender, 2007 to 2016[J]. Ann Epidemiol, 2020, 44: 60-63. |
| [14] |
Fernández P, Iborra MA, Simón M, et al. Outbreak of Chlamydia psittaci pneumonia in the region of murcia[J]. Enferm Infecc Microbiol Clin (Engl Ed), 2020, 38(6): 300-301. |
| [15] |
Radomski N, Karger A, Franzke K, et al. Chlamydia psittaci-infected dendritic cells communicate with NK cells via exosomes to activate antibacterial immunity[J]. Infect Immun, 2019, 88(1): e00541-19. |
| [16] |
Radomski N, Franzke K, Matthiesen S, et al. NK cell-mediated processing of Chlamydia psittaci drives potent anti-bacterial Th1 immunity[J]. Sci Rep, 2019, 9(1): 4799. |
| [17] |
Knittler MR, Sachse K. Chlamydia psittaci: update on an underestimated zoonotic agent[J]. Pathog Dis, 2015, 73(1): 1-15. |
| [18] |
Meijer R, van Biezen P, Prins G, et al. Multi-organ failure with necrotic skin lesions due to infection with Chlamydia psittaci[J]. Int J Infect Dis, 2021, 106: 262-264. |
| [19] |
沈凌, 田贤江, 梁荣章, 等. 鹦鹉热衣原体肺炎48例临床特征分析[J]. 中华结核和呼吸杂志, 2021, 44(10): 886-891. Shen L, Tian XJ, Liang RZ, et al. Clinical and imaging features of Chlamydia psittaci pneumonia: an analysis of 48 cases in China[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2021, 44(10): 886-891. |
| [20] |
Kong CY, Zhu J, Lu JJ, et al. Clinical characteristics of Chlamydia psittaci pneumonia[J]. Chin Med J (Engl), 2021, 134(3): 353-355. |
| [21] |
Su SS, Su XQ, Zhou LP, et al. Severe Chlamydia psittaci pneumonia: clinical characteristics and risk factors[J]. Ann Palliat Med, 2021, 10(7): 8051-8060. |
| [22] |
陆晓旻, 朱际平, 陈扬, 等. 基于宏基因组二代测序诊断的鹦鹉热衣原体肺炎的流行病学特征分析[J]. 中国临床研究, 2022, 35(1): 1-5. Lu XM, Zhu JP, Chen Y, et al. Epidemiological characteristics of Chlamydia psittaci pneumonia diagnosed by meta-genomic next-generation sequencing[J]. Chinese Journal of Clinical Research, 2022, 35(1): 1-5. |



