2. 广州医科大学附属第二医院西院区综合科, 广东 广州 510000;
3. 中山大学附属第三医院肾移植科, 广东 广州 510700
2. Department of General Ward, West District Hospital, The Second Affiliated Hospital of Guangzhou Medical University, Guangzhou 510000, China;
3. Department of Kidney Transplantation, The Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510700, China
慢性肾脏疾病(chronic kidney disease,CKD)是一个主要的公共卫生问题,据估计全球有4.975亿成年人受到影响[1]。感染是移植后患者主要的并发症和死亡原因[2]。主要是由于移植后免疫抑制药物的使用,降低了机体的免疫反应,防御能力下降,易感性增加。研究[3-5]发现45%~60.2%的肾移植患者在1年内发生过感染,最常见的是围手术期供体源性感染、医院感染、潜伏感染的重新激活,以及社区获得性细菌和侵袭性真菌感染等[6]。早期诊断有助于优化免疫抑制方案,针对性使用抗菌药物,从而减少感染,提高移植物和移植受者的存活率。多年来,多种预防策略的实施也影响了感染时间表[7],并且不同国家、不同地区的感染病原谱也各有差异[8-9],国内很少报道肾移植术后第1年内感染的病因、病原体及感染患者的死亡风险。本研究回顾性分析肾移植患者术后第1年内感染病原体的时间分布特点,分析感染患者死亡的相关危险因素,探讨如何根据感染的时间特点来进行肾移植术后病原学诊断和经验性抗感染治疗,从而改善患者的预后,为降低肾移植患者的感染率和病死率提供依据。
1 资料与方法 1.1 临床资料通过医院病历系统回顾性收集2018年1月—2020年12月在某院移植中心接受了异体肾移植术及随访的肾移植受者临床资料。患者均接受同种异体肾移植术,其中死亡器官捐献供者均符合“中国公民逝世后器官捐献规范”[10],活体肾移植供者均系受者亲属且自愿无偿捐献其一侧肾脏予受者,均经中山大学附属第三医院伦理委员会讨论通过和广东省卫生健康委员会审批。通过病历系统查询患者住院记录,有明确因感染导致的住院事件,且符合相关感染的诊断标准,感染时间定义为从移植日期起至感染入院的时间,观察入组患者自移植后1年内出现的感染情况及临床预后。纳入标准:(1)年龄≥18岁;(2)单纯肾移植手术;(3)有完整的病历资料;(4)无其他血液系统、肿瘤、人类免疫缺陷病毒感染情况。排除标准:年龄<18岁;移植后3个月内失去随访、肝肾联合移植或因非感染相关原因导致的1个月内肾功能丢失的患者。
1.2 免疫抑制治疗方案以中国肾移植受者免疫抑制治疗指南[11]为准则,免疫诱导方案:(1)术中及术后第4天应用巴利昔单抗(IL-2RA)20 mg,每日1次;(2)术中以及术后第1、2天分别给予50 mg/d的兔抗人胸腺细胞免疫球蛋白(rabbit anti-human thymocyte immunoglobulin,rATG),或抗人T细胞猪免疫球蛋白(anti-human T lymphocyte porcine immunoglobulin,ALG-P)每日20~30 mg/kg。免疫抑制维持方案,采用三联免疫抑制方案:(1)术中及术后第1、2天予甲泼尼龙10 mg/kg,1次/日,静脉滴注,后逐渐减量,术后第4~5天改为口服强的松30 mg,1次/日,口服,并逐渐减量;(2)术后第1天他克莫司(FK506)初始剂量每日0.05~0.25 mg/kg,分2次口服,或术后第1天环孢素起始剂量每日6~8 mg/kg,每日2次,口服;(3)吗替麦考酚酯(mycophenolate mofetil, MMF)0.5~1.0 g,每日2次,或麦考酚钠起始剂量360~720 mg,每日2次。维持治疗剂量,根据血药浓度、血清肌酐水平调整。如出现急性排斥反应给予大剂量甲泼尼龙冲击或rATG治疗,若感染控制不理想则减少或者停用抗排斥药物。
1.3 感染诊断标准根据临床特征和放射学、生化和微生物学检查,根据感染部位分为肺部、泌尿道、胃肠道、皮肤和软组织、血流、颅内等。记录感染患者的微生物病原学结果。感染诊断标准:对肾移植术后再次住院患者进行全面评估,肺部感染患者有咳嗽、咳痰、肺部啰音临床表现,并有下列情况之一:(1)发热;(2)白细胞总数和(或)中性粒细胞增高;(3)肺部影像学显示有炎症浸润性病变。其他部位感染,需有腹痛、腹泻、尿频、尿急等全身或局部感染临床表现,从感染部位采集标本进行病原学培养或血清学诊断,有同一部位2次或2次以上病原学阳性结果。根据各部位感染临床表现,医院感染定义为对于无明确潜伏期,入院48 h后或出院后48 h内发生的感染[12]。社区获得性感染为入院48 h以内及之前发生的感染。机会性感染定义为由细菌、真菌、病毒或寄生虫引起的感染,这些感染通常不会引起疾病,但当机体的防御系统受损时就会致病[13]。肾移植术后感染,根据Fishman的报道[14]:分为移植后早期(<1个月)、移植后免疫抑制高峰期(1~6个月)和移植后晚期(>6~12个月)三个时间段。
1.4 观察指标本研究采用单中心回顾性研究方法,收集移植肾受者的一般临床资料,包括性别、年龄、终末期肾病病因、合并症、术前透析方式及时间、既往基础病史。治疗方案:围手术期免疫诱导方案、免疫抑制维持方案、随访时间、是否有移植物功能延迟恢复(delayed graft function,DGF),急性排斥,术前、术后实验室检查指标等,记录感染的部位、发生时间、体液培养和病原菌鉴定结果。纳入术后1年内感染的患者,根据结局事件分为生存组和死亡组。其中肾功能延迟恢复定义为术后1周内因肾功能延迟恢复需透析治疗,急性排斥需病理学诊断。本研究获得中山大学附属第三医院医学伦理委员会批准(审批号[2019]02-633-01)。
1.5 统计学方法应用SPSS 20.0统计软件进行数据处理与分析。计量资料采用均数±标准差(x±s)表示,非正态分布的计量资料采用中位数和四分位距[M(IQR)]描述,符合正态分布的变量采用两独立样本t检验进行单因素分析,非正态分布计量资料采用Mann-Whienty U检验。计数资料比较主要采用四格表卡方检验(矫正卡方检验)或Fisher确切概率法进行分析;分类变量以频率和百分比表示。多因素分析采用二元logistic回归分析。P≤0.05为差异有统计学意义。
2 结果 2.1 肾移植术后感染患者一般资料和临床特征2018年1月—2020年12月,共完成432例肾移植手术,排除失访95例(含台湾/香港患者失访49例),年龄<18岁患者1例,肝肾联合移植6例,非感染性移植肾失功患者4例。纳入研究的肾移植受者326例,其中119例(36.5%)在随访期间至少有一次感染。在移植术后发生感染的患者中,男性78例(65.5%),女性41例(34.5%),平均年龄(43.26± 11.35)岁。终末期肾病病因:肾小球肾炎76例(63.9%),IgA肾病16例(13.4%),糖尿病肾病9例(7.6%),多囊肾5例(4.2%),其他13例(10.9%)。术前行血液透析81例(68.1%),腹膜透析29例(24.4%),未行任何肾替代治疗9例(7.5%)。免疫诱导方案:兔抗人胸腺细胞免疫球蛋白/抗人T细胞猪免疫球蛋白(rATG/ALG-P) 90例(75.6%),IL-2RA 29例(24.4%)。
2.2 肾移植术后主要感染部位及病原菌分布各感染时期病原学检出情况各不相同,119例患者中共发生145例次感染,检出病原菌128株,主要感染类型是肺部感染(53.1%),其次是泌尿道感染(25.5%),见表 1。革兰阴性菌检出率最高(38.3%),其次是革兰阳性菌(14.8%),中晚期真菌感染和病毒感染增加。常见病原菌有大肠埃希菌、肺炎克雷伯菌、葡萄球菌、念珠菌、耶氏肺孢子菌(PCP)、巨细胞病毒(CMV)和BK病毒。见表 2。
| 表 1 肾移植患者术后感染部位及其病原体分布(n=145) Table 1 Distribution of the infection sites and pathogens in patients after kidney transplantation(n=145) |
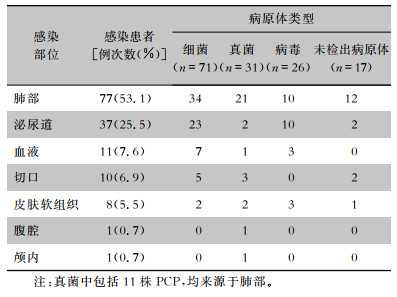
|
| 表 2 不同感染发生时间的肾移植患者检出病原体分布[株(%)] Table 2 Distribution of pathogens detected from kidney transplant patients at different infection times (No. of isolates [%]) |
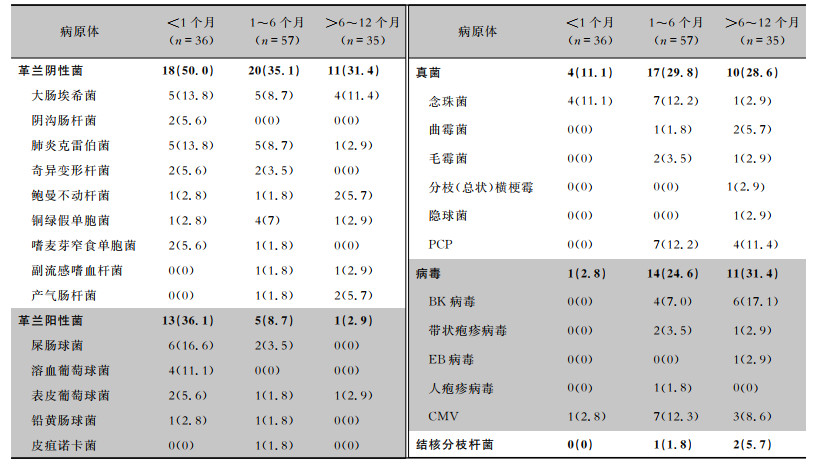
|
死亡组15例患者中,死亡原因皆归因为感染,排除由心脑血管等其他非感染疾病导致的死亡。导致感染相关死亡的最常见病因为肺部感染,共10例(66.7%),其次是脓毒症2例(13.3%),腹腔感染1例(6.7%),EB病毒颅内感染相关淋巴瘤1例(6.7%),颅内毛霉菌感染1例(6.7%)。导致死亡的最常见病原体为PCP。
2.4 死亡相关的危险因素分析单因素分析结果表明,不同年龄、性别、吸烟史、共患病情况、终末期肾病病因、术前血透时长、围手术期诱导方案、供体肾类型的肾移植患者术后病死率比较,差异均无统计学意义(均P>0.05)。肾功能延迟恢复、急性排斥反应、术后28天血清清蛋白(ALB)水平、28天FK506血药浓度的肾移植患者术后病死率比较,差异均有统计学意义(均P<0.05)。见表 3。将单因素分析中有统计学差异的指标纳入二分类logistic回归分析,排除混杂因素影响,结果显示肾功能延迟恢复(OR=4.479,P < 0.05)为感染相关性死亡的主要独立危险因素,术后28天血清ALB水平高为保护因素(OR=0.266, P < 0.05)。见表 4。
| 表 3 肾移植术后感染患者死亡的单因素分析 Table 3 Univariate analysis on death in infected patients after kidney transplantation |
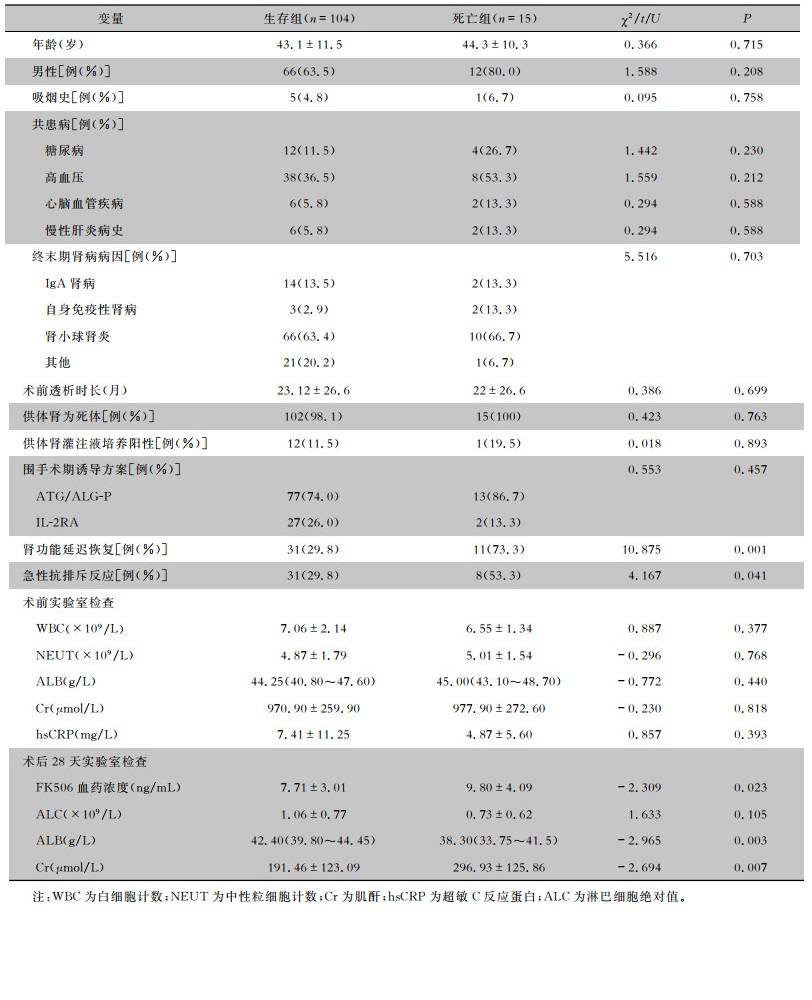
|
| 表 4 肾移植术后感染患者死亡的多因素分析 Table 4 Multivariate analysis on death in infected patients after kidney transplantation |
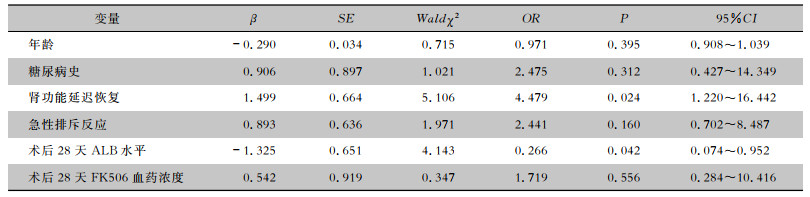
|
在我国,感染是器官移植术后最主要的并发症[15],在过去的几十年里,使用钙神经蛋白抑制剂(calcineurin inhibitor,CNI)和MMF为基础的免疫抑制方案帮助提高了移植物的短期存活率[9],同时,感染的风险也相应增加。在我国,关于肾移植术后随时间分布的感染病原菌及死亡风险分析鲜有报道。因此,有必要在肾移植人群中确定感染发生的流行病学情况,以便个体化的定制免疫抑制、抗感染预防方案和规划监测方案,达到最好的经济效益比。
本研究结果显示,肾移植术后感染率为36.5%,最常见的感染是肺部感染,占53.1%,其次为泌尿道感染(25.5%)和血流感染(7.6%),肺部感染检出菌主要为细菌,其次为真菌和病毒。受种族和地域的影响,不同地区的主要感染部位略有差异。在欧美国家以泌尿系统感染为主[3, 16],但印度等亚洲国家的相关资料则显示其以肺部感染为主[15, 17-18],这可能与地区人口密度高,社区中总体感染暴露程度较高有关。另外,手术切口感染占6.9%,与既往报道一致[19],除了与患者本身的免疫抑制状态有关,也反映了手术及术后护理水平。
本研究结果显示,移植后感染病原体有一定时间分布规律,革兰阳性菌在早期感染患者中检出率高,以表皮葡萄球菌和溶血葡萄球菌多见,术后1个月以上革兰阳性菌检出率减少,革兰阴性菌感染所占比例增多(常见病原菌为肺炎克雷伯菌、大肠埃希菌),移植后中晚期细菌感染较早期减少,机会性感染增加,以PCP感染、CMV感染及BK病毒感染为主。其原因可能在于早期感染与医院感染或供体预先存在感染有关,并且该院肾移植术后使用第三代头孢或喹诺酮类抗菌药物预防感染,在早期减少了革兰阴性菌感染的发生。1个月以后患者多数已出院居家,处于免疫稳定期,面临着社区获得性感染的风险。研究[14]表明移植后感染的发生时间是相对可预测的。许多因素影响感染发生的时间,如预先存在的感染、抗菌药物的预防使用和免疫状态[7],本研究中大多数机会性感染发生在移植后3个月以上,感染时间较前时间表有所推迟,可能与近年来预防策略的优化有关[20-21]。尽管大部分患者常规预防性使用复方磺胺甲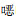
本研究队列中的病死率为12.6%,与之前的研究在10.5%~20%的范围内相当[5]。肺部感染为死亡最常见病因。本研究结果显示肾功能延迟恢复是肾移植患者死亡的独立危险因素,血清ALB水平高为保护性因素。发生肾功能延迟恢复的患者死亡风险增加3.479倍。年龄、性别、糖尿病、死亡供体移植、诱导免疫抑制剂的类型,这些已被报道的移植后感染高危因素在生存组与死亡组中无明显差异。关于引起肾功能延迟恢复的原因很多[17],与冷缺血时间、缺血再灌注后严重的急性肾小管坏死、肾单位破坏有关[29];本研究中的患者大部分接受的是尸体供肾,供肾质量具有复杂性,且受者在移植术中应用诱导免疫抑制剂,有研究[30]表明如果在移植肾功能建立之前,使用细胞因子释放诱导治疗和(或)环孢素治疗可能会进一步加剧严重急性肾小管坏死的发展,从而导致移植肾功能的损伤。本研究中急性排斥反应在单因素分析中与患者的死亡相关,但多因素分析中却不是死亡的独立危险因素,提示患者的急性排斥可能存在其他协同因素作用,例如肾功能延迟恢复可能会增加抗体介导的排斥风险和加速排斥的发展[31]。大剂量糖皮质激素冲击治疗或者强化免疫抑制治疗,虽有利于恢复肾脏功能,却增加受者的感染风险。随着器官短缺导致的边缘肾使用增多,肾功能延迟恢复对患者和移植物预后的影响可能会扩大,降低移植肾存活率、增加病死率及再入院率。因此,缩短移植肾的冷缺血时间,做好移植物保存,掌握好诱导期药物的使用时机,能够减少移植肾损伤和炎症,延迟抗体介导的排斥反应,改善移植结局。
血清ALB是肾病患者营养状态的可靠标志,并与长期预后密切相关[32]。患者出现低血清ALB水平时,往往是营养不良和炎症的潜在反应[33],同时血清ALB降低会导致局部组织和器官氧供应相对减少,且患者免疫力和抵抗力均明显降低,从而促进继发性感染[34-35]。因此,肾移植术后的血清ALB水平变化应引起相关医护人员的重视,以便有效地管理临床风险,降低患者的病死率。
因本研究为单中心的回顾性研究,仅反映该机构患者的病原学特点,并且未能系统分析特定感染事件对肾移植结局的影响。接下来,将继续扩大样本量,对研究人群进行再分组,探讨不同病原菌感染的危险因素及临床特点,为有效预防感染、降低病死率提供依据。
综上所述,常见的肾移植术后感染的发生时间及病原体分布有一定的规律,对比既往的时间表,病原体时间模式有所改变。可根据移植后不同时间段,选择合适的抗感染药物。肺部感染是导致感染相关死亡的最常见原因。PCP等导致的机会性感染,是感染相关死亡事件的主要病原体。临床需重点关注发生肾功能延迟恢复的患者及监测患者术后血清ALB水平变化。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Mills KT, Xu Y, Zhang WD, et al. A systematic analysis of worldwide population-based data on the global burden of chronic kidney disease in 2010[J]. Kidney Int, 2015, 88(5): 950-957. DOI:10.1038/ki.2015.230 |
| [2] |
Martin-Gandul C, Mueller NJ, Pascual M, et al. The impact of infection on chronic allograft dysfunction and allograft survival after solid organ transplantation[J]. Am J Transplant, 2015, 15(12): 3024-3040. DOI:10.1111/ajt.13486 |
| [3] |
Sousa SRD, Galante NZ, Barbosa DA, et al. Incidence of infectious complications and their risk factors in the first year after renal transplantation[J]. J Bras Nefrol, 2010, 32(1): 75-82. |
| [4] |
Kosmadakis G, Daikos GL, Pavlopoulou ID, et al. Infectious complications in the first year post renal transplantation[J]. Transplant Proc, 2013, 45(4): 1579-1583. DOI:10.1016/j.transproceed.2012.10.047 |
| [5] |
Gopalakrishnan V, Agarwal SK, Aggarwal S, et al. Infection is the chief cause of mortality and non-death censored graft loss in the first year after renal transplantation in a resource limited population: A single centre study[J]. Nephrology (Carlton), 2019, 24(4): 456-463. DOI:10.1111/nep.13401 |
| [6] |
Chelala L, Kovacs CS, Taege AJ, et al. Common infectious complications of liver transplant[J]. Cleve Clin J Med, 2015, 82(11): 773-784. DOI:10.3949/ccjm.82a.14118 |
| [7] |
Agrawal A, Ison MG, Danziger-Isakov L. Long-term infectious complications of kidney transplantation[J]. Clin J Am Soc Nephrol, 2022, 17(2): 286-295. DOI:10.2215/CJN.15971020 |
| [8] |
Illesy L, Szabo-Pap M, Toth F, et al. Bacterial infections after kidney transplantation: a single-center experience[J]. Transplant Proc, 2016, 48(7): 2540-2543. DOI:10.1016/j.transproceed.2016.07.011 |
| [9] |
van Delden C, Stampf S, Hirsch HH, et al. Burden and timeline of infectious diseases in the first year after solid organ transplantation in the Swiss transplant cohort study[J]. Clin Infect Dis, 2020, 71(7): e159-e169. DOI:10.1093/cid/ciz1113 |
| [10] |
中华医学会器官移植学分会. 中国公民逝世后器官捐献流程和规范(2019版)[J]. 器官移植, 2019, 10(2): 122-127. Branch of Organ Transplantation of Chinese Medical Association. Process and specification of Chinese donation after citizen's death (2019 edition)[J]. Organ Transplantation, 2019, 10(2): 122-127. DOI:10.3969/j.issn.1674-7445.2019.02.003 |
| [11] |
中华医学会器官移植学分会, 中国医师协会器官移植医师分会. 中国肾移植受者免疫抑制治疗指南(2016版)[J]. 器官移植, 2016, 7(5): 327-331. Organ Transplantation Branch of Chinese Medical Association, Organ Transplantation Physicians Branch of the Chinese Medical Association. Immunosuppressive therapy guidelines for Chinese kidney transplant recipients (2016)[J]. Organ Transplantation, 2016, 7(5): 327-331. DOI:10.3969/j.issn.1674-7445.2016.05.001 |
| [12] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. Ministry of Health, PRC. Diagnostic criteria for nosocomial infections (proposed)[J]. National Medical Journal of China, 2001, 81(5): 314-320. DOI:10.3760/j:issn:0376-2491.2001.05.027 |
| [13] |
Riccardi N, Rotulo GA, Castagnola E. Definition of opportuni-stic infections in immunocompromised children on the basis of etiologies and clinical features: a summary for practical purposes[J]. Curr Pediatr Rev, 2019, 15(4): 197-206. DOI:10.2174/1573396315666190617151745 |
| [14] |
Fishman JA, Rubin RH. Infection in organ-transplant reci-pients[J]. N Engl J Med, 1998, 338(24): 1741-1751. DOI:10.1056/NEJM199806113382407 |
| [15] |
Jiang T, Xue F, Zheng X, et al. Clinical data and CT findings of pulmonary infection caused by different pathogens after kidney transplantation[J]. Eur J Radiol, 2012, 81(6): 1347-1352. DOI:10.1016/j.ejrad.2011.03.070 |
| [16] |
Snyder JJ, Israni AK, Peng Y, et al. Rates of first infection following kidney transplant in the United States[J]. Kidney Int, 2009, 75(3): 317-326. DOI:10.1038/ki.2008.580 |
| [17] |
Mangalgi S, Madan K, Das CJ, et al. Pulmonary infections after renal transplantation: a prospective study from a tropical country[J]. Transpl Int, 2021, 34(3): 525-534. DOI:10.1111/tri.13817 |
| [18] |
Kara S, Sen N, Kursun E, et al. Pneumonia in renal transplant recipients: a single-center study[J]. Exp Clin Transplant, 2018, 16(Suppl 1): 122-125. |
| [19] |
Abbo LM, Grossi PA, AST ID Community of Practice. Surgical site infections: guidelines from the American Society of Transplantation Infectious Diseases community of practice[J]. Clin Transplant, 2019, 33(9): e13589. |
| [20] |
Martin-Gandul C, Stampf S, Héquet D, et al. Preventive strategies against cytomegalovirus and incidence of α-herpesvi-rus infections in solid organ transplant recipients: a nationwide cohort study[J]. Am J Transplant, 2017, 17(7): 1813-1822. DOI:10.1111/ajt.14192 |
| [21] |
Brakemeier S, Pfau A, Zukunft B, et al. Prophylaxis and treatment of Pneumocystis jirovecii pneumonia after solid organ transplantation[J]. Pharmacol Res, 2018, 134: 61-67. DOI:10.1016/j.phrs.2018.06.010 |
| [22] |
White PL, Backx M, Barnes RA. Diagnosis and management of Pneumocystis jirovecii infection[J]. Expert Rev Anti Infect Ther, 2017, 15(5): 435-447. DOI:10.1080/14787210.2017.1305887 |
| [23] |
Pegorie M, Denning DW, Welfare W. Estimating the burden of invasive and serious fungal disease in the United Kingdom[J]. J Infect, 2017, 74(1): 60-71. DOI:10.1016/j.jinf.2016.10.005 |
| [24] |
Bartlett MS, Vermund SH, Jacobs R, et al. Detection of Pneumocystis carinii DNA in air samples: likely environmental risk to susceptible persons[J]. J Clin Microbiol, 1997, 35(10): 2511-2513. DOI:10.1128/jcm.35.10.2511-2513.1997 |
| [25] |
Hosseini-Moghaddam SM, Krishnan RJ, Guo H, et al. Cytomegalovirus infection and graft rejection as risk factors for Pneumocystis pneumonia in solid organ transplant recipients: a systematic review and Meta-analysis[J]. Clin Transplant, 2018, 32(8): e13339. DOI:10.1111/ctr.13339 |
| [26] |
Muhammad Iqbal AH, Lim SK, Ng KP, et al. Pneumocystis jirovecii pneumonia 13 years post renal transplant following a recurrent cytomegalovirus infection[J]. Transpl Infect Dis, 2012, 14(4): E23-E26. DOI:10.1111/j.1399-3062.2012.00738.x |
| [27] |
Harari A, Zimmerli SC, Pantaleo G. Cytomegalovirus (CMV)-specific cellular immune responses[J]. Hum Immunol, 2004, 65(5): 500-506. DOI:10.1016/j.humimm.2004.02.012 |
| [28] |
Fishman JA, Gans H, AST Infectious Diseases Community of Practice. Pneumocystis jiroveci in solid organ transplantation: guidelines from the American Society of Transplantation Infectious Diseases Community of Practice[J]. Clin Transplant, 2019, 33(9): e13587. |
| [29] |
Ojo AO, Wolfe RA, Held PJ, et al. Delayed graft function: risk factors and implications for renal allograft survival[J]. Transplantation, 1997, 63(7): 968-974. DOI:10.1097/00007890-199704150-00011 |
| [30] |
Cole EH, Cattran DC, Farewell VT, et al. A comparison of rabbit antithymocyte serum and OKT3 as prophylaxis against renal allograft rejection[J]. Transplantation, 1994, 57(1): 60-67. DOI:10.1097/00007890-199401000-00012 |
| [31] |
Eerhart MJ, Reyes JA, Blanton CL, et al. Complement blocka-de in recipients prevents delayed graft function and delays an-tibody-mediated rejection in a nonhuman primate model of kidney transplantation[J]. Transplantation, 2022, 106(1): 60-71. DOI:10.1097/TP.0000000000003754 |
| [32] |
Uludag K, Boz G, Gunal AI. Lower serum albumin level is associated with increased risk of hospital admission and length of stay in hospital among incident hemodialysis patients by using overdispersed model[J]. Ther Apher Dial, 2021, 25(2): 179-187. DOI:10.1111/1744-9987.13552 |
| [33] |
柯小云, 童金英, 许继涛, 等. 老年脑梗死长期卧床患者医院感染细菌学及其风险预测模型[J]. 中华医院感染学杂志, 2022, 32(7): 994-998. Ke XY, Tong JY, Xu JT, et al. Bacteriology of nosocomial infections and prediction model in elderly long-term bedridden patients with cerebral infarction[J]. Chinese Journal of Nosocomiology, 2022, 32(7): 994-998. |
| [34] |
Kotzé SR, Pedersen OB, Petersen MS, et al. Low-grade inflammation is associated with lower haemoglobin levels in healthy individuals: results from the Danish blood donor study[J]. Vox Sang, 2016, 111(2): 144-150. DOI:10.1111/vox.12396 |
| [35] |
Srivastava A, Bodnar J, Osman F, et al. Serum albumin level before kidney transplant predicts post-transplant BK and possibly cytomegalovirus infection[J]. Kidney Int Rep, 2020, 5(12): 2228-2237. DOI:10.1016/j.ekir.2020.09.012 |



