慢性肾脏病(chronic kidney disease, CKD)是我国重要的公共健康问题,流行率约为10.8%,据此推算,我国成人CKD患者约1.2亿[1]。根据肾小球滤过率估算值(estimated glomerular filtration rate, eGFR),CKD可分为1~5期[2]。CKD患者免疫功能低下,易受细菌、病毒和其他病原体感染,丙型肝炎病毒(hepatitis C virus, HCV)感染在CKD人群中更为高发,血液透析等高危因素进一步增加了HCV感染的风险。一旦感染HCV,长期慢性感染可进一步导致肝硬化与肝癌,及时清除HCV的抗病毒治疗可阻止疾病进展并降低远期并发症发生率。近年来,直接抗病毒药物(direct-acting antiviral agent, DAA)问世并广泛应用于临床,泛基因型DAA方案在已知主要基因型和主要基因亚型的HCV感染患者中都能达到90%以上的持续病毒学应答(sustained virological response,SVR),并且安全性良好,药物相互作用较少。
为帮助我国临床医生掌握CKD患者合并HCV感染的筛查、诊断、治疗和预防,我们邀请肾脏病、感染病、肝病和感控专家组成指南编写委员会。自2022年7月开始,专家组在2019年版专家共识基础上[3],对CKD患者合并HCV感染的诊断、治疗和预防进行证据检索和评价,证据检索截止时间为2022年8月。证据来源:检索PubMed、Embase、Cochrane Library、Web of Science、万方、中国知网及中国生物医学文献数据库发表的英文和中文文献,严格遵循世界卫生组织指南制订手册和美国医学研究所制定临床实践指南的定义,采用推荐评估、制定及评价分级方法(grading of recommendations assessment, development and evaluation, GRADE)对证据质量及推荐意见进行分级(表 1),并按照医疗保健实践指南报告规则(reporting items for practice guidelines in healthcare, RIGHT)进行报告。
| 表 1 推荐等级和证据级别 |
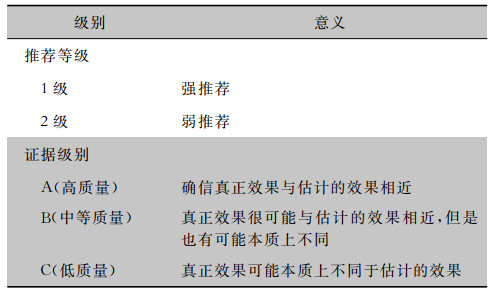
|
推荐意见采用专家一致性原则,通过制订GRADE决策表,并组织德尔菲法调查和多轮讨论达成对推荐意见的共识。指南编写专家组历时3个月,经过3轮讨论和修改,最终形成目前的临床实践指南。本指南可供肾脏病科、感染科和医院感控科医生在临床实践中参考,并已在国际实践指南注册平台进行注册(注册号:PREPARE-2022CN780)。
1 HCV病原学及其流行病学特点HCV属于黄病毒科肝炎病毒属,传播途径以血液传播为主。HCV尚无有效疫苗预防,只能通过对高危人群的筛查、治疗、管理,切断传播途径和及时治疗减少HCV的传播。HCV基因易变异,目前分为6个基因型及多个亚型。在我国HCV基因型分布与地域相关,基因1型和2型较为常见,其次为3型和6型,基因4型和5型罕见[4]。
HCV暴露后1~3周外周血可检测到HCV RNA,3个月后约90%患者可出现抗-HCV抗体,部分患者可出现自发性病毒清除[5]。病毒清除后,抗-HCV仍可阳性。病毒血症持续6个月以上可诊断为慢性HCV感染,HCV感染慢性化率为55%~85%。HCV感染进展多缓慢,感染后20年肝硬化发生率为5%~15%[6-8],感染后30年肝细胞癌(hepatocellular carcinoma, HCC)发生率为1%~3%。一旦进展为肝硬化,HCC年发生率为2%~4%[9]。肝硬化和HCC是慢性丙型肝炎患者的主要死因。肝硬化患者10年生存率约为80%,如出现肝功能失代偿,10年生存率仅为25%。HCC在诊断后的第一年,死亡可能性为33%[10]。
为减少HCV感染的危害,世界卫生组织(WHO)倡议到2030年在全球清除HCV感染,我国政府也作出了相同的要求。由于血液透析目标患者明确,治疗药物可及,医疗费用医保可付,因此,提出到2025年底在我国血液透析患者中清除HCV感染(Zero by 2025)。清除HCV感染将杜绝透析中心急性丙型肝炎暴发事件,消除丙型肝炎对血液透析患者健康的威胁,提高场地和设备使用效益,提升透析患者生命质量。
2 CKD患者合并HCV感染的筛查与诊断•推荐对所有CKD患者进行抗-HCV检测(1A)。
•抗-HCV阳性患者,应进行HCV RNA定量检测,以明确是否为现症感染(1A)。
2.1 CKD患者合并HCV感染的筛查CKD患者应常规进行HCV筛查,主要原因在于:①未进行透析治疗的CKD患者中HCV感染率高于普通人群[11-12];②HCV感染是发生CKD的高危因素[13];③合并HCV感染加速CKD患者疾病进展[14-15]。
抗-HCV检测可用于CKD患者合并HCV感染的筛查。但是,一些自身免疫性疾病患者可能出现抗-HCV假阳性;血液透析和免疫功能缺陷或抑制者可能出现抗-HCV假阴性;急性丙型肝炎患者可因为处于窗口期出现抗-HCV阴性;HCV自发或治疗后清除,抗-HCV仍可能持续阳性。因此,HCV RNA检测是HCV现症感染的确诊方法,也可用于高感染率或高感染风险人群的筛查。抗-HCV与HCV RNA检测结果解读见表 2。
| 表 2 抗-HCV和HCV RNA检测结果及临床意义 |
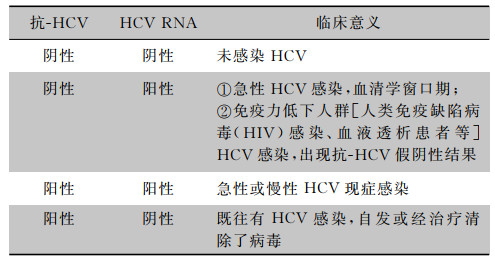
|
① 流行病学史:就诊前6个月以内有明确的流行病学史,如输血史、应用血液制品史、不安全注射等其他明确的血液暴露史及有创检查。②临床表现:多数患者发病隐匿,无明显临床症状;可有全身乏力、食欲减退、恶心和右季肋部疼痛等;少数伴低热,黄疸,轻度肝大,部分患者可出现脾大。③实验室检查:有明确的6个月内抗-HCV和/或HCV RNA检测阳性,伴或不伴肝功能异常。具有上述①+②+③或②+③者可诊断急性丙型肝炎。
2.2.2 慢性丙型肝炎诊断标准HCV感染超过6个月,或有6个月以前的流行病学史,或感染日期不明;抗-HCV及HCV RNA阳性,肝组织病理学检查符合慢性肝炎;或根据症状、体征、实验室及影像学检查结果综合分析,亦可诊断慢性丙型肝炎。
3 CKD患者合并HCV感染的治疗目标•所有HCV RNA阳性的CKD患者,应接受DAA治疗(1A)。
•抗病毒治疗终点是SVR,定义为治疗结束后12或24周,采用敏感检测方法(检测下限≤15 IU/mL)检测不到HCV RNA(SVR12或24)(1A)。
CKD患者合并HCV感染的抗病毒治疗目标是清除HCV,获得治愈,清除或减轻HCV相关肝损伤和肾脏等肝外脏器损伤,阻止肝脏疾病进展为肝硬化或HCC,减缓肾脏疾病进展,从而提高患者的长期生存率,改善患者的生活质量,并预防HCV传播[16-17]。
长期随访研究提示,SVR是HCV治愈的可靠替代终点[18]。SVR12或24是指在抗病毒治疗结束后12或24周,采用敏感检测方法(检测下限≤15 IU/mL)检测不到HCV RNA。SVR12和SVR24的一致性高达99%以上[19]。
国际指南推荐的DAA均已在我国上市,目前国内治疗HCV感染的主要治疗方案见表 3。结合临床研究和真实世界研究结果,DAA方案在普通人群中具有良好的疗效和安全性。部分DAA方案在CKD患者(包括血液透析或肾移植术后患者)均有临床研究数据,但在实际临床应用中仍需要多学科合作完成诊治。在CKD患者中尚无临床研究数据的DAA方案,暂未列入治疗推荐。
| 表 3 目前国内治疗丙型肝炎的主要直接抗病毒方案 |
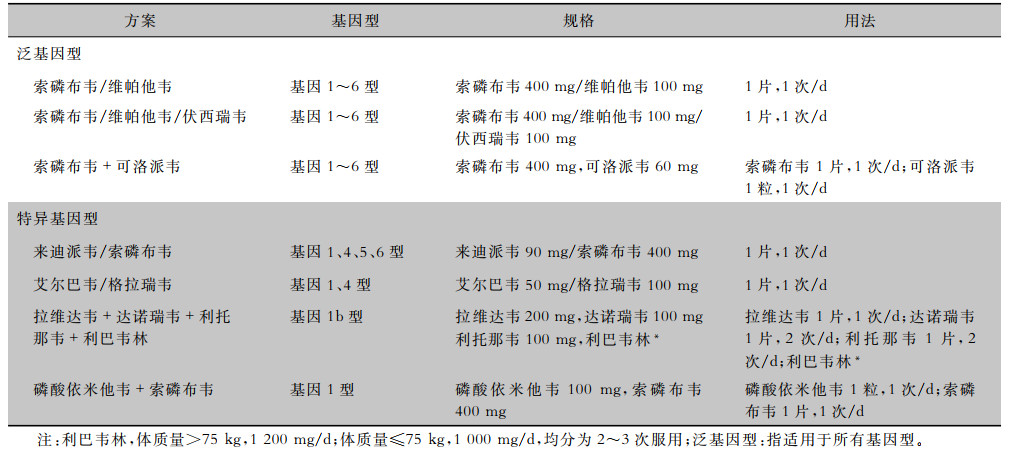
|
•CKD患者在进行HCV抗病毒治疗前,需评估肝脏疾病的严重程度、肾功能及电解质、HCV RNA定量检测、HCV基因型、HBV血清学指标、合并疾病与合并用药情况(1B)。
4.1 肝脏疾病的评估 4.1.1 实验室检查① 血常规;②凝血功能;③肝肾功能;④电解质。
4.1.2 肝纤维化无创诊断① 瞬时弹性成像(transient elastography,TE):对慢性丙型肝炎肝纤维化分期的诊断较为可靠,对肝硬化诊断更准确。肝硬度测定值(LSM)≥14.6 kPa诊断为肝硬化,LSM < 9.3 kPa可排除肝硬化;LSM≥9.3 kPa可诊断进展性肝纤维化,LSM < 7.3 kPa排除进展性肝纤维化[16, 20]。②APRI评分:为天冬氨酸转氨酶(AST)和血小板(PLT)比率指数[APRI=AST(/ULN)÷PLT(×109/L)×100],可用于肝硬化的评估,简单易行,但灵敏度和特异度不高[21]。成人APRI评分>2,预示患者已经发生肝硬化。
4.1.3 影像学检查① 腹部超声检查:是肝脏检查最常用方法,可判断肝脏和脾脏大小和形态、肝内重要血管情况及肝内有无占位性病变。②电子计算机断层成像(CT):是肝脏病变诊断和鉴别诊断的重要影像学检查方法,用于观察肝脏形态,了解有无肝硬化,及时发现占位性病变和鉴别其性质,动态增强多期扫描对于HCC的诊断具有高灵敏度和特异度。③磁共振成像(MRI):组织分辨率高,可以多方位、多序列成像,对肝组织结构变化如出血坏死、脂肪变性及肝内结节的显示和分辨率优于CT和超声。动态增强多期扫描及特殊增强剂显像对鉴别良恶性肝内占位病变优于CT。
4.1.4 Child-Pugh评分对肝硬化患者肝脏储备功能进行量化评估的分级标准(表 4)。代偿期肝硬化一般为A级(总分5~6分),失代偿期肝硬化一般为B级(总分7~9分)或C级(总分≥10分)。
| 表 4 Child-Pugh分级标准 |
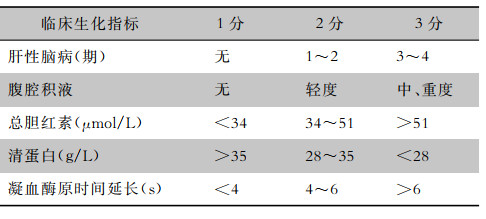
|
RNA定量检测和HCV基因型
4.2.1 HCV RNA定量检测适用于HCV现症感染的确定,抗病毒治疗前基线病毒载量分析,以及治疗结束后的应答评估。
4.2.2 HCV基因型如果泛基因型DAA方案不可及,采用基因型特异性DAA方案治疗的感染者,需要先检测基因型。
4.3 HBV血清学检查HBV血清学标志物包括HBsAg、抗-HBs、HBeAg、抗-HBe和抗-HBc。HBsAg阳性患者建议在抗-HCV治疗前进行HBV DNA定量检测。
4.4 药物相互作用(drug-drug interaction,DDI)DDI是启动抗病毒治疗前需要考虑的一个重要因素,可查阅关于药物相互作用的在线资源(http://www.hep-druginteractions.org),停用与DAA有相互作用的合并用药,或者转换为具有较少相互作用的合并用药[22]。
CKD患者合并HCV感染的诊疗流程见图 1。
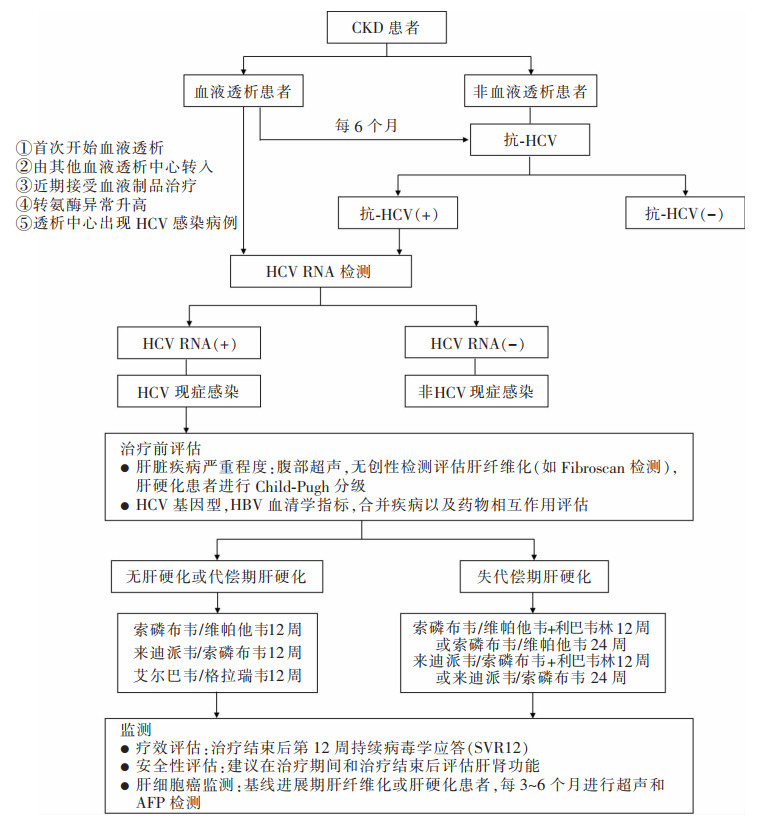 |
| 注:CKD:慢性肾脏病;HCV:丙型肝炎病毒;代偿期肝硬化:Child-Pugh A级;失代偿期肝硬化:Child-Pugh B或C级;AFP:甲胎蛋白。 图 1 CKD患者合并HCV感染的诊疗流程 |
•推荐用于CKD G1~5期患者的抗病毒方案:索磷布韦/维帕他韦(HCV基因1~6型),来迪派韦/索磷布韦(HCV基因1、4、5、6型),艾尔巴韦/格拉瑞韦(HCV基因1、4型),治疗剂量与普通人群相同,无需调整(1A)。
•不推荐CKD G4~5期HCV感染患者使用含利巴韦林的治疗方案(1A)。
5.1 索磷布韦/维帕他韦(sofosbuvir/velpatasvir,SOF/VEL)每片复合片剂含索磷布韦400 mg及维帕他韦100 mg,1片/d,治疗基因1~6型初治或者干扰素方案经治患者,无肝硬化或代偿期肝硬化疗程12周;针对基因3型代偿期肝硬化可考虑延长疗程至24周或联合利巴韦林12周;失代偿期肝硬化患者建议疗程24周或联合利巴韦林12周[16]。
索磷布韦是非结构蛋白5B(NS5B)依赖性RNA聚合酶抑制剂,主要经肾脏排泄[23]。维帕他韦是非结构蛋白5A(NS5A)抑制剂,主要通过肝脏代谢[24]。索磷布韦/维帕他韦用于CKD G1~5期及透析患者,无需调整剂量。CKD G1~3期HCV患者接受索磷布韦为基础治疗方案,eGFR保持稳定,肾脏相关不良事件发生率低[25-26]。CKD G4~5D期HCV基因1~6型患者接受索磷布韦/维帕他韦治疗,SVR12率为95%~96.8%,安全性及耐受性良好[27-31]。
5.2 来迪派韦/索磷布韦(ledipasvir/sofosbuvir,LDV/SOF)每片复合片剂含索磷布韦400 mg和来迪派韦90 mg,1片/d。治疗基因1、4、5、6型初治或干扰素经治患者。无肝硬化或代偿期肝硬化患者疗程12周,失代偿期肝硬化患者建议疗程24周或联合利巴韦林12周[16]。
来迪派韦是NS5A抑制剂,主要通过肝脏代谢[32]。来迪派韦/索磷布韦用于CKD G1~5期及透析患者,无需调整剂量。CKD G1~3期HCV患者接受索磷布韦为基础治疗方案,eGFR保持稳定,肾脏相关不良事件发生率低[25-26]。CKD G4~5D期HCV基因1、4、5、6型患者接受来迪派韦/索磷布韦治疗,SVR12率为94%~100%,安全性及耐受性良好[33-35]。
5.3 艾尔巴韦/格拉瑞韦(grazoprevir/elbasvir,GZR/EBR)每片复合片剂含艾尔巴韦50 mg和格拉瑞韦100 mg,1片,1次/日,治疗基因1、4型初治或干扰素经治患者。基因1a或4型无肝硬化,初治患者疗程12周,干扰素经治患者疗程16周;基因1b型无肝硬化或代偿期肝硬化患者,疗程12周[16]。
艾尔巴韦是NS5A抑制剂,主要通过肝脏代谢。格拉瑞韦是NS3/4A蛋白酶抑制剂,主要通过肝脏代谢[36]。肝功能失代偿(Child B级或C级)或既往曾有肝功能失代偿病史患者,不推荐使用含NS3/4A蛋白酶抑制剂的方案,因其血药浓度升高且缺乏安全性数据[37]。
艾尔巴韦/格拉瑞韦用于CKD G1~5期及透析患者,均无需调整剂量。CKD G4~5D期HCV基因1、4型患者接受艾尔巴韦/格拉瑞韦治疗,SVR12率为94.6%~100%,安全性及耐受性良好[38-42]。
5.4 可洛派韦(Coblopasvir)联合索磷布韦可洛派韦60 mg联合索磷布韦400 mg,1次/日,可用于治疗基因1、2、3、6型HCV感染者,但在CKD患者中尚无研究数据。
6 CKD合并HCV感染的特殊人群•对于CKD合并HBV/HCV共感染的患者,如HBsAg阳性,建议在DAA治疗期间和治疗后3个月联合恩替卡韦或丙酚替诺福韦治疗,如HBsAg阴性但抗-HBc阳性,建议治疗期间和治疗后3个月监测HBsAg和HBV DNA(2C)。
•对于干扰素经治的CKD合并HCV感染患者,推荐使用索磷布韦/维帕他韦(基因1~6型)、来迪派韦/索磷布韦(基因1、4、5、6型)或者格拉瑞韦/艾尔巴韦(基因1b型)治疗,治疗剂量与普通人群相同,无需调整(1A)。
•对于DAA经治的CKD合并HCV感染患者,建议使用索磷布韦/维帕他韦/伏西瑞韦(基因1~6型)治疗,治疗剂量与普通人群相同,无需调整(2C)。
•对于CKD合并急性丙型肝炎患者,推荐使用索磷布韦/维帕他韦(基因1~6型)、来迪派韦/索磷布韦(基因1、4、5、6型)或者格拉瑞韦/艾尔巴韦(基因1、4型)治疗,疗程12周(1B)。
6.1 HBV/HCV共感染HCV合并HBV感染时,患者HBV DNA多处于低复制水平或低于检测值,而HCV多为肝病进展的主要原因。HBV/HCV合并感染者的抗HCV治疗方案和治疗原则与单一HCV感染者相同。如果CKD患者符合HBV抗病毒治疗指征,可考虑予以恩替卡韦或丙酚替诺福韦抗HBV治疗[16]。HBsAg阳性患者在治疗HCV过程中,有HBV再激活风险。因此,在DAA治疗期间和治疗后3个月内,联合恩替卡韦或丙酚替诺福韦预防HBV再激活,停药后仍需密切监测[43-45]。对于HBsAg阴性、抗-HBc阳性患者,DAA治疗后发生HBV再激活风险低[46],可监测血清HBsAg和HBV DNA水平,如HBsAg和HBV DNA转阳,则需开始恩替卡韦或丙酚替诺福韦抗HBV治疗。
6.2 经治患者的再治疗经过规范聚乙二醇干扰素α联合利巴韦林抗病毒治疗,仍有部分患者不能获得SVR,定义为干扰素经治患者。干扰素经治患者采用DAA治疗方案与初治患者相同。患者经过规范的DAA抗病毒治疗后未获得SVR,定义为DAA经治患者。DAA经治、无肝硬化或代偿期肝硬化患者可考虑索磷布韦/维帕他韦/伏西瑞韦(SOF/VEL/VOX)治疗12周[16-17, 47]。DAA经治的失代偿期肝硬化或有失代偿病史患者禁用蛋白酶抑制剂,可考虑索磷布韦/维帕他韦(SOF/VEL)治疗,同时加用利巴韦林治疗24周[16-17]。
6.3 急性丙型肝炎急性丙型肝炎患者往往临床症状轻微,感染明确时间很难确定,但由于慢性化率高达55%~85%,因此对于这类患者应积极处理。HCV感染风险高的人群,如血液透析患者等一旦出现急性丙型肝炎聚集性病例,推荐立即启动抗病毒治疗并采取相应感染控制措施。尽管对于急性丙型肝炎患者,多个小样本研究采用短疗程DAA治疗方案(6周或8周),SVR率为77%~100%[48-52],但鉴于目前证据尚不充分,推荐对此类患者疗程为12周[47]。
7 抗病毒治疗中的监测与随访•CKD患者在DAA治疗过程中应对肝、肾功能和HCV RNA应答情况进行监测。推荐治疗前基线、治疗4周、治疗结束时、治疗结束后12周评估肝肾功能、HCV RNA定量检测(1B)。
•对于有进展期肝纤维化或肝硬化的患者,无论是否获得SVR,建议每3~6个月复查一次腹部超声和甲胎蛋白(1B)。
CKD患者在抗病毒治疗过程中应进行疗效监测和安全性监测。疗效监测主要是检测HCV RNA,应采用灵敏度高的实时定量PCR试剂(检测下限 < 15 IU/mL),如果高敏的HCV RNA检测不可及,可使用非高敏HCV RNA检测。建议在治疗前基线、治疗第4周、治疗结束时、治疗结束后12或24周检测HCV RNA。安全性检测包括临床不良反应的观察,以及在治疗前基线、治疗第4周、治疗结束时、治疗结束后12或24周进行肝功能和肾功能监测[16]。
基线存在进展期肝纤维化及肝硬化患者,清除HCV可降低肝硬化失代偿和HCC的发生率,但不能完全避免HCC的发生。因此,对于进展期肝纤维化和肝硬化患者,无论抗病毒治疗是否获得SVR,均应该每3~6个月复查一次腹部超声和血清甲胎蛋白,筛查HCC的发生[16]。
8 血液透析中心HCV感染的治疗与管理 8.1 血液透析中心的HCV筛查•CKD G5期患者,包括围透析期以及血液透析患者,推荐每6个月进行抗-HCV检测,如抗-HCV阳性患者,应进行HCV RNA定量检测,如确诊HCV现症感染,推荐积极进行DAA治疗(1A)。
•血液透析患者在以下情况时推荐进行HCV RNA定量检测:①首次开始血液透析前;②由其他血液透析中心转入时;③近期接受血液制品治疗;④转氨酶异常升高;⑤透析中心出现HCV感染病例(1A)。
血液透析患者是HCV感染的主要高危人群之一,其感染风险随透析时间延长逐年上升[53-54]。随着我国医院感染防控管理的日趋严格和专业化,血液透析患者中的HCV流行率和新发感染率也有所下降。在透析预后与实践模式研究(Dialysis Outcomes and Practice Patterns Study, DOPPS)中国队列中,HCV抗体阳性率在DOPPS 4期(2009—2011年)、5期(2012—2015年)和7期(2019—2021年)中分别为14.8%、11.5%、7.4%,新发HCV感染率在DOPPS 5期和7期中分别为2.1/100患者年、1.2/100患者年[55]。尽管血液透析患者中HCV抗体阳性率已明显降低,但是仍明显高于普通人群。同时,血液透析中心急性HCV感染暴发事件仍有报道,2008—2019年我国共报道12起HCV感染暴发事件[56]。
HCV筛查是科学防控HCV在透析单元内传播的关键环节之一。对于CKD G5期患者,应积极筛查HCV,力争在进入血液透析治疗前清除病毒。由于抗-HCV检测本身的局限性,血液透析患者可能出现抗-HCV假阴性,抗-HCV无法鉴别既往感染和现症感染,因此对于血液透析患者,采用HCV RNA检测是更为精准的筛查和诊断方法[57-58]。如果高敏的HCV RNA检测不可及,可使用非高敏HCV RNA检测替代。
8.2 血液透析患者HCV感染的治疗•血液透析患者,一旦发现HCV RNA阳性,推荐立即启动抗病毒治疗(1A)。
血液透析合并HCV感染者疾病负担重、预后较差,全因死亡风险和肝病相关死亡风险分别是非感染者的1.4、3.8倍[59]。因此,无论从患者还是公共卫生角度,临床都应积极对透析HCV感染者进行抗病毒治疗。随着直接抗病毒药物的问世和普及,多种DAA方案已在CKD G4~5D期患者中证实良好的疗效和安全性。索磷布韦/维帕他韦方案用于CKD G4~5D期HCV基因1~6型患者,SVR12率为95%~96.8%[27-31]。CKD G4~5D期HCV基因1、4、5、6型患者接受来迪派韦/索磷布韦治疗,SVR12率为94%~100%[33-35]。CKD G4~5D期HCV基因1、4型患者接受艾尔巴韦/格拉瑞韦治疗,SVR12率为94.6%~100%[38-42]。
8.3 血液透析中心预防HCV传播的质量控制和管理•血液透析中心应严格遵照《血液净化标准操作规程(2021版)》的感染控制标准操作流程(1A)。
•HCV现症感染的血液透析患者,在接受DAA治疗结束时,治疗结束后12周以及治疗结束后24周进行高敏的HCV RNA检测(检测下限为≤15 IU/mL),3次检测HCV RNA均检测不到后可进入普通透析室/区进行透析(2C)。
•HCV既往感染的血液透析患者(抗-HCV阳性,但HCV RNA阴性或低于检测下限),建议连续3次进行高敏的HCV RNA检测(检测下限为≤15 IU/mL),每次间隔12周,3次检测HCV RNA均检测不到后可进入普通透析室/区进行透析(2C)。
国内外指南在对HCV感染患者在血液透析中心是否需要隔离专机透析,目前尚有分歧。改善全球肾脏病预后组织(KDIGO)坚持严格遵守清洁和消毒程序,不推荐抗-HCV阳性或HCV RNA阳性的患者隔离透析或者在专机上透析,并可以参与透析器复用程序[57]。我国目前对HCV RNA阳性的患者执行严格的分区分机隔离透析,并配备专门的护理车,护理人员相对固定,对丙型肝炎患者不得复用透析器[58]。
2018年,国家卫生健康委员会制定了HCV RNA检测结果阴转患者血液透析管理方案,明确指出HCV RNA持续阴性达6个月以上的患者,可安置于非隔离区进行透析[58]。基于对HCV感染者在DAA治疗后的大规模长期随访研究,超过99.5%的获得SVR24患者持续保持HCV RNA不可测[60-64]。在血液透析患者中,小样本的随访研究结果显示,获得SVR后随访长达3年,患者HCV RNA持续不可测[65-67]。
9 肾移植患者HCV感染的治疗和管理 9.1 肾移植受者HCV感染的抗病毒治疗时机•所有等待肾移植的HCV感染者推荐在移植前或移植后进行抗病毒治疗(1A)。
肾移植是终末期肾脏病(ESRD)患者最佳治疗选择[57]。无论是否合并HCV感染,接受肾移植的患者生存率均高于维持性透析患者[68-69]。HCV感染增加肾移植后死亡率、移植物排斥,以及糖尿病、心血管疾病、肝衰竭等并发症发生率。目前部分DAA方案已获批用于血液透析和肾移植术后患者,可有效清除HCV感染。对于肾移植术前接受DAA治疗获得SVR的患者,在移植术后也不会因为免疫抑制剂的使用而复发[70-71]。
HCV感染的抗病毒治疗时机(移植前或移植后),主要取决于等待移植时间[57]。如预期等待移植时间在24周内,可考虑在移植后进行DAA治疗。如预期等待移植时间超过24周,可考虑在移植前或移植后进行DAA治疗。此外,对于合并失代偿期肝硬化或严重门脉高压的肾移植受者,应考虑肝肾联合移植,在移植后接受DAA治疗。
9.2 HCV感染者供肾的使用•推荐对所有肾移植供者进行抗-HCV和HCV RNA检测(1A)。
•推荐HCV感染的供肾用于所有潜在的肾移植受者,无论受者是否感染HCV(1C)。
•HCV阴性受者接受HCV感染的供肾,应在移植术后尽早进行预防性抗病毒治疗(2C)。
HCV可通过器官移植发生传播。因此,对于所有器官捐献者均推荐进行HCV筛查。单纯的抗-HCV阳性不能诊断为HCV现症感染,应同时进行HCV RNA定量检测[57]。在2014年之前,由于HCV治疗药物有限,HCV感染的供肾只能用于HCV感染的受体。从2017年开始,多项研究评估了DAA治疗接受HCV阳性供肾移植的HCV阴性受者的疗效和安全性,其中样本数超过10例的研究共16项,总计525例患者,DAA治疗不仅可获得较高的HCV感染治愈率,SVR12率达97.7%,移植后1年的人肾存活率也高达98%[57]。在安全性方面,这些研究中报道3例移植后纤维淤胆性肝炎,均发生在移植后超过30 d才启动DAA治疗的患者[72-73]。因此,建议及早启动DAA治疗,但目前仍无充分证据确定DAA治疗的最佳启动时机。
9.3 肾移植患者HCV感染治疗方案•对于肾移植术后的HCV感染者以及接受HCV RNA阳性供肾的HCV阴性受者,推荐索磷布韦/维帕他韦(基因1~6型),来迪派韦/索磷布韦(基因1、4、5、6型),艾尔巴韦/格拉瑞韦(基因1、4型),治疗剂量与普通人群相同,无需调整(1A)。
索磷布韦/维帕他韦方案用于HCV阳性供体、HCV阴性受体的预防性抗病毒治疗,在小样本研究中,启动治疗时机从首次用药在肾移植术前2 h至肾移植术后1~2周,SVR12率100%[74-76]。肾移植术后HCV RNA(+)的患者接受来迪派韦/索磷布韦治疗,在多个队列研究中,SVR12率为95.4%~100%[77-79]。艾尔巴韦/格拉瑞韦方案用于HCV基因1型的肾移植患者,在小样本研究中,SVR12率为100%[80-83]。
针对肾移植受者,药物相互作用是选择DAA方案时需要考虑的一个重要因素,DAA与临床常用免疫抑制剂的药物相互作用见表 5[17]。
| 表 5 DAA与免疫抑制剂的药物相互作用 |
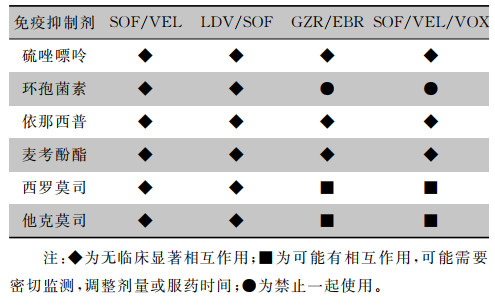
|
HCV感染与肾小球疾病之间存在相关性。免疫复合物介导肾小球肾炎是HCV感染常见的肝外表现,可伴或不伴混合型冷球蛋白血症血管炎的证据。HCV相关性肾小球肾炎(HCV-associated glomerulonephritis,HCV-GN),主要表现为蛋白尿和镜下血尿,伴或不伴有肾小球滤过率(GFR)下降。HCV-GN可伴或不伴明显肝病症状,并且在获得SVR患者中亦有新发或持续存在报道[84]。
10.1 HCV-GN临床及病理类型 10.1.1 混合型冷球蛋白血症肾小球肾炎(cryoglobulinemic glomerulonephritis, CGN)免疫复合物介导的膜增生性肾小球肾炎(membrano-proliferative glomerulonephritis, MPGN)是最常见的病理类型,通常见于Ⅱ型冷球蛋白血症患者。病理学检查中,光镜下可见肾小球呈分叶状伴“双轨征”形成,但与原发性MPGN不同,HCV-CGN特征性病理表现包括含冷球蛋白的免疫复合物在肾小球内沉积,通常见于内皮下,冷球蛋白亦可在毛细血管腔内沉积形成嗜酸性血栓样病变阻塞管腔。由于单核细胞和多形核白细胞浸润,肾小球细胞数显著增加,系膜细胞和基质增生,毛细血管内皮肿胀和基底膜分层;电镜可见大量内皮下沉积物,约30%的患者合并肾小动脉血管炎。病理学上这种大量毛细血管腔内血栓和血管炎在临床上常常表现为急进性肾炎综合征和快速进展性肾衰竭。
10.1.2 非冷球蛋白血症肾小球肾炎(non-cryoglobulinemic glomerulonephritis, nCGN)病理类型亦以MPGN常见,此外还有膜性肾病或其他病理类型。这些患者的临床和病理学表现与原发性肾小球疾病中的相同病理类型表现一致[85-86]。
10.2 肾活检的指征和时机在具有典型免疫复合物肾小球肾炎表现和GFR稳定的HCV感染患者,可以不进行肾活检直接给予DAA治疗,如果治疗后达到SVR但GFR或蛋白尿仍恶化,或考虑同时给予免疫抑制治疗时,应作肾活检。HCV感染患者临床表现不典型或呈现快速进展性肾小球肾炎、严重肾病综合征,应进行肾活检[57]。肾活检流程见图 2。
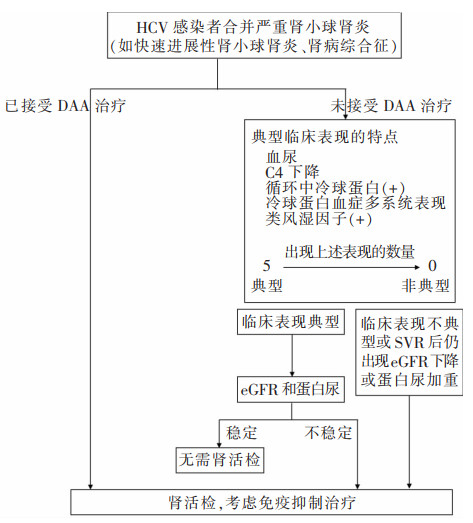 |
| 图 2 HCV感染合并严重肾小球肾炎的肾活检流程适应证 |
•所有HCV-GN患者均应接受抗病毒治疗(1A)。
•对于肾功能稳定和(或)伴有非肾病性蛋白尿的HCV-GN患者,采用DAA方案进行初始治疗(1C)。
•对于重度冷球蛋白血症或快速进展肾衰竭的HCV-GN患者,推荐DAA治疗的同时应用免疫抑制剂和(或)血浆置换治疗。肾病综合征应根据不同特征包括肾功能不全、病理损伤急慢性程度进行个体化治疗。肾病综合征和规范DAA治疗未能改善且组织学呈活动性HCV-GN,推荐DAA治疗基础上加用免疫抑制治疗;利妥昔单抗可作为一线免疫抑制剂使用。DAA方案的剂量和疗程与普通患者一致(1C)。
近年来DAA在临床广泛应用并取得良好效果,可减少尿蛋白并改善GFR[87-88]。对于重度冷球蛋白血症或HCV导致的严重肾小球疾病(肾病综合征或肾功能迅速减退)患者除DAA治疗外,应同时使用免疫抑制剂和(或)血浆置换治疗[57, 89]。血浆置换(每周3次,持续2~3周)可有效去除血浆中的冷球蛋白,减少免疫复合物在肾脏中沉积。既往最常用的传统免疫抑制方案为糖皮质激素和环磷酰胺[2 mg/(kg·d),持续2~4个月]联合治疗,严重者可使用甲基泼尼松龙冲击治疗,0.5~1 g/d,3 d为一个疗程,该方案后期可序贯硫唑嘌呤维持治疗。近年来,针对B细胞靶向清除的生物制剂利妥昔单抗(每周375 mg/m2,持续4周,或者分二次注射,每次1 000 mg,间隔2周)已被证实可显著减少HCV-GN尿蛋白,改善肾功能,目前已成为一线免疫抑制治疗药物[57]。两个小型RCT研究比较利妥昔单抗与传统的免疫抑制方案疗效,发现利妥昔单抗可快速显著地改善冷球蛋白血症血管炎的临床症状和长期预后,少数复发患者再次使用利妥昔单抗仍然有效[90-91]。但应注意利妥昔单抗与严重感染并发症有关,包括极为罕见的HCV再激活导致的胆汁淤积性肝病以及较常见HBV再激活。严重细菌感染更常发生于应用多种免疫抑制剂的肾移植患者,高龄(>70岁),GFR降低(< 60 mL/min/1.73 m2)和同时使用大剂量糖皮质激素是最常见的危险因素[92]。在无法使用利妥昔单抗情况下,也可使用传统的免疫抑制剂。不伴严重并发症(如血栓栓塞事件,严重低蛋白血症、浆膜腔积液和肾衰竭)的肾病综合征患者可通过DAA治疗获得蛋白尿缓解,因此可暂不使用免疫抑制剂而仅给予抗凝等支持治疗,若病情无改善或加重且组织学呈活动性HCV-GN再启动免疫抑制治疗。其他可能改善预后的治疗还包括霉酚酸酯维持治疗,肾素-血管紧张素系统阻滞剂降蛋白治疗,控制血压、利尿等。
HCV-GN治疗流程见图 3。
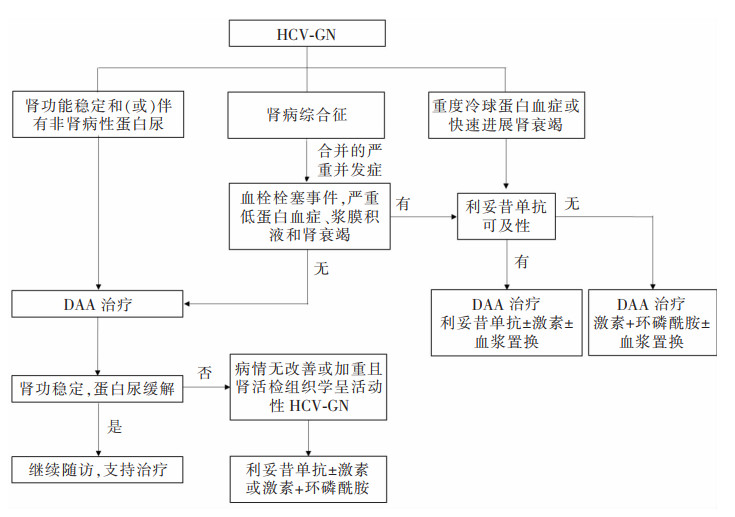 |
| 图 3 HCV-GN治疗流程 |
CKD患者中HCV感染率高,随着直接抗病毒药物问世并广泛应用于临床,HCV感染已成为可治愈的疾病。多学科专家组参考国内外最新文献,结合我国临床实践特点,经过多次讨论,最终达成共识,制定出临床实践指南。本指南介绍了CKD患者合并HCV感染的流行病学、筛查、诊断、治疗、预防,以及特殊人群HCV感染的管理建议,期望为广大医生提供临床实践指导,更希望通过积极的筛查和治疗,在血液透析患者中早日实现消除HCV感染的目标。
慢性肾脏病合并丙型肝炎病毒感染诊断、治疗和预防专家组
专家组组长:梅长林、张文宏
执笔人:戴兵
专家组成员(按姓名汉语拼音排序)
肾脏病科:陈江华(浙江大学医学院第一附属医院)、陈崴(中山大学附属第一医院)、陈晓农(上海交通大学医学院附属瑞金医院)、戴兵(海军军医大学第二附属医院)、丁峰(上海交通大学医学院附属第九人民医院)、付平(四川大学华西医院)、郝传明(复旦大学附属华山医院)、蒋红利(西安交通大学第一附属医院)、李贵森(四川省人民医院)、李雪梅(北京协和医院)、刘必成(东南大学附属中大医院)、刘虹(中南大学湘雅二医院)、梅长林(海军军医大学第二附属医院)、徐钢(华中科技大学同济医学院附属同济医院)、姚丽(中国医科大学附属第一医院)、余晨(同济大学附属同济医院)、袁伟杰(上海交通大学医学院附属第一人民医院)
肝脏病科:南月敏(河北医科大学第三附属医院)、唐红(四川大学华西医院)、赵英仁(西安交通大学第一附属医院)
感染病科:谢青(上海交通大学医学院附属瑞金医院)、张文宏(复旦大学附属华山医院)
医院感染控制科:胡必杰(复旦大学附属中山医院)、吴安华(中南大学湘雅医院)
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Zhang LX, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. Lancet, 2012, 379(9818): 815-822. DOI:10.1016/S0140-6736(12)60033-6 |
| [2] |
Stevens PE, Levin A, Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline[J]. Ann Intern Med, 2013, 158(11): 825-830. DOI:10.7326/0003-4819-158-11-201306040-00007 |
| [3] |
CKD合并HCV感染诊治共识专家委员会. 慢性肾脏病合并丙型肝炎病毒感染诊断及治疗的专家共识[J]. 临床肾脏病杂志, 2019, 19(5): 305-310. The Committee of Expert Consensus for the Diagnosis and Treatment of Chronic Kid. The expert consensus for the diagnosis and treatment of chronic kidney disease with hepatitis C infection[J]. Journal of Clinical Nephrology, 2019, 19(5): 305-310. DOI:10.3969/j.issn.1671-2390.2019.05.001 |
| [4] |
Yang J, Liu HX, Su YY, et al. Distribution and changes in hepatitis C virus genotype in China from 2010 to 2020[J]. World J Clin Cases, 2022, 10(14): 4480-4493. DOI:10.12998/wjcc.v10.i14.4480 |
| [5] |
Corey KE, Mendez-Navarro J, Gorospe EC, et al. Early treatment improves outcomes in acute hepatitis C virus infection: a Meta-analysis[J]. J Viral Hepat, 2010, 17(3): 201-207. DOI:10.1111/j.1365-2893.2009.01167.x |
| [6] |
Chen SL, Morgan TR. The natural history of hepatitis C virus (HCV) infection[J]. Int J Med Sci, 2006, 3(2): 47-52. |
| [7] |
Freeman AJ, Dore GJ, Law MG, et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection[J]. Hepatology, 2001, 34(4 Pt 1): 809-816. |
| [8] |
Poynard T, Bedossa P, Opolon P. Natural history of liver fibrosis progression in patients with chronic hepatitis C. The OBSVIRC, METAVIR, CLINIVIR, and DOSVIRC groups[J]. Lancet, 1997, 349(9055): 825-832. DOI:10.1016/S0140-6736(96)07642-8 |
| [9] |
Irshad M, Mankotia DS, Irshad K. An insight into the diagnosis and pathogenesis of hepatitis C virus infection[J]. World J Gastroenterol, 2013, 19(44): 7896-7909. DOI:10.3748/wjg.v19.i44.7896 |
| [10] |
Heim MH. Innate immunity and HCV[J]. J Hepatol, 2013, 58(3): 564-574. DOI:10.1016/j.jhep.2012.10.005 |
| [11] |
Bergman S, Accortt N, Turner A, et al. Hepatitis C infection is acquired pre-ESRD[J]. Am J Kidney Dis, 2005, 45(4): 684-689. DOI:10.1053/j.ajkd.2004.12.014 |
| [12] |
Iwasa Y, Otsubo S, Sugi O, et al. Patterns in the prevalence of hepatitis C virus infection at the start of hemodialysis in Japan[J]. Clin Exp Nephrol, 2008, 12(1): 53-57. DOI:10.1007/s10157-007-0005-6 |
| [13] |
Fabrizi F, Verdesca S, Messa P, et al. Hepatitis C virus infection increases the risk of developing chronic kidney disease: a systematic review and Meta-analysis[J]. Dig Dis Sci, 2015, 60(12): 3801-3813. DOI:10.1007/s10620-015-3801-y |
| [14] |
Crook ED, Penumalee S, Gavini B, et al. Hepatitis C is a predictor of poorer renal survival in diabetic patients[J]. Diabetes Care, 2005, 28(9): 2187-2191. DOI:10.2337/diacare.28.9.2187 |
| [15] |
Noureddine LA, Usman SA, Yu ZS, et al. Hepatitis C increases the risk of progression of chronic kidney disease in patients with glomerulonephritis[J]. Am J Nephrol, 2010, 32(4): 311-316. DOI:10.1159/000319456 |
| [16] |
中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2019年版)[J]. 中华肝脏病杂志, 2019, 27(12): 962-979. Chinese Society of Hepatology, Chinese Society of Infectious Diseases, Chinese Medical Association. Guidelines for the prevention and treatment of hepatitis C(2019 version)[J]. Chinese Journal of Hepatology, 2019, 27(12): 962-979. DOI:10.3760/cma.j.issn.1007-3418.2019.12.008 |
| [17] |
European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C: final update of the series[J]. J Hepatol, 2020, 73(5): 1170-1218. DOI:10.1016/j.jhep.2020.08.018 |
| [18] |
Simmons B, Saleem J, Hill A, et al. Risk of late relapse or reinfection with hepatitis C virus after achieving a sustained virological response: a systematic review and Meta-analysis[J]. Clin Infect Dis, 2016, 62(6): 683-694. DOI:10.1093/cid/civ948 |
| [19] |
Martinot-Peignoux M, Stern C, Maylin S, et al. Twelve weeks posttreatment follow-up is as relevant as 24 weeks to determine the sustained virologic response in patients with hepatitis C virus receiving pegylated interferon and ribavirin[J]. Hepatology, 2010, 51(4): 1122-1126. DOI:10.1002/hep.23444 |
| [20] |
中国肝炎防治基金会, 中华医学会感染病学分会, 中华医学会肝病学分会和中国研究型医院学会肝病专业委员会. 瞬时弹性成像技术诊断肝纤维化专家共识(2018年更新版)[J]. 中华肝脏病杂志, 2019, 27(3): 182-191. Chinese Foundation for Hepatitis Prevention and Control, Chinese Society of Infectious Disease and Chinese Society of Hepatology, Chinese Medical Association, Liver Disease Committee of Chinese Research Hospital Association. Consensus on clinical application of transient elastography detecting liver fibrosis: a 2018 update[J]. Chinese Journal of Hepatology, 2019, 27(3): 182-191. |
| [21] |
Wai CT, Greenson JK, Fontana RJ, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C[J]. Hepatology, 2003, 38(2): 518-526. DOI:10.1053/jhep.2003.50346 |
| [22] |
中国肝炎防治基金会, 中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎直接抗病毒药物应用中的药物相互作用管理专家共识[J]. 中华肝脏病杂志, 2018, 26(7): 481-488. Chinese Foundation for Hepatitis Prevention and Control, Chinese Society of Hepatology, Chinese Medical Association, Chinese Society of Infectious Diseases, Chinese Medical Association. Consensus on management of drug-drug interaction with direct-acting antiviral agents in chronic hepatitis C[J]. Chinese Journal of Hepatology, 2018, 26(7): 481-488. DOI:10.3760/cma.j.issn.1007-3418.2018.07.001 |
| [23] |
Kirby BJ, Symonds WT, Kearney BP, et al. Pharmacokine-tic, pharmacodynamic, and drug-interaction profile of the hepatitis C virus NS5B polymerase inhibitor sofosbuvir[J]. Clin Pharmacokinet, 2015, 54(7): 677-690. DOI:10.1007/s40262-015-0261-7 |
| [24] |
Chahine EB, Sucher AJ, Hemstreet BA. Sofosbuvir/velpatasvir: the first pangenotypic direct-acting antiviral combination for hepatitis C[J]. Ann Pharmacother, 2017, 51(1): 44-53. DOI:10.1177/1060028016668897 |
| [25] |
Sulkowski M, Telep LE, Colombo M, et al. Sofosbuvir and risk of estimated glomerular filtration rate decline or end-stage renal disease in patients with renal impairment[J]. Aliment Pharmacol Ther, 2022, 55(9): 1169-1178. DOI:10.1111/apt.16830 |
| [26] |
Huang CF, Tseng KC, Cheng PN, et al. Impact of sofosbuvir-based direct-acting antivirals on renal function in chronic hepatitis C patients with impaired renal function: a large cohort study from the nationwide HCV registry program (TACR)[J]. Clin Gastroenterol Hepatol, 2022, 20(5): 1151-1162. e6. DOI:10.1016/j.cgh.2021.07.037 |
| [27] |
Borgia SM, Dearden J, Yoshida EM, et al. Sofosbuvir/velpatasvir for 12 weeks in hepatitis C virus-infected patients with end-stage renal disease undergoing dialysis[J]. J Hepatol, 2019, 71(4): 660-665. DOI:10.1016/j.jhep.2019.05.028 |
| [28] |
Taneja S, Duseja A, Mehta M, et al. Sofosbuvir and velpatasvir combination is safe and effective in treating chronic hepatitis C in end-stage renal disease on maintenance haemo-dialysis[J]. Liver Int, 2021, 41(4): 705-709. DOI:10.1111/liv.14685 |
| [29] |
Liu CH, Chen CY, Su WW, et al. Sofosbuvir/velpatasvir with or without low-dose ribavirin for patients with chronic hepatitis C virus infection and severe renal impairment[J]. Gut, 2022, 71(1): 176-184. DOI:10.1136/gutjnl-2020-323569 |
| [30] |
Yu ML, Huang CF, Wei YJ, et al. Establishment of an outreach, grouping healthcare system to achieve microelimination of HCV for uremic patients in haemodialysis centres (ERASE-C)[J]. Gut, 2021, 70(12): 2349-2358. DOI:10.1136/gutjnl-2020-323277 |
| [31] |
Gaur N, Malhotra V, Agrawal D, et al. Sofosbuvir-velpatasvir fixed drug combination for the treatment of chronic hepatitis C infection in patients with end-stage renal disease and kidney transplantation[J]. J Clin Exp Hepatol, 2020, 10(3): 189-193. DOI:10.1016/j.jceh.2019.10.004 |
| [32] |
German P, Mathias A, Brainard D, et al. Clinical pharmacokinetics and pharmacodynamics of ledipasvir/sofosbuvir, a fixed-dose combination tablet for the treatment of hepatitis C[J]. Clin Pharmacokinet, 2016, 55(11): 1337-1351. DOI:10.1007/s40262-016-0397-0 |
| [33] |
Chuang WL, Hu TH, Buggisch P, et al. Ledipasvir/sofosbuvir for 8, 12, or 24 weeks in hepatitis C patients undergoing dialysis for end-stage renal disease[J]. Am J Gastroenterol, 2021, 116(9): 1924-1928. DOI:10.14309/ajg.0000000000001281 |
| [34] |
Lawitz E, Landis CS, Flamm SL, et al. Sofosbuvir plus ribavirin and sofosbuvir plus ledipasvir in patients with genotype 1 or 3 hepatitis C virus and severe renal impairment: a multicentre, phase 2b, non-randomised, open-label study[J]. Lancet Gastroenterol Hepatol, 2020, 5(10): 918-926. DOI:10.1016/S2468-1253(19)30417-0 |
| [35] |
Gohel K, Borasadia P. Sofosbuvir-based HCV treatment in maintenance hemodialysis patients: a single-center study[J]. Transplant Proc, 2020, 52(6): 1684-1686. DOI:10.1016/j.transproceed.2020.02.136 |
| [36] |
Caro L, Wenning L, Feng HP, et al. Pharmacokinetics of elbasvir and grazoprevir in subjects with end-stage renal disease or severe renal impairment[J]. Eur J Clin Pharmacol, 2019, 75(5): 665-675. DOI:10.1007/s00228-018-2585-3 |
| [37] |
Caro L, Wenning L, Guo ZF, et al. Effect of hepatic impairment on the pharmacokinetics of grazoprevir, a hepatitis C virus protease inhibitor[J]. Antimicrob Agents Chemother, 2017, 61(12): e00813-17. |
| [38] |
Roth D, Nelson DR, Bruchfeld A, et al. Grazoprevir plus elbasvir in treatment-naive and treatment-experienced patients with hepatitis C virus genotype 1 infection and stage 4-5 chronic kidney disease (the C-SURFER study): a combination phase 3 study[J]. Lancet, 2015, 386(10003): 1537-1545. DOI:10.1016/S0140-6736(15)00349-9 |
| [39] |
Bruchfeld A, Roth D, Martin P, et al. Elbasvir plus grazoprevir in patients with hepatitis C virus infection and stage 4-5 chronic kidney disease: clinical, virological, and health-related quality-of-life outcomes from a phase 3, multicentre, randomi-sed, double-blind, placebo-controlled trial[J]. Lancet Gastroenterol Hepatol, 2017, 2(8): 585-594. DOI:10.1016/S2468-1253(17)30116-4 |
| [40] |
Flamm SL, Bacon B, Curry MP, et al. Real-world use of elbasvir-grazoprevir in patients with chronic hepatitis C: retrospective analyses from the TRIO network[J]. Aliment Pharmacol Ther, 2018, 47(11): 1511-1522. DOI:10.1111/apt.14635 |
| [41] |
Liu CH, Peng CY, Fang YJ, et al. Elbasvir/grazoprevir for hepatitis C virus genotype 1b East-Asian patients receiving hemodialysis[J]. Sci Rep, 2020, 10(1): 9180. DOI:10.1038/s41598-020-66182-8 |
| [42] |
Ji QH, Chu XD, Zhou YG, et al. Safety and efficacy of grazoprevir/elbasvir in the treatment of acute hepatitis C in hemodialysis patients[J]. J Med Virol, 2022, 94(2): 675-682. DOI:10.1002/jmv.27374 |
| [43] |
Wang C, Ji D, Chen J, et al. Hepatitis due to reactivation of hepatitis B virus in endemic areas among patients with hepatitis C treated with direct-acting antiviral agents[J]. Clin Gastroenterol Hepatol, 2017, 15(1): 132-136. DOI:10.1016/j.cgh.2016.06.023 |
| [44] |
Liu CJ, Chuang WL, Sheen IS, et al. Efficacy of ledipasvir and sofosbuvir treatment of HCV infection in patients coinfec-ted with HBV[J]. Gastroenterology, 2018, 154(4): 989-997. DOI:10.1053/j.gastro.2017.11.011 |
| [45] |
Liu CJ, Sheen IS, Chen CY, et al. Ledipasvir/sofosbuvir for patients coinfected with chronic hepatitis C and hepatitis B in Taiwan: follow-up at 108 weeks posttreatment[J]. Clin Infect Dis, 2022, 75(3): 453-459. DOI:10.1093/cid/ciab971 |
| [46] |
Mücke VT, Mücke MM, Peiffer KH, et al. No evidence of hepatitis B virus reactivation in patients with resolved infection treated with direct-acting antivirals for hepatitis C in a large real-world cohort[J]. Aliment Pharmacol Ther, 2017, 46(4): 432-439. DOI:10.1111/apt.14177 |
| [47] |
The American Association for the Study of Liver Diseases and the Infectious Diseases Society of America Present. HCV gui-dance: recommendations for testing, managing, and treating hepatitis C[EB/OL]. [2022-12-26]. https://www.hcvguidelines.org/.
|
| [48] |
Rockstroh JK, Bhagani S, Hyland RH, et al. Ledipasvir-sofosbuvir for 6 weeks to treat acute hepatitis C virus genotype 1 or 4 infection in patients with HIV coinfection: an open-label, single-arm trial[J]. Lancet Gastroenterol Hepatol, 2017, 2(5): 347-353. DOI:10.1016/S2468-1253(17)30003-1 |
| [49] |
Deterding K, Spinner CD, Schott E, et al. Ledipasvir plus sofosbuvir fixed-dose combination for 6 weeks in patients with acute hepatitis C virus genotype 1 monoinfection (HepNet acute HCV IV): an open-label, single-arm, phase 2 study[J]. Lancet Infect Dis, 2017, 17(2): 215-222. DOI:10.1016/S1473-3099(16)30408-X |
| [50] |
Martinello M, Bhagani S, Gane E, et al. Shortened therapy of eight weeks with paritaprevir/ritonavir/ombitasvir and dasabuvir is highly effective in people with recent HCV genotype 1 infection[J]. J Viral Hepat, 2018, 25(10): 1180-1188. DOI:10.1111/jvh.12917 |
| [51] |
Martinello M, Orkin C, Cooke G, et al. Short-duration pan-genotypic therapy with glecaprevir/pibrentasvir for 6 weeks among people with recent hepatitis C viral infection[J]. Hepatology, 2020, 72(1): 7-18. DOI:10.1002/hep.31003 |
| [52] |
Matthews GV, Bhagani S, Van der Valk M, et al. Sofosbuvir/velpatasvir for 12 vs. 6 weeks for the treatment of recently acquired hepatitis C infection[J]. J Hepatol, 2021, 75(4): 829-839. DOI:10.1016/j.jhep.2021.04.056 |
| [53] |
Fissell RB, Bragg-Gresham JL, Woods JD, et al. Patterns of hepatitis C prevalence and seroconversion in hemodialysis units from three continents: the DOPPS[J]. Kidney Int, 2004, 65(6): 2335-2342. DOI:10.1111/j.1523-1755.2004.00649.x |
| [54] |
Jadoul M, Bieber BA, Martin P, et al. Prevalence, incidence, and risk factors for hepatitis C virus infection in hemodialysis patients[J]. Kidney Int, 2019, 95(4): 939-947. DOI:10.1016/j.kint.2018.11.038 |
| [55] |
Gan LY, Wang DY, Bieber B, et al. Hepatitis C prevalence, incidence, and treatment in Chinese hemodialysis patients: results from the dialysis outcomes and practice patterns study-China (2019-21)[J]. Front Med (Lausanne), 2022, 9: 910840. |
| [56] |
缪兴全, 王超然, 曾翠, 等. 血液透析室丙型肝炎病毒暴发事件的分析与防控[J]. 中国感染控制杂志, 2020, 19(12): 1140-1144. Miao XQ, Wang CR, Zeng C, et al. Prevention and control of hepatitis C virus outbreak event in hemodialysis room[J]. Chinese Journal of Infection Control, 2020, 19(12): 1140-1144. DOI:10.12138/j.issn.1671-9638.20206202 |
| [57] |
Kidney Disease: Improving Global Outcomes (KDIGO) Hepatitis C Work Group. KDIGO 2022 clinical practice guideline for the prevention, diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease[J]. Kidney Int, 2022, 102(6S): S129-S205. |
| [58] |
中华人民共和国国家卫生健康委员会医政医管局. 国家卫生健康委办公厅关于印发血液净化标准操作规程(2021版)的通知: 国卫办医函(2021)552号[EB/OL]. (2021-11-09)[2022-12-26]. http://www.nhc.gov.cn/yzygj/s7659/202111/6e25b8260b214c55886d6f0512c1e53f.shtml. Medical Administration Bureau of the National Health Commission of the People's Republic of China. Notice of the General Office of the National Health Commission on Printing and Distributing the Standard Operating Procedures for Blood Purification (2021): GYH [2021] No. 552[EB/OL]. (2021-11-09)[2022-12-26]. http://www.nhc.gov.cn/yzygj/s7659/202111/6e25b8260b214c55886d6f0512c1e53f.shtml. |
| [59] |
Fabrizi F, Dixit V, Messa P. Impact of hepatitis C on survival in dialysis patients: a link with cardiovascular mortality?[J]. J Viral Hepat, 2012, 19(9): 601-607. DOI:10.1111/j.1365-2893.2012.01633.x |
| [60] |
Younossi ZM, Stepanova M, Racila A, et al. Long-term benefits of sustained virologic response for patient-reported outcomes in patients with chronic hepatitis C virus infection[J]. Clin Gastroenterol Hepatol, 2020, 18(2): 468-476. e11. DOI:10.1016/j.cgh.2019.07.047 |
| [61] |
Younossi ZM, Racila A, Muir A, et al. Long-term patient-centered outcomes in cirrhotic patients with chronic hepatitis C after achieving sustained virologic response[J]. Clin Gastroenterol Hepatol, 2022, 20(2): 438-446. DOI:10.1016/j.cgh.2021.01.026 |
| [62] |
Poordad F, Felizarta F, Yao BB, et al. Durability of sustained virological response to glecaprevir/pibrentasvir and resistance development: a long-term follow-up study[J]. Liver Int, 2022, 42(6): 1278-1286. DOI:10.1111/liv.15211 |
| [63] |
Wyles DL, Kang M, Matining RM, et al. Continued low rates of hepatitis C virus (HCV) recurrence in HCV/HIV-and HCV-Infected participants who achieved sustained virologic response after direct-acting antiviral treatment: final results from the AIDS clinical trials group a5320 viral hepatitis C infection long-term cohort study (V-HICS)[J]. Open Forum Infect Dis, 2021, 8(12): ofab511. DOI:10.1093/ofid/ofab511 |
| [64] |
Lin CP, Liang PC, Huang CI, et al. Concordance of SVR12, SVR24 and SVR durability in Taiwanese chronic hepatitis C patients with direct-acting antivirals[J]. PLoS One, 2021, 16(2): e0245479. DOI:10.1371/journal.pone.0245479 |
| [65] |
Zhang J, Sun W, Lin J, et al. Long-term follow-up of HCV infected kidney transplant recipients receiving direct-acting antiviral agents: a single-center experience in China[J]. BMC Infect Dis, 2019, 19(1): 645. DOI:10.1186/s12879-019-4217-7 |
| [66] |
张唯伟, 袁琼婧, 宁建平, 等. 维持性血液透析丙型肝炎病毒感染患者的抗病毒治疗及预后[J]. 中南大学学报(医学版), 2021, 46(12): 1332-1337. Zhang WW, Yuan QJ, Ning JP, et al. Antiviral treatment and prognosis in patients undergoing maintenance hemodialysis due to hepatitis C virus[J]. Journal of Central South University(Medical Science), 2021, 46(12): 1332-1337. |
| [67] |
Liu CH, Peng CY, Kao WY, et al. Hepatitis C virus reinfection in patients on haemodialysis after achieving sustained virologic response with antiviral treatment[J]. Aliment Pharmacol Ther, 2022, 55(4): 434-445. DOI:10.1111/apt.16697 |
| [68] |
Wolfe RA, Ashby VB, Milford EL, et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant[J]. N Engl J Med, 1999, 341(23): 1725-1730. DOI:10.1056/NEJM199912023412303 |
| [69] |
Bloom RD, Sayer G, Fa K, et al. Outcome of hepatitis C virus-infected kidney transplant candidates who remain on the waiting list[J]. Am J Transplant, 2005, 5(1): 139-144. DOI:10.1111/j.1600-6143.2004.00652.x |
| [70] |
Kamar N, Toupance O, Buchler M, et al. Evidence that clea-rance of hepatitis C virus RNA after alpha-interferon therapy in dialysis patients is sustained after renal transplantation[J]. J Am Soc Nephrol, 2003, 14(8): 2092-2098. DOI:10.1097/01.ASN.0000079613.81511.3C |
| [71] |
Nicot F, Kamar N, Mariamé B, et al. No evidence of occult hepatitis C virus (HCV) infection in serum of HCV antibody-positive HCV RNA-negative kidney-transplant patients[J]. Transpl Int, 2010, 23(6): 594-601. |
| [72] |
Molnar MZ, Azhar A, Tsujita M, et al. Transplantation of kidneys from hepatitis C virus-infected donors to hepatitis C virus-negative recipients: one-year kidney allograft outcomes[J]. Am J Kidney Dis, 2021, 77(5): 739-747. e1. DOI:10.1053/j.ajkd.2020.10.017 |
| [73] |
Kapila N, Menon KVN, Al-Khalloufi K, et al. Hepatitis C virus NAT-positive solid organ allografts transplanted into hepatitis C virus-negative recipients: a real-world experience[J]. Hepatology, 2020, 72(1): 32-41. DOI:10.1002/hep.31011 |
| [74] |
Chen RY, Li DW, Zhang M, et al. Sofosbuvir/velpatasvir prophylaxis for 12 weeks in hepatitis C virus (HCV)-negative recipients receiving kidney transplantation from HCV-positive donors[J]. Ann Transplant, 2021, 26: e933313. |
| [75] |
Zhang HD, Liu QH, Hu SB, et al. Utilization of HCV viremic kidneys with genotyping/subtyping-free sofosbuvir/velpatasvir treatment strategy: experience from China[J]. Biomed Res Int, 2022, 2022: 3758744. |
| [76] |
Terrault NA, Burton J, Ghobrial M, et al. Prospective multicenter study of early antiviral therapy in liver and kidney transplant recipients of HCV-viremic donors[J]. Hepatology, 2021, 73(6): 2110-2123. DOI:10.1002/hep.31551 |
| [77] |
Colombo M, Aghemo A, Liu H, et al. Treatment with ledipasvir-sofosbuvir for 12 or 24 weeks in kidney transplant recipients with chronic hepatitis C virus genotype 1 or 4 infection: a randomized trial[J]. Ann Intern Med, 2017, 166(2): 109-117. DOI:10.7326/M16-1205 |
| [78] |
Saxena V, Khungar V, Verna EC, et al. Safety and efficacy of current direct-acting antiviral regimens in kidney and liver transplant recipients with hepatitis C: results from the HCV-TARGET study[J]. Hepatology, 2017, 66(4): 1090-1101. DOI:10.1002/hep.29258 |
| [79] |
Tronina O, Durlik M, Orłowska I, et al. Real-world direct-acting antiviral treatment in kidney transplant and hemodialysis patients: the EpiTer-2 multicenter observational study[J]. Ann Gastroenterol, 2021, 34(3): 438-446. |
| [80] |
Reese PP, Abt PL, Blumberg EA, et al. Twelve-month outcomes after transplant of hepatitis C-infected kidneys into uninfected recipients: a single-group trial[J]. Ann Intern Med, 2018, 169(5): 273-281. DOI:10.7326/M18-0749 |
| [81] |
Durand CM, Bowring MG, Brown DM, et al. Direct-acting antiviral prophylaxis in kidney transplantation from hepatitis C virus-infected donors to noninfected recipients: an open-label nonrandomized trial[J]. Ann Intern Med, 2018, 168(8): 533-540. DOI:10.7326/M17-2871 |
| [82] |
Eisenberger U, Friebus-Kardash J, Guberina H, et al. Treatment with grazoprevir/elbasvir for renal transplant recipients with chronic hepatitis C virus infection and impaired allograft function[J]. Transplant Direct, 2019, 5(1): e419. DOI:10.1097/TXD.0000000000000860 |
| [83] |
Lai PC, Chen CH, Jeng LB, et al. Grazoprevir/elbasvir treatment in liver or kidney transplant recipients with genotype 1b hepatitis C virus infection[J]. Antimicrob Agents Chemother, 2022, 66(2): e0200321. DOI:10.1128/aac.02003-21 |
| [84] |
Sikorska-Wiśniewska M, Sikorska K, Wróblewska A, et al. Recurrence of cryoglobulinemia secondary to hepatitis C in a patient with HCV RNA (-) negative in the serum[J]. Case Rep Nephrol Dial, 2021, 11(2): 110-115. DOI:10.1159/000515587 |
| [85] |
Fabrizi F, Plaisier E, Saadoun D, et al. Hepatitis C virus infection, mixed cryoglobulinemia, and kidney disease[J]. Am J Kidney Dis, 2013, 61(4): 623-637. DOI:10.1053/j.ajkd.2012.08.040 |
| [86] |
D'Amico G. Renal involvement in hepatitis C infection: cryoglobulinemic glomerulonephritis[J]. Kidney Int, 1998, 54(2): 650-671. DOI:10.1046/j.1523-1755.1998.00028.x |
| [87] |
Gragnani L, Visentini M, Fognani E, et al. Prospective study of guideline-tailored therapy with direct-acting antivirals for hepatitis C virus-associated mixed cryoglobulinemia[J]. Hepatology, 2016, 64(5): 1473-1482. DOI:10.1002/hep.28753 |
| [88] |
Sise ME, Bloom AK, Wisocky J, et al. Treatment of hepatitis C virus-associated mixed cryoglobulinemia with direct-acting antiviral agents[J]. Hepatology, 2016, 63(2): 408-417. DOI:10.1002/hep.28297 |
| [89] |
Rovin BH, Adler SG, Barratt J, et al. Executive summary of the KDIGO 2021 guideline for the management of glomerular diseases[J]. Kidney Int, 2021, 100(4): 753-779. DOI:10.1016/j.kint.2021.05.015 |
| [90] |
De Vita S, Quartuccio L, Isola M, et al. A randomized controlled trial of rituximab for the treatment of severe cryoglobulinemic vasculitis[J]. Arthritis Rheum, 2012, 64(3): 843-853. DOI:10.1002/art.34331 |
| [91] |
Sneller MC, Hu ZH, Langford CA. A randomized controlled trial of rituximab following failure of antiviral therapy for he-patitis C virus-associated cryoglobulinemic vasculitis[J]. Arthritis Rheum, 2012, 64(3): 835-842. DOI:10.1002/art.34322 |
| [92] |
Terrier B, Launay D, Kaplanski G, et al. Safety and efficacy of rituximab in nonviral cryoglobulinemia vasculitis: data from the French autoimmunity and rituximab registry[J]. Arthritis Care Res (Hoboken), 2010, 62(12): 1787-1795. DOI:10.1002/acr.20318 |

