2. 徐州医科大学附属连云港医院胃肠外科, 江苏 连云港 222002
2. Department of Gastrointestinal Surgery, Lianyungang Hospital Affiliated to Xuzhou Medical University, Lianyungang 222002, China
根据世界卫生组织(WHO)2020年全球癌症统计报告(GLOBOCAN 2020)公布的数据显示,全球胃癌新发病例约108.9万例[1],死亡率居所有癌症中第三位[2]。手术是胃癌患者主要的治疗方法[3],相关研究[4-5]表明,手术部位感染(surgical site infection,SSI)是胃癌术后常见并发症,导致胃癌患者住院时间延长以及治疗费用的增加,探讨胃癌术后SSI的危险因素对预防SSI有重要意义。目前国内外对胃癌术后SSI危险因素的研究结果不一,因此,本研究对胃癌术后SSI危险因素的相关研究进行系统评价,旨在筛选出胃癌术后SSI的相关危险因素并分析关联强度,为临床预防SSI提供科学依据。
1 资料与方法 1.1 文献检索策略采用主题词与自由词结合的方式检索PubMed、Web of Science、EMbase、The Cochrane Library、中国知网、万方、中国生物医学文献数据库、维普。以胃癌、胃肿瘤、胃癌切除术、胃肿瘤切除术、胃癌根治术、手术部位感染、切口感染、伤口感染、危险因素、影响因素、相关因素、预测因素、原因为中文检索词,以stomach neoplasms surgery、stomach cancer surgery、gastric cancer surgery、gastrectomy、gastric resection、stomach resection、surgical site infection、surgical wound infection、SSI、postoperative wound infection、incision infection、relevant factors、risk factors、associate factors、dangerous factors、predictive factors为英文检索词,检索时间为2012年11月29日—2022年11月29日,同时手动检索纳入文献的参考文献作为补充。
1.2 文献纳入与排除标准纳入标准:①文献类型为以中英文公开发表的病例对照和队列研究;②研究对象为接受手术治疗的胃癌患者且有SSI的明确诊断标准;③采用多因素logistic回归分析获得胃癌患者术后SSI的危险因素,比值比(OR)及95%置信区间(CI)数据完整。排除标准:①文献质量评价太低;②无法提取OR值。
1.3 文献筛选、数据提取和质量评价由2名研究者对确定纳入的文献共同筛选文献并提取以下信息:第一作者、发表年份、研究地点、样本量、有2篇及以上文献报道的危险因素、OR值及95%CI等。由2名研究者使用纽卡斯尔-渥太华质量评估量表(NOS)[6]对病例对照研究及队列研究进行质量评价,总分为9分,实际评分为<6分则认定为低质量文献予以删除,如意见不同时邀请第3名研究者介入确定。
1.4 统计学方法应用RevMan 5.4软件对胃癌术后发生SSI的危险因素OR值及95%CI进行效应量的合并,以P≤0.05为差异有统计学意义。当各研究间异质性低(P≥0.10,I2≤50%)时,采用固定效应模型;当各研究间异质性较高(P<0.10,I2>50%),采用敏感性分析探讨异质性来源,若无法确定异质性来源则采用随机效应模型,并通过更换两种效应模型,比较合并结果是否发生实质性改变以判断结果是否稳定。当原始文献数量>10篇时,进行发表偏倚分析。
2 结果 2.1 纳入文献的基本特征共检索获得文献797篇,依据纳入和排除标准进行筛选,筛选流程见图 1,最终纳入17篇文献,共包括13 953例患者,见表 1。
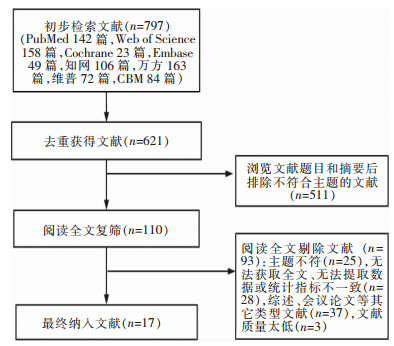 |
| 图 1 文献筛选流程及结果 Figure 1 Literature screening process and results |
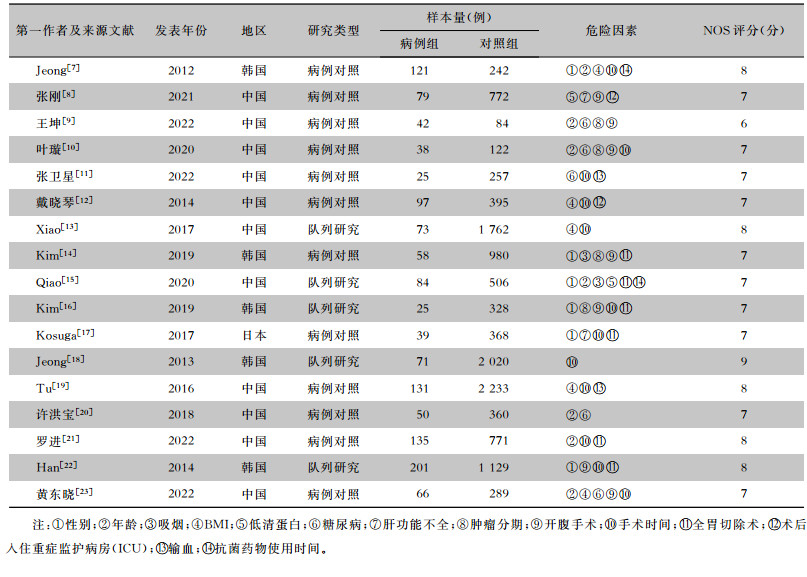
| 表 1 胃癌术后SSI危险因素Meta分析纳入文献基本特征 Table 1 Basic characteristics of literatures included in Meta-analysis on risk factors for post-operative SSI of gastric cancer |
|
共纳入4项危险因素进行分析,其中男性、高龄及身体质量指数(BMI)共3项危险因素合并结果有统计学意义,见图 2。6项研究[7, 14-17, 22]报告男性与SSI的关系,经异质性检验后获得I2=22%,采用固定效应模型计算合并效应值,结果显示[OR=1.66,95%CI(1.26,2.20)];7项研究[7, 9-10, 15, 20-21, 23]报告了年龄与SSI的关系,I2=31%,采用固定效应模型计算合并效应值,结果显示[OR=1.96,95%CI(1.65,2.34)];5项研究[7, 12-13, 19, 23]报道了BMI对SSI的影响,其中3项研究因BMI分类标准不同未纳入Meta分析,另2项研究[13, 19]以BMI>25 kg/m2为分界线,I2=58%,采用随机效应模型分析结果显示[OR=2.70,95%CI(1.48,4.93)];2项研究[14-15]报告术前吸烟与SSI的关系,采用固定效应模型进行合并分析,差异无统计学意义[OR=1.32,95%CI(0.82,2.13)],尚需更高质量研究证明该结论。
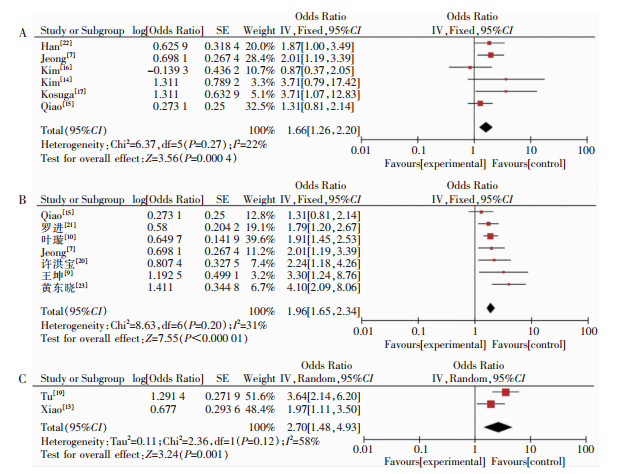 |
| 注:A为性别与SSI的关系分析;B为年龄与SSI的关系分析;C为BMI与SSI的关系分析。 图 2 一般因素对SSI影响的森林图 Figure 2 Forest plot of the impact of general factors on SSI |
共纳入4项危险因素,其中糖尿病、肿瘤分期共2项危险因素合并结果有统计学意义,见图 3。5项研究[9-11, 20, 23]报道糖尿病与SSI的关系,经计算I2=0,采用固定效应模型进行分析,结果显示差异有统计学意义[OR=2.41,95%CI(1.99,2.92)];4项研究[9-10, 14, 16]报道Ⅲ期以上肿瘤与SSI的关系,I2=61%,采用随机效应模型进行分析,结果显示差异有统计学意义[OR=2.38,95%CI(1.25,4.55)];两项研究[8, 15]报告低蛋白血症与SSI的关系,因数据类型不一致未纳入合并分析;两项研究[8, 15]报告肝功能不全与SSI的关系,异质性检验I2=76%,采用随机效应模型进行合并分析,差异无统计学意义[OR=3.56,95%CI(0.61,20.70)]。
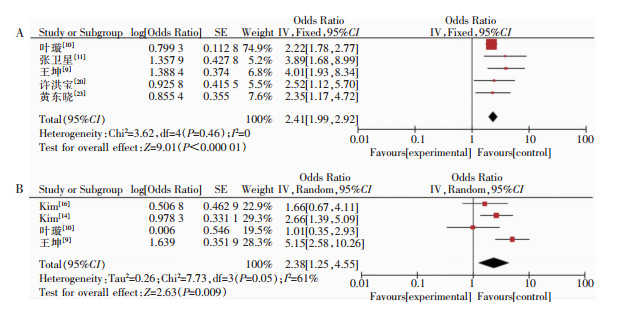 |
| 注:A为糖尿病与SSI的关系分析;B为肿瘤分期与SSI的关系分析。 图 3 疾病相关因素对SSI影响的森林图 Figure 3 Forest plot of the impact of disease-related factors on SSI |
共纳入6项危险因素,其中开腹手术、手术时间、全胃切除、输血共4项危险因素合并结果有统计学意义,见图 4。7项研究[8-10, 14, 16, 22-23]报告了开腹手术与SSI的关系,经计算I2=67%,采用随机效应模型进行分析,结果显示差异有统计学意义[OR=2.04,95%CI(1.43,2.92)];12项研究[7, 10-13, 16-19, 21-23]报告手术时间与SSI的关系,I2=92%,异质性较高,删除3项研究[7, 10, 16]后I2下降至28%,采用固定效应模型进行合并分析,结果为[OR=3.41,95%CI(2.74,4.25)];6项研究[14-17, 21-22]报告了全胃切除术与SSI的关系,经异质性检验I2=0,采用固定效应模型进行分析,结果显示[OR=1.97,95%CI(1.53,2.54)];2项研究[11, 19]报告输血与SSI的相关性,I2=18%,合并结果为[OR=3.71,95%CI(2.32,5.91)];2项研究[8, 12]报告手术后入住ICU对SSI的影响,异质性检验结果I2=72%,采用随机效应模型分析显示差异无统计学意义[OR=17.10,95%CI(0.69,426.60)]。2项研究[7, 15]报告手术后使用抗菌药物与SSI的关系,因数据不一致纳入讨论部分进行分析。
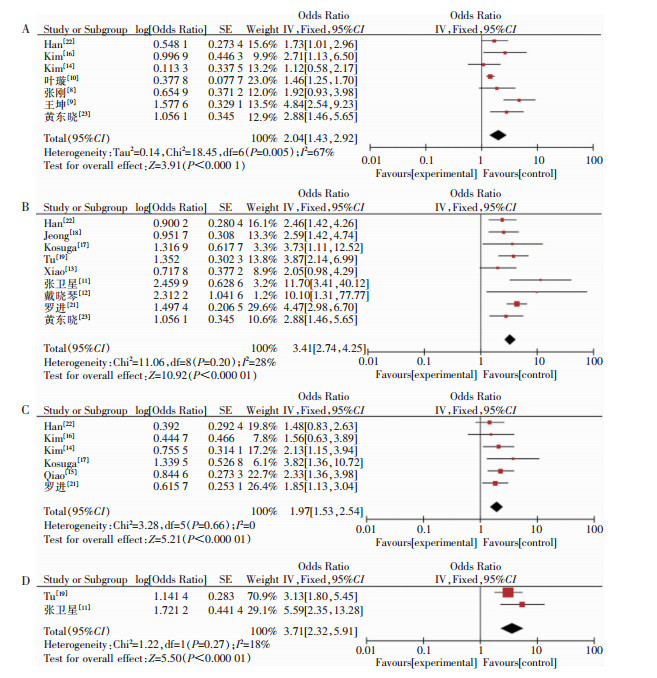 |
| 注:A为开腹手术与SSI的关系分析;B为手术时间与SSI的关系分析;C为全胃切除术与SSI的关系分析;D为输血与SSI的关系分析。 图 4 医疗相关因素对SSI影响的森林图 Figure 4 Forest plot of the impact of healthcare-related factors on SSI |
对异质性检验中I2>50%的危险因素进行敏感性分析,BMI异质性检验结果I2=61%,固定效应模型获得[OR=2.65,95%CI(1.79,3.91)],随机效应模型获得[OR=2.38,95%CI(1.25,4.55)];开腹手术异质性检验结果I2=67%,固定效应模型获得[OR=1.61,95%CI(1.41,1.84)],随机效应模型获得[OR=2.04,95%CI(1.43,2.92)]。各危险因素合并效应值未发生实质性改变,表明Meta结果稳定。
2.4 发表偏倚评估当纳入文献数≥10应作漏斗图进行偏倚性分析,本研究纳入的危险因素文献数目均<10篇,因此未进行发表偏倚分析。
3 讨论本研究结果表明,男性患者手术后发生SSI的风险更高,这可能与性激素对免疫系统的影响有关,雌激素增强免疫功能,睾酮抑制免疫功能[24-25];年龄是SSI的独立危险因素,随着年龄增加,各脏器功能减退,感染的发生风险更大。戴晓琴等[12]研究表明,BMI≥28或<18.5 kg/m2是SSI的独立危险因素[OR=5.06,95%CI(1.72,14.24)],Jeong等[7]研究表明BMI>23 kg/m2时,SSI发病率增高[OR=1.72,95%CI(1.05,2.84)];黄东晓等[23]研究表明BMI>24 kg/m2时,SSI发病率更高[OR=3.88,95%CI(1.89,8.00)]。肥胖患者皮下脂肪层厚,脂肪组织在术中受到挤压、钳夹等机械刺激时易氧化分解、脂肪液化,因此,缝合脂肪层前冲洗切口,清除游离脂肪粒[26];胃癌患者手术前常合并营养不良,王坤等[9]研究显示营养不良是SSI的危险因素[OR=3.14,95%CI(1.44,9.27)],手术前对营养不良患者做好营养支持工作对降低术后SSI发病率起着重要作用[27]。虽然年龄、性别、BMI等危险因素属于不可控因素,但医务人员可以通过加强重点人群风险筛查,做好相关预防措施。
Qiao等[15]研究中手术后3 d低清蛋白是SSI的独立危险因素[OR=1.87,95%CI(1.07,3.27)];张刚等[8]研究显示,术前低蛋白血症患者的SSI发病率升高[OR=4.45,95%CI(1.11,17.81)]。受手术创伤应激,机体的基础代谢率和分解代谢率增高,体内储存的蛋白质被大量消耗[28],同时机体释放大量的炎症因子,血管内皮细胞损伤,血管内皮屏障的完整性破坏,毛细血管通透性增加,血浆清蛋白渗漏到组织间隙引起组织液渗漏[29],切口周围组织肿胀,更容易引起细菌繁殖。糖尿病患者受糖代谢紊乱影响,蛋白质合成减少,机体抵抗力更低[30],加之高糖环境是细菌良好的培养基[31],SSI发生风险更高。临床Ⅲ期以上癌症病灶相对较大,肿瘤细胞扩散严重,患者多处于负氮平衡状况,机体免疫力低,SSI风险更高。综上所述,有必要对高危患者做好手术前准备工作,对低蛋白血症患者给予合理的营养支持,加强患者的血糖监测与控制,纠正糖、蛋白质代谢紊乱。
开腹手术因创伤更大、内脏组织与周围环境接触更多[32-33],感染风险更高,腹腔镜手术具有精准、微创优势[34],术后发生SSI风险更低。手术时间越久,伤口附近的组织在空气中暴露的时间延长,污染概率增加,因此长时间手术时应适当增加切口的冲洗。全胃切除术是最具侵入性的胃肠道手术之一,手术中的器官拉伸和牵拉更多,可能导致炎症反应[33, 35-37],SSI风险更高[38]。输血后可引起辅助性T细胞减少[39],白细胞可能介导输血引起的免疫抑制[40-42],因而SSI发病率更高。Jeong等[7]研究表明,手术时间较长是SSI的危险因素[OR=1.12,95%CI(1.07,1.17)];Qiao等[15]研究表明,预防性使用抗菌药物超过48 h SSI发生风险更高[OR=1.42,95%CI(0.85,2.36)],我国2015版《抗菌药物临床应用指导原则》也建议胃肠道手术后预防性使用抗菌药物最长不超过48 h[43]。因此,建议手术者提高手术技巧,控制手术时间,减少手术中失血量,加强血液管理以减少输血相关风险,尽可能缩短手术后预防性抗菌药物使用时间。
胃癌术后SSI的独立危险因素包括性别、年龄、BMI、糖尿病、肿瘤分期、开腹手术、手术时间、全胃切除术、输血;而吸烟、肝功能不全、手术后入住ICU与胃癌术后SSI的发生无相关性。本研究仅纳入多因素logistic回归分析的研究进行分析,一定程度上减少了混杂因素的影响,研究结果基本可靠,但也存在局限性:①仅纳入公开发表的中英文文献,可能存在发表偏倚;②大部分研究未统一手术方式,可能会对结果造成一定的影响;③医疗相关危险因素中如引流管放置日数[8]、联合多器官切除术[13]等危险因素因相关研究过少未能纳入Meta分析中,目前尚缺乏直接的证据证明无菌技术及手术技术欠缺、低体温、低氧等术中因素与SSI的相关性,需要进一步开展高质量的研究加以验证。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
Fugazzola P, Ansaloni L, Sartelli M, et al. Advanced gastric cancer: the value of surgery[J]. Acta Biomed, 2018, 89(8-S): 110-116. |
| [4] |
Kim W, Kim HH, Han SU, et al. Decreased morbidity of laparoscopic distal gastrectomy compared with open distal gastrectomy for stage I gastric cancer: short-term outcomes from a multicenter randomized controlled trial (KLASS-01)[J]. Ann Surg, 2016, 263(1): 28-35. DOI:10.1097/SLA.0000000000001346 |
| [5] |
Kim HH, Hyung WJ, Cho GS, et al. Morbidity and mortality of laparoscopic gastrectomy versus open gastrectomy for gastric cancer: an interim report-a phase Ⅲ multicenter, prospective, randomized trial (KLASS Trial)[J]. Ann Surg, 2010, 251(3): 417-420. DOI:10.1097/SLA.0b013e3181cc8f6b |
| [6] |
Stang A. Critical evaluation of the Newcastle-ottawa scale for the assessment of the quality of nonrandomized studies in Meta-analyses[J]. Eur J Epidemiol, 2010, 25(9): 603-605. DOI:10.1007/s10654-010-9491-z |
| [7] |
Jeong SJ, Kim CO, Han SH, et al. Risk factors for surgical site infection after gastric surgery: a multicentre case-control study[J]. Scand J Infect Dis, 2012, 44(6): 419-426. DOI:10.3109/00365548.2011.652159 |
| [8] |
张刚, 曹文成, 林芳, 等. 胃癌根治术手术部位感染危险因素研究[J]. 中国消毒学杂志, 2021, 38(8): 638-640. Zhang G, Cao WC, Lin F, et al. Study on risk factors of surgical site infection after radical gastrectomy[J]. Chinese Journal of Disinfection, 2021, 38(8): 638-640. |
| [9] |
王坤, 张玉盼, 杨亚鹏. 胃癌根治术后手术部位感染的病原学特征及危险因素分析[J]. 实用中西医结合临床, 2022, 22(4): 89-92. Wang K, Zhang YP, Yang YP. Pathogenic characteristics and risk factors of surgical site infection after radical gastrectomy[J]. Practical Clinical Journal of Integrated Traditional Chinese and Western Medicine, 2022, 22(4): 89-92. |
| [10] |
叶璇, 金程程, 高纯, 等. 胃癌根治术后手术部位感染的病原学特征及相关因素分析[J]. 中华医院感染学杂志, 2020, 30(9): 1369-1372. Ye X, Jin CC, Gao C, et al. Etiological characteristics and related factors for postoperative surgical site infection in radical gastrectomy patients[J]. Chinese Journal of Nosocomiology, 2020, 30(9): 1369-1372. |
| [11] |
张卫星, 张波涛, 乔海军. 胃癌根治术后手术切口感染的病原学特征及危险因素分析[J]. 罕少疾病杂志, 2022, 29(8): 85-86. Zhang WX, Zhang BT, Qiao HJ. Pathologic characteristics and risk factors analysis of surgical incision infection after radical gastric cancer[J]. Journal of Rare and Uncommon Diseases, 2022, 29(8): 85-86. |
| [12] |
戴晓琴, 李疆, 章玉英. 胃癌术后切口感染危险因素分析及护理对策的研究[J]. 中国微生态学杂志, 2014, 26(12): 1434-1436. Dai XQ, Li J, Zhang YY. Risk factors and nursing countermeasures for incision infections after operation of gastric can-cer[J]. Chinese Journal of Microecology, 2014, 26(12): 1434-1436. DOI:10.13381/j.cnki.cjm.201412020 |
| [13] |
Xiao H, Xiao YP, Quan H, et al. Intra-abdominal infection after radical gastrectomy for gastric cancer: incidence, pathogens, risk factors and outcomes[J]. Int J Surg, 2017, 48: 195-200. DOI:10.1016/j.ijsu.2017.07.081 |
| [14] |
Kim JH, Kim J, Lee WJ, et al. A high visceral-to-subcutaneous fat ratio is an independent predictor of surgical site infection after gastrectomy[J]. J Clin Med, 2019, 8(4): 494. DOI:10.3390/jcm8040494 |
| [15] |
Qiao YQ, Zheng L, Jia B, et al. Risk factors for surgical-site infections after radical gastrectomy for gastric cancer: a study in China[J]. Chin Med J (Engl), 2020, 133(13): 1540-1545. DOI:10.1097/CM9.0000000000000860 |
| [16] |
Kim JH, Kim J, Lee WJ, et al. The incidence and risk factors for surgical site infection in older adults after gastric cancer surgery: a STROBE-compliant retrospective study[J]. Medicine (Baltimore), 2019, 98(32): e16739. DOI:10.1097/MD.0000000000016739 |
| [17] |
Kosuga T, Ichikawa D, Komatsu S, et al. Clinical and surgical factors associated with organ/space surgical site infection after laparoscopic gastrectomy for gastric cancer[J]. Surg Endosc, 2017, 31(4): 1667-1674. DOI:10.1007/s00464-016-5156-7 |
| [18] |
Jeong SJ, Ann HW, Kim JK, et al. Incidence and risk factors for surgical site infection after gastric surgery: a multicenter prospective cohort study[J]. Infect Chemother, 2013, 45(4): 422-430. DOI:10.3947/ic.2013.45.4.422 |
| [19] |
Tu RH, Huang CM, Lin JX, et al. A scoring system to predict the risk of organ/space surgical site infections after laparoscopic gastrectomy for gastric cancer based on a large-scale re-trospective study[J]. Surg Endosc, 2016, 30(7): 3026-3034. DOI:10.1007/s00464-015-4594-y |
| [20] |
许洪宝, 蔡炜龙, 汪伟民, 等. 老年胃癌患者手术部位感染相关并发症的危险因素分析[J]. 中华普通外科杂志, 2018, 33(4): 276-279. Xu HB, Cai WL, Wang WM, et al. Risk factors for surgical site infectious in postoperative elderly gastric cancer patients[J]. Chinese Journal of General Surgery, 2018, 33(4): 276-279. DOI:10.3760/cma.j.issn.1007-631X.2018.04.002 |
| [21] |
罗进, 燕速, 邢多, 等. 胃癌根治术术后手术部位感染的危险因素分析及预测模型的建立[J]. 中国消毒学杂志, 2022, 39(1): 47-49. Luo J, Yan S, Xing D, et al. Analysis of risk factors for surgical site infection after radical resection of gastric cancer and establishment of predictive model[J]. Chinese Journal of Disinfection, 2022, 39(1): 47-49. |
| [22] |
Han JH, Jeong O, Ryu SY, et al. Efficacy of single-dose antimicrobial prophylaxis for preventing surgical site infection in radical gastrectomy for gastric carcinoma[J]. J Gastric Can-cer, 2014, 14(3): 156-163. DOI:10.5230/jgc.2014.14.3.156 |
| [23] |
黄东晓, 何丽芸, 李丽. 胃癌术后手术部位感染的预测模型构建[J]. 中国护理管理, 2022, 22(10): 1519-1524. Huang DX, He LY, Li L. Construction of a prediction model for postoperative surgical site infection of gastric cancer[J]. Chinese Nursing Management, 2022, 22(10): 1519-1524. |
| [24] |
Angele MK, Schwacha MG, Ayala A, et al. Effect of gender and sex hormones on immune responses following shock[J]. Shock, 2000, 14(2): 81-90. DOI:10.1097/00024382-200014020-00001 |
| [25] |
Beery TA. Sex differences in infection and sepsis[J]. Crit Care Nurs Clin North Am, 2003, 15(1): 55-62. DOI:10.1016/S0899-5885(02)00028-X |
| [26] |
樊振东. 开腹阑尾炎切除术术中冲洗对术后切口感染与脂肪液化的预防研究[D]. 沈阳: 沈阳医学院, 2019. Fan ZD. Prevention of postoperative incision infection and fat liquefaction by incision irrigation during open appendicitis[D]. Shenyang: Shenyang Medical College, 2019. |
| [27] |
Zheng HL, Lu J, Li P, et al. Effects of preoperative malnutrition on short- and long-term outcomes of patients with gastric cancer: can we do better?[J]. Ann Surg Oncol, 2017, 24(11): 3376-3385. DOI:10.1245/s10434-017-5998-9 |
| [28] |
Blackburn GL. Metabolic considerations in management of surgical patients[J]. Surg Clin North Am, 2011, 91(3): 467-480. |
| [29] |
Runyon BA. Low-protein-concentration ascitic fluid is predisposed to spontaneous bacterial peritonitis[J]. Gastroenterology, 1986, 91(6): 1343-1346. |
| [30] |
Kwon S, Thompson R, Dellinger P, et al. Importance of perioperative glycemic control in general surgery: a report from the surgical care and outcomes assessment program[J]. Ann Surg, 2013, 257(1): 8-14. |
| [31] |
谢朝云, 陈品奇, 熊永发, 等. 糖尿病患者急性开放性创伤伤口感染的影响因素分析[J]. 华南国防医学杂志, 2018, 32(10): 683-685. Xie CY, Chen PQ, Xiong YF, et al. Analysis on affecting factors of wound infection in acute open trauma patients with diabetes mellitus[J]. Military Medical Journal of South China, 2018, 32(10): 683-685. |
| [32] |
Mangram AJ, Horan TC, Pearson ML, et al. Guideline for prevention of surgical site infection, 1999. Centers for Disease Control and Prevention (CDC) Hospital Infection Control Practices Advisory Committee[J]. Am J Infect Control, 1999, 27(2): 97-132; quiz 133-134; discussion 96. |
| [33] |
吴照东. 胃癌患者胃大部切除术后感染危险因素分析[J]. 中国感染控制杂志, 2019, 18(2): 172-174. Wu ZD. Risk factors for infection after subtotal gastrectomy in patients with gastric cancer[J]. Chinese Journal of Infection Control, 2019, 18(2): 172-174. |
| [34] |
中华医学会外科学分会, 中华医学会麻醉学分会. 加速康复外科中国专家共识及路径管理指南(2018版)[J]. 中国实用外科杂志, 2018, 38(1): 1-20. Surgery Branch of Chinese Medical Association, Anesthesiology Branch of Chinese Medical Association. Chinese expert consensus and path management guide for accelerated rehabilitation surgery(2018 version)[J]. Chinese Journal of Practical Surgery, 2018, 38(1): 1-20. |
| [35] |
Ji X, Yan Y, Bu ZD, et al. The optimal extent of gastrectomy for middle-third gastric cancer: distal subtotal gastrectomy is superior to total gastrectomy in short-term effect without sacrificing long-term survival[J]. BMC Cancer, 2017, 17(1): 345. |
| [36] |
Watanabe M, Miyata H, Gotoh M, et al. Total gastrectomy risk model: data from 20, 011 Japanese patients in a nationwide internet-based database[J]. Ann Surg, 2014, 260(6): 1034-1039. |
| [37] |
Kurita N, Miyata H, Gotoh M, et al. Risk model for distal gastrectomy when treating gastric cancer on the basis of data from 33, 917 Japanese patients collected using a nationwide web-based data entry system[J]. Ann Surg, 2015, 262(2): 295-303. |
| [38] |
Jiang YX, Yang F, Ma JF, et al. Surgical and oncological outcomes of distal gastrectomy compared to total gastrectomy for middle-third gastric cancer: a systematic review and Meta-analysis[J]. Oncol Lett, 2022, 24(3): 291. |
| [39] |
刘雅珺, 于建设. 恶性肿瘤患者围术期输血管理研究进展[J]. 中国医药, 2020, 15(7): 1129-1132. Liu YJ, Yu JS. Research progress of perioperative blood transfusion management in malignant tumor patients[J]. China Medicine, 2020, 15(7): 1129-1132. |
| [40] |
Bordin JO, Heddle NM, Blajchman MA. Biologic effects of leukocytes present in transfused cellular blood products[J]. Blood, 1994, 84(6): 1703-1721. |
| [41] |
Youssef LA, Spitalnik SL. Transfusion-related immunomodulation: a reappraisal[J]. Curr Opin Hematol, 2017, 24(6): 551-557. |
| [42] |
Vamvakas EC, Blajchman MA. Transfusion-related immunomodulation (TRIM): an update[J]. Blood Rev, 2007, 21(6): 327-348. |
| [43] |
《抗菌药物临床应用指导原则》修订工作组. 抗菌药物临床应用指导原则(2015年版)[EB/OL]. (2015-08-27)[2022-10-19]. http://www.gov.cn/foot/site1/20150827/9021440664034848.pdf. Working Group on Revision of Guiding Principles for Clinical Application of Antibiotics. Guiding Principles for the Clinical Application of Antibiotics (2015)[EB/OL]. (2015-08-27)[2022-10-19]. http://www.gov.cn/foot/site1/20150827/9021440664034848.pdf. |



