流行性脑脊髓膜炎(简称流脑)是脑膜炎奈瑟菌(Neisseria meningitidis, Nm)感染引起的急性传染病。Nm有12个公认的血清群,是全世界许多地区细菌性脑膜炎和迅速致命败血症的主要原因[1]。绝大多数侵袭性流脑与6种Nm血清群有关:A、B、C、W、X、Y群[2],A、B、C群为主要致病菌群,X群为次要菌群之一。近年来在撒哈拉以南几个非洲国家发生了X群流脑暴发流行,但在中国和发达国家仅见零星病例。在国内,仅2008年在北京市[3]和2015年在浙江省[4]分别报道了1例Nm X群流脑本土病例,湖南省尚未发现相关病例报道。目前还没有获得许可的疫苗可以对抗Nm X群。现报告1例2019年某院收治的湖南省首例X群重症流脑本土病例,并结合相关文献进行复习,旨在提高临床医生对X群流脑的认识。
1 病历资料 1.1 入院情况患者男性,12岁,于2019年3月12日17点出现发热,体温40.1℃,伴头痛、乏力,在诊所予克林霉素抗感染治疗2 d,病情无好转。3月14日凌晨6点30分左右出现胡言乱语、寒战、四肢抖动,意识障碍,于3月14日9点45分入住该院重症监护病房(ICU)。入院体查:体温38.8℃,脉搏90次/min,呼吸20次/min, 血压90/60 mmHg;体重45 kg,神志深昏迷;全身可见散在红色皮疹,压之不褪色,无皮下结节、瘢痕, 扁桃体Ⅰ度肿大,无脓性分泌物,胸廓正常;双肺呼吸音粗,无啰音,无胸膜摩擦音, 心率90次/min,心律齐,心音有力;腹平坦, 腹部柔软无包块,肝、脾未触及;肠鸣音活跃,11次/min;四肢活动自如,肌张力正常,末端凉,毛细血管充盈时间3 s;双侧膝反射、跟腱反射正常,巴氏征阳性,克氏征和布氏征阴性。
1.2 流行病学史患者籍贯湖南长沙,为长沙市芙蓉区某中学初一学生,既往身体健康,发病前几个月一直在学校内学习,无外出史,无外来人员来访,主要活动范围在学校和家,无类似病例接触史,也无外籍人员接触史。患者分别在6月龄时接种A群,3岁时接种A+C群流脑疫苗。湖南省疾病预防控制中心(CDC)调查患者家人及周围同学密切接触者获悉,近1个月均无外出史,健康状况良好,在患者发病前后均未出现类似症状的人员。
1.3 实验室检查外周血白细胞计数(WBC)1.01×109/L,中性粒细胞比值0.871,淋巴细胞比值0.129,血红蛋白131.00 g/L,血小板计数146.00×109/L。全血C反应蛋白(CRP)197.16 mg/L。脑脊液常规:混浊,潘氏试验+ +,细胞总数5 400×106/L,白细胞计数4 300×106/L,单核细胞比值0.2,多核细胞比值0.8。脑脊液生化:葡萄糖0.01 mmol/L,腺苷脱氨酶4.50 U/L,乳酸脱氢酶137.00 IU/L,蛋白2.91 g/L,氯113.8 mmol/L。3月12日16点35分脑脊液涂片:找到革兰阴性双球菌,疑似脑膜炎球菌。3月16日脑脊液和血培养:脑膜炎奈瑟氏菌,对氨苄西林[最低抑菌浓度(MIC)≤0.06 μg/mL]、头孢曲松(MIC≤0.12 μg/mL)、氯霉素(MIC=2 μg/mL)、美罗培南(MIC≤0.12 μg/mL)、利福平(MIC≤0.5 μg/mL)、阿奇霉素(MIC≤0.25 μg/mL)敏感;对青霉素中介(MIC=0.12 μg/mL);对环丙沙星(MIC=0.25 μg/mL)、复方磺胺甲
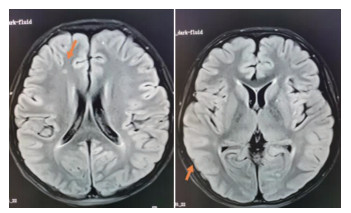 |
| 图 1 患者头颅MRI检查结果 Figure 1 Head MRI examination results of the patient |
入院后诊断流脑,于3月14日予青霉素+头孢噻肟钠抗感染,地塞米松磷酸钠抗炎,甘露醇、甘油氯化钠降颅内压等治疗,患者出现呼吸衰竭,予呼吸机辅助通气。抗生素使用2 d后患者仍持续发热,深昏迷状态,3月16日结合药敏结果更换抗生素为头孢曲松+氨苄西林,联合输血浆、白蛋白、鸡尾酒疗法等对症支持治疗。3月22日体温开始稳定(见图 2),病情逐渐好转。3月24日撤呼吸机,3月28日患者开始恢复意识,病情逐渐好转,脑膜炎症状消失,予综合康复治疗,4月15日停止使用抗生素,住院46 d后于4月29日出院。
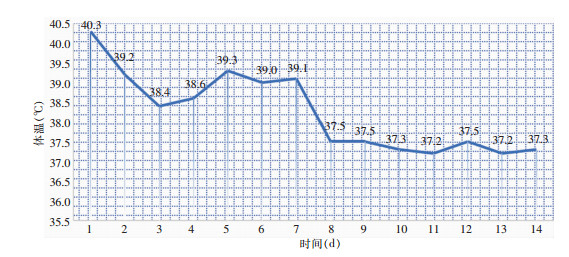 |
| 图 2 患者入院后2周体温曲线 Figure 2 Body temperature curve of the patient for 2 weeks after admission |
患者神志恢复后出现认知功能障碍,重度吞咽障碍3级(不能经口进食),语言障碍(4岁11月水平),构音障碍(构音清晰下降)等并发症,予综合康复治疗,病情好转出院。出院时无发热,神志清楚,吞咽障碍恢复,认知和语言障碍好转,嘱其继续家庭康复训练。出院后2年电话随访,患者身体状况良好,认知和语言障碍恢复,能正常上学。
2 讨论Nm X群历来在非洲”脑膜炎地带”造成散发性和聚集性脑膜炎病例,在欧美发达国家和中国被认为是散发性脑膜炎的罕见病因,而湖南省近十年,流脑发病率处于历史低位, 从流脑病例和健康人群中分离培养的Nm主要为C群、B群和w135群,未检测出Nm X群[5]。本例患儿为12岁儿童,既往健康状况良好,已接种流脑A+C群疫苗,发病前2个月无外出史,发病前15 d内亦未接触过疑似流脑病例,故可判断为本地感染病例。研究[6]表明,Nm的表型分类是基于荚膜多糖、脂寡糖和外膜蛋白的结构差异,Nm进化的一个核心特征是基因组的可塑性,以及由此产生的表型多样性的可塑性。北京发现的X群流脑病例被证明是由ST7型的A群菌株通过重组导致包膜转换而来[3]。推测本例血清型病例可能是由A群或者其他常见血清型转换而来,但需要进一步研究证实。
国内和欧美发达国家对X群流脑临床特征的研究较少,非洲研究报道的X群流脑临床特征显示,X群流脑的临床表现主要为发热、意识障碍,抽搐。意识障碍和抽搐较A群流脑更常见,男性更容易发病,平均年龄为5~14岁,1~9岁的儿童是受影响最严重的年龄组。相比A群流脑,X群流脑更容易发生致命性的结局,病死率更高。较流行期间,非流行期间发生的X群流脑病死率更高,预后更差[7]。本例患者在非流脑流行期间发病,临床表现主要为发热和意识障碍,病情进展迅速,发热时间长,出现严重的并发症,预后极差。因此,需要特别关注非流行期间,出现迅速进展的重症脑膜炎时需要考虑X群流脑的可能。
X流脑的诊断主要是通过对脑脊液Nm进行聚合酶链反应(PCR)鉴别出Nm X进行诊断。国内及非洲报道的Nm X群菌株对青霉素G、阿莫西林、头孢曲松敏感[4, 7],但Chen等[8]研究发现,Nm对抗菌药物的耐药性正在增加,在中国脑膜炎奈瑟菌对喹诺酮类药物的耐药率很高(>70%),超过一半的分离株通过3种共生奈瑟菌属的耐喹诺酮基因(gyrA)水平转移而获得耐药性,对青霉素的敏感性下降。有文献[6]报道X群流脑脑脊液很少出现明显化脓性改变,本例患者NmX对青霉素中度敏感,对头孢曲松敏感,对环丙沙星和复方磺胺甲
儿童X群流脑的抗菌药物治疗方案主要有青霉素或头孢曲松。本例患者发病2 d后出现昏迷,尽管发病初期,诊所立即使用了抗生素克林霉素治疗,但仍未能避免病情迅速加重而出现昏迷。入院后予经验性使用青霉素和头孢噻肟抗感染,但患者体温控制不理想,症状无明显好转,待血培养结果明确Nm X药敏后,选用头孢曲松联合氨苄西林治疗,患者症状逐渐好转。提示在使用抗生素治疗脑膜炎球菌之前需尽早确定Nm X群菌株对青霉素和第三代头孢的敏感性。Nm对头孢曲松的耐药率相对较低,可作为推荐使用药物。环丙沙星、利福平和头孢曲松被推荐用于全世界侵袭性脑膜炎球菌(invasive meningococcal disease, IMD)病例密切接触者的化学预防,以有效和迅速地控制IMD传播[9]。鉴于环丙沙星和磺胺药物的耐药性,本研究对接触该患者的家属、同学及医务人员使用利福平预防性治疗,未出现流脑继发病例。因此可推荐利福平作为预防Nm X感染的药物。
X群流脑并发症为休克、昏迷和运动感觉障碍,病死率高于A群流脑[7]。本患者为青少年,既往健康,免疫力正常,但出现了认知障碍、运动感觉缺陷、吞咽困难等严重并发症,其中吞咽困难是之前文献没有报道的。患者出现严重并发症,不能用药物敏感性、年龄来解释,且患者的密切接触者均未发现感染Nm X群。人类遗传易感基因在脑膜炎奈瑟菌感染易感性中起作用[10],建议对这种严重流脑患者进行基因测序检测,收集更完整的临床观察结果开展进一步的研究。
Nm X群感染中枢神经系统是致命的,进展非常快,尽管使用敏感抗生素起到很重要作用,患者神志恢复,但仍存在很严重的后遗症。因此,在非传染病暴发年代,对进展快、病情危重的脑膜炎仍需考虑流脑的可能,争取早诊断、早治疗,有针对性地选择抗菌药物治疗。同时需要加强对Nm血清群的监测,特别警惕新变种的出现,并为疾病暴发的预防和控制提供证据,指导快速公共卫生干预,防止耐药性Nm感染。
致谢: 衷心感谢湖南省CDC对本次调查给予的支持与帮助。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Ceyhan M, Gürler N, Ozsurekci Y, et al. Meningitis caused by Neisseria meningitidis, hemophilus influenzae type B and Streptococcus pneumoniae during 2005-2012 in Turkey. A multicenter prospective surveillance study[J]. Hum Vaccin Immunother, 2014, 10(9): 2706-2712. DOI:10.4161/hv.29678 |
| [2] |
Tzeng YL, Stephens DS. A narrative review of the W, X, Y, E, and NG of meningococcal disease: emerging capsular groups, pathotypes, and global control[J]. Microorganisms, 2021, 9(3): 519. DOI:10.3390/microorganisms9030519 |
| [3] |
Zhu BQ, Yao PP, Zhang LY, et al. Genetic analysis of Neisseria meningitidis sequence type 7 serogroup X originating from serogroup a[J]. Infect Immun, 2017, 85(6): e01019-16. |
| [4] |
张恒, 潘金仁, 姚苹苹, 等. 浙江省首例X群流行性脑脊髓膜炎病例调查分析[J]. 中华预防医学杂志, 2015, 49(6): 579-580. Zhang H, Pan JR, Yao PP, et al. Investigation and response for the first case of group X meningococcal disease in Zhejiang province[J]. Chinese Journal of Preventive Medicine, 2015, 49(6): 579-580. DOI:10.3760/cma.j.issn.0253-9624.2015.06.025 |
| [5] |
戴德芳, 李放军, 夏昕, 等. 1951—2016年湖南省流行性脑脊髓膜炎流行病学特征及菌群变迁趋势分析[J]. 实用预防医学, 2017, 24(12): 1440-1442. Dai DF, Li FJ, Xia X, et al. Epidemiological features of meningococcal meningitis and trend of serogroup switching of Neisseria meningitides strains in Hunan Province, 1951-2016[J]. Practical Preventive Medicine, 2017, 24(12): 1440-1442. DOI:10.3969/j.issn.1006-3110.2017.12.009 |
| [6] |
Rouphael NG, Stephens DS. Neisseria meningitidis: biology, microbiology, and epidemiology[J]. Methods Mol Biol, 2012, 799: 1-20. |
| [7] |
Delrieu I, Yaro S, Tamekloé TAS, et al. Emergence of epidemic Neisseria meningitidis serogroup X meningitis in Togo and Burkina Faso[J]. PLoS One, 2011, 6(5): e19513. DOI:10.1371/journal.pone.0019513 |
| [8] |
Chen ML, Zhang C, Zhang X, et al. Meningococcal quinolone resistance originated from several commensal Neisseria species[J]. Antimicrob Agents Chemother, 2020, 64(2): e01494-19. |
| [9] |
Zalmanovici Trestioreanu A, Fraser A, Gafter-Gvili A, et al. Antibiotics for preventing meningococcal infections[J]. Cochrane Database Syst Rev, 2013, 2013(10): CD004785. |
| [10] |
Hodeib S, Herberg JA, Levin M, et al. Human genetics of meningococcal infections[J]. Hum Genet, 2020, 139(6-7): 961-980. DOI:10.1007/s00439-020-02128-4 |



