新生儿重症监护病房(neonatal intensive care unit, NICU)是新生儿集中救治的场所,收治的新生儿因病情重、免疫力低下、接受操作多,成为医院感染的高风险人群,医院感染发生率为5.5%~40.0%[1-2]。研究[3]显示,NICU环境中物体表面细菌污染普遍,被污染的表面可成为潜在的病原体储存库,造成病原菌传播。输液是最常见和重要的救治措施,但会引起导管相关血流感染(catheter-related bloodstream infection, CRBSI)等并发症,进而延长住院时间、增加病死率和住院费用,其中,细菌从导管连接处(即输液连接装置)进入管腔是发生CRBSI的主要方式之一。输液连接装置是连接穿刺导管与输液管路用于留置输液的接头,也称输液连接器或输液接头,包括肝素帽、无针输液接头、三通接头。住院新生儿因病情危重,有时需要多个通道进行输液,且气管插管新生儿唾液、粪便等容易污染导管穿刺处和导管装置,增加了细菌被引入接口的风险。目前,输液管理更多关注消毒剂、消毒时间等对临床感染结局的影响,对输液连接器上微生物污染的具体情况及消毒后效果关注较少。本研究对某院2021年11月NICU中的输液连接器肝素帽和无针接头进行采样培养,了解输液连接器微生物定植污染情况并分析消毒效果,旨在为规范输液操作、降低输液接头所致导管相关感染提供依据。
1 对象与方法 1.1 研究对象采用便利抽样法选取2021年11月重庆市某三级甲等儿童专科医院NICU留置期间的输液接头共161个,包括正压接头137个(法国美德,批号50026319)和肝素帽24个(苏州林华医疗器械有限公司,批号20030003)。留置期间未消毒的输液接头为对照组(59个),常规消毒后的输液接头为观察A组(52个),输液接头消毒方法培训后再消毒的输液接头为观察B组(50个)。纳入标准为输液接头留置时间≥24 h。所有静脉输液导管均由取得资质的护士在无菌技术下置入,导管及其连接器按照CRBSI预防策略使用和维护。
1.2 方法 1.2.1 采样方法按照中华人民共和国国家标准GB 15982—2012《医院消毒卫生标准》[4]的微生物污染检查方法,由NICU医院感染控制专职护士分别对三组输液接头表面采样,并立即送细菌室培养。具体采样方法如下:采样员戴无菌手套,用浸有灭菌生理盐水的棉拭子在输液接头横切面采取横竖往返各涂抹5次,再沿输液接头侧面采取“圆周运动”顺时针、逆时针往返各涂抹5次,并随之转动棉拭子,将棉拭子放入含10 mL灭菌生理盐水的试管中。采样位置见图 1。
 |
| 图 1 输液接头消毒及采样位置 Figure 1 Disinfection and sampling sites of the infusion connector |
三组标本的采样时机分别为:①对照组新生儿完成所有输液治疗后断开输液接头与输液管路,暴露于病房环境4 h后进行采样;②观察A组及观察B组使用75%乙醇棉片擦拭消毒输液接头, 待干后进行采样。
1.2.2 细菌检测方法采用VITEK MS质谱仪、法国梅里埃全自动微生物鉴定及药敏分析系统、VITEK 2 Compact及配套的细菌鉴定卡和药敏卡。将培养物接种于哥伦比亚血琼脂平板和巧克力琼脂平板,置于5% CO2培养箱35℃培养,每天取出平板观察,根据菌落形态、是否溶血等情况将分离到的细菌接种血琼脂平板进行分离、纯化,观察菌落生长情况,挑取可疑菌落行质谱鉴定。
1.2.3 输液接头消毒培训由护士长根据2021美国静脉输液护理学会(INS)《静脉治疗实践标准》[5]对责任护士进行输液接头消毒方法集中培训。使用独立包装的5 cm×5 cm 75% 乙醇棉片(健尔康医疗科技股份有限公司,批号220928),一手固定输液接头下端,一手将棉片包裹输液接头,来回用力擦拭输液接头的横切面及侧面,消毒时间为15~20 s。
1.2.4 观察指标包括三组输液接头的病原菌培养结果和培训前后责任护士的输液接头消毒时间及消毒方法正确率。为还原临床操作的真实性,采样人员不告知标本采集目的,采样后调取床旁视频记录消毒时间,并由采样人员判定消毒方法是否正确。
1.2.5 统计学方法应用SPSS 26.0进行统计描述和分析,计量资料用均数±标准差(x±s)表示,计数资料用频数(%)表示。符合正态分布的计量资料采用独立样本t检验,不符合正态分布的计量资料采用Mann -Whitney U检验;计数资料三组比较采用χ2检验,两两组间比较采用Bonferroni法。以P≤0.05为差异有统计学意义。
2 结果 2.1 三组输液接头基本情况比较三组输液接头的输液留置管路[留置针和经外周静脉穿刺中心静脉置管(PICC)]、输液接头类型(正压接头和肝素帽),以及输入药物基本情况比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 输液接头基本情况[个(%)] Table 1 Basic condition of infusion collectors (No. of infusion collectors [%]) |
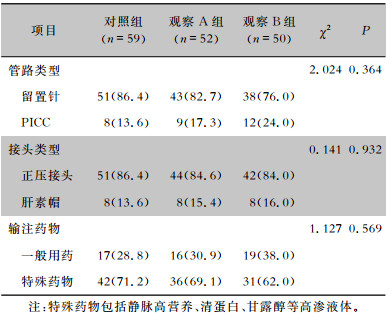
|
对照组共检出细菌68株,依次为表皮葡萄球菌(32株)、屎肠球菌(14株)、地衣芽孢杆菌(6株)、粪肠球菌(3株)、鲍曼不动杆菌(2株),蜡样芽孢杆菌、金黄色葡萄球菌、溶血葡萄球菌、藤黄微球菌、人葡萄球菌、头状葡萄球菌、少动鞘氨醇杆菌、产气肠杆菌、大肠埃希菌、肺炎克雷伯菌、白念珠菌各1株。对照组中,39个输液接头各检出1株病原菌,13个输液接头各检出2株病原菌,1个输液接头检出3株病原菌。观察A组检出表皮葡萄球菌8株,屎肠球菌、鲍曼不动杆菌各2株,头状葡萄球菌1株。观察B组检出表皮葡萄球菌、屎肠球菌各2株。不同组输液接头检出病原菌类别分布见表 2。
| 表 2 各组输液接头病原菌检出情况 Table 2 Detection of pathogenic bacteria from infusion co-llectors in each group |
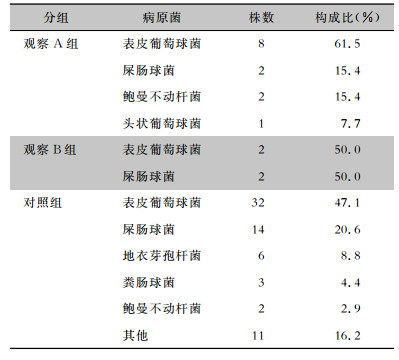
|
对照组、观察A组和观察B组病原菌检出率分别为89.8%、25.0%和8.0%。观察A组和观察B组输液接头的病原菌检出率均低于对照组,观察B组的病原菌检出率低于观察A组,差异均有统计学意义(均P<0.05)。见表 3。
| 表 3 三组输液接头病原菌检出情况 Table 3 Detection of pathogenic bacteria in three groups of infusion collectors |
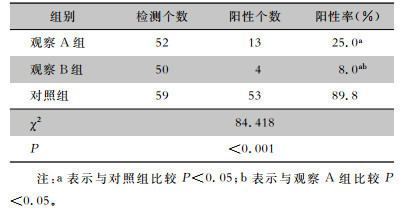
|
培训后责任护士的消毒方法正确率、平均消毒时长均优于培训前,差异有统计学意义(P<0.05),见表 4。消毒不正确的输液连接器的病原菌培养阳性率是消毒正确的输液连接器病原菌培养阳性率的3.7倍(1/0.27)。
| 表 4 培训前后责任护士消毒方法及消毒时间比较 Table 4 Comparison of disinfection methods and disinfection time before and after training of nurses |
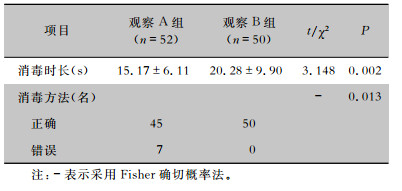
|
NICU环境中细菌普遍存在,输液连接器表面污染普遍,感染暴露风险高。本调查中输液连接器表面微生物定植率89.8%,提示输液装置被污染的概率大,输液过程存在潜在感染风险。医院是感染患者的聚集场所,其呼吸道、肠道定植着各种病原微生物,加上病房内人员流动、床位密集、医务人员大量接触患者及各类物品等原因,使医院成为病原菌存活的天然场所。赖龙龙[6]发现,机械通气新生儿痰培养结果中细菌定植率达72.5%,其中正常菌群为38.6%,致病菌为61.4%。新生儿口腔、鼻腔、呼吸道、肠道等多个部位均存在不同类型的细菌定植[7-9]。由于NICU需配备大量仪器设备,设备表面容易被病原微生物污染,使新生儿暴露于感染的高风险中;加上新生儿病情危重,有时需多个通道进行输液,气管插管新生儿唾液、粪便等容易污染导管穿刺处和导管装置,增加了细菌被引入接口的风险。Hankins等[10]采用中断输液、断开连接器后直接将连接器隔膜压在血琼脂板上的采样方法,计算出输液连接器微生物检出率为41.9%。本研究对已断开并暴露于环境中的输液接头进行采样,输液连接器微生物检出率为89.8%,高于上述研究,一方面可能与采样方法不同有关(Hankins等是对使用中的连接器进行采样,输液接头在采样前与输液管路相连,处于相对密闭状态),另一方面可能与采样环境不同有关(如小房间或单间病房)。环境污染可引起输液装置及输液过程的污染,病房静脉输液受污染的概率是洁净室的10倍,重症监护病房(ICU)的感染发病率更高[11-12]。我国一项三级甲等儿童医院细菌室分离菌株的流行病学调查[13]显示,NICU中新生儿耐碳青霉烯类肠杆菌检出率显著高于儿童,且呈明显上升趋势。因此,需做好对新生儿感染控制的管理,如:早产儿与足月儿、非感染新生儿与感染新生儿应分室或分区收治;对新生儿进行诊疗与操作时,应按照先非感染性疾病新生儿后感染性疾病新生儿的原则进行;做好新生儿口腔护理、沐浴、臀部护理等基础护理;落实新生儿病室医院感染的标准预防措施;进行有可能接触新生儿血、体液的诊疗、护理、清洁等工作时,应戴清洁手套,操作完毕后应脱去手套并立即洗手或进行卫生手消毒等。
输液连接器表面污染细菌种类多,应引起医护人员高度重视。本研究结果显示,输液连接器在未消毒的情况下细菌污染种类达16种,以非致病性的革兰阳性菌凝固酶阴性葡萄球菌为主。尽管凝固酶阴性葡萄球菌被认为是非致病菌,但对免疫力低下患者存在感染风险,因此凝固酶阴性葡萄球菌被认为是重要的医院感染病原体,也被认为是造成迟发型新生儿败血症的最常见原因和早发型新生儿感染最主要的诱发因素[14]。对照组输液接头处检出屎肠球菌,该细菌是肠道正常菌群,也是引起血流感染的重要病原菌之一。报道[15]显示,屎肠球菌主要来源于ICU及新生儿科,与革兰阴性菌血流感染相比,具有治疗难、预后差的特点。输液接头处还检出鲍曼不动杆菌、肺炎克雷伯菌等医院感染的重要病原菌。鲍曼不动杆菌在医院环境中广泛分布,且可长期存活,在物体表面可以存活数周甚至数月,引发患者呼吸道感染、败血症等。肺炎克雷伯菌在医院环境中广泛存在,可在物体表面存活超过30个月,在住院新生儿呼吸道和肠道定植率高,新生儿胎龄越低、体重越低、住院时间越长,肺炎克雷伯菌定植的风险也越高[7]。新生儿床单位、周围物品和使用器具污染概率较大,暴露于感染源的风险增加。因此,应结合细菌特点,加强NICU环境、物体表面和设施设备的清洁消毒。新生儿的一般性诊疗器械(听诊器、软尺、血压计腕带等)宜专床专用,并在新生儿出院后做好终末消毒;暖箱、辐射台、监护仪、输液泵每日擦拭消毒;对待用输液连接器,可采用无菌纱布包裹等方式,减少病原菌定植的发生。
消毒可降低输液连接器表面微生物的定植污染,应加强落实输液过程中输液连接器的消毒。污染的环境表面与医院感染有很大关联,清洁和消毒可以降低医疗设施物体表面微生物的负荷,减少医院感染的发生[16-17]。本研究中,对照组、观察A组和观察B组的微生物检出率分别为89.8%、25.0%和8.0%,与未消毒相比,使用乙醇棉片对输液连接器进行擦拭,可显著减少细菌量,说明在输液前对输液连接器进行消毒的必要性。消毒效果受擦拭时间、消毒剂类型、消毒剂作用时间、消毒手法、连接器材质与工艺等多方面影响[5]。本调查显示,使用不正确的消毒方法(如没有用力擦拭或擦拭面积不够)时,输液接头培养阳性率是消毒方法正确时的3.7倍,说明实施正确的消毒方法对减少细菌定植非常重要。2021版《输液治疗实践标准》[5]推荐输液连接器消毒时间需≥15 s;但也有研究[18]表明,采用5 s或15 s去污方案后检测的细菌数量差异无统计学意义。本研究显示,不同消毒时间(5~10 s、10~20 s,>20 s)的消毒效果比较,差异无统计学意义,与Casey等[18]的研究一致。这提示,当存在广泛的污染时,对于某些输液连接器即使延长消毒时间,也不足以从注射部位清除所有微生物,其原因可能是消毒剂没有完全渗透到输液接头的凹槽中。此外,消毒后待干可确保有效消毒效果。70%异丙醇的干燥时间为5 s,乙醇氯己定复合液干燥时间为20 s,聚维酮碘需要超过6 min才能彻底干燥。待干时间太长不适合临床,因此,选择合适的消毒剂至关重要。相比于灭菌,消毒的无菌保证水平低,不同消毒剂的消毒效果不尽相同。除消毒剂的化学作用外,反复擦拭输液连接器进行消毒,即,对输液接口及周围部位采取“往复运动”或“圆周运动”进行物理机械去污也很重要。但临床实践中,消毒手法因人而异,效果也有差异。
输液所致感染发生率高,需加强对输液连接器使用的管理。据统计,外周静脉输液所致CRBSI发病率0.1%,PICC所致住院患者感染发病率2.4%[19]。CRBSI是医院感染防控的重点监测指标,但目前相关部门侧重于结局指标的追踪,并未将使用中的输液连接器纳入常规医院感染物体表面进行监测,临床科室也很少将其作为独立项目进行管理、督查和培训,导致临床医护人员使用输液连接器缺乏规范可循。尽管指南和规范均要求在连接输液管路或进行注射时消毒,但此步骤仍经常被忽略。调查[20]显示,31%的临床医生使用输液连接器时没有消毒。虽然本研究中,输液连接器消毒培训后病原菌检出率由25.0%降为8.0%,但即使经过特定教育,输液连接器消毒效果也很差(< 50%)[21]。为减少细菌定植,一种含消毒剂的输液连接器保护装置—消毒帽已被应用,这种消毒帽通过使输液连接器与消毒剂持续接触而被动发挥作用,使输液接口下次使用前一直处于“消毒+保护”状态。尽管消毒帽可减少连接器细菌定植,但细菌定植率仍高达23.1%[10]。由于此类消毒帽价格较贵,目前国内未能普遍使用。因此,减少输液所致感染,仍需持续关注输液中的管理,并继续探寻更加有效的消毒方法。
新生儿病房环境中细菌易定植,输液连接器易污染,需加强对环境的清洁消毒和输液过程中的消毒管理,以降低血流感染风险。本研究数据收集在床边完成,能代表临床护理期间的输液器细菌定植风险,也比较真实地反映临床工作的情景。本研究为单中心采样,样本量较少,没有评估追踪新生儿血流感染结果,因此,无法推断细菌定植、消毒效果与血流感染的相关性或因果关系,未来可通过多中心研究及扩大样本量,追踪输液连接器细菌定植与感染的相关性等,进一步探寻不同地域不同场所新生儿输液管理中的定植及感染问题。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Newby J. Nosocomial infection in neonates: inevitable or preventable?[J]. J Perinat Neonatal Nurs, 2008, 22(3): 221-227. DOI:10.1097/01.JPN.0000333923.45575.04 |
| [2] |
Auriti C, Ronchetti MP, Pezzotti P, et al. Determinants of nosocomial infection in 6 neonatal intensive care units: an Ita-lian multicenter prospective cohort study[J]. Infect Control Hosp Epidemiol, 2010, 31(9): 926-933. DOI:10.1086/655461 |
| [3] |
Huslage K, Rutala WA, Sickbert-Bennett E, et al. A quantitative approach to defining "high-touch" surfaces in hospitals[J]. Infect Control Hosp Epidemiol, 2010, 31(8): 850-853. DOI:10.1086/655016 |
| [4] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 医院消毒卫生标准: GB 15982—2012[S]. 北京: 中国标准出版社, 2012. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, China National Standardization Administration. Hygienic standard for disinfection in hospitals: GB 15982-2012[S]. Beijing: Standards Press of China, 2012. |
| [5] |
Gorski LA, Hadaway L, Hagle ME, et al. Infusion therapy standards of practice, 8th edition[J]. J Infus Nurs, 2021, 44(1S): S1-S224. DOI:10.1097/NAN.0000000000000396 |
| [6] |
赖龙龙. 新生儿重症监护室细菌定植和感染的监测[J]. 国际感染病学(电子版), 2019, 8(4): 25-27. Lai LL. Surveillance of bacterial colonization and infection in the neonatal intensive care unit[J]. International Infections Diseases (Electronic Edition), 2019, 8(4): 25-27. |
| [7] |
殷丽军, 杨韦菁, 缪瑾, 等. 新生儿重症监护患者耐碳青霉烯类肺炎克雷伯菌定植发展为感染的危险因素分析[J]. 中国感染控制杂志, 2022, 21(1): 15-21. Yin LJ, Yang WJ, Miao J, et al. Risk factors for development of infection from colonization of carbapenem-resistant Klebsiella pneumoniae in neonates in neonatal intensive care unit[J]. Chinese Journal of Infection Control, 2022, 21(1): 15-21. |
| [8] |
李文婷, 耿文静, 姚开虎, 等. 新生儿重症监护室金黄色葡萄球菌定植菌株的耐药性及生物膜形成能力研究[J]. 中国抗生素杂志, 2022, 47(3): 289-294. Li WT, Geng WJ, Yao KH, et al. Antibiotic resistance and biofilm formation of Staphylococcus aureus colonization among neonatal intensive care units[J]. Chinese Journal of Antibio-tics, 2022, 47(3): 289-294. DOI:10.3969/j.issn.1001-8689.2022.03.014 |
| [9] |
王红, 郁洁, 王博, 等. 住院新生儿鼻腔和体表定植金黄色葡萄球菌的分子特征及耐药性[J]. 中国循证儿科杂志, 2021, 16(5): 379-383. Wang H, Yu J, Wang B, et al. Molecular characteristics and antibiotic resistance of colonized Staphylococcus aureus at mucosal and skin surface in hospitalized neonates[J]. Chinese Journal of Evidence Based Pediatrics, 2021, 16(5): 379-383. DOI:10.3969/j.issn.1673-5501.2021.05.010 |
| [10] |
Hankins R, Majorant OD, Rupp ME, et al. Microbial colonization of intravascular catheter connectors in hospitalized patients[J]. Am J Infect Control, 2019, 47(12): 1489-1492. DOI:10.1016/j.ajic.2019.05.024 |
| [11] |
Daisy JA, Abrutyn EA, MacGregor RR. Inadvertent administration of intravenous fluids contaminated with fungus[J]. Ann Intern Med, 1979, 91(4): 563-565. DOI:10.7326/0003-4819-91-4-563 |
| [12] |
Sengul T, Guven B, Ocakci AF, et al. Connectors as a risk factor for blood-associated infections (3-way stopcock and needleless connector): a randomized-experimental study[J]. Am J Infect Control, 2020, 48(3): 275-280. DOI:10.1016/j.ajic.2019.08.020 |
| [13] |
蒋思远, 曹云. 新生儿耐碳青霉烯类肠杆菌感染的防治[J]. 中国小儿急救医学, 2021, 28(2): 92-97. Jiang SY, Cao Y. Prevention and treatment of carbapenem-resistant Enterobacteriaceae infection in neonates[J]. Chinese Pediatric Emergency Medicine, 2021, 28(2): 92-97. DOI:10.3760/cma.j.issn.1673-4912.2021.02.003 |
| [14] |
Sgro M, Shah PS, Campbell D, et al. Early-onset neonatal sepsis: rate and organism pattern between 2003 and 2008[J]. J Perinatol, 2011, 31(12): 794-798. DOI:10.1038/jp.2011.40 |
| [15] |
陈胜会, 董亮, 张秀红, 等. 血培养分离肠球菌属细菌的分布及耐药性[J]. 中国感染控制杂志, 2017, 16(11): 1004-1007. Chen SH, Dong L, Zhang XH, et al. Distribution and antimicrobial resistance of Enterococcus spp. isolated from blood culture[J]. Chinese Journal of Infection Control, 2017, 16(11): 1004-1007. DOI:10.3969/j.issn.1671-9638.2017.11.003 |
| [16] |
Gebel J, Exner M, French G, et al. The role of surface disinfection in infection prevention[J]. GMS Hyg Infect Control, 2013, 8(1): Doc10. |
| [17] |
Loveday HP, Wilson JA, Pratt RJ, et al. Epic3: national evidence-based guidelines for preventing healthcare-associated infections in NHS hospitals in England[J]. J Hosp Infect, 2014, 86(Suppl 1): S1-S70. |
| [18] |
Casey AL, Karpanen TJ, Nightingale P, et al. The risk of microbial contamination associated with six different needle-free connectors[J]. Br J Nurs, 2018, 27(2): S18-S26. DOI:10.12968/bjon.2018.27.2.S18 |
| [19] |
Maki DG, Kluger DM, Crnich CJ. The risk of bloodstream infection in adults with different intravascular devices: a systema- tic review of 200 published prospective studies[J]. Mayo Clin Proc, 2006, 81(9): 1159-1171. DOI:10.4065/81.9.1159 |
| [20] |
Slater K, Cooke M, Whitby M, et al. Microorganisms present on peripheral intravenous needleless connectors in the clinical environment[J]. Am J Infect Control, 2017, 45(8): 932-934. DOI:10.1016/j.ajic.2017.02.008 |
| [21] |
Drews FA. An evaluation of methods to reduce Ⅳ catheter related bloodstream infections[J]. Am J Infect Control, 2013, 41(6S): S91. |



