2. 中南大学湘雅三医院检验科, 湖南 长沙 410013;
3. 中南大学湘雅医院医院感染控制中心, 湖南 长沙 410008;
4. 湖南省细菌耐药监测网办公室, 湖南 长沙 410008;
5. 浏阳市中医医院检验科, 湖南 浏阳 410300;
6. 中南大学湘雅医院检验科, 湖南 长沙 410008;
7. 湘潭市中心医院检验科, 湖南 湘潭 411100;
8. 湖南中医药大学第一附属医院医学检验与病理中心, 湖南 长沙 410007;
9. 长沙市中心医院检验科, 湖南 长沙 410004;
10. 长沙市第一医院检验科, 湖南 长沙 410005;
11. 张家界市人民医院检验科, 湖南 张家界 427000;
12. 郴州市第一人民医院检验医学中心, 湖南 郴州 423000;
13. 湖南省医院感染管理质量控制中心, 湖南 长沙 410008;
14. 国家老年疾病临床医学研究中心(湘雅医院), 湖南 长沙 410008
2. Department of Laboratory Medicine, The Third Xiangya Hospital of Central South University, Changsha 410013, China;
3. Center for Healthcare-associated Infection Control, Xiang-ya Hospital, Central South University, Changsha 410008, China;
4. Hunan Provincial Antimicrobial Resistance Surveillance System Office, Changsha 410008, China;
5. Department of Laboratory Medicine, Liuyang Traditional Chinese Medicine Hospital, Liuyang 410300, China;
6. Department of Laboratory Medicine, Xiangya Hospital, Central South University, Changsha 410008, China;
7. Department of Laboratory Medicine, Xiangtan Central Hospital, Xiangtan 411100, China;
8. Medical Laboratory and Pathology Center, The First Hospital of Hunan University of Chinese Medicine, Changsha 410007, China;
9. Department of Laboratory Medicine, Changsha Central Hospital, Changsha 410004, China;
10. Department of Laboratory Medicine, The First Hospital of Changsha, Changsha 410005, China;
11. Department of Laboratory Medicine, Zhangjiajie People's Hospital, Zhangjiajie 427000, China;
12. Center of Laboratory Medicine, The First People's Hospital of Chenzhou, Chenzhou 423000, China;
13. Hunan Provincial Healthcare-associated Infection Management Quality Control Center, Changsha 410008, China;
14. National Clinical Research Center for Geriatric Disorders[Xiangya Hospital], Changsha 410008, China
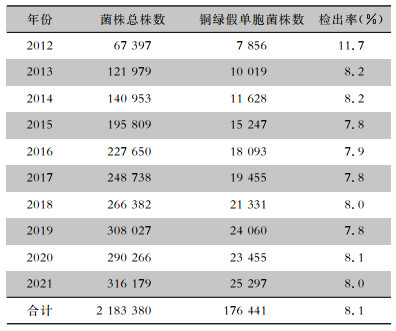
随着临床常见微生物耐药问题日趋严重,多重耐药菌检出增加给临床抗感染治疗带来了极大挑战[1]。由于不同地区,甚至同一地区不同医院中耐药细菌的流行分布也会有区别,因此需要抗微生物药物临床监测系统充分发挥监测作用。湖南省细菌耐药监测网成立于2011年,依托湖南省医院感染管理质量控制中心建立,覆盖了该省所有区县,是全省规模最大的细菌耐药监测网[2-3]。2012—2021年10年间共监测细菌2 183 380株,其中铜绿假单胞菌176 441株,检出率为8.1%。现将铜绿假单胞菌对临床常见抗菌药物的耐药情况总结如下。
1 资料与方法 1.1 数据来源全部监测数据来自2012—2021年湖南省细菌耐药监测网成员单位。各监测网点医院将细菌监测数据从医院信息系统、药物敏感性(药敏)测定系统直接导入或手工录入WHONET软件,通过湖南省细菌耐药监测网上报,要求上报细菌药敏的最低抑菌浓度(MIC)值或抑菌圈直径。经数据审核,2012—2021年纳入数据分析的医院数分别为162、162、166、164、161、163、163、166、165、162所。
1.2 技术方案细菌鉴定方法、质控菌株选择及测试抗菌药物种类参照全国细菌耐药监测网(CARSS)技术方案执行[4]。药敏试验结果按照美国临床实验室标准化协会(Clinical & Laboratory Standards Institute, CLSI)推荐的《抗微生物药物敏感性试验执行标准2022年版》[5](M100第32版)进行判断,结果分为敏感(S)、中介/剂量依赖型敏感(I/SDD)、耐药(R)三种情况,文中I/SDD结果未列出。头孢哌酮/舒巴坦无药敏解释折点,参照头孢哌酮折点判断[6-7]。替加环素采用美国食品药品监督管理局(food and drug administration, FDA)推荐的折点[8]。多黏菌素B参考欧盟药敏试验标准委员会(European committee on antimicrobial susceptibility testing, EUCAST)推荐折点[9]。
1.3 统计分析依据每例患者相同标本统计第一株菌的原则剔除重复菌株。应用WHONET 5.6软件进行药敏结果分析。计数资料用数字及构成比表示,应用SPSS对数据进行趋势性检验(Cochran-Armitage检验)及卡方检验。在Cochran-Armitage检验中,Pearson系数>0表示正相关,<0表示负相关。P≤0.05表示差异有统计学意义。
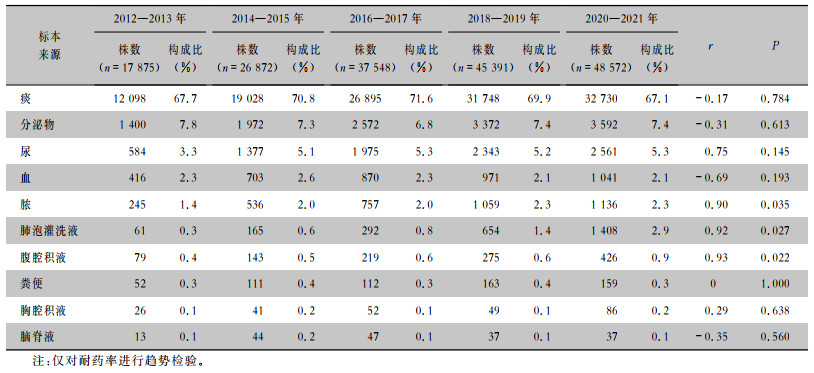
2 结果 2.1 细菌分布湖南省耐药监测网自2012年起覆盖湖南省所有区县,至2021年共收集铜绿假单胞菌非重复菌株176 441株,其中,99.4%(175 399株)的菌株分离自住院患者,8.4%(14 739株)来源于儿童(0~17岁),91.6%(161 702)来源于成人。10年间,铜绿假单胞菌的检出率比较稳定,除2012年为11.7%,2013—2021年的检出率为7.8%~8.2%,见表 1。分离培养出铜绿假单胞菌居前5位的标本为痰(67.1%~71.6%)、分泌物(6.8%~7.8%)、尿(3.3%~5.3%)、血(2.1%~2.6%)和脓(1.4%~2.3%)。其中,痰标本构成比最高;腹腔积液、胸腔积液、脑脊液和粪便的构成比偏低,不超过1%;脓、肺泡灌洗液、腹腔积液的构成比随时间升高,见表 2。
| 表 1 2012—2021年湖南省细菌耐药监测网铜绿假单胞菌在临床菌株中的检出情况 Table 1 Detection of P. aeruginosa in clinically isolated bacteria, Hunan Provincial Antimicrobial Resis-tance Surveillance System, 2012-2021 |
|
| 表 2 2012—2021年湖南省细菌耐药监测网铜绿假单胞菌主要标本来源分布 Table 2 Distribution of major specimen sources of P. aeruginosa, Hunan Provincial Antimicrobial Resistance Surveillance System, 2012-2021 |
|
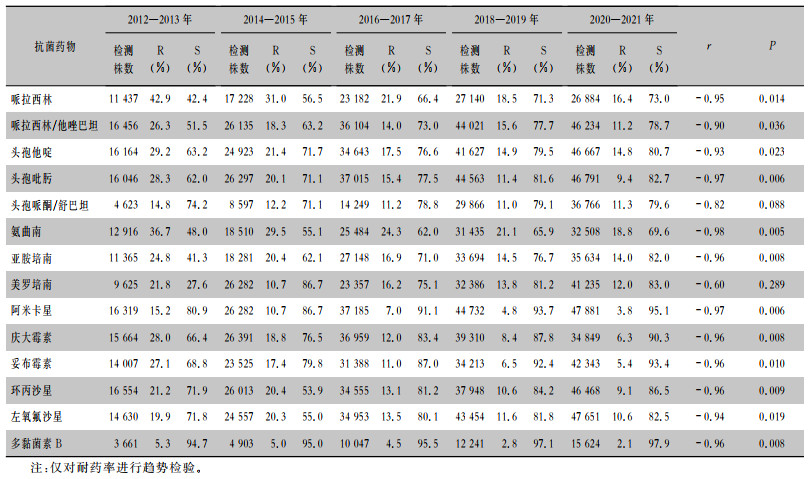
10年间铜绿假单胞菌对多黏菌素B最敏感,耐药率低于6%,对头孢吡肟、美罗培南、亚胺培南和头孢他啶的耐药率为9.4%~29.2%。2012—2021年铜绿假单胞菌对哌拉西林、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、氨曲南、亚胺培南、阿米卡星、庆大霉素、妥布霉素、环丙沙星、左氧氟沙星、多黏菌素B的耐药率均呈下降趋势(均P<0.001)。见表 3。
| 表 3 2012—2021年湖南省细菌耐药监测网铜绿假单胞菌的药敏试验结果 Table 3 Antimicrobial susceptibility testing results of P. aeruginosa, Hunan Provincial Antimicrobial Resistance Surveillance System, 2012-2021 |
|
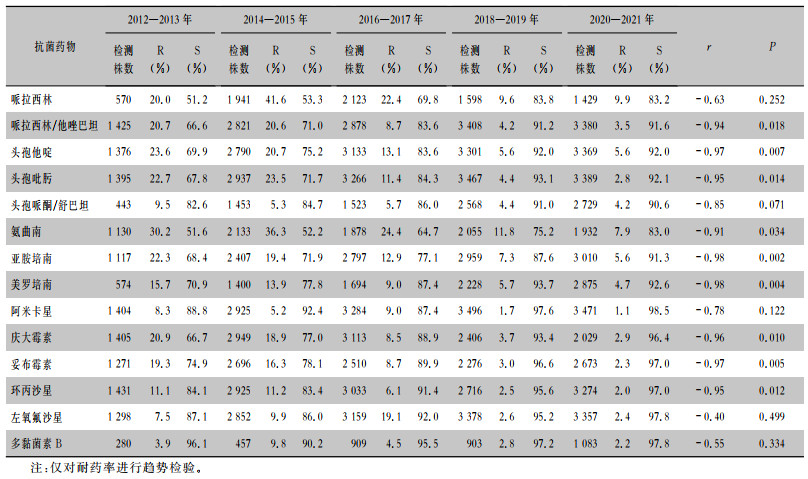
对14 739株分离自儿童的铜绿假单胞菌进行监测,10年间儿童分离株对碳青霉烯类药物耐药率呈下降趋势。对亚胺培南耐药率从22.3%下降至5.6%,对美罗培南耐药率从15.7%下降至4.7%;对哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、氨曲南、亚胺培南、美罗培南、庆大霉素、妥布霉素、环丙沙星的耐药率均呈下降趋势,见表 4。
| 表 4 2012—2021年湖南省细菌耐药监测网铜绿假单胞菌儿童分离株的药敏试验结果 Table 4 Antimicrobial susceptibility testing results of P. aeruginosa from children, Hunan Provincial Antimicrobial Resis-tance Surveillance System, 2012-2021 |
|
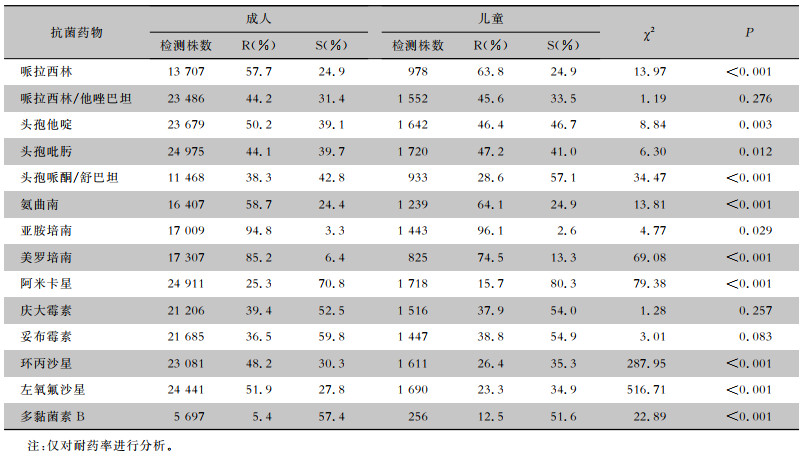
本次监测共检出CRPA 29 920株,CRPA 10年的平均分离率为18.0%,成人CRPA检出率(18.5%,28 154/151 850)高于儿童(12.3%,1 766/14 321)。CRPA检出率逐年下降,成人检出率从28.8%下降到15.7%,儿童检出率从23.5%下降到6.2%,见图 1。科室分布来看,CRPA主要来源于住院患者,检出率为68.7%(20 555株);住院患者中,重症监护病房(ICU)CRPA检出率最高,为14.4%(2 959/20 555)。标本分布来看,CRPA主要来源于痰(77.1%,23 062株),其次为分泌物(4.2%,1 260株)、尿(3.4%,1 003株)、血(1.7%,497株)。成人检出的CRPA对哌拉西林、头孢吡肟、氨曲南、亚胺培南和多黏菌素B的耐药率低于儿童检出CRPA的耐药率(均P<0.05),而对头孢他啶、头孢哌酮/舒巴坦、美罗培南、阿米卡星、环丙沙星和左氧氟沙星的耐药率前者均高于后者(均P<0.01),见表 5。
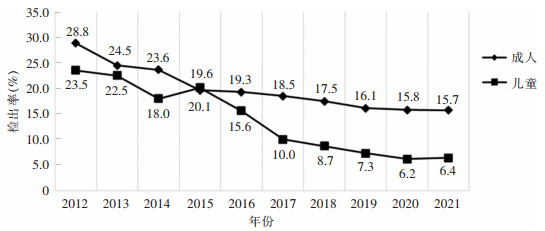 |
| 图 1 2012—2021年湖南省细菌耐药监测网CRPA检出率变化趋势 Figure 1 Changing trend in detection rates of CRPA, Hunan Province Antimicrobial Resistance Surveillance System, 2012-2021 |
| 表 5 2012—2021年湖南省细菌耐药监测网CRPA的药敏试验结果 Table 5 Antimicrobial susceptibility testing results of CRPA, Hunan Provincial Antimicrobial Resistance Surveillance System, 2012-2021 |
|
铜绿假单胞菌是临床常见的革兰阴性杆菌,自然界分布广泛,可从人体皮肤表面分离,还可污染医疗器械甚至消毒剂,具有易定植、易变异和多耐药的特点[10]。铜绿假单胞菌为条件致病菌,是引起医院感染的主要病原体之一,可以引起肺炎、尿路感染、菌血症、神经外科术后脑膜炎、皮肤软组织及外科手术后感染。由于其耐药严重,易形成生物膜,特别是近十多年来CRPA的出现,使治疗更为困难[11]。
2012—2021年湖南省细菌耐药监测系统共监测铜绿假单胞菌非重复菌株176 441株,其中99.4%的菌株分离自住院患者;儿童来源的铜绿假单胞菌占8.4%,成人来源的铜绿假单胞菌占91.6%。铜绿假单胞菌的检出率比较稳定,约为8%,与CARSS[12]的数据一致。该菌主要来源为呼吸道标本,约占70%,各年分离率波动幅度小;其次来源于分泌物、尿、血和脓,这五类标本的检出率约为90%;剩下约10%来源于腹腔积液、胸腔积液、脑脊液和粪便等标本。呼吸道标本成为菌株主要来源,除了与呼吸道标本本身所占比例较高有关外,也可能与铜绿假单胞菌的荚膜多糖使细菌更易黏附在呼吸道细胞表面有关[13]。从增长趋势看,脓、肺泡灌洗液、腹腔积液的构成比随时间升高。就呼吸道标本而言,肺泡灌洗液质量高于痰标本,在辅助诊断呼吸道感染性疾病,如肺结核、侵袭性肺曲霉病等疾病时,多采集肺泡灌洗液行病原菌培养或二代测序等检测[14-15]。
药敏结果显示,2012—2021年湖南省铜绿假单胞菌对各抗菌药物的平均耐药率均<25%;对多黏菌素B最敏感,耐药率<5.3%;对头孢吡肟、美罗培南、亚胺培南和头孢他啶的耐药率为12.0%~29.2%;对哌拉西林、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、氨曲南、亚胺培南、阿米卡星、庆大霉素、妥布霉素、环丙沙星、左氧氟沙星、多黏菌素B的耐药率均呈下降趋势,与CARSS[12]一致。
近10年革兰阴性杆菌对碳青霉烯类药物耐药率呈上升趋势,其中肠杆菌目细菌占比最大;CRPA 10年的平均分离率为18.0%,成人检出率(18.5%)高于儿童(12.3%),检出率逐年下降,成人检出率从最高28.8%下降到15.7%,儿童检出率从最高23.5% 下降到6.2%。可能与各级医院加强抗菌药物管理,严格把控抗菌药物使用指征,合理合规使用抗菌药物等举措有关[16]。10年间铜绿假单胞菌儿童株碳青霉烯类药物耐药率明显下降,亚胺培南耐药率从22.3%下降至5.6%,美罗培南从15.7%下降至4.7%,与全省检出的铜绿假单胞菌对碳青霉烯类药物耐药率呈下降趋势一致,而从CARSS公布的数据[12]来看,全国检出的铜绿假单胞菌对碳青霉烯类药物耐药率比较平稳,说明近几年该省在铜绿假单胞菌的感染治疗上,对碳青霉烯类药物管理控制方面的工作富有成效。比较成人检出CRPA的耐药率与儿童检出CRPA的耐药率发现,对哌拉西林、头孢吡肟、氨曲南、亚胺培南和多黏菌素B的耐药率前者低于后者,而对头孢他啶、头孢哌酮/舒巴坦、美罗培南、阿米卡星、环丙沙星和左氧氟沙星的耐药率前者则高于后者。
碳青霉烯类抗菌药物是治疗非发酵菌感染的最有效药物之一。近年来,随着该类药物的广泛使用,细菌对其耐药率也在逐渐提高。铜绿假单胞菌有多种天然和获得性耐药途径,耐药机制复杂,包括非产酶机制及产酶机制。非产酶机制主要与膜孔蛋白OprD2的缺失有关。铜绿假单胞菌外膜上的OprD蛋白是碳氢酶烯类药物进入细菌的重要通道,OprD蛋白的变化使抗菌药物通过外膜的量减少,从而产生耐药。CRPA外膜蛋白缺失率高达74.3%,导致其对亚胺培南100%耐药,对美罗培南耐药率达72.5%[17]。CRPA的产酶耐药机制中最常产生β-内酰胺酶(如AmpC酶),可介导对青霉素和头孢菌素类药物耐药;部分菌株产金属酶(如IMP和VIM型),介导对碳氢酶烯类药物耐药[18-19]。通过对10年CRPA平均耐药率的分析可以看出,CRPA对亚胺培南耐药率94.9%,高于美罗培南的84.7%,两者耐药率差异较大,说明湖南省CRPA对碳青霉烯类药物的耐药机制除了产酶机制外还包括非产酶机制。CRPA对其他β-内酰胺类抗生素的耐药率均>28.6%,但对多黏菌素B耐药率最低(<12.5%),提示多黏菌素B治疗CRPA的临床应用价值较高。
人体或环境中的铜绿假单胞菌可能在医疗机构内引起医院感染暴发,特别是CRPA引起的感染治疗更困难,病死率更高,因此预防和控制铜绿假单胞菌感染尤其重要。加强手卫生和环境清洁消毒,进行患者隔离及接触预防等基本措施,都是预防和控制铜绿假单胞菌感染的重要手段[20]。本研究主要统计了2012—2021年湖南省耐药监测网监测的铜绿假单胞菌非重复菌株的检出率、标本构成比,以及对主要抗菌药物的耐药率等情况,有助于准确掌握该地区细菌感染的组成特点及耐药性变化,指导临床合理选择敏感抗菌药物,降低细菌耐药率。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Jurado-Martín I, Sainz-Mejías M, McClean S. Pseudomonas aeruginosa: an audacious pathogen with an adaptable arsenal of virulence factors[J]. Int J Mol Sci, 2021, 22(6): 3128. DOI:10.3390/ijms22063128 |
| [2] |
湖南省人民政府. 我省建立医疗机构细菌耐药监测网[EB/OL]. (2011-11-28)[2022-11-25]. http://www.hunan.gov.cn/hnszf/hnyw/zwdt/201212/t20121210_4733059.html. Hunan Provincial People' Government. Establishing a bacterial resistance monitoring network for medical institutions in our province[EB/OL]. (2011-11-28)[2022-11-25]. http://www.hunan.gov.cn/hnszf/hnyw/zwdt/201212/t20121210_4733059.html. |
| [3] |
文细毛, 付陈超, 任南, 等. 湖南省细菌耐药监测网2011年度监测报告[J]. 中国感染控制杂志, 2012, 11(5): 321-327. Wen XM, Fu CC, Ren N, et al. Hunan provincial bacterial antimicrobial-resistance surveillance system: 2011 surveillance report[J]. Chinese Journal of Infection Control, 2012, 11(5): 321-327. |
| [4] |
全国细菌耐药监测网. 《全国细菌耐药监测网技术方案(2022年版)》修订说明[EB/OL]. (2022-04-06)[2022-11-15]. http://carss.cn/Notice/Details/823. China Antimicrobial Resistance Surveillance System. Revision explanation of the technical plan for the China Antimicrobial Resistance Surveillance System (2022 edition)[EB/OL]. (2022-04-06)[2022-11-15]. http://carss.cn/Notice/Details/823. |
| [5] |
CLSI. CLSI publishes M100-performance standards for antimicrobial susceptibility testing, 32nd edition[EB/OL]. (2022-03-15)[2023-08-01]. https://clsi.org/about/press-releases/clsi-publishes-m100-performance-standards-for-antimicrobial-susceptibility-testing-32nd-edition.
|
| [6] |
Barry AL, Jones RN. Criteria for disk susceptibility tests and quality control guidelines for the cefoperazone-sulbactam combination[J]. J Clin Microbiol, 1988, 26(1): 13-17. DOI:10.1128/jcm.26.1.13-17.1988 |
| [7] |
Jones RN, Barry AL, Packer RR, et al. in vitro antimicrobial spectrum, occurrence of synergy, and recommendations for dilution susceptibility testing concentrations of the cefoperazone-sulbactam combination[J]. J Clin Microbiol, 1987, 25(9): 1725-1729. DOI:10.1128/jcm.25.9.1725-1729.1987 |
| [8] |
Food and Drug Administration. Tigecycline-injection produ-cts[EB/OL]. (2023-01-26)[2023-08-04]. https://www.fda.gov/drugs/development-resources/tigecycline-injection-products.
|
| [9] |
Satlin MJ, Lewis JS, Weinstein MP, et al. Clinical and laboratory standards institute and European committee on antimicrobial susceptibility testing position statements on polymyxin B and colistin clinical breakpoints[J]. Clin Infect Dis, 2020, 71(9): e523-e529. |
| [10] |
Araya S, Gebreyohannes Z, Tadlo G, et al. Epidemiology and multidrug resistance of Pseudomonas aeruginosa and Acinetobacter baumanni isolated from clinical samples in Ethiopia[J]. Infect Drug Resist, 2023, 16: 2765-2773. DOI:10.2147/IDR.S402894 |
| [11] |
Islam OK, Islam I, Saha O, et al. Genomic variability correlates with biofilm phenotypes in multidrug resistant clinical isolates of Pseudomonas aeruginosa[J]. Sci Rep, 2023, 13(1): 7867. DOI:10.1038/s41598-023-35056-0 |
| [12] |
全国细菌耐药监测网. 全国细菌耐药监测网2014-2019年细菌耐药性监测报告[J]. 中国感染控制杂志, 2021, 20(1): 15-30. China Antimicrobial Resistance Surveillance System. Antimicrobial resistance of bacteria: surveillance report from China Antimicrobial Resistance Surveillance System in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(1): 15-30. |
| [13] |
Marei EM. Isolation and characterization of Pseudomonas aeruginosa and its virulent bacteriophages[J]. Pak J Biol Sci, 2020, 23(4): 491-500. DOI:10.3923/pjbs.2020.491.500 |
| [14] |
Wu XC, Liang RB, Xiao YQ, et al. Application of targeted next generation sequencing technology in the diagnosis of Mycobacterium tuberculosis and first line drugs resistance directly from cell-free DNA of bronchoalveolar lavage fluid[J]. J Infect, 2023, 86(4): 399-401. DOI:10.1016/j.jinf.2023.01.031 |
| [15] |
Ledoux MP, Herbrecht R. Invasive pulmonary aspergillosis[J]. J Fungi (Basel), 2023, 9(2): 131. DOI:10.3390/jof9020131 |
| [16] |
陆章平, 张红微, 耿方敏, 等. 2019-2022年甘肃省ICU病原菌分布及耐药性[J]. 中国感染控制杂志, 2023, 22(6): 646-654. Lu ZP, Zhang HW, Geng FM, et al. Distribution and antimicrobial resistance of pathogens from intensive care units in Gansu Province from 2019 to 2022[J]. Chinese Journal of Infection Control, 2023, 22(6): 646-654. |
| [17] |
Lister PD, Wolter DJ, Hanson ND. Antibacterial-resistant Pseudomonas aeruginosa: clinical impact and complex regulation of chromosomally encoded resistance mechanisms[J]. Clin Microbiol Rev, 2009, 22(4): 582-610. DOI:10.1128/CMR.00040-09 |
| [18] |
朱蓓伟, 吴芳芳, 潘晓夫, 等. 耐碳青霉烯类铜绿假单胞菌耐药基因的研究[J]. 中国卫生检验杂志, 2019, 29(8): 937-940. Zhu BW, Wu FF, Pan XF, et al. Research on resistance genotype of carbapenems-resistant Pseudomonas aeruginosa[J]. Chinese Journal of Health Laboratory Technology, 2019, 29(8): 937-940. |
| [19] |
Zhu YW, Chen J, Shen H, et al. Emergence of ceftazidime- and avibactam-resistant Klebsiella pneumoniae carbapenemase-producing Pseudomonas aeruginosa in China[J]. mSystems, 2021, 6(6): e0078721. DOI:10.1128/mSystems.00787-21 |
| [20] |
中华医学会呼吸病学分会感染学组. 中国铜绿假单胞菌下呼吸道感染诊治专家共识(2022年版)[J]. 中华结核和呼吸杂志, 2022, 45(8): 739-752. Pulmonary Infection Assembly of Chinese Thoracic Society. Chinese expert consensus on the management of lower respiratory tract infections of Pseudomonas aeruginosa in adults(2022)[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2022, 45(8): 739-752. |



