纹带棒状杆菌是棒状杆菌属的一种机会性致病菌,近年来该菌引起的临床感染病例逐年增加,同时临床耐药菌感染甚至多重耐药菌感染病例也逐渐增多,该菌在临床上呈多重耐药趋势,感染后如不及时治疗可导致死亡[1]。本文对国内外相关研究进行总结,综述纹带棒状杆菌感染及耐药现状。
1 纹带棒状杆菌的病原学特点棒状杆菌属(Corynebacterium)为革兰阳性菌,菌体粗细不一,常一端或两端膨大呈棒状,故被称为棒状杆菌,是自然界中广泛分布的无孢子菌。该菌属细菌种类较多,超过132种,包括至少50种与医学或生物技术相关的菌种[2]。其中有致病力较强的白喉棒状杆菌(Corynebacterium diphtheriae),可引起假膜性炎-白喉(diphtheria)。还有纹带棒状杆菌、假白喉棒状杆菌等类白喉杆菌(diphtheroid bacilli),但造成机会性感染的多为纹带棒状杆菌,临床培养或试验分离所获得的菌株也以纹带棒状杆菌为主[3]。纹带棒状杆菌通常存在于人类的皮肤、口腔、咽喉、下呼吸道等处,其毒力较弱,一般不引起感染[4]。只有在机体免疫力低下、患有基础疾病的情况下,该菌会在机体进行黏附、侵入,形成生物膜,产生神经氨酸酶、透明质酸酶、溶血素等而导致感染[5],也可通过异体传播造成医院感染[4]。虽然纹带棒状杆菌毒力较弱,感染后使用敏感抗菌药物可有较好转归,但报道显示纹带棒状杆菌感染后仍有20%的病死率[1],若合并多种细菌感染,病死率可明显升高[6]。
2 纹带棒状杆菌感染的致病机制纹带棒状杆菌存在一系列的毒力因素,帮助其在宿主组织中存活,并且防止其被宿主的免疫机制清除。体外研究[1, 7-9]表明,这类细菌拥有的最重要的致病机制是在不同的非生物表面形成生物膜。该菌可以在疏水或是亲水的非生物表面形成有效的菌落,同时纹带棒状杆菌经过人体纤维蛋白原的刺激可以表现出更高的生物膜形成潜力[1, 9],而且不同水平的纤维蛋白原(Fbg)结合黏附素的表达可能与菌株“调节膜”的产生相关,这样的“调节膜”可以为细菌的传播起到助力作用[9]。
3 纹带棒状杆菌感染的危险因素纹带棒状杆菌的易感人群主要是老年人,儿童及中青年也占一定比例。研究[3, 6]发现,60岁以上患者感染率逐渐增多,尤以80岁以上患者占比最大,高达56.02%。从感染患者来源科室看,多为呼吸科、急诊科(EICU)、重症监护病房(ICU)等。杨佩红等[10]对分离出纹带棒状杆菌的患者进行分析,发现送检前使用过两种以上抗菌药物治疗的患者占60.0%,接受过侵入性操作(气管插管、呼吸机、深静脉导管、导尿管)的患者占62.5%。由此可见,年龄大、患有基础疾病、使用广谱抗菌药物、接受过侵入性操作等,是引起该菌感染的易感因素。
4 纹带棒状杆菌感染流行病学特征近年来,随着广谱抗菌药物的大量使用,棒状杆菌属感染患者较前有明显增加,相应感染病例的报道也越来越多[11-12]。不仅在中国,美国、欧洲各国等都有相应病例报道,可见纹带棒状杆菌感染并无明显的地域区别[1]。临床中纹带棒状杆菌可导致呼吸道、血液、心内膜等部位感染,但主要以呼吸道为主,其他部位感染的报道呈上升趋势[13-18]。近年来,我国学者对肺部感染患者进行分析发现,572例患者中纹带棒状杆菌感染达38例,占6.66%[19]。Silva-Santana等[20]总结1976—2020年世界各国纹带棒状杆菌感染暴发共254起,纹带棒状杆菌成为导致免疫功能低下患者感染居第二位的棒状微生物。对近20年发表的文献进行总结发现,纹带棒状杆菌感染与其他机会致病菌感染相似,以呼吸道、血流感染为主,偶可见感染性心内膜炎[20-21]。近来年,纹带棒状杆菌感染部位已经扩展到深部伤口、泌尿道等无菌腔道[13]。国外还有报道发现,纹带棒状杆菌可引起皮肤软组织感染以及骨关节置换术后假肢关节感染[22-23]。因此,纹带棒状杆菌感染部位并不仅局限于呼吸道等常见部位,也可感染各种无菌腔道、人工植入物,如人工瓣膜、人工关节等不常见部位,应引起临床的高度关注。
研究[24]证实,棒状杆菌属细菌可以通过手-手水平传播,国外也曾有其医院感染暴发的报道[20, 25-26]。比利时在一起多重耐药纹带棒状杆菌医院感染暴发流行病学调查时发现,定植/感染者是传播病菌的宿主,同时接触宿主的医护人员是交叉感染的传播媒介,而免疫功能低下的患者则是被感染者[26]。同时,研究[26-27]也证明同一区域患者标本中分离的菌株有着高度同源性,菌株之间存在流行病学相关性,且在较长时间的流行后菌株可出现染色体的变化[26]。纹带棒状杆菌在医院内分布广泛,无论是医疗器械还是常用的医疗物品(如负压吸引器、导管、内镜、呼吸机、病历夹等)均可检出,说明经医疗相关物品传播可能是该菌感染、传播不可忽视的重要因素和途径[10-11]。
5 纹带棒状杆菌感染的实验室检测临床上对纹带棒状杆菌的培养结果存在争议,如出现阳性结果,该菌多数情况下会被判定为污染菌群,而不是致病的病原体[7, 12, 28],这也意味着临床上很多的纹带棒状杆菌感染被忽略。对于痰、血标本中反复分离的棒状杆菌属菌株,应该引起重视[3, 10-11, 29],结合临床进行相应分析,而不能单纯将其视为污染菌,应该充分认识到纹带棒状杆菌致病的可能性,以免延误病情。临床对于纹带棒状杆菌的检测所使用的鉴定方法存在不足,曾有使用传统的VITEK系统对细菌进行鉴定以致误诊的事件[1]。也有研究[1, 10]认为临床确定纹带棒状杆菌感染可采用质谱法或基因测序,但是就鉴定方法的敏感性和准确性来说,宏基因组测序(16S rRNA)检测可以被视为金标准,基质辅助激光解析/电离飞行时间质谱(MALDI-TOF MS)和VITEK系统也可作为替代方法。对于不同菌株的确定,可采用脉冲凝胶电泳(PFGE)进行分析[29]。
6 纹带棒状杆菌耐药性现状国内外对分离的纹带棒状杆菌进行了耐药性相关研究,早期分离的菌株对于绝大部分抗菌药物均敏感[30],但近年来临床上分离的菌株很大部分为多重耐药菌,同时对于菌株进行基因分析也发现其存在高度变异性及适应能力[24]。2014年王瑞俊等[27]对所分离的纹带棒状杆菌进行耐药性分析,表明大部分菌株对青霉素、红霉素、四环素、环丙沙星、克林霉素5种抗菌药物抑制90%细菌生长的最低抑菌浓度(MIC90)值≥64 μg/mL;对庆大霉素、万古霉素和利福平的MIC90值均为0.5 μg/mL。2017年杨佩红等[10]分离的棒状杆菌应用CLSIM 45-A3最新折点判读标准分析试验数据发现,其对青霉素、克林霉素、头孢噻肟、头孢他啶、环丙沙星的耐药率为95%以上;对庆大霉素、四环素、复方磺胺甲
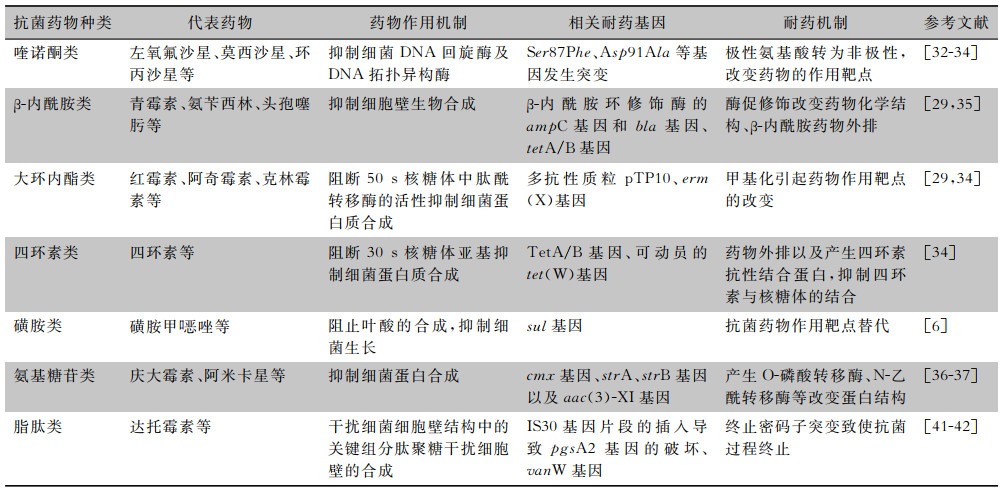
喹诺酮类药物是人工合成的含4-喹诺酮基本结构的抗菌药物,其抑制细菌的DNA回旋酶,对细菌DNA造成不可逆损伤,达到抗菌效果。但纹带棒状杆菌对于喹诺酮类有高度的抗性。研究[1, 32]表明,棒状杆菌对氟喹诺酮类药物的抗性最有可能是QRDR gyrA基因的密码子87和91突变的结果。而Dragomirescu等[33]报道也进一步验证了这一点,即Ser87Phe和Asp91Ala发生突变时,菌株对氟喹诺酮类药物的抗性增加。同时Ser95Thr、Asp94Ala、Glu88Ala和Asp87Gly等新突变可致极性氨基酸转为非极性,降低细菌对喹诺酮类药物的亲和度,从而提高对喹诺酮类药物的抗性[29, 34]。
β-内酰胺类药物包括青霉素、头孢菌素等,其通过抑制胞壁黏肽合成酶,即青霉素结合蛋白(penicillin binding protein, PBP),阻碍细胞壁黏肽合成,使细菌胞壁缺损,菌体裂解。而研究[1, 6, 35]表明,纹带棒状杆菌对β-内酰胺的抗性很可能是编码β-内酰胺环修饰酶的ampC和bla基因的作用,导致药物化学结构被酶促修饰而失去原有的抗菌功能。同时纹带棒状杆菌抗β-内酰胺类药物还与编码为tetA/B基因的非特异性外排泵有关[29]。
大环内酯类及四环素类抗生素,是通过抑制细菌蛋白合成从而达到抑菌效果。近些年对分离的纹带棒状杆菌基因进行研究发现,其含有的多抗性质粒pTP10使其对大环内酯类及四环素类药物均具有一定抗性[1, 29]。pTP10质粒及erm(X)基因、TN5432等可移动基因组带有erm(X)基因,该基因编码甲基转移酶,可使大环内酯类药物靶点改变从而导致细菌的药物抗性[10, 29, 34]。而除tetA/B基因外,从菌株基因中发现的可动员tet(W)基因,通过编码四环素抗性核糖体蛋白来保护细菌免受四环素类药物的伤害[34]。
其他抗菌药物包括磺胺类药物、氨基糖苷类等,Wang等[6]研究表明,纹带棒状杆菌对于磺胺类药物的耐药性可能与sul基因相关。同时有研究[6, 36-37]发现,cmx基因与strA、strB以及aac(3)-XI基因使细菌产生相关的酶改变蛋白结构,赋予细菌对氯霉素及氨基糖苷类药物的抗性。
糖肽类抗生素万古霉素通过干扰细菌细胞壁结构中的关键组分肽聚糖干扰细胞壁的合成,抑制细胞壁中磷脂和多肽的生成,在大部分的国内外研究中均为敏感抗生素。但抗万古霉素相关基因vanW曾在纹带棒状杆菌基因组中被发现,虽然该分离菌株对于万古霉素仍有良好的敏感性[32]。但也有棒状杆菌对万古霉素耐药的病例[29]。达托霉素是一种由玫瑰孢链霉菌产生的钙依赖性脂肽抗生素,通过与磷脂酰甘油(PG)和钙离子形成复合物,导致去极化和离子通透性增加从而杀灭细菌,通常用于治疗革兰阳性菌引起的严重感染。但研究[38-40]发现,所分离的纹带棒状杆菌对达托霉素有耐药性,而且即使最初对达托霉素敏感的菌株,在短时间内也可出现耐药性[39]。关于纹带棒状杆菌对达托霉素的耐药机制,国外最新研究[41-42]发现,IS30的插入导致pgsA2基因的破坏,而终止密码子突变导致PG产生中断,致使抗菌过程终止,产生高水平达托霉素(DAP)抗性(HLDR)棒状杆菌。
最新研究[29]认为,大部分纹带棒状杆菌对抗菌药物的抗性与插入序列及pTP10质粒的Tn5432转座子相关。Tn5432转座子存有插入序列及不同的抗性基因导致纹带棒状杆菌对抗菌药物耐药,同时插入序列是同种属细菌间水平抗性的潜在传播者,在纹状体抗性组的持续形成和进化中发挥重要作用[29]。中国学者李科等[43]研究发现,所有多重耐药的纹带棒状杆菌均携带转座子Tnl545整合酶及intTn基因,此类转座子可结合多个耐药基因片段,在染色体、质粒和噬菌体之间自行移动,可能是耐药性在菌株间垂直或水平传播的重要原因。而且,Leyton等[29]强调纹带棒状杆菌的抗性基因组呈动态变化且明显扩展,应引起广大研究者及临床工作者的重视。纹带棒状杆菌耐药机制见表 1。
| 表 1 纹带棒状杆菌的耐药机制汇总 |
|
纹带棒状杆菌感染的治疗目前无权威的临床指南,因为较多研究均证实纹带棒状杆菌对万古霉素敏感[1, 3, 12, 29],所以治疗的首选抗菌药物为万古霉素,可以作为单一或者与其他敏感抗菌药物联合使用[1]。对喹诺酮类、β-内酰胺类、大环内酯类、四环素类等抗性较高的抗菌药物不推荐使用,利奈唑胺、达托霉素等可用于重症感染[1]。但是该菌对达托霉素的耐药性已被证实,并且可能在患者治疗期间发生。因此,建议谨慎使用达托霉素单药治疗[13, 44]。在临床工作中,也可根据细菌培养药敏结果选用抗菌药物,抗菌药物治疗期间也应根据感染的严重程度和解剖部位进行调整,同时避免长期使用单种抗生素治疗[1]。
9 纹带棒状杆菌感染的预防研究发现纹带棒状杆菌对常见的5种消毒剂包括安尔碘皮肤消毒剂、乙醇消毒剂(含70%~80%乙醇)、速干手消毒剂、复合醇手消毒剂、消毒泡腾片等的抗性水平基本一致,均具有很高的敏感性。但是乙醇和含氯消毒剂受浓度影响较大,其抗菌效果与浓度呈正相关[45]。因此,临床中可以使用常见消毒剂做好器械消毒工作和环境卫生(手消毒及常用物品消毒),预防医院内纹带棒状杆菌相关感染的发生。但是国外也有研究[46]报道,纹带棒状杆菌对于防腐剂、消毒剂(如戊二醛)存在抗性,说明部分纹带棒状杆菌对某些普通消毒剂有一定的抗性,值得临床工作者关注及进一步研究。
综上所述,作为机会致病菌的纹带棒状杆菌是棒状杆菌属的一员,通常定植在人类的皮肤、口腔、咽喉等处,在机体免疫力低下、存在基础疾病等情况下可能造成感染。纹带棒状杆菌在医疗环境中分布广,应重视医疗环境及医疗器械的消毒,避免造成医院感染,纹带棒状杆菌对于普通的消毒剂如碘伏等具有良好的敏感性。基因测序是鉴定纹带棒状杆菌感染最为可靠的方法。临床工作时应该重视纹带棒状杆菌感染,对于反复培养阳性的标本应该结合临床考虑其是否为致病菌。对于纹带棒状杆菌感染的药物治疗,可根据临床药敏结果选择敏感抗菌药物。纹带棒状杆菌不同的基因变化使其对β-内酰胺类、喹诺酮类、四环素类等药物有不同程度的耐药性,而对于万古霉素、利奈唑胺等药物仍有较高的敏感性。但是因为pPT10质粒、插入序列等相关的抗性基因的增加,使纹带棒状杆菌的耐药性日益变化,且有不断增加的趋势。因此,纹带棒状杆菌感染及耐药性问题仍然值得临床持续关注。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Milosavljevic MN, Milosavljevic JZ, Kocovic AG, et al. Antimicrobial treatment of Corynebacterium striatum invasive infections: a systematic review[J]. Rev Inst Med Trop Sao Paulo, 2021, 63: e49. DOI:10.1590/s1678-9946202163049 |
| [2] |
Nagao PE, Burkovski A, Mattos-Guaraldi AL. Editorial: Streptococcus spp.: clinical and zoonotic epidemiology, virulence potential, antimicrobial resistance, and genomic trends and approaches[J]. Front Microbiol, 2022, 13: 867210. DOI:10.3389/fmicb.2022.867210 |
| [3] |
孙伟, 李亚娜, 苏建荣. 棒状杆菌属细菌感染的流行病学特点和药物敏感性分析[J]. 临床和实验医学杂志, 2018, 17(20): 2228-2231. Sun W, Li YN, Su JR. Study on the epidemiological features and drug sensitivity of Corynebacterium spp. infection[J]. Journal of Clinical and Experimental Medicine, 2018, 17(20): 2228-2231. DOI:10.3969/j.issn.1671-4695.2018.20.031 |
| [4] |
陈东科, 许宏涛, 胡付品. 纹带棒杆菌医院内感染状况分析[J]. 中华流行病学杂志, 2013, 34(9): 947-948. Chen DK, Xu HT, Hu FP. Analysis on nosocomial infection of Corynebacterium striatum[J]. Chinese Journal of Epidemio-logy, 2013, 34(9): 947-948. DOI:10.3760/cma.j.issn.0254-6450.2013.09.023 |
| [5] |
Mangutov EO, Kharseeva GG, Alutina EL. Corynebacterium spp.-problematic pathogens of the human respiratory tract (review of literature)[J]. Klin Lab Diagn, 2021, 66(8): 502-508. DOI:10.51620/0869-2084-2021-66-8-502-508 |
| [6] |
Wang XB, Zhou HJ, Chen DK, et al. Whole-genome sequencing reveals a prolonged and persistent intrahospital transmission of Corynebacterium striatum, an emerging multidrug-resistant pathogen[J]. J Clin Microbiol, 2019, 57(9): e00683-19. DOI:10.1128/JCM.00683-19 |
| [7] |
Ramos JN, Souza C, Faria YV, et al. Bloodstream and catheter-related infections due to different clones of multidrug-resistant and biofilm producer Corynebacterium striatum[J]. BMC Infect Dis, 2019, 19(1): 672. DOI:10.1186/s12879-019-4294-7 |
| [8] |
Souza CD, Simpson-Louredo L, Mota HF, et al. Virulence potential of Corynebacterium striatum towards Caenorhabditis elegans[J]. Antonie Van Leeuwenhoek, 2019, 112(9): 1331-1340. DOI:10.1007/s10482-019-01265-9 |
| [9] |
Souza CD, Faria YV, Sant'Anna LDO, et al. Biofilm production by multiresistant Corynebacterium striatum associated with nosocomial outbreak[J]. Mem Inst Oswaldo Cruz, 2015, 110(2): 242-248. DOI:10.1590/0074-02760140373 |
| [10] |
杨佩红, 徐修礼, 周柯, 等. 纹带棒状杆菌的临床分布及耐药性分析[J]. 中华医院感染学杂志, 2017, 27(15): 3415-3418, 3426. Yang PH, Xu XL, Zhou K, et al. Analysis of clinical distribution and drug resistance of Corynebacterium striatum[J]. Chinese Journal of Nosocomiology, 2017, 27(15): 3415-3418, 3426. |
| [11] |
谢爱香, 刘红军, 杨志新, 等. 棒状杆菌感染流行趋势及感染因素分析[J]. 中国中医药现代远程教育, 2012, 10(1): 92-93. Xie AX, Liu HJ, Yang ZX, et al. Analysis of epidemic trend and infection factors of Corynebacterium infection[J]. Chinese Medicine Modern Distance Education of China, 2012, 10(1): 92-93. |
| [12] |
Qin L, Sakai Y, Bao R, et al. Characteristics of multidrug-resistant Corynebacterium spp. isolated from blood cultures of hospitalized patients in Japan[J]. Jpn J Infect Dis, 2017, 70(2): 152-157. DOI:10.7883/yoken.JJID.2015.530 |
| [13] |
McMullen AR, Anderson N, Wallace MA, et al. When good bugs go bad: epidemiology and antimicrobial resistance profiles of Corynebacterium striatum, an emerging multidrug-resis-tant, opportunistic pathogen[J]. Antimicrob Agents Chemo-ther, 2017, 61(11): e01111-17. DOI:10.1128/AAC.01111-17 |
| [14] |
谢桂扬, 李苑芳, 吴国, 等. 42株纹带棒状杆菌感染所致呼吸道感染疾病及耐药性分析[J]. 海南医学, 2021, 32(5): 628-630. Xie GY, Li YF, Wu G, et al. Analysis of 42 strains of Corynebacterium striatum causing respiratory tract infection and drug resistance[J]. Hainan Medical Journal, 2021, 32(5): 628-630. |
| [15] |
Shariff M, Aditi A, Beri K. Corynebacterium striatum: an emerging respiratory pathogen[J]. J Infect Dev Ctries, 2018, 12(7): 581-586. DOI:10.3855/jidc.10406 |
| [16] |
Garcia CM, McKenna J, Fan LN, et al. Corynebacterium stria-tum bacteremia in end-stage renal disease: a case series and review of literature[J]. R I Med J (2013), 2020, 103(8): 46-49. |
| [17] |
Tang JL, Kornblum D, Godefroy N, et al. Corynebacterium striatum thrombophlebitis: a nosocomial multidrug-resistant disease?[J]. Access Microbiol, 2021, 3(12): 000307. |
| [18] |
Chen FL, Hsueh PR, Teng SO, et al. Corynebacterium striatum bacteremia associated with central venous catheter infection[J]. J Microbiol Immunol Infect, 2012, 45(3): 255-258. DOI:10.1016/j.jmii.2011.09.016 |
| [19] |
李苑芳, 彭方, 谢桂扬. 纹带棒状杆菌在呼吸道检出的临床意义及耐药性分析[J]. 中外医学研究, 2021, 19(17): 88-90. Li YF, Peng F, Xie GY. Clinical significance and drug resis-tance analysis of Corynebacterium striatum detected in respiratory tract[J]. Chinese and Foreign Medical Research, 2021, 19(17): 88-90. |
| [20] |
Silva-Santana G, Silva CMF, Olivella JGB, et al. Worldwide survey of Corynebacterium striatum increasingly associated with human invasive infections, nosocomial outbreak, and antimicrobial multidrug-resistance, 1976-2020[J]. Arch Microbiol, 2021, 203(5): 1863-1880. DOI:10.1007/s00203-021-02246-1 |
| [21] |
Fernández Guerrero ML, Molins A, Rey M, et al. Multidrug-resistant Corynebacterium striatum endocarditis successfully treated with daptomycin[J]. Int J Antimicrob Agents, 2012, 40(4): 373-374. |
| [22] |
Agrawal SK, Khullar S, Srivastava A, et al. Corynebacterium striatum: an emerging nosocomial skin and soft-tissue pathogen[J]. Natl Med J India, 2021, 34(2): 88-89. DOI:10.4103/0970-258X.326750 |
| [23] |
Fernández-Esgueva M, Pérez-Jimeno N, Roda-Rojo V, et al. Corynebacterium striatum prosthetic joint infection[J]. Enferm Infecc Microbiol Clin (Engl Ed), 2019, 37(7): 480-481. DOI:10.1016/j.eimc.2018.05.007 |
| [24] |
Renom F, Gomila M, Garau M, et al. Respiratory infection by Corynebacterium striatum: epidemiological and clinical determinants[J]. New Microbes New Infect, 2014, 2(4): 106-114. DOI:10.1002/nmi2.48 |
| [25] |
Baio PVP, Mota HF, Freitas AD, et al. Clonal multidrug-resistant Corynebacterium striatum within a nosocomial environment, Rio de Janeiro, Brazil[J]. Mem Inst Oswaldo Cruz, 2013, 108(1): 23-29. DOI:10.1590/S0074-02762013000100004 |
| [26] |
Verroken A, Bauraing C, Deplano A, et al. Epidemiological investigation of a nosocomial outbreak of multidrug-resistant Corynebacterium striatum at one Belgian university hospital[J]. Clin Microbiol Infect, 2014, 20(1): 44-50. DOI:10.1111/1469-0691.12197 |
| [27] |
王俊瑞, 杜小莉, 崔晶花, 等. 住院患者分离纹带棒状杆菌耐药性及同源性分析[J]. 中华医学杂志, 2014, 94(32): 2501-2505. Wang JR, Du XL, Cui JH, et al. Drug susceptibility and homologous analysis on Corynebacterium striatum strains isolated from inpatients[J]. National Medical Journal of China, 2014, 94(32): 2501-2505. |
| [28] |
Zasada AA, Mosiej E. Contemporary microbiology and identification of Corynebacteria spp. causing infections in human[J]. Lett Appl Microbiol, 2018, 66(6): 472-483. DOI:10.1111/lam.12883 |
| [29] |
Leyton B, Ramos JN, Baio PVP, et al. Treat me well or will resist: uptake of mobile genetic elements determine the resistome of Corynebacterium striatum[J]. Int J Mol Sci, 2021, 22(14): 7499. DOI:10.3390/ijms22147499 |
| [30] |
Kang SJ, Choi SM, Choi JA, et al. Factors affecting the clinical relevance of Corynebacterium striatum isolated from blood cultures[J]. PLoS One, 2018, 13(6): e0199454. DOI:10.1371/journal.pone.0199454 |
| [31] |
林冬玲, 龙一飞, 叶依, 等. 61株纹带棒状杆菌耐药表型与分子流行病学[J]. 中华医院感染学杂志, 2020, 30(19): 2927-2930. Lin DL, Long YF, Ye Y, et al. Drug-resistant phenotypes and molecular epidemiology of 61 strains of Corynebacterium striatum[J]. Chinese Journal of Nosocomiology, 2020, 30(19): 2927-2930. |
| [32] |
Ramos JN, Rodrigues IDS, Baio PVP, et al. Genome sequence of a multidrug-resistant Corynebacterium striatum isolated from bloodstream infection from a nosocomial outbreak in Rio de Janeiro, Brazil[J]. Mem Inst Oswaldo Cruz, 2018, 113(9): e180051. |
| [33] |
Dragomirescu CC, Lixandru BE, Coldea IL, et al. Antimicrobial susceptibility testing for Corynebacterium species isolated from clinical samples in Romania[J]. Antibiotics (Basel), 2020, 9(1): 31. DOI:10.3390/antibiotics9010031 |
| [34] |
Nudel K, Zhao X, Basu S, et al. Genomics of Corynebacterium striatum, an emerging multidrug-resistant pathogen of im-munocompromised patients[J]. Clin Microbiol Infect, 2018, 24(9): 1016. e7-1016. e13. |
| [35] |
Alibi S, Ferjani A, Boukadida J, et al. Occurrence of Corynebacterium striatum as an emerging antibiotic-resistant nosocomial pathogen in a Tunisian hospital[J]. Sci Rep, 2017, 7(1): 9704. |
| [36] |
Navas J, Fernández-Martínez M, Salas C, et al. Susceptibility to aminoglycosides and distribution of aph and aac(3)-XI genes among Corynebacterium striatum clinical isolates[J]. PLoS One, 2016, 11(12): e0167856. |
| [37] |
Galimand M, Fishovitz J, Lambert T, et al. AAC(3)-XI, a new aminoglycoside 3-N-acetyltransferase from Corynebacte-rium striatum[J]. Antimicrob Agents Chemother, 2015, 59(9): 5647-5653. |
| [38] |
Tran TT, Jaijakul S, Lewis CT, et al. Native valve endocarditis caused by Corynebacterium striatum with heterogeneous high-level daptomycin resistance: collateral damage from daptomycin therapy?[J]. Antimicrob Agents Chemother, 2012, 56(6): 3461-3464. |
| [39] |
McElvania TeKippe E, Thomas BS, Ewald GA, et al. Rapid emergence of daptomycin resistance in clinical isolates of Corynebacterium striatum-a cautionary tale[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(12): 2199-2205. |
| [40] |
Hagiya H, Kimura K, Okuno H, et al. Bacteremia due to high-level daptomycin-resistant Corynebacterium striatum: a case report with genetic investigation[J]. J Infect Chemother, 2019, 25(11): 906-908. |
| [41] |
Gotoh K, Mayura IPB, Enomoto Y, et al. Detection of in-frame mutation by IS30-family insertion sequence in the phospholipid phosphatidylglycerol synthase gene (pgsA2) of high-level daptomycin-resistant Corynebacterium striatum[J]. Eur J Clin Microbiol Infect Dis, 2022, 41(2): 331-333. |
| [42] |
Goldner NK, Bulow C, Cho K, et al. Mechanism of high-level daptomycin resistance in Corynebacterium striatum[J]. mSphere, 2018, 3(4): e00371-18. |
| [43] |
李科, 张德纯, 张名均, 等. 多重耐药纹带棒状杆菌的耐药机制研究[J]. 中国抗生素杂志, 2014, 39(5): 361-364. Li K, Zhang DC, Zhang MJ, et al. Research on resistance mechanism of the multidrug-resistant Corynebacterium striatum strains[J]. Chinese Journal of Antibiotics, 2014, 39(5): 361-364. |
| [44] |
Mitchell KF, McElvania E, Wallace MA, et al. Evaluating the rapid emergence of daptomycin resistance in Corynebacte-rium: a multicenter study[J]. J Clin Microbiol, 2021, 59(4): e02052-20. |
| [45] |
孙伟, 马立艳. 临床无菌部位分离的纹带棒状杆菌对常用消毒剂的抗性研究[J]. 中国消毒学杂志, 2022, 39(1): 13-16, 19. Sun W, Ma LY. Study on the resistance of Corynebacterium striatum isolated from clinically sterile sites to common disinfectants[J]. Chinese Journal of Disinfection, 2022, 39(1): 13-16, 19. |
| [46] |
Souza CD, Mota HF, Faria YV, et al. Resistance to antiseptics and disinfectants of planktonic and biofilm-associated forms of Corynebacterium striatum[J]. Microb Drug Resist, 2020, 26(12): 1546-1558. |



