2. 成都医学院药学院,四川 成都 610500
2. School of Pharmacy, Chengdu Medical College, Chengdu 610500, China
泛耐药鲍曼不动杆菌(extensively drug-resis-tant Acinetobacter baumannii,XDR-AB)具有极强的生物被膜形成能力和获得性耐药的特点,耐受抗菌药物、消毒剂、干燥环境等恶劣环境的能力很强[1],临床检出率逐年呈上升趋势[2],并且感染传播迅猛,被美国感染病协会列为全球6个严重的医院感染微生物之一[3],已成为我国乃至国际上重要的“超级细菌”[4-5]。鲍曼不动杆菌(Acinetobacter baumannii,AB)生物被膜形成过程复杂,受多基因、多机制共同调控[6]。相对于AB浮游菌,XDR-AB在结构、基因表型和生化特性等方面发生明显改变,使其耐药性与致病性大幅度增强,导致持续感染与反复感染。整合子作为一类可移动元件,可携带多种耐药基因在物种间水平传播,是细菌多重耐药性产生的重要原因[7]。研究[8]表明, 细菌存在的整合子有六类,仅Ⅰ、Ⅱ、Ⅲ类整合子与耐药性有明确关系。本研究拟通过分析临床分离AB的耐药性, 检测其生物被膜相关基因和整合子的携带与分布情况,重点探讨XDR-AB生物被膜相关基因及整合子与耐药性的关系,为临床防治XDR-AB感染提供参考依据。
1 材料与方法 1.1 菌株来源2019—2020年成都医学院第一附属医院临床标本分离的AB 59株,来自6个不同类型标本,痰标本占64.41%(38株),灌洗液标本占18.64%(11株),腹腔引流导管标本占5.08%(3株),血液标本占1.69%(1株),脑脊液标本、尿液标本、脓液标本各占3.39%(各2株)。分离自59例患者,其中重症医学科患者21例(35.59%),呼吸科重症监护病房12例(20.34%),呼吸科6例(10.17%),内科5例(8.47%),外科9例(15.25%),感染科1例(1.69%),其他科室5例(8.47%)。质控菌金黄色葡萄球菌ATCC 29213、大肠埃希菌ATCC 25922、鲍曼不动杆菌ATCC 19606,均为本实验室留存。
1.2 仪器与试剂恒温培养箱(上海一恒科技有限公司)、生物安全柜(Thermo Fisher Scientific)、酶标仪(SpectraMa190)、PCR扩增仪器(ABI-Veriti)、96孔细胞培养板(科兹莫生物科技有限公司)。PCR引物(上海生工生物工程有限公司),PCR产物测序(北京擎科生物科技有限公司)、2×Taq Master Mix (Dye Plus, 南京诺唯赞生物科技股份有限公司)、DNA marker(大连宝生物公司)。
1.3 药敏试验参照美国临床实验室标准化协会(CLSI 2020)标准,采用微量肉汤稀释法测定59株AB对碳青霉烯类、青霉素类、头孢菌素类、氨基糖苷类、喹诺酮类、四环素类和多粘菌素类等17种抗菌药物的最低抑菌浓度(MIC),并依据各种药物的药敏折点判定结果。
1.4 PCR扩增生物被膜相关基因及Ⅰ、Ⅱ、Ⅲ类整合酶基因挑取对数期单克隆菌落悬浮于0.9%生理盐水,重悬液作为模板。PCR检测17种生物被膜相关基因(bfmR、bfmS、csuA/B、csuA、csuB、csuC、csuD、csuE、abaI、epsA、pgaA、pgaB、pgaC、pgaD、pglC、bap、ompA),以及整合酶基因(intI-1、intI-2和intI-3)。引物序列见表 1。扩增体系参数参考文献[9],并设空白对照。判断标准:依据XDR-GNB感染抗菌治疗专家共识,对多重耐药(multidrug resistance, MDR)定义为对在抗菌谱范围内的3类或3类以上抗菌药物不敏感;XDR定义为1~2类抗菌药物(主要指多黏菌素类和替加环素)外,几乎对所有类别抗菌药物不敏感[10]。
| 表 1 基因引物序列及预期目的产物长度 Table 1 Gene primer sequences and expected target product length |
|
对Ⅰ类整合酶阳性菌株的耐药基因盒进行扩增,序列如下:intCS-F 5’-GGCATCCAAGCAGCAAG-3’,intCS-R 5’-AAGCAGACTTGACCTGA-3’,基因盒为预计长度800~3 000 bp,高保真酶扩增。阳性菌株送测序,测序结果在NCBI进行对比分析。
1.6 统计学处理应用SPSS 26.0进行统计学分析,基因检出阳性菌株和阴性菌株数量为计数资料,两组间比较采用Fisher’s精确概率法,以P≤0.05为差异有统计学意义。
2 结果 2.1 MIC除对替加环素和多粘菌素敏感率为100%外,59株AB对米诺环素耐药率为1.69%,对碳青霉烯类的亚胺培南、美罗培南耐药率分别为67.80%、71.19%,对头孢哌酮/舒巴坦耐药率为76.27%,对左氧氟沙星耐药率为59.32%,对哌拉西林、头孢他啶、头孢曲松、头孢噻肟、阿米卡星、及其他抗菌药物的耐药率均大于76%。依据XDR-GNB感染抗菌治疗专家共识和CLSI 2020标准判定:XDR-AB 40株,占67.80%;多重耐药鲍曼不动杆菌(MDR-AB)5株,占8.47%;敏感AB 14株,占23.73%。见表 2。
| 表 2 临床分离的59株鲍曼不动杆菌抗菌药物药敏试验结果 Table 2 Antimicrobial susceptibility testing results of 59 strains of clinically isolated Acinetobacter baumannii |

|
59株AB均携带11种以上生物被膜相关基因,最多可携带17种生物被膜相关基因,其中6种基因bfmR、bfmS、csuC、csuD、csuE、pgaD检出率均为100%,csuA/B、csuA、csuB、abaI、epsA、pgaA、pgaB、pgaC、pglC、bap、ompA检出率分别为98.31%、98.31%、96.61%、91.53%、76.27%、74.58%、93.22%、94.92%、94.92%、98.31%、88.14%。见图 1。
 |
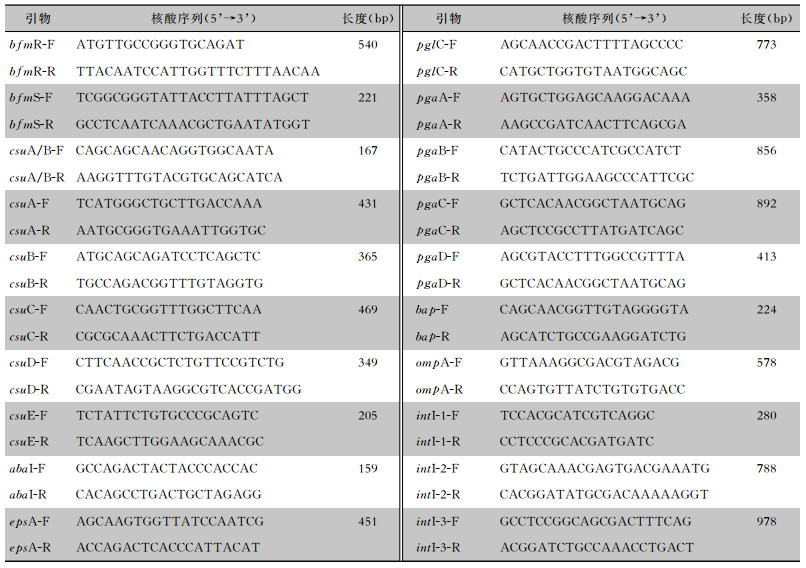
| 注:M为100 bp DNA Marker,kb为阴性对照,其他泳道为espA阳性菌株。 图 1 部分菌株生物被膜相关基因epsA扩增情况 Figure 1 Amplification of biofilm-related genes epsA in partial strains |
扩增intI-1、intI-2、intI-3整合酶基因,作为判定Ⅰ、Ⅱ、Ⅲ类整合子的存在依据。59株AB均未检测出intI-2和intI-3;intI-1检出率为66.10%(39株),阳性菌株分别为XDR-AB 36株和MDR-AB 3株。见图 2。
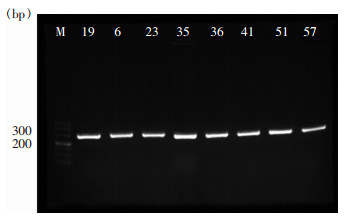 |
| 注:M为500 bp DNA Marker,其他泳道为intI-1阳性菌株。 图 2 部分菌株intI-1扩增情况 Figure 2 Amplification of intI-1 of partial strains |
59株AB中XDR-AB占67.80%(40株),MDR-AB占8.47%(5株),敏感AB占23.73%(14株)。abaI、epsA、pglC、ompA 4种生物被膜相关基因检出率:XDR-AB分别为100%、95.00%、87.50%、100%,高于敏感AB菌株的64.29%、7.14%、42.86%、50.00%(均P<0.05)。Ⅰ类整合基因阳性的XDR-AB 36株,占90.00%,敏感AB未携带Ⅰ类整合子(P<0.01)。见表 3。
| 表 3 XDR-AB与AB相关基因检出情况 Table 3 Detection results of XDR-AB-related genes and AB-related genes |

|
对39株Ⅰ类整合酶阳性菌株可变区进行扩增,检测到可变区阳性菌株38株,片段大小约2 000 bp,其中XDR-AB 35株,MDR-AB 3株,产物序列在GenBank进行同源性对比,均携带耐药基因盒(aacA4、catB8和aadA1)。见图 3。
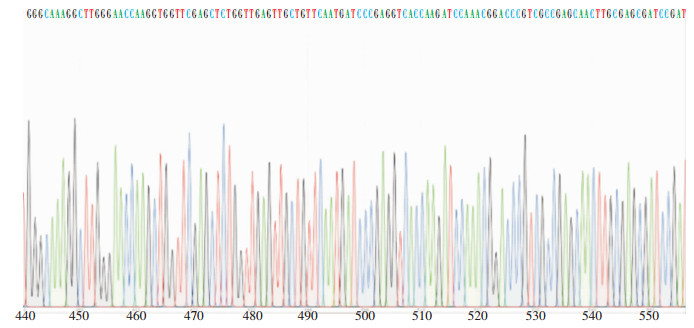 |
| 图 3 intI CS区部分测序图片 Figure 3 Partial sequencing image of intI CS region |
生物被膜的形成从菌毛的黏附、胞外多糖(EPS)的产生,以及从成熟到脱离,都涉及到特定基因的表达[11]。而整合子作为一种可移动的遗传元件,通过特异的重组位点捕获和整合单个或多个外源性基因,使不同耐药基因盒在细菌种内或种间进行传播,在AB耐药性的形成和传播中均具有重要的作用。
本研究测定的MIC结果显示,AB对多粘菌素B和替加环素100%敏感,对青霉素类(哌拉西林、氨苄西林)、三代头孢菌素(头孢他啶、头孢曲松和头孢噻肟)的耐药率达76.27%~84.75%,对氨基糖苷类(庆大霉素、阿米卡星)、氟喹诺酮类(环丙沙星、左氧氟沙星)的耐药率达59.32%~76.27%,对碳青霉烯类(亚胺培南、美罗培南)和β-内酰胺酶抑制剂复合制剂(头孢哌酮/舒巴坦)的耐药率高达67.80%~ 76.27%;AB耐药情况十分严峻,泛耐药菌高达67.80%。AB对米诺环素耐药率(1.69%)低于其他抗菌药物,提示米诺环素在本地区可作为治疗XDR-AB感染的选用药物。但需要注意的是,37.50%(15/40) 的XDR-AB MIC值处于中介范围(8 μg/mL),建议治疗时需要在安全范围内加大剂量或者联合用药来提高疗效。
研究检测59株AB的17种生物被膜相关基因,31株(52.54%)菌株100%检出,而且主要分布在XDR-AB和MDR-AB(XDR-AB 29株和MDR-AB 2株);6种生物被膜相关基因bfmR、bfmS、csuC、csuD、csuE、pgaD在59株AB中检出率为100%,其他11种生物被膜相关基因检出率为74.58%~98.31%;检出率高于相关文献报道的检出结果[12];而基因abaI、bap、ompA的检出率低于皇甫昱婵等[13]的检出结果。XDR-AB abaI、epsA、pglC、ompA 4种生物被膜相关基因检出率分别为100%、95.00%、87.50%、100%,在敏感AB分别为64.29%、7.14%、42.86%、50.00%,XDR-AB中的检出率均高于敏感AB(均P<0.05)。最新研究表明,AbaI广泛分布于AB中,是表面相关运动必不可少的,且与耐药性、上皮细胞的侵袭力和毒力显著相关[14]。abaI编码乙酰高丝氨酸内酯自诱导合成酶基因,介导群体感应系统感知信号分子并且引起大量细菌聚集参与生物被膜形成。epsA编码EPS,EPS作为生物被膜中最重要的成分,EPS基质的性质和组成与细菌菌株、培养条件和生物膜成熟度有关[6]。pglC编码O-连接蛋白糖基化系统,与黏附到非生物表面的EPS和生物被膜的成熟有关。细菌中蛋白质糖基化的进化起源多样化,糖基化系统可作为细菌适应性耐高糖环境的策略[15]。ompA编码外膜蛋白,外膜蛋白有助于上皮细胞和塑料表面生物被膜的形成,同时也是控制抗菌药物进入细菌体内的重要通道。外膜蛋白的改变可影响细胞膜的通透性,使渗透至细菌体内的抗菌药物减少,导致细菌耐药[16]。
细菌中整合子类型的地域差异性明显,在中国以Ⅰ类整合子为主。不同地区Ⅰ类整合酶基因携带率也有差异,本研究中在59株AB Ⅰ类整合酶基因的检出率为66.10%(39株),且均为XDR-AB和MDR-AB菌株所携带。40株XDR-AB中Ⅰ类整合酶基因检出率为90%(36株),而在14株敏感AB中并未检测出Ⅰ类整合子,推测Ⅰ类整合子的存在与XDR-AB耐药性之间具有密切的关系[17-18]。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Koo H, Allan RN, Howlin RP, et al. Targeting microbial biofilms: current and prospective therapeutic strategies[J]. Nat Rev Microbiol, 2017, 15(12): 740-755. DOI:10.1038/nrmicro.2017.99 |
| [2] |
Farajzadeh Sheikh A, Savari M, Abbasi Montazeri E, et al. Genotyping and molecular characterization of clinical Acinetobacter baumannii isolates from a single hospital in Southwes-tern Iran[J]. Pathog Glob Health, 2020, 114(5): 251-261. DOI:10.1080/20477724.2020.1765124 |
| [3] |
van Dessel H, Dijkshoorn L, van der Reijden T, et al. Identification of a new geographically widespread multiresistant Acinetobacter baumannii clone from European hospitals[J]. Res Microbiol, 2004, 155(2): 105-112. DOI:10.1016/j.resmic.2003.10.003 |
| [4] |
周华, 周建英, 俞云松. 中国鲍曼不动杆菌感染诊治与防控专家共识解读[J]. 中国循证医学杂志, 2016, 16(1): 26-29. Zhou H, Zhou JY, Yu YS. The interpretation of Chinese expert consensus for the diagnosis, treatment, prevention and control of Acinetobacter baumannii infection[J]. Chinese Journal of Evidence-Based Medicine, 2016, 16(1): 26-29. |
| [5] |
Lee CR, Lee JH, Park M, et al. Biology of Acinetobacter baumannii: pathogenesis, antibiotic resistance mechanisms, and prospective treatment options[J]. Front Cell Infect Microbiol, 2017, 7: 55. |
| [6] |
Grande R, Puca V, Muraro R. Antibiotic resistance and bacterial biofilm[J]. Expert Opin Ther Pat, 2020, 30(12): 897-900. DOI:10.1080/13543776.2020.1830060 |
| [7] |
林丽, 凌保东, 张翔, 等. 鲍曼不动杆菌Ⅰ类整合子与多重耐药相关性研究[J]. 中国抗生素杂志, 2010, 35(1): 54-58. Lin L, Ling BD, Zhang X, et al. Study on the relationship between class Ⅰ integron and multidrug resistance in Acinetobacter baumannii clinical isolates[J]. Chinese Journal of Antibiotics, 2010, 35(1): 54-58. |
| [8] |
Escudero JA, Loot C, Nivina A, et al. The integron: adaptation on demand[J]. Microbiol Spectr, 2015, 3(2): MDNA3-0019-2014. |
| [9] |
蔺飞, 余彬, 袁明勇, 等. 鲍曼不动杆菌生物被膜形成与调控的研究进展[J]. 中国感染控制杂志, 2019, 18(12): 1176-1183. Lin F, Yu B, Yuan MY, et al. Research advances in Acinetobacter baumannii biofilm formation and regulation[J]. Chinese Journal of Infection Control, 2019, 18(12): 1176-1183. DOI:10.12138/j.issn.1671-9638.20195537 |
| [10] |
Chinese XDR Consensus Working Group, Guan X, He L, et al. Laboratory diagnosis, clinical management and infection control of the infections caused by extensively drug-resistant Gram-negative bacilli: a Chinese consensus statement[J]. Clin Microbiol Infect, 2016, 22(Suppl 1): S15-S25. |
| [11] |
Flemming HC, Wingender J, Szewzyk U, et al. Biofilms: an emergent form of bacterial life[J]. Nat Rev Microbiol, 2016, 14(9): 563-575. DOI:10.1038/nrmicro.2016.94 |
| [12] |
蔺飞, 袁明勇, 凌保东. 鲍曼不动杆菌生物膜相关基因研究[J]. 中华实验和临床感染病杂志(电子版), 2021, 15(2): 129-132. Lin F, Yuan MY, Ling BD. Biofilm formation related genes of Acinetobacter baumannii[J]. Chinese Journal of Experimental and Clinical Infectious Diseases(Electronic Edition), 2021, 15(2): 129-132. DOI:10.3877/cma.j.issn.1674-1358.2021.02.010 |
| [13] |
皇甫昱婵, 刁文晶, 俞静, 等. 鲍曼不动杆菌生物被膜形成能力的研究[J]. 诊断学理论与实践, 2019, 18(5): 532-537. HuangFu YC, Diao WJ, Yu J, et al. Study on in vitro biofilm formation ability of Acinetobacter baumannii[J]. Journal of Diagnostics Concepts & Practice, 2019, 18(5): 532-537. |
| [14] |
Tang J, Chen Y, Wang XL, et al. Contribution of the AbaI/AbaR quorum sensing system to resistance and virulence of Acinetobacter baumannii clinical strains[J]. Infect Drug Resist, 2020, 13: 4273-4281. DOI:10.2147/IDR.S276970 |
| [15] |
Lees-Miller RG, Iwashkiw JA, Scott NE, et al. A common pathway for O-linked protein-glycosylation and synthesis of capsule in Acinetobacter baumannii[J]. Mol Microbiol, 2013, 89(5): 816-830. DOI:10.1111/mmi.12300 |
| [16] |
Thummeepak R, Kongthai P, Leungtongkam U, et al. Distribution of virulence genes involved in biofilm formation in multi-drug resistant Acinetobacter baumannii clinical isolates[J]. Int Microbiol, 2016, 19(2): 121-129. |
| [17] |
周亚玲, 陈红, 朱丽华, 等. 临床革兰阴性杆菌整合子携带情况及其与耐药性的相关性分析[J]. 临床检验杂志, 2019, 37(1): 59-61. Zhou YL, Chen H, Zhu LH, et al. Analysis of integron carriage in clinical Gram-negative bacilli and its correlation with drug resistance[J]. Chinese Journal of Clinical Laboratory Science, 2019, 37(1): 59-61. |
| [18] |
柏淑禹, 孙静. 老年病房耐亚胺培南鲍曼不动杆菌整合子及分子流行病学研究[J]. 实用老年医学, 2018, 32(11): 1013-1015. Bo SY, Sun J. Study on the integrons and molecular epidemio-logy of Acinetobacter baumannii isolates resistant to imipenem in geriatric ward[J]. Practical Geriatrics, 2018, 32(11): 1013-1015. DOI:10.3969/j.issn.1003-9198.2018.11.005 |



