2. 解放军总医院服务保障中心, 北京 100853;
3. 解放军总医院医疗保障中心药剂科, 北京 100853
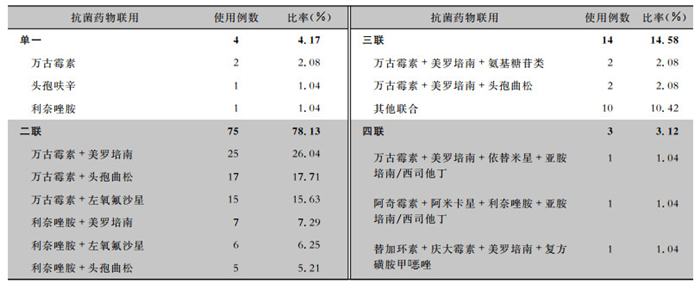
 唑、氨苄西林耐药率均为100%。PJI患者住院期间抗菌药物使用主要以联合用药为主, 其中万古霉素联合美罗培南占26.04%;骨水泥中人工添加抗生素也以万古霉素和美罗培南为主。结论 关节置换术后PJI主要病原菌为表皮葡萄球菌, 其对青霉素、苯唑西林等普遍耐药, 抗感染治疗以万古霉素联合美罗培南为主。
唑、氨苄西林耐药率均为100%。PJI患者住院期间抗菌药物使用主要以联合用药为主, 其中万古霉素联合美罗培南占26.04%;骨水泥中人工添加抗生素也以万古霉素和美罗培南为主。结论 关节置换术后PJI主要病原菌为表皮葡萄球菌, 其对青霉素、苯唑西林等普遍耐药, 抗感染治疗以万古霉素联合美罗培南为主。2. Service Guarantee Center, Chinese PLA General Hospital, Beijing 100853, China;
3. Department of Pharmacy, Medical Supplies Center, Chinese PLA General Hospital, Beijing 100853, China
假体周围感染(peri-prosthetic joint infection,PJI)是关节置换术后的一种严重并发症,其发病率较高,需要复杂的跨学科治疗策略[1]。初次关节置换术PJI发生率为1%~2%,翻修关节置换术PJI发生率为4%,全髋关节置换术(total hip arthroplasty,THA)术后PJI发生率为0.3%~1.7%,全膝关节置换术(total knee arthroplasty,TKA)术后PJI发生率为0.8%~1.9%,再感染发生率为14%[1-2]。发生PJI会让原本成功的关节置换术变得更加复杂,其治疗通常需要多次外科手术,增加并发症和病死率。感染是翻修髋关节置换术的第三大适应证(占14.7%),也是TKA失败的最常见原因(占25.2%)[3]。
PJI不仅影响患者的治疗效果,并且多次外科手术还增加患者的身体痛苦和经济负担。目前PJI的诊断标准、相关因素以及与PJI相关植入物感染也是国外研究的热点,但国内PJI调查侧重于病原菌的分布特点及耐药性,较少分析患者治疗使用抗菌药物情况[4-5],及时更新PJI病原菌及耐药性特点和治疗使用抗菌药物情况,对防治THA和TKA术后PJI具有重要意义。本研究以某院2019年1月—2021年11月诊断为PJI的患者为研究对象,分析PJI病原菌分布特点、耐药情况及其治疗情况,旨在为关节置换术后PJI的治疗提供参考。
1 对象与方法 1.1 研究对象选取解放军某医院2019年1月—2021年11月诊断为PJI的患者为研究对象,采用《中国人工关节感染诊断与治疗指南》[6]推荐的诊断标准诊断PJI。纳入标准:(1)THA和TKA术后PJI患者;(2)患者年龄>18岁;(3)无免疫系统疾病以及未使用免疫抑制剂;(4)同一关节采集两次及以上的标本进行培养,且培养出同一种致病菌。
1.2 研究方法利用医院PRIDE系统查询相关病历信息,查询内容包括患者一般情况(性别、年龄、身高、体重、住院时间、原发疾病等),PJI病原菌及药敏试验数据,治疗使用抗菌药物情况。根据术后感染发生时间,将PJI分为术后早期感染(术后<3个月),迟发感染(术后3~24个月)和晚期慢性感染(术后>24个月)[1]。
1.3 标本采集及病原菌分离鉴定采用注射器在严格无菌条件下吸取关节腔中液体,分别注入需氧瓶和厌氧瓶中进行培养,采用法国梅里埃公司API微生物鉴定系统对细菌进行鉴定。
1.4 统计方法所有数据经双人核查后录入Microsoft Excel中进行分析。数据采用描述性分析,计量资料以(x±s)表示,计数资料以例数或百分比表示。
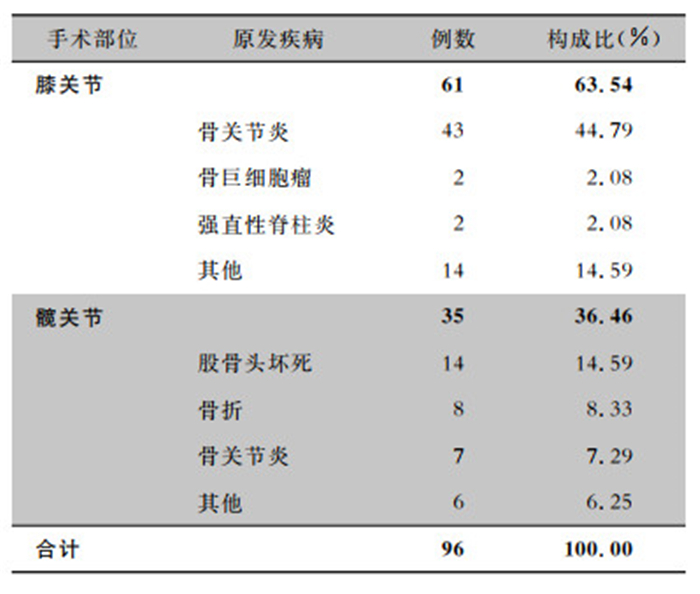
2 结果 2.1 一般资料本研究共纳入96例PJI患者,其中男性44例,女性52例;年龄25~83岁,平均(62.3±11.9)岁;体重指数(BMI)15.59~35.49 kg/m2,平均(25.63±3.61)kg/m2;住院日数3~92 d,平均住院日数(21.5±13.7)d。按感染发生时间统计,术后早期感染14例,延迟(或亚急性)感染34例,晚期感染48例。按照部位分类,其中TKA术后发生PJI 61例,THA术后发生PJI 35例。原发疾病中膝关节以骨关节炎为主,髋关节以股骨头坏死为主。关节置换手术部位及原发疾病构成情况见表 1。
| 表 1 96例PJI患者关节置换手术部位及原发疾病构成情况 Table 1 Constituent of joint replacement sites and primary diseases in 96 PJI patients |
|
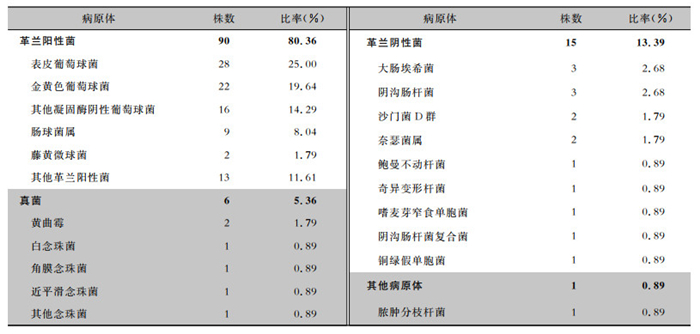
96例PJI患者共分离病原体112株,其中革兰阳性菌株占80.36%,革兰阴性菌占13.39%,真菌占5.36%。革兰阳性菌株中表皮葡萄球菌28株,金黄色葡萄球菌22株。见表 2。
| 表 2 PJI病原体分布情况 Table 2 Distribution of pathogens in PJI |
|
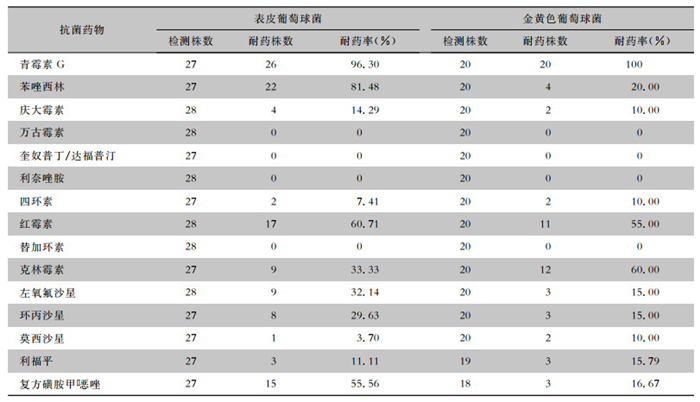
革兰阳性菌中表皮葡萄球菌对青霉素G、苯唑西林耐药率分别为96.30%、81.48%;对左氧氟沙星、红霉素和复方磺胺甲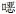
| 表 3 革兰阳性菌对常用抗菌药物的耐药情况 Table 3 Resistance of Gram-positive bacteria to commonly used antimicrobial agents |
|
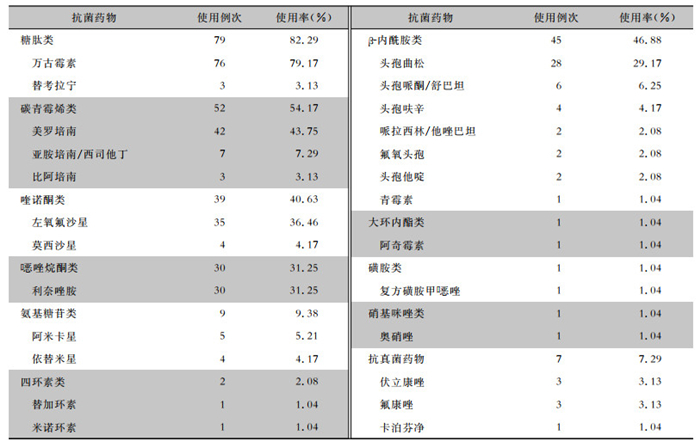
96例PJI患者住院期间全部静脉使用抗菌药物,其中使用抗细菌药物9类22种,使用率高的抗菌药物分别为糖肽类、碳青霉烯类、喹诺酮类、
| 表 4 96例PJI患者住院期间抗菌药物使用情况 Table 4 Antimicrobial use of 96 PJI patients during hospitalization period |
|
联合用药主要以二联用药为主,占78.13%,三联用药占14.58%,见表 5。18例多重耐药菌PJI患者,分离的病原菌以葡萄球菌属细菌为主,联合用药多为万古霉素联合美罗培南或左氧氟沙星或头孢曲松,见表 6。
| 表 5 96例PJI患者抗菌药物联合使用情况 Table 5 Combination use of antimicrobial agents of 96 PJI patients |
|
| 表 6 18例多重耐药菌PJI患者病原菌分布及抗菌药物使用情况 Table 6 Pathogen distribution and antimicrobial use of 18 PJI patients infected with multidrug-resistant organisms |

|
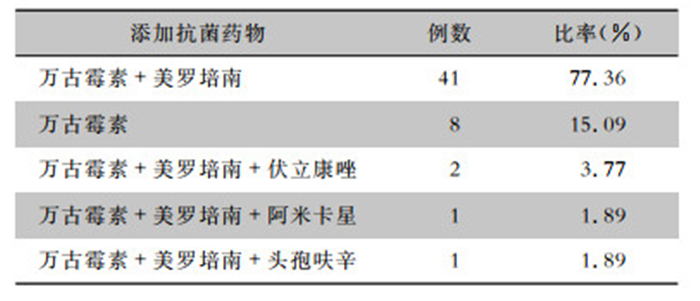
96例PJI患者中有53例使用预混庆大霉素的骨水泥,在临床应用时又人工添加其他抗生素,其中添加抗生素以万古霉素+美罗培南为主,共41例,占77.36%。见表 7。
| 表 7 53例PJI患者庆大霉素骨水泥中人工添加抗生素情况 Table 7 Artificially added antimicrobial agents to gentamicin bone cement in 53 PJI patients |
|
本研究发现PJI患者平均年龄较大,BMI偏高,且原发疾病中膝关节以骨关节炎为主,髋关节以股骨头坏死为主。Kunutsor等[7]对全关节置换术后PJI患者相关危险因素的Meta分析显示,年龄与PJI风险之间无明显统计学意义上的关联;在涉及BMI>30 kg/m2或更高临界的BMI比较中,PJI风险的增加与BMI呈正相关;在原发性疾病分析中,类风湿关节炎会增加TKA或THA术后发生PJI的风险,但没有证据表明骨关节炎、骨坏死、创伤后关节炎会增加THA或TKA术后PJI风险。
在骨关节感染中,最常见的病原菌为金黄色葡萄球菌、凝固酶阴性葡萄球菌和肠球菌属[8]。表皮葡萄球菌作为机会性病原体,特别是在医疗植入物中,其感染率呈上升趋势,占PJI病原菌的25%[9]。本研究PJI病原菌中,革兰阳性菌占80.36%,主要以凝固酶阴性葡萄球菌为主,金黄色葡萄球菌次之,与相关研究[10-11]结果一致。凝固酶阴性葡萄球菌中表皮葡萄球菌占比高于金黄色葡萄球菌,与边森等[12]研究结果有一定差异,其结果显示表皮葡萄球菌数量少于金黄色葡萄球菌。此差异可能与纳入病例数量有关,也可能与地区之间存在差异有关。在美国全关节置换术最常见的病原体是金黄色葡萄球菌,在欧洲最常见的病原体是表皮葡萄球菌,可能是由于不同的手术流程和报道结果造成的,也可能涉及其他因素,如当地病原体流行情况和病原菌对抗菌药物耐药性,以及所应用的无菌技术和预防措施的类型[8, 13]。
本研究中,耐甲氧西林表皮葡萄球菌(MRSE)占比很高,其导致的PJI抗感染治疗较困难,与MRSE致病特点及耐药机制有关。Hischebeth等[14]对PJI治疗后的患者进行回顾性研究,结果表明与耐甲氧西林金黄色葡萄球菌(MRSA)、甲氧西林敏感金黄色葡萄球菌(MSSA)、甲氧西林敏感表皮葡萄球菌(MSSE)引起的PJI相比,MRSE引起者治疗后根除率最低。目前认为MRSE耐药机制可能是含有mecA基因的可移动SCCmec元件被整合到染色体中,其编码的青霉素蛋白对β-内酰胺类抗生素亲和力较差,使得细菌除对第5代头孢菌素外所有经典的β-内酰胺类抗生素均耐药[14-15]。表皮葡萄球菌的耐药性还表现在通过分泌自溶素等黏附素、细胞外DNA,以及葡萄球菌表面蛋白1和2等细胞壁锚定蛋白黏附到假体表面[16]。表皮葡萄球菌可以在植入物表面形成坚固的生物膜,有助于其逃避免疫和产生耐药性[17]。生物膜的形成也是治疗PJI的困难之一,细菌侵占假体,在其表面形成生物膜,紧密地附着在假体表面,并包裹在丰富的胞外聚合物基质中[8]。表皮葡萄球菌可在不到12 h的生长时间内迅速在手术材料上形成生物被膜[18],对抗菌药物具有高耐受性[19]。生物膜通过增加细菌的水平基因转移而增强耐药性,且细菌产生的基质形成生物膜的支架,发挥保护功能,以及影响细菌的新陈代谢等多种机制,增加细菌的耐受性[20]。
PJI的治疗方法有四种,即保留假体清创术、一期翻修术、二期翻修术,以及单纯应用抗菌药物治疗[6, 21]。目前根据相关指南和国际共识[6, 22]建议,若为浅表感染、早期深部感染或急性血源感染可选择清创,应用抗菌药物和保留假体治疗,即保留假体清创术,其他类型感染需去除假体[6, 23-25]。一期翻修术主要适用于免疫功能正常,无全身脓毒血症,骨缺损较小,软组织条件较好,且单一病原菌及药物敏感性已知的患者[6]。二期翻修术是应用最广的PJI治疗方案[6]。单纯应用抗菌药物治疗无法完全治愈PJI,仅在特定情况下考虑使用,包括因非感染因素翻修而术中培养阳性患者和无法耐受手术患者[26-28]。以上四种治疗方法均要求重视抗菌药物的使用[6],在本研究中,PJI患者治疗大致分为住院期间静脉使用抗菌药物、抗菌药物骨水泥局部用药,以及出院后的口服抗菌药物治疗。
根据美国传染病学会《假体周围感染的诊断和管理》临床实践指南,住院期间的药物治疗,对于苯唑西林耐药葡萄球菌和对青霉素耐药的肠球菌推荐使用万古霉素[22]。在病原菌未明确时,推荐单独或联合使用抗菌药物以覆盖常见的革兰阳性菌及革兰阴性菌,病原菌明确后,应尽快改为相对窄谱的抗菌药物,以减少抗菌药物相关并发症[29]。全身性抗感染治疗中,理想的抗感染药物应在骨关节组织中浓度高,能够穿透生物膜并抑制生物膜形成[30]。有关节假体留置时(保留假体清创术、一期翻修或二期翻修假体植入后),建议联合使用利福平,以抑制生物膜形成[6, 22, 31],但不建议单独使用利福平,否则极易导致病原菌快速耐药[6, 32]。在铜绿假单胞菌、大肠埃希菌等革兰阴性菌感染时,若有假体留置,建议联合使用氟喹诺酮类抗菌药物(环丙沙星、左氧氟沙星、莫西沙星等)[6, 22]。本研究结果显示,最常使用的药物为万古霉素,最常用的药物联合治疗方案为二联用药,其中以万古霉素和美罗培南联用为主。该院就诊患者中部分患者存在以下情况:非首次感染,存在反复感染;已使用低级别抗菌药物但是感染控制不佳;病情危重,需要尽快控制感染等情况。在β-内酰胺类抗生素使用并不多的情况下,表皮葡萄球菌对青霉素G和苯唑西林耐药率很高,革兰阴性菌对第三、四代头孢也有不同程度的耐药,此可能与该院碳青霉烯类抗生素使用范围较广有关,建议临床在使用此类药物时应依照抗菌药物使用原则等相关文件和指南,严格把控适应证。
抗生素骨水泥局部用药,即在一期翻修术或二期翻修术中加入含有抗生素的骨水泥,在感染部位形成高浓度抗生素,发挥抗菌作用。虽然氨基糖苷类已被证明对关节间隙内的甲氧西林敏感和甲氧西林耐药葡萄球菌都有良好的杀菌活性[33],但葡萄球菌也存在对氨基糖苷类药物耐药的情况[34]。本研究中,53例患者在预混庆大霉素抗生素骨水泥中添加了其他抗主素,主要以添加万古霉素和美罗培南为主,此有利于覆盖几乎大部分关节间隙内的常见细菌。根据骨感染的病原菌分布、局部药物高浓度的需求和骨水泥在凝固和聚合反应中的放热等因素,用于制备骨水泥的抗生素需要具备抗菌谱广、效价高、耐药少、蛋白结合率低、不易过敏、对骨水泥机械性影响小、稳定性高、水溶性好,以及能够从骨水泥中较好释放等特点[35-36]。Schmid等[37]研究表明,美罗培南在聚甲基丙烯酸甲酯骨水泥(PMMA)聚合过程温度基本保持稳定。李涛等[38]研究表明,美罗培南和万古霉素联合使用后可促进万古霉素释放(释放比率从5.25%上升至7.96%),对美罗培南的释放影响不大。本研究并未统计患者出院后口服抗菌药物治疗信息,也是本研究的不足。
综上所述,该院近三年的关节置换术后PJI病原菌以革兰阳性菌中的凝固酶阴性葡萄球菌为主。参考药敏结果,住院患者抗菌药物使用主要以万古霉素为主的单药或万古霉素联合美罗培南,同时,骨水泥中通常添加万古霉素和美罗培南,以保证对病原菌的广覆盖和局部有效浓度。除合理使用抗菌药物外,提高患者免疫力,注重手术护理等是预防和治疗PJI的关键。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Izakovicova P, Borens O, Trampuz A. Periprosthetic joint infection: current concepts and outlook[J]. EFORT Open Rev, 2019, 4(7): 482-494. DOI:10.1302/2058-5241.4.180092 |
| [2] |
Bjerke-Kroll BT, Christ AB, McLawhorn AS, et al. Periprosthetic joint infections treated with two-stage revision over 14 years: an evolving microbiology profile[J]. J Arthroplasty, 2014, 29(5): 877-882. DOI:10.1016/j.arth.2013.09.053 |
| [3] |
Zmistowski B, Karam JA, Durinka JB, et al. Periprosthetic joint infection increases the risk of one-year mortality[J]. J Bone Joint Surg Am, 2013, 95(24): 2177-2184. DOI:10.2106/JBJS.L.00789 |
| [4] |
周一逸, 刘仪, 袁鹏, 等. 骨关节置换术后假体周围感染的病原菌特征及影响因素分析[J]. 中华医院感染学杂志, 2019, 29(14): 2189-2193. Zhou YY, Liu Y, Yuan P, et al. Etiological characteristics and influencing factors for postoperative periprosthetic joint infection in arthroplasty patients[J]. Chinese Journal of Nosocomiology, 2019, 29(14): 2189-2193. |
| [5] |
徐倩, 刘玥, 李丹华. 人工关节置换术后假体周围感染病原菌分布及耐药性分析[J]. 检验医学与临床, 2020, 17(13): 1854-1856, 1859. Xu Q, Liu Y, Li DH. Analysis of the distribution and drug resistance of pathogenic bacteria after artificial joint replacement[J]. Laboratory Medicine and Clinic, 2020, 17(13): 1854-1856, 1859. DOI:10.3969/j.issn.1672-9455.2020.13.016 |
| [6] |
中华医学会骨科学分会关节外科学组《中国PJI诊断和治疗指南》编写委员会. 中国人工关节感染诊断与治疗指南[J]. 中华外科杂志, 2021, 59(6): 430-442. Compilation Committee of Chinese PJI diagnosis and treatment guidelines by joint surgery group of Orthopaedic Branch of Chinese Medical Association. Guidelines for the diagnosis and treatment of prosthetic joint infection[J]. Chinese Journal of Surgery, 2021, 59(6): 430-442. DOI:10.3760/cma.j.cn112139-20210309-00120 |
| [7] |
Kunutsor SK, Whitehouse MR, Blom AW, et al. Patient-related risk factors for periprosthetic joint infection after total joint arthroplasty: a systematic review and Meta-analysis[J]. PLoS One, 2016, 11(3): e0150866. DOI:10.1371/journal.pone.0150866 |
| [8] |
Arciola CR, Campoccia D, Montanaro L. Implant infections: adhesion, biofilm formation and immune evasion[J]. Nat Rev Microbiol, 2018, 16(7): 397-409. DOI:10.1038/s41579-018-0019-y |
| [9] |
Masters EA, Ricciardi BF, Bentley KLDM, et al. Skeletal infections: microbial pathogenesis, immunity and clinical mana-gement[J]. Nat Rev Microbiol, 2022, 1-16. DOI:10.1038/s41579-022-00686-0 |
| [10] |
陈志, 林佳俊, 刘文革, 等. 髋膝关节置换术后假体周围感染病原菌分布与耐药性变化趋势分析[J]. 中国骨伤, 2020, 33(11): 1032-1036. Chen Z, Lin JJ, Liu WG, et al. Distribution and drug resis-tance of pathogens causing periprosthetic infections after hip and knee arthroplasty[J]. China Journal of Orthopaedics and Traumatology, 2020, 33(11): 1032-1036. DOI:10.12200/j.issn.1003-0034.2020.11.009 |
| [11] |
程翔, 梁玉龙, 邵宏翊, 等. 假体周围感染病原菌及耐药性分析[J]. 中国矫形外科杂志, 2020, 28(11): 870-875. Cheng X, Liang YL, Shao HY, et al. An analysis on pathogens and their drug resistance in periprosthetic joint infection[J]. Orthopedic Journal of China, 2020, 28(11): 870-875. |
| [12] |
边森, 许方彧, 宋晓飞, 等. 某院35例行髋膝关节置换术患者术后假体周围感染病原菌的分布及其耐药情况分析[J]. 抗感染药学, 2021, 18(3): 394-397. Bian S, Xu FY, Song XF, et al. Distribution and drug resis-tance analysis of pathogenic bacteria around prosthesis in 35 patients undergoing hip and knee arthroplasty in a hospital[J]. Anti-Infection Pharmacy, 2021, 18(3): 394-397. |
| [13] |
Aggarwal VK, Bakhshi H, Ecker NU, et al. Organism profile in periprosthetic joint infection: pathogens differ at two arthroplasty infection referral centers in Europe and in the Uni-ted States[J]. J Knee Surg, 2014, 27(5): 399-406. DOI:10.1055/s-0033-1364102 |
| [14] |
Hischebeth GT, Randau TM, Ploeger MM, et al. Staphylococcus aureus versus Staphylococcus epidermidis in periprosthetic joint infection-outcome analysis of methicillin-resistant versus methicillin-susceptible strains[J]. Diagn Microbiol Infect Dis, 2019, 93(2): 125-130. DOI:10.1016/j.diagmicrobio.2018.08.012 |
| [15] |
Ito T, Katayama Y, Asada K, et al. Structural comparison of three types of staphylococcal cassette chromosome mec integrated in the chromosome in methicillin-resistant Staphylococcus aureus[J]. Antimicrob Agents Chemother, 2001, 45(12): 3677. DOI:10.1128/AAC.45.12.3677-3677.2001 |
| [16] |
Sabaté Brescó M, Harris LG, Thompson K, et al. Pathogenic mechanisms and host interactions in Staphylococcus epidermidis device-related infection[J]. Front Microbiol, 2017, 8: 1401. DOI:10.3389/fmicb.2017.01401 |
| [17] |
Kranjec C, Morales Angeles D, Torrissen Mårli M, et al. Staphylococcal biofilms: challenges and novel therapeutic perspectives[J]. Antibiotics (Basel), 2021, 10(2): 131. DOI:10.3390/antibiotics10020131 |
| [18] |
Kajiyama S, Tsurumoto T, Osaki M, et al. Quantitative analy-sis of Staphylococcus epidermidis biofilm on the surface of biomaterial[J]. J Orthop Sci, 2009, 14(6): 769-775. DOI:10.1007/s00776-009-1405-0 |
| [19] |
Koch JA, Pust TM, Cappellini AJ, et al. Staphylococcus epidermidis biofilms have a high tolerance to antibiotics in periprosthetic joint infection[J]. Life (Basel), 2020, 10(11): 253. |
| [20] |
Lamret F, Colin M, Mongaret C, et al. Antibiotic tolerance of Staphylococcus aureus biofilm in periprosthetic joint infections and antibiofilm strategies[J]. Antibiotics (Basel), 2020, 9(9): 547. DOI:10.3390/antibiotics9090547 |
| [21] |
Zimmerli W. Clinical presentation and treatment of orthopaedic implant-associated infection[J]. J Intern Med, 2014, 276(2): 111-119. DOI:10.1111/joim.12233 |
| [22] |
Osmon DR, Berbari EF, Berendt AR, et al. Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2013, 56(1): e1-e25. DOI:10.1093/cid/cis803 |
| [23] |
张超凡, 忻振凯, 张文明. 保留假体的清创术治疗急性人工关节感染[J]. 中华骨与关节外科杂志, 2016, 9(6): 520-525. Zhang CF, Xin ZK, Zhang WM. A review on debridement, antibiotics and implant retention for acute periprosthetic joint infetcion[J]. Chinese Journal of Bone and Joint Surgery, 2016, 9(6): 520-525. |
| [24] |
宋兴桂, 李昕, 陈继营. 保留假体清创术治疗人工关节置换术后假体周围感染[J]. 协和医学杂志, 2019, 10(4): 370-374. Song XG, Li X, Chen JY. Treatment of periprosthetic joint infection following total hip and knee arthroplasty with debridement and prosthesis retention[J]. Medical Journal of Peking Union Medical College Hospital, 2019, 10(4): 370-374. DOI:10.3969/j.issn.1674-9081.2019.04.012 |
| [25] |
Kunutsor SK, Beswick AD, Whitehouse MR, et al. Debridement, antibiotics and implant retention for periprosthetic joint infections: a systematic review and Meta-analysis of treatment outcomes[J]. J Infect, 2018, 77(6): 479-488. DOI:10.1016/j.jinf.2018.08.017 |
| [26] |
Rao N, Crossett LS, Sinha RK, et al. Long-term suppression of infection in total joint arthroplasty[J]. Clin Orthop Relat Res, 2003(414): 55-60. |
| [27] |
Goulet JA, Pellicci PM, Brause BD, et al. Prolonged suppression of infection in total hip arthroplasty[J]. J Arthroplasty, 1988, 3(2): 109-116. DOI:10.1016/S0883-5403(88)80075-5 |
| [28] |
Tsukayama DT, Wicklund B, Gustilo RB. Suppressive antibio-tic therapy in chronic prosthetic joint infections[J]. Orthopedics, 1991, 14(8): 841-844. DOI:10.3928/0147-7447-19910801-07 |
| [29] |
Berbari EF, Marculescu C, Sia I, et al. Culture-negative prosthetic joint infection[J]. Clin Infect Dis, 2007, 45(9): 1113-1119. DOI:10.1086/522184 |
| [30] |
Tande AJ, Patel R. Prosthetic joint infection[J]. Clin Microbiol Rev, 2014, 27(2): 302-345. DOI:10.1128/CMR.00111-13 |
| [31] |
Berdal JE, Skråmm I, Mowinckel P, et al. Use of rifampicin and ciprofloxacin combination therapy after surgical debridement in the treatment of early manifestation prosthetic joint infections[J]. Clin Microbiol Infect, 2005, 11(10): 843-845. DOI:10.1111/j.1469-0691.2005.01230.x |
| [32] |
Wehrli W. Rifampin: mechanisms of action and resistance[J]. Rev Infect Dis, 1983, 5(Suppl 3): S407-S411. |
| [33] |
Gandhi R, Backstein D, Zywiel MG. Antibiotic-laden bone cement in primary and revision hip and knee arthroplasty[J]. J Am Acad Orthop Surg, 2018, 26(20): 727-734. DOI:10.5435/JAAOS-D-17-00305 |
| [34] |
Corona PS, Espinal L, Rodríguez-Pardo D, et al. Antibiotic susceptibility in Gram-positive chronic joint arthroplasty infections: increased aminoglycoside resistance rate in patients with prior aminoglycoside-impregnated cement spacer use[J]. J Arthroplasty, 2014, 29(8): 1617-1621. DOI:10.1016/j.arth.2014.03.029 |
| [35] |
Kuehn KD, Ege W, Gopp U. Acrylic bone cements: composition and properties[J]. Orthop Clin North Am, 2005, 36(1): 17-28. DOI:10.1016/j.ocl.2004.06.010 |
| [36] |
刘浩, 李静. 骨折内固定术后感染的药物治疗[J]. 中华创伤杂志, 2020, 36(6): 567-573. Liu H, Li J. Drug therapy for infection after internal fixation of fracture[J]. Chinese Journal of Trauma, 2020, 36(6): 567-573. DOI:10.3760/cma.j.issn.1001-8050.2020.06.016 |
| [37] |
Schmid M, Steiner O, Fasshold L, et al. The stability of carbapenems before and after admixture to PMMA-cement used for replacement surgery caused by Gram-negative bacteria[J]. Eur J Med Res, 2020, 25(1): 34. DOI:10.1186/s40001-020-00428-z |
| [38] |
李涛, 史占军, 王健, 等. 两种抗生素复合骨水泥的材料学性能及抗菌活性研究[J]. 中华关节外科杂志(电子版), 2016, 10(4): 407-412. Li T, Shi ZJ, Wang J, et al. Effects of bone cement impregnated with two antibiotics on material and antibacterial properties[J]. Chinese Journal of Joint Surgery(Electronic Edition), 2016, 10(4): 407-412. DOI:10.3877/cma.j.issn.1674-134X.2016.04.009 |



