2. 上海市疾病预防控制中心传染病防治所, 上海 200336
2. Department of Acute Communicable Disease Control and Prevention, Shanghai Municipal Center for Disease Control and Prevention, Shanghai 200336, China
金黄色葡萄球菌(Staphylococcus aureus),尤其是耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA),是引起医院感染的重要病原菌之一,可导致菌血症、中毒休克综合征等多种进行性坏死疾病[1]。据世界卫生组织(WHO)报道,2011年全世界医院感染发病率为5.7%~19.1%,平均发病率为10.1%[2],医院感染将成为日益严重的公共卫生问题。
医务人员手卫生与医院感染的发生密切相关。医院感染通常是直接或间接经手传播,经医务人员手传播细菌造成的感染约占30%[3],也可因医务人员手携带耐药菌株而导致感染在医院内广泛传播甚至暴发流行[4]。研究[5]报道多重耐药菌医院感染的主要传播途径是医务人员的手。胡瑛等[6]对某儿童医院内新生儿及医务人员分离的MRSA进行研究发现,医务人员手是MRSA医院感染的主要途径。
为了解上海市各级医院医务人员手部金黄色葡萄球菌的携带情况,本研究分析2018-2020年16所不同级别医院工作人员手部分离的金黄色葡萄球菌,并利用全基因组测序技术(whole genoem sequencing, WGS)和脉冲肠凝胶电泳(pulsed-field gel electrophoresis,PFGE)对分离的金黄色葡萄球菌进行同源性分析,耐药性、耐药基因、抗消毒剂基因、毒力基因及核心基因组多位点序列分型(cgMLST)和多位点序列分型(MLST)分析,鉴定MRSA菌株,调查其传播途径,为医院感染的预防与控制提供依据。
1 材料与方法 1.1 采样方案本研究中监测点医疗机构均根据2016年版《上海市医疗机构耐药菌监测方案》,对医疗机构重点科室工作人员的手进行采样,如外科、重症监护病房(ICU)、呼吸内科、心血管内科等,每所监测点医疗机构每季度采集工作人员手标本4份,针对医务人员在工作状态时、脱掉手套时暴露的手部皮肤进行采样,检测金黄色葡萄球菌。
1.2 试剂与仪器甲酸(formic acid, FA)、乙腈(acetonitrile, ACN)、无水乙醇(色谱纯)均为美国Sigma公司。VITEK MS-CHCA基质液(法国梅里埃)。Baird-Parker平板(上海申启)、哥伦比亚血平板(上海申启)。细菌全基因组提取试剂盒(Takara,日本)。药敏板(珠海美华)。基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry, MALDI-TOF MS)仪器为法国生物梅里埃公司。
1.3 采样及金黄色葡萄球菌检测将浸有无菌0.03 mol/L磷酸盐缓冲液或生理盐水采样液的棉拭子一支在双手指曲面从指根到指端来回涂擦各2次,一只手涂擦面积约30 cm2。将采样液接种到等体积的双倍SCDLP液体培养基中,于36℃孵育24 h;划线接种于金黄色葡萄球菌显色培养基,于36℃孵育24 h,挑取可疑菌落(圆形、光滑、凸起、紫色的菌落),革兰染色为阳性、触酶试验为阴性、血浆凝固酶试验阳性,最后利用微生物质谱鉴定仪进行鉴定。质谱鉴定用参考菌株:ATCC 8739。
1.4 MALDI-TOFMS鉴定[7]挑取适量(约5~10 mg)菌落样品于1.5 mL离心管中,加入900 μL无水乙醇,混匀;12 000 r/min离心2 min,弃去上清液;加入40 μL 70%甲酸,混匀,再加入40 μL乙腈,混匀,12 000 r/min离心2 min,吸取1 μL上清液点在靶板上,自然晾干后再点1 μL CHCA基质覆盖,晾干后进行质谱分析。30 min后观察结果。
1.5 药敏试验采用微量肉汤稀释法进行药敏试验,采用革兰阳性药敏板检测,依据说明书的检测原理及操作步骤完成:每种抗菌药物都设有一系列倍比稀释的浓度,通过加入待检金黄色葡萄球菌肉汤培养液稀释的菌悬液,经18~20 h孵育后,肉眼判读药敏板条,获得其最低抑菌浓度(minimum inhibitory concentration, MIC)值,并根据2020版美国临床实验室标准化协会(CLSI)的标准获得相应敏感(S)、中介(I)和耐药(R)结果。
1.6 全基因组测序取适量新鲜菌液,用Genomic DNA purification kit试剂盒提取细菌全基因组DNA。全基因组测序由生工生物工程公司完成,采用Illumina Hiseaxten PE150测序仪(美国Illumina公司)进行全基因组分析。测序策略:先将样本DNA随机打断,构建DNA文库,然后分别进行平行测序。数据处理:测序获得原始数据,进行质控,将合格的数据Clean data导入BioNumerics 7.0软件进行序列拼接。
1.7 MLST和cgMLST分析MLST参考S. aureus分型的管家基因:arcC、aroE、glpF、gmk、pta、tpiA和yqiL (http://pubmlst.org/database/)。利用BioNumerics 7.0软件从上述拼接好的序列中提取相应的管家基因,然后利用BN软件的功能分配ST型。
cgMLST分析,根据BioNumerics Calculation Engine上的Staphylococcus aureus数据库,从上述拼接好的序列中选取1 861个核心基因,利用BioNumerics 7.0软件对其进行聚类分析。
1.8 毒力基因和耐药基因分析利用BioNumerics软件拼接后的序列,通过序列比对分析获得毒力基因谱和耐药基因谱。分别参考官网:Virulence Factor Database (VFDB)、(MOH Key Laboratory of Systems Biology of Pathogen, Institute of Pathogen Biology, Beijing, China)、(http://www.mgc.ac.cn)和CARD (https://card.mcmaster.ca/)。
1.9 耐消毒剂基因检测计算机检索中国知网(CNKI)、万方数据库、PubMed等数据库,以金黄色葡萄球菌、消毒剂、主动外排系统、耐消毒剂基因作为检索词,在上述数据库进行检索。检索到的耐消毒剂基因为:qacA/B、qacC、qacD、qacG、qacH、qacJ、norA。将这些基因在NCBI官网搜索核酸序列,再与本研究中金黄色葡萄球菌拼接序列进行比对,分析耐消毒剂基因。
2 结果 2.1 金黄色葡萄球菌检出情况2018-2020年16所医疗机构共采样768份。经生化和MALDI-TOF MS鉴定,工作人员手部共检测出22株金黄色葡萄球菌,携带率为2.9%(22/768),来自9所医疗机构(医院A~I),医生检出8株(36.4%),护士检出9株(40.9%),护工检出5株(22.7%)。来源于6个科室:综合ICU 7株(31.8%),老年科7株(31.8%),呼吸内科、普通外科、烧伤科、神经外科均为2株(9.1%)。调查中医务人员使用的手消毒剂有3种:醇类消毒剂占68.2%(15名)、含氯消毒剂占9.1%(2名)、复合型消毒剂占22.7%(5名)。见表 1。
| 表 1 22株医疗机构工作人员手分离金黄色葡萄球菌的来源情况 Table 1 Sources of 22 strains of SA from hands of medical staff |
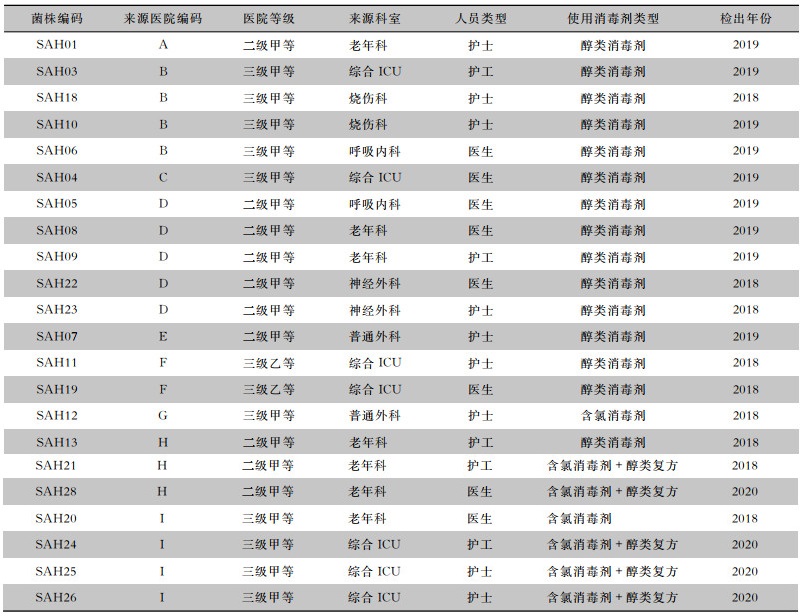
|
分析22株金黄色葡萄球菌全基因组测序的原始数据,满足以下条件:平均测序读长为200~300 bp,原始数据量≥1.5 G,且Q20高质量数据量平均1.2 G(Clean data≥1 G);基因组整体覆盖深度≥100 X;碱基数据质量值Q20≥95%,Q30≥85%,SCAFFOLD数量<100个,Contig数量<200个,单碱基错误率低于十万分之一。
2.3 耐药性、耐药基因及耐消毒剂基因分析22株手标本检出的金黄色葡萄球菌对红霉素、环丙沙星的耐药率较高,分别为36.3%、22.7%;其次为四环素、左氧氟沙星和奎奴普丁/达福普汀,耐药率均为18.2%;对头孢西丁和苯唑西林的耐药率均为13.6%;对米诺环素、庆大霉素和复方磺胺甲口恶唑的耐药率分别为9.1%、4.5%、4.5%。对万古霉素、利奈唑胺、替加环素均敏感,见表 2。22株金黄色葡萄球菌共携带10种耐药基因,其中13株(59.1%)携带blaZ基因;9株(40.9%)携带氨基糖苷类耐药基因:2株aac(6’)-aph(2”),2株aph(3’)-Ⅲ,3株ant(9)-Ia,2株ant(6)-Ia;7株(31.8%)携带红霉素耐药基因:3株erm(A)、1株erm(B)、2株erm(C)、1株erm(T);4株(18.2%)携带甲氧西林耐药基因mecA;2株(9.1%)携带克林霉素耐药基因lnu(A),1株携带夫西地酸耐药基因fusB,1株携带介导外排泵的msr(A)基因;1株携带磺胺类耐药基因dfrG,见表 3。
| 表 2 医疗机构工作人员手分离金黄色葡萄球菌对16种抗菌药物的耐药情况(%) Table 2 Resistance of SA from hands of medical staff to 16 kinds of antimicrobial agents (%) |
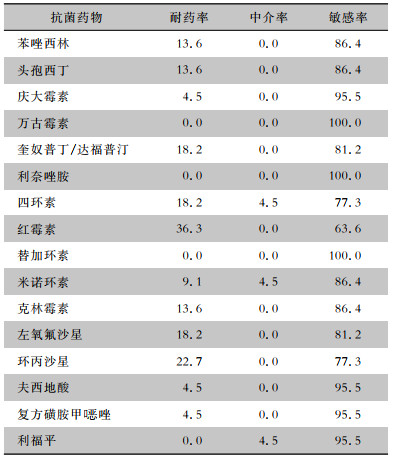
|
| 表 3 医疗机构工作人员手分离金黄色葡萄球菌的耐药性、耐药基因、毒力基因、耐消毒剂基因及ST型分析 Table 3 Antimicrobial resistance, resistance genes, virulence genes, disinfectant resistance genes and ST type of SA from hands of medical staff |
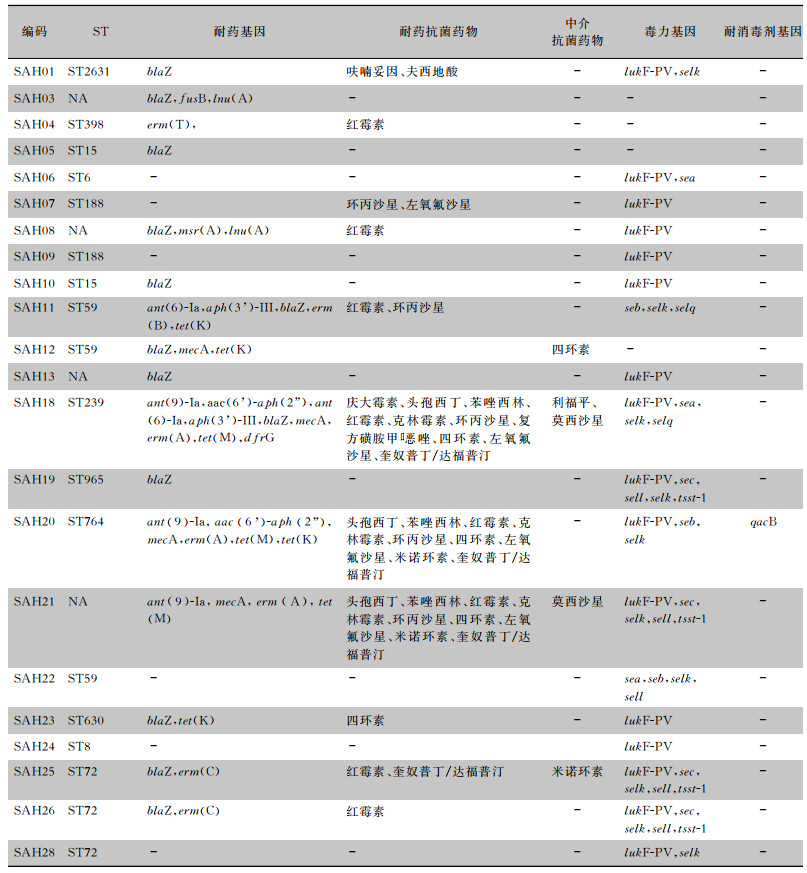
|
3株金黄色葡萄球菌对苯唑西林和头孢西丁耐药,为MRSA,其中1株同时携带mecA和blaZ耐药基因,19株为甲氧西林敏感金黄色葡萄球菌(methicillin-susceptible Staphylococcus aureus,MSSA)。3株MRSA (SAH18、SAH20、SAH21)分别来自3所医院不同科室的护士、医生和护工,均对7种及以上抗菌药物耐药。
22株金黄色葡萄球菌仅1株携带耐消毒剂基因qacB,此菌株被鉴定为MRSA(SAH20),同时携带6种耐药基因,携带多种毒力基因(lukF-PV, seb, selk)。
2.4 携带毒力基因情况分析22株金黄色葡萄球菌携带lukF-PV、tsst-1和肠毒素基因的情况。各毒力基因的携带率:lukF-PV为72.7%(16株);tsst-1为18.2%(4株);肠毒素基因sea为13.6%(3株);seb为13.6%(3株);sec为18.2%(4株);selk为45.5%(10株);sell为22.7%(5株);selq为9.1%(2株)。其中4株菌(SAH19、SAH21、SAH25和SAH26)同时携带lukF-PV、tsst-1和肠毒素基因,见表 3。
2.5 金黄色葡萄球菌分子分型特征MLST结果显示,22株金黄色葡萄球菌中18株分为12个ST型,还有4株为新ST型。12个ST型中,ST72、ST59各有3株,ST15、ST188各有2株,其他型别各有1株,分别为ST2631、ST398、ST6、ST239、ST965、ST764、ST630、ST8。22株金黄色葡萄球菌除1株ST398外,其余菌株均可进行PFGE分型。共分为20个PFGE带型(PT1-PT20),呈现高度多样性,见图 1。PT3和PT8中金黄色葡萄球菌的PFGE带型相似度均为96.6%,提示SAH05和SAH10以及SAH25和SAH26菌株可能为克隆株。SAH05和SAH10分别来自医院D的医生和医院B的护士,均为ST15。SAH25和SAH26均为ST72,于2020年分离自医院I护士的手。
 |
| 注:N/A表示不能分型。 图 1 22株医疗机构工作人员手分离金黄色葡萄球菌的PFGE聚类分析 Figure 1 PFGE profiles of 22 strains of SA from hands of medical staff |
cgMLST分析结果显示,22株金黄色葡萄球菌中除SAH25和SAH26之间有1个差异基因,其余金黄色葡萄球菌菌株之间的差异基因个数均>145,提示这些菌株之间没有亲缘关系,见图 2。cgMLST结果与PFGE结果一致,进一步证实SAH25和SAH26为克隆株。
 |
| 注:等位基因差异的个数为图中显示数字的10倍;N/A表示不能分型。注:等位基因差异的个数为图中显示数字的10倍;N/A表示不能分型。 图 2 22株医疗机构工作人员手分离金黄色葡萄球菌cgMLST聚类图 Figure 2 cgMLST clusters of 22 strains of SA from hands of medical staff |
研究[8]证实,医务人员被污染的手在金黄色葡萄球菌传播过程中发挥重要作用。甚至有研究[9]表明医务人员的手作为重要的细菌传播载体,所造成的医院感染占总医院感染的30%左右。本研究中,医疗机构工作人员的手金黄色葡萄球菌分离率为2.9%。张友平等[10]报道广东省某医院医务人员手的MRSA检出率为37.5%。综合ICU和老年科往往是金黄色葡萄球菌分离率较高的病区,医务人员为患者进行侵入性操作时,可导致医务人员手被污染的概率增加[11],我国有医务人员手携带MRSA并导致ICU发生医院感染暴发的报道[12]。已有研究[13]显示,该院综合ICU和老年科临床住院患者金黄色葡萄球菌的分离率也较高,因此导致护理人员被污染的概率增加。国外研究[14]发现,提高手卫生依从率可降低医院感染发病率,因此重视手卫生,做好手清洁、消毒,可以有效阻断金黄色葡萄球菌传播,预防医院感染。
根据耐药性和耐药基因携带情况,3株菌被鉴定为MRSA,分别来自不同医院、不同科室的护士、护工和医生,同时携带多种耐药基因和多种毒力基因,与医疗机构中MRSA的耐药性一致[11]。值得注意的是,其中1株MRSA携带qacB,qacB是季铵盐类、双胍类消毒剂的耐药机制,也是细菌对碘伏、戊二醛消毒剂的耐药基因,主要因质子动力的多药外排导致耐药[15]。由于qacA和qacB只有7~9个碱基序列不同,聚合酶链反应(PCR)很难将其区分,因此很多研究报道中均是将qacA、qacB作为耐消毒剂基因。qacA、qacB尤其在MRSA菌株间广泛流行[16-17],吴建国等[18]研究表明,某医院中qacA、qacB在MRSA中的检出率为17.1%;国内其他地区qacA、qacB在MRSA中的检出率为38%~92%[19];2011年欧洲报道的qacA、qacB在MRSA中的检出率为44%~63%[20];qacA、qacB检出率的差异可能与地域不同、使用消毒剂的频次、习惯不同有关。qacA、qacB位于质粒pSK23上,其介导对抗菌药物的耐药性能在细菌间传递,使敏感株获得耐药性[21],因此qac基因的出现需引起人们重视。对医疗机构金黄色葡萄球菌进行耐消毒剂基因监测,可以为消毒剂的使用选择提供重要依据。
MLST显示22株金黄色葡萄球菌型别高度多样化,没有优势ST型。PFGE分型显示PT3(SAH05和SAH10)和PT8(SAH25和SAH26)中金黄色葡萄球菌的带型相似度很高(>95%),流行病学资料显示SAH05和SAH10来自不同医院的不同人员,其相关性较低。而SAH25和SAH26均为ST72,于2020年6月13日分离自同一所医院护士的手,而且cgMLST结果显示该2株菌株的差异基因仅10个,进一步证实其为克隆株,可能是护士之间相互传播,也可能是均感染自相同的环节或患者。因此,及时找出病原菌、切断传播途径,是预防控制金黄色葡萄球菌医院感染的重要手段。
22株金黄色葡萄球菌中MSSA比率较高,占86.4%,尽管3株MRSA的耐药率远高于MSSA,但是MSSA对红霉素、环丙沙星、四环素、左氧氟沙星也表现出不同程度的耐药性。研究[22]报道MSSA对常用抗菌药物也有不同程度的耐药,因此临床应合理选用抗菌药物。本研究显示金黄色葡萄球菌的耐药性和其携带耐药基因并不完全一致,与笔者对MRSA菌株的监测结果一致,可能是由于耐药基因的表达受到各种因素的影响,不一定表现出耐药性。因此在金黄色葡萄球菌的监测中,耐药性和耐药基因的监测同样重要。
本研究中,MRSA与MSSA携带毒力基因无明显差异,均携带较高的lukF-PV(72.7%)和较低比率的tsst-1(18.2%)和肠毒素基因(18.2%)。研究[23]表明MSSA携带较高比例的tsst-1基因,其编码中毒休克综合征毒素TSST-1[24]。这可能与金黄色葡萄球菌的来源不同有关,研究[25]发现不同疾病类型患者TSST-1阳性率比较,差异有统计学意义。
综上所述,上海市医疗机构工作人员手部金黄色葡萄球菌分离率为2.9%。共检出3株MRSA,且有1株携带qacB基因。PFGE和cgMLST提示在某医院中可能存在以手作为传播载体的金黄色葡萄球菌克隆传播。因此,重视手卫生,合理选用消毒剂,持续加强医疗机构工作人员手部金黄色葡萄球菌的监测,预防与控制医疗机构中由金黄色葡萄球菌引起的医院感染。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Lina G, Piémont Y, Godail-Gamot F, et al. Involvement of panton-valentine leukocidin-producing Staphylococcus aureus in primary skin infections and pneumonia[J]. Clin Infect Dis, 1999, 29(5): 1128-1132. DOI:10.1086/313461 |
| [2] |
World Health Organization. Report on the burden of endemic health care-associated infection worldwide[EB/OL]. [2021-11-20]. https://apps.who.int/iris/bitstream/handle/10665/80135/9789241501507_eng.pdf;sequence=1.
|
| [3] |
邵卫东. 手部卫生与医院感染[J]. 现代中西医结合杂志, 2007, 16(20): 2953-2954. Shao WD. Hand's hygiene and infection in hospitals[J]. Mo-dern Journal of Integrated Traditional Chinese and Western Medicine, 2007, 16(20): 2953-2954. DOI:10.3969/j.issn.1008-8849.2007.20.129 |
| [4] |
Boyce JM, Pittet D, Healthcare Infection Control Practices Advisory Committee, et al. Guideline for hand hygiene in health-care settings: recommendations of the healthcare infection control practices advisory committee and the HICPAC/SHEA/APIC/IDSA hand hygiene task force[J]. Infect Control Hosp Epidemiol, 2002, 23(12 Suppl): S3-S40. |
| [5] |
胡瑛, 文飞球, 梁静, 等. 新生儿重症监护病房医院感染肺炎克雷伯菌耐药性与同源性分析[J]. 儿科药学杂志, 2013, 19(11): 7-10. Hu Y, Wen FQ, Liang J, et al. Antibiotic resistance and homology of Klebsiella pneumoniae in hospital-acquired infections in the NICU[J]. Journal of Pediatric Pharmacy, 2013, 19(11): 7-10. |
| [6] |
胡瑛, 文飞球, 刘犇, 等. 新生儿、医务人员及环境分离耐甲氧西林金黄色葡萄球菌的同源性[J]. 中国感染控制杂志, 2017, 16(2): 142-145. Hu Y, Wen FQ, Liu B, et al. Homology of methicillin-resis-tant Stphylococcus aureus isolated from neonates, health care workers, and environment[J]. Chinese Journal of Infection Control, 2017, 16(2): 142-145. DOI:10.3969/j.issn.1671-9638.2017.02.010 |
| [7] |
Stephan R, Ziegler D, Pflüger V, et al. Rapid genus- and species-specific identification of Cronobacter spp. by matrix-assisted laser desorption ionization-time of flight mass spectrometry[J]. J Clin Microbiol, 2010, 48(8): 2846-2851. DOI:10.1128/JCM.00156-10 |
| [8] |
Genc O, Arikan I. The relationship between hand hygiene practices and nasal Staphylococcus aureus carriage in healthcare workers[J]. Med Lav, 2020, 111(1): 54-62. |
| [9] |
何梅花. 手卫生在预防和控制医院感染中的作用[J]. 世界最新医学信息文摘, 2017, 17(59): 151. He MH. The role of hand's hygiene in prevention and control of infection in hospital[J]. World Latest Medicine Information, 2017, 17(59): 151. |
| [10] |
张友平, 王凯, 徐敏丽, 等. 医务人员手耐甲氧西林金黄色葡萄球菌带菌状况及消毒效果的研究[J]. 护理学报, 2011, 18(24): 65-67. Zhang YP, Wang K, Xu ML, et al. MRSA-carrying hands of medical staff and its disinfection[J]. Journal of Nursing(China), 2011, 18(24): 65-67. DOI:10.3969/j.issn.1008-9969.2011.24.026 |
| [11] |
范水英, 龙素芬, 刘艳阳. 医院感染与护理人员手污染的调查研究[J]. 当代护士, 2018(5): 37-38. Fan SY, Long SF, Liu YY. Investigation of hands' contamination in hospitals[J]. Modern nurse, 2018(5): 37-38. |
| [12] |
赵文凯. 耐甲氧西林金黄色葡萄球菌暴发流行的调查研究[J]. 中华医院感染学杂志, 2008, 18(1): 64. Zhao WK. Investigation of outbreak caused by methicillin-resistant Staphylococcus aureus[J]. Chinese Journal of Nosocomiology, 2008, 18(1): 64. DOI:10.3321/j.issn:1005-4529.2008.01.056 |
| [13] |
陈泰尧, 葛忆琳, 刘雪薇, 等. 2017-2018年上海某医院耐甲氧西林金黄色葡萄球菌分子生物学特征研究[J]. 中华预防医学杂志, 2020, 54(8): 849-853. Chen TY, Ge YL, Liu XW, et al. Molecular epidemiological characteristics of methicillin-resistant Staphylococcus aureus during 2017-2018 at a hospital in Shanghai[J]. Chinese Journal of Preventive Medicine, 2020, 54(8): 849-853. DOI:10.3760/cma.j.cn112150-20190819-00669 |
| [14] |
甘露, 周炼红, 吴之坤, 等. 眼科感染性疾病的病原菌种类及耐药性分析[J]. 临床血液学杂志, 2015, 28(8): 712-714. Gan L, Zhou LH, Wu ZK, et al. Species and antimicrobial resistance of pathogenic bacteria causing infections in department of ophthalmology[J]. Journal of Clinical Hematology, 2015, 28(8): 712-714. |
| [15] |
Putman M, van Veen HW, Konings WN. Molecular properties of bacterial multidrug transporters[J]. Microbiol Mol Biol Rev, 2000, 64(4): 672-693. DOI:10.1128/MMBR.64.4.672-693.2000 |
| [16] |
Alam MM, Kobayashi N, Uehara N, et al. Analysis on distribution and genomic diversity of high-level antiseptic resistance genes qacA and qacB in human clinical isolates of Staphylococcus aureus[J]. Microb Drug Resist, 2003, 9(2): 109-121. DOI:10.1089/107662903765826697 |
| [17] |
Noguchi N, Suwa J, Narui K, et al. Susceptibilities to antiseptic agents and distribution of antiseptic-resistance genes qacA/B and smr of methicillin-resistant Staphylococcus aureus isolated in Asia during 1998 and 1999[J]. J Med Microbiol, 2005, 54(Pt 6): 557-565. |
| [18] |
吴建国, 黄余清, 严明, 等. 金黄色葡萄球菌耐消毒剂基因的检测[J]. 中国感染与化疗杂志, 2016, 16(3): 340-345. Wu JG, Huang YQ, Yan M, et al. Detection of disinfectant-resistant gene in Staphylococcus aureus[J]. Chinese Journal of Infection and Chemotherapy, 2016, 16(3): 340-345. |
| [19] |
Song Y, Du X, Li TM, et al. Phenotypic and molecular chara-cterization of Staphylococcus aureus recovered from different clinical specimens of inpatients at a teaching hospital in Shanghai between 2005 and 2010[J]. J Med Microbiol, 2013, 62(Pt 2): 274-282. |
| [20] |
Fluit AC, Wielders CL, Verhoef J, et al. Epidemiology and susceptibility of 3, 051 Staphylococcus aureus isolates from 25 university hospitals participating in the European SENTRY study[J]. J Clin Microbiol, 2001, 39(10): 3727-3732. DOI:10.1128/JCM.39.10.3727-3732.2001 |
| [21] |
Nakaminami H, Noguchi N, Nishijima S, et al. Transduction of the plasmid encoding antiseptic resistance gene qacB in Staphylococcus aureus[J]. Biol Pharm Bull, 2007, 30(8): 1412-1415. DOI:10.1248/bpb.30.1412 |
| [22] |
Deasy EC, Brennan GI, Tecklenborg SC, et al. A molecular epidemiological investigation of methicillin-susceptible Staphy-lococcus aureus causing bloodstream infections in Ireland, 2006-2017[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(5): 927-936. DOI:10.1007/s10096-019-03523-0 |
| [23] |
Bonsaglia ECR, Silva NCC, Rossi BF, et al. Molecular epidemiology of methicillin-susceptible Staphylococcus aureus (MSSA) isolated from milk of cows with subclinical mastitis[J]. Microb Pathog, 2018, 124: 130-135. DOI:10.1016/j.micpath.2018.08.031 |
| [24] |
Kim HK, Garcia AB, Siu E, et al. Macrophage migration inhibitory factor regulates innate γδ T-cell responses via IL-17 expression[J]. FASEB J, 2019, 33(6): 6919-6932. DOI:10.1096/fj.201802433R |
| [25] |
董秀慧, 范玉, 张树元, 等. 皮肤软组织感染分离的甲氧西林敏感金黄色葡萄球菌TSST-1基因及耐药性[J]. 中华医院感染学杂志, 2020, 30(16): 2498-2501. Dong XH, Fan Y, Zhang SY, et al. TSST-1 gene in methicillin-sensitive Staphylococcus aureus isolated from patients with skin and soft tissue infection and drug resistance[J]. Chinese Journal of Nosocomiology, 2020, 30(16): 2498-2501. |



