2. 兰州大学第二医院小儿心血管科, 甘肃 兰州 730030;
3. 兰州大学第二临床医学院, 甘肃 兰州 730030
2. Department of Pediatric Cardiology, Lanzhou University Second Hospital, Lanzhou 730030, China;
3. The Second School of Clinical Medicine, Lanzhou University, Lanzhou 730030, China
川崎病(Kawasaki disease, KD)作为一种以全身性血管炎为主要病变的儿科常见疾病,发病率逐年升高,已成为发达国家和我国部分地区儿童获得性心脏病的主要病因[1],其心血管并发症严重威胁着KD患儿远期的生命健康,是导致患儿死亡的主要原因[2]。目前KD的病因尚不明确,有学者认为病原体感染与KD发生密切相关[3],其中肺炎支原体(Mycoplasma pneumoniae, MP)即为潜在的致病菌之一[4]。MP作为小儿呼吸道感染常见的病原体,除主要损伤呼吸系统外,还可累及诸多系统引发肺外并发症[5]。近年来研究[6]发现,KD患儿常伴有MP感染,从而加重疾病对患儿健康的影响;但目前国内外鲜有比较全面的关于MP感染后KD患儿心血管损伤的文献报道,故本研究对某三级综合医院小儿心血管科收治的270例KD患儿进行回顾性分析,了解MP感染对KD患儿心血管损伤特点,以期指导临床对患儿采取个体化治疗。
1 对象与方法 1.1 研究对象选取2018年1月—2021年3月收治于某三级综合医院小儿心血管科的KD患儿为研究对象,并根据MP感染情况分为KD合并MP感染组(KD-MP组)和KD未合并MP感染组(KD组)。纳入标准:(1)符合KD的诊断标准;(2)初次确诊KD的患儿;(3)年龄≤14岁。排除标准:(1)临床病历资料不全者;(2)入院前已静脉注射丙种球蛋白(IVIG)者;(3)合并其他病原体感染者(如柯萨奇病毒、EB病毒、轮状病毒、副流感病毒、金黄色葡萄球菌、链球菌等);(4)先天性心脏病患者。
1.2 诊断标准KD的诊断参照2017年美国心脏协会(AHA)更新的标准[7]。由于本研究所纳入的病例包含部分未使用冠状动脉内径Z值判断冠状动脉损伤(coronary artery lesion,CAL)及冠状动脉瘤(coronary artery aneurysm, CAA)分级的病例,故仍将冠状动脉内径的绝对值作为诊断依据,主要参考2015年出版的《诸福棠实用儿科学》第八版[8]:0~3岁≥2.5 mm、3~9岁≥3.0 mm、9~14岁≥3.5 mm定义为CAL;其中<4 mm为轻度扩张,4~7 mm为中型CAA,≥8 mm为巨大CAA。MP感染诊断依据《儿童肺炎支原体肺炎诊治专家共识(2015年版)》[9],经九项呼吸道感染病原体检测肺炎支原体IgM呈阳性,且血清抗体滴度≥1 ∶160,并结合临床表现综合判断。
1.3 研究方法通过患者的病案号查阅电子病历系统,回顾性收集KD患儿的临床资料。主要包括,(1)一般资料:性别、年龄、是否合并MP感染;(2)血小板参数:血小板计数(PLT)、血小板分布宽度(PDW)、平均血小板体积(MPV)、血小板压积(PCT);(3)凝血相关指标:凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、纤维蛋白原(FIB)、凝血酶时间(TT)、抗凝酶Ⅲ(AT-Ⅲ)、D-二聚体(D-D)、纤维蛋白原降解产物(FDP);(4)心肌酶谱:天门冬氨酸氨基转移酶(AST)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH);(5)超声心动图:冠状动脉内径、血栓形成、心脏增大、心包积液、二尖瓣反流、三尖瓣反流、主动脉瓣反流、心功能降低。若患儿首次使用IVIG治疗前有多次检查结果,则取最差值。
1.4 统计学方法应用SPSS 26.0统计软件进行数据分析,计量资料若为正态分布,以x±s表示,不服从正态分布则以M(P25,P75)表示,并分别采用独立样本t检验和非参数检验进行比较。计数资料以例数和百分比表示,采用χ2检验或Fisher’s确切概率法进行比较。P≤0.05为差异具有统计学意义。
2 结果 2.1 一般资料2018年1月—2021年3月共收治确诊KD患儿376例,依据纳入、排除标准共排除106例,其中52例临床资料不全,43例合并其他病原体感染,7例入院前已行IVIG治疗,4例患有先天性心脏病。最终纳入270例KD患儿,其中KD-MP组70例,男性43例(61.43%),女性27例(38.57%),年龄为[2.28(1.68,3.76)]岁;KD组200例,男性140例(70.00%),女性60例(30.00%),年龄为[2.14(1.36,3.40)]岁,两组患儿在性别、年龄分布上比较,差异均无统计学意义(均P>0.05)。
2.2 KD-MP组与KD组患儿血小板参数比较KD-MP组MPV中位水平[10.00(9.08,11.00) fL]较KD组[9.60(8.83,10.68) fL] 更高,差异有统计学意义(P<0.05);两组患儿PLT、PDW、PCT水平比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 KD-MP组与KD组患儿血小板参数水平比较[M(P25, P75)] Table 1 Comparison of platelet parameters in children in KD-MP group and KD group (M[P25, P75]) |
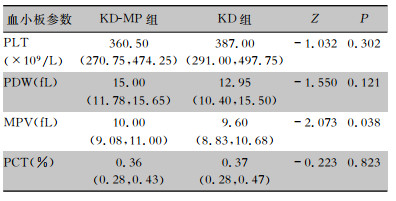
|
在凝血相关指标中,KD-MP组与KD组患儿除FIB、D-D外,结果多在正常参考范围内,两组患儿所有凝血指标比较,差异均无统计学意义(均P>0.05)。见表 2。
| 表 2 KD-MP组与KD组患儿凝血相关指标比较[M(P25, P75)] Table 2 Comparison of coagulation-related indexes in children in KD-MP group and KD group (M[P25, P75]) |
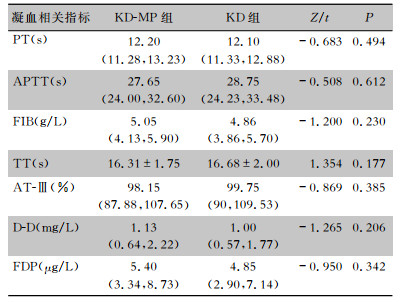
|
KD-MP组与KD组患儿的心肌酶水平比较,差异均无统计学意义(均P>0.05)。见表 3。
| 表 3 KD-MP组与KD组患儿心肌酶水平比较[M(P25, P75)] Table 3 Comparison of myocardial enzyme level in children in KD-MP group and KD group (M[P25, P75]) |
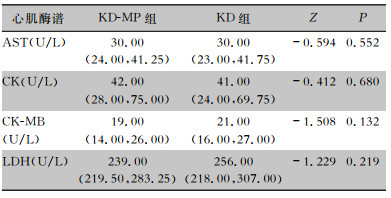
|
KD-MP组CAL、冠状动脉轻度扩张、心包积液的占比分别为55.71%、47.14%、15.71%,高于KD组的38.50%、30.50%、5.50%,差异均有统计学意义(均P<0.05);两组患儿心脏增大、中型CAA、巨大CAA、二尖瓣反流、三尖瓣反流、主动脉瓣反流及心功能降低等不良结局占比比较,差异均无统计学意义(均P>0.05)。见表 4。
| 表 4 KD-MP组与KD组患儿不良结局指标比较[例(%)] Table 4 Comparison of adverse outcomes in children in KD-MP group and KD group(No. of cases[%]) |
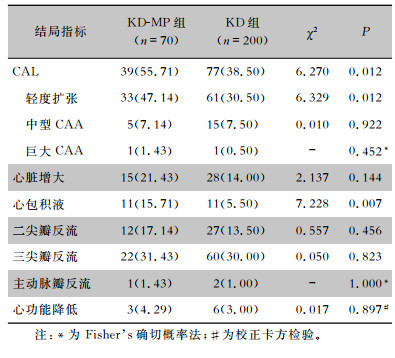
|
自1967年首次报告KD以来,医学界对其病因进行了广泛的研究,其主要集中在病原体感染、遗传倾向、免疫失调和环境因素四方面[10],特别是KD的流行病学特征高度提示感染源起重要作用,目前研究报道可能与KD发病有关的病原体达数十种[11],MP为其中之一[12]。本研究中KD-MP感染患儿共70例,占纳入研究对象的25.93%,与既往研究[13]报道相近,但远低于林翊君等[14]研究中报道的38.91%,主要原因可能是MP感染流行具有周期性,但每个地区的流行高峰不一致,同时也说明在KD患儿中,呈现出MP高感染率的现象。
KD易侵犯中小血管,尤以并发CAL最为常见。本研究显示,KD-MP组患儿中CAL占比为55.71%,高于KD组的38.50%,提示KD-MP患儿更易发生CAL,与国内相关研究[15-16]结果相符。50多年来,KD并发CAL的机制尚无统一定论,有学者认为是KD患儿免疫系统异常活化,免疫细胞释放大量的细胞因子和炎性介质,促进基质金属蛋白酶的表达上调,进而降解细胞外基质,导致血管结构的重建[17]。当合并MP感染时,MP所致的间接组织损伤会触发炎症反应[18],炎性因子过度表达,加重免疫损伤,最终导致冠状动脉扩张,甚至CAA的发生。
在KD病程发展过程中,特别是对于存在冠状动脉异常的患儿,需要积极的进行抗血小板及抗凝治疗,以预防血栓的形成[19],因此,急性期的血小板及凝血功能监测对于KD患儿显得尤为重要。本研究发现KD-MP组患儿MPV高于KD组,MPV作为反映血小板年龄和体积大小的指标,提示KD-MP组患儿血小板代谢更加活跃。但在此次研究中,对于血栓形成意义较大的指标,如PLT、D-D,两组比较差异无统计学意义,与仲辉等[20]的研究结果一致。同时仅在KD组发现1例血栓患儿,说明尚未发现合并MP感染会增加KD患儿血栓形成的风险。
当前,国内外关于MP感染对KD患儿心血管损伤的研究大多仅关注冠状动脉病变,但需明确的是,KD还可并发累及心包、心肌和心内膜的非冠状动脉心脏异常(noncoronary cardiac abnormality,NCA),指南中也特别提出对心室形态和功能、心包积液、膜瓣反流的评估在KD诊治及长期管理过程中同样不可忽视[7]。一项基于中国KD患儿的研究显示,有高达74.65%的患者出现NCA,提示NCA在急性KD中普遍存在[21],应引起儿科医生的高度重视。有关KD-MP患者的NCA研究报道较少,本研究发现KD-MP组存在心包积液的占比为15.71%,高于KD组的5.50%,差异有统计学意义(P<0.01)。一项多中心、回顾性队列研究指出,约有3%的KD患儿出现心包积液[22],同时MP感染在对小儿心血管损伤过程中,同样可引起心包积液的发生[23],这就导致合并MP感染的KD患儿更易并发心包积液。
此外,心肌酶谱作为反映心肌功能的一组指标,可用于评估KD患儿心肌受损的严重程度。本研究显示,KD-MP组与KD组患儿心肌酶水平比较,差异均无统计学意义,与Wang等[24]研究结果一致。同时此次研究中尚未发现两组患儿在心脏增大、二尖瓣反流、三尖瓣反流、主动脉瓣反流及心功能降低的占比上存在统计学差异,可能需要更大的样本量来验证MP感染与其之间的关系。
综上所述,合并MP感染的KD患儿更易并发CAL和心包积液,面临更大的心血管损伤风险。因此,在KD诊治过程中,需及时筛查KD患儿是否存在MP感染,同时积极采取抗感染治疗,减少心血管并发症的发生。由于本研究为回顾性研究,因果关系论证力度相对不足,加之样本量有限,所得结论还需在前瞻性大样本研究中进行验证。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
中华医学会儿科学分会心血管学组, 中华儿科杂志编辑委员会. 川崎病冠状动脉病变的临床处理建议(2020年修订版)[J]. 中华儿科杂志, 2020, 58(9): 718-724. The Subspecialty Group of Cardiology, the Society of Pedia-trics, Chinese Medical Association, the Editorial Board, Chinese Journal of Pediatrics. Recommendations for clinical ma-nagement of Kawasaki disease with coronary artery lesions (2020 revision)[J]. Chinese Journal of Pediatrics, 2020, 58(9): 718-724. |
| [2] |
穆志龙, 焦富勇, 谢凯生. 《川崎病心血管后遗症的诊断和管理指南(JCS/JSCS2020)》解读[J]. 中国当代儿科杂志, 2021, 23(3): 213-220. Mu ZL, Jiao FY, Xie KS. Interpretation of the JCS/JSCS 2020 guideline on diagnosis and management of cardiovascular sequelae in Kawasaki disease[J]. Chinese Journal of Contemporary Pediatrics, 2021, 23(3): 213-220. |
| [3] |
董彤, 黄先玫. 病原体感染与川崎病发病机制关系的研究进展[J]. 国际儿科学杂志, 2020, 47(1): 18-21. Dong T, Huang XM. Pathogen infection and pathogenesis of Kawasaki disease[J]. International Journal of Pediatrics, 2020, 47(1): 18-21. DOI:10.3760/cma.j.issn.1673-4408.2020.01.005 |
| [4] |
Lee MN, Cha JH, Ahn HM, et al. Mycoplasma pneumoniae infection in patients with Kawasaki disease[J]. Korean J Pediatr, 2011, 54(3): 123-127. DOI:10.3345/kjp.2011.54.3.123 |
| [5] |
杨雪, 陆国平. 肺炎支原体感染后的少见并发症[J]. 中国小儿急救医学, 2021, 28(1): 12-15. Yang X, Lu GP. Rare complications of Mycoplasma pneumo-niae infection[J]. Chinese Pediatric Emergency Medicine, 2021, 28(1): 12-15. DOI:10.3760/cma.j.issn.1673-4912.2021.01.003 |
| [6] |
蒋秀芳, 任常军, 朱舒, 等. 川崎病患儿肺炎支原体感染的临床指征及特点[J]. 中国病原生物学杂志, 2019, 14(1): 96-98. Jiang XF, Ren CJ, Zhu S, et al. The clinical manifestations and features of Kawasaki disease in patients infected with Mycoplasma pneumoniae[J]. Journal of Pathogen Biology, 2019, 14(1): 96-98. |
| [7] |
McCrindle BW, Rowley AH, Newburger JW, et al. Diagnosis, treatment, and long-term management of Kawasaki di-sease: a scientific statement for health professionals from the American Heart Association[J]. Circulation, 2017, 135(17): e927-e999. |
| [8] |
胡亚美, 江载芳, 倪鑫, 等. 诸福棠实用儿科学[M]. 8版. 北京: 人民卫生出版社, 2015: 782-783. Hu YM, Jiang ZF, Ni X, et al. Zhu Futang practice of pediatrics[M]. 8th ed. Beijing: People's Medical Publishing House, 2015: 782-783. |
| [9] |
中华医学会儿科学分会呼吸学组, 《中华实用儿科临床杂志》编辑委员会. 儿童肺炎支原体肺炎诊治专家共识(2015年版)[J]. 中华实用儿科临床杂志, 2015, 30(17): 1304-1308. Respiratory Branch of Chinese Pediatric Society of Chinese Medical Association, Editorial Board of Chinese Journal of Applied Clinical Pediatrics. Expert consensus on diagnosis and treatment of Mycoplasma pneumoniae pneumonia in children (2015)[J]. Chinese Journal of Applied Clinical Pediatrics, 2015, 30(17): 1304-1308. DOI:10.3760/cma.j.issn.2095-428X.2015.17.006 |
| [10] |
牛超, 王琳琳, 贾尝, 等. 川崎病发生机制研究[J]. 中国小儿急救医学, 2020, 27(9): 645-649. Niu C, Wang LL, Jia C, et al. The pathogenesis of Kawasaki disease[J]. Chinese Pediatric Emergency Medicine, 2020, 27(9): 645-649. DOI:10.3760/cma.j.issn.1673-4912.2020.09.002 |
| [11] |
Huang SM, Huang SH, Weng KP, et al. Update on association between Kawasaki disease and infection[J]. J Chin Med Assoc, 2019, 82(3): 172-174. DOI:10.1097/JCMA.0000000000000025 |
| [12] |
陈璐, 黄文红, 叶红, 等. 肺炎支原体感染与川崎病及冠状动脉病变的关系[J]. 临床荟萃, 2017, 32(1): 71-73. Chen L, Huang WH, Ye H, et al. Study on relationship between Mycoplasma pneumoniae infection and Kawasaki disease coronary artery[J]. Clinical Focus, 2017, 32(1): 71-73. DOI:10.3969/j.issn.1004-583X.2017.01.017 |
| [13] |
Park HR, Han MY, Yoon KL, et al. Mycoplasma infection as a cause of persistent fever after intravenous immunoglobulin treatment of patients with Kawasaki disease: frequency and clinical impact[J]. Infect Chemother, 2017, 49(1): 38-43. DOI:10.3947/ic.2017.49.1.38 |
| [14] |
林翊君, 林杉, 王程毅, 等. 肺炎支原体感染对川崎病的影响及机制探讨[J]. 中国微生态学杂志, 2020, 32(12): 1413-1418. Lin YJ, Lin S, Wang CY, et al. Effect of Mycoplasma pneumoniae infection on Kawasaki disease and the mechanism[J]. Chinese Journal of Microecology, 2020, 32(12): 1413-1418. |
| [15] |
蓝莹, 陈洋, 熊越华, 等. 川崎病患儿肺炎支原体感染的临床特征分析[J]. 中华医院感染学杂志, 2017, 27(14): 3311-3314. Lan Y, Chen Y, Xiong YH, et al. Clinical characteristics of Kawasaki disease children complicated with Mycoplasma pneumoniae infections[J]. Chinese Journal of Nosocomiology, 2017, 27(14): 3311-3314. |
| [16] |
赵春娜, 杜忠东. 感染因素对川崎病及其冠状动脉病变的影响[J]. 中国循证儿科杂志, 2015, 10(6): 454-457. Zhao CN, Du ZD. Influence of infection on Kawasaki disease and coronary artery lesions[J]. Chinese Journal of Evidence Based Pediatrics, 2015, 10(6): 454-457. DOI:10.3969/j.issn.1673-5501.2015.06.011 |
| [17] |
Wang LX, Yang YN, Cui QM, et al. Evaluating the added predictive ability of MMP-9 in serum for Kawasaki disease with coronary artery lesions[J]. J Investig Med, 2021, 69(1): 13-19. DOI:10.1136/jim-2020-001281 |
| [18] |
Poddighe D. Extra-pulmonary diseases related to Mycoplasma pneumoniae in children: recent insights into the pathogenesis[J]. Curr Opin Rheumatol, 2018, 30(4): 380-387. DOI:10.1097/BOR.0000000000000494 |
| [19] |
谭朝中, 刘芳. 川崎病严重冠状动脉病变的治疗和长期管理[J]. 中国小儿急救医学, 2020, 27(9): 661-665. Tan CZ, Liu F. The treatment and long-term management of severe coronary artery lesion in Kawasaki disease[J]. Chinese Pediatric Emergency Medicine, 2020, 27(9): 661-665. DOI:10.3760/cma.j.issn.1673-4912.2020.09.006 |
| [20] |
仲辉, 薛秀娟, 刘晓东. 川崎病合并肺炎支原体感染患儿实验室检查指标及临床特征研究[J]. 潍坊医学院学报, 2018, 40(1): 45-47. Zhong H, Xue XJ, Liu XD. Clinical characteristics and inflammation-associated factors of peripheral blood in Kawasaki disease children with Mycoplasma pneumoniae infection[J]. Acta Academiae Medicinae Weifang, 2018, 40(1): 45-47. |
| [21] |
Liu FF, Liu HH, Qiu Z, et al. Clinical observation of noncoro- nary cardiac abnormalities in Chinese children with Kawasaki disease[J]. Eur J Clin Invest, 2020, 50(4): e13210. |
| [22] |
Schexnayder AG, Tang XY, Collins RT3, et al. Pericardial effusion in children admitted with Kawasaki disease: a multicenter retrospective cohort study from the pediatric health information system[J]. Clin Pediatr (Phila), 2021, 60(1): 9-15. DOI:10.1177/0009922820927021 |
| [23] |
Rao H, Ericson JE, O'Hara C. Mycoplasma pneumoniae presenting with pericardial tamponade[J]. Clin Pediatr (Phila), 2020, 59(2): 198-200. DOI:10.1177/0009922819885662 |
| [24] |
Wang CY, Song CM, Liu GH, et al. Association between Mycoplasma pneumoniae infection and coronary artery aneurysm in children with Kawasaki disease[J]. Iran J Pediatr, 2021, 31(1): e104737. |



