2. 长沙市第一医院艾滋病研究所, 湖南 长沙 410005
2. Institute of AIDS, Changsha First Hospital, Changsha 410005, China
临床上用于判断抗逆转录病毒疗法(antiretroviral therapy,ART)治疗效果的重要方法是检测血浆病毒载量(viral load, VL)。研究[1]表明4%~10%的人类免疫缺陷病毒Ⅰ型(HIV-1)感染者,在接受ART治疗后,仍维持低病毒载量(low viral load, LVL),HIV-1感染者出现病毒学失败,产生耐药性的风险更高。基于Sanger测序的传统HIV-1 RNA基因耐药检测方法通常只能检测VL≥1 000 copies/mL的HIV-1感染者,当VL<1 000 copies/mL时,病毒基因的扩增失败率较高,导致部分患者的耐药情况易被忽视而导致无法及时进行处理,《全国艾滋病检测技术规范(2015年修订版)》指出:当耐药毒株在病毒群体中低于10%~20%时,通常检测不到其存在[2]。
2018年,加拿大艾滋病诊疗指南中提出对HIV-1 RNA<1 000 copies/mL的患者,可以进行HIV-1前病毒DNA基因型耐药检测[3]。《全国艾滋病检测技术规范(2020年修订版)》在全球范围内首次将HIV-1前病毒DNA定量检测纳入检测规范中,文中指出:HIV-1前病毒DNA定量检测可判定HIV储存库含量,可更准确预测HIV传播风险和病程发展[4]。为更科学有效的指导艾滋病防治工作,针对HIV-1 RNA病毒载量在50~1 000 copies/mL的LVL患者,本研究利用Sanger测序方法,对某院2020年5月—2021年5月门诊已接受抗病毒治疗半年以上、诊断为LVL的HIV-1感染者的HIV-1前病毒DNA耐药情况开展研究。HIV-1前病毒DNA在患者个体水平存在高度的变异性,Sanger测序的原理是对所有序列中丰度占比最高的优势DNA序列(dominant sequence)进行优先测序,这些优势序列的占比理论上要超过总序列数的40%[5]。HIV-1 DNA水平的耐药突变(drug-resistance mutations, DRMs)信息,代表HIV-1感染者外周血HIV-1储存库中的优势DRMs。
1 对象与方法 1.1 研究对象研究纳入2020年5月—2021年5月在该院门诊接受抗病毒治疗6个月以上且连续两次检测VL为50~1 000 copies/mL的HIV-1感染者进行分析。入组标准:(1)年龄>18岁,通过艾滋病抗体确证试验确证的HIV-1感染者;(2)接受抗病毒治疗6个月以上;(3)连续两次检测VL为50~1 000 copies/mL[6-7];(4)签署知情同意书。以上条件应同时满足。收集符合以上纳入标准患者的抗凝全血标本,-80℃冰箱储存备用。
1.2 主要仪器及试剂主要仪器:Sanger测序仪、荧光定量PCR仪。主要试剂:人类免疫缺陷病毒Ⅰ型(HIV-1)DNA定量检测试剂盒(广州海力特生物科技有限公司)、核酸提取或纯化试剂(海力特)。
1.3 方法 1.3.1 HIV-1 VL和HIV-1 DNA载量的测定罗氏Cobas TaqMan HIV-1 Test Version 2.0全自动分析系统定量检测HIV-1 RNA VL。为测定HIV-1 DNA载量,首先从全血标本中提取HIV-1 DNA,并通过荧光定量PCR法对每百万细胞中HIV-1 DNA的拷贝数进行测定[8-9]。
1.3.2 核酸提取及基因扩增使用核酸提取纯化试剂(海力特)提取全血标本中的HIV-1 DNA,通过in-house HIV-1基因型耐药检测方法,进行巢式聚合酶链式反应扩增HIV-1 PR/RT区基因片段(对应HXB2国际标准参考株位置为2253~3553)和IN区基因片段(对应HXB2国际标准参考株位置为4230~5076)。
1.3.3 产物的提纯PCR产物经1%琼脂糖凝胶电泳后切胶纯化,纯化后的产物通过Sanger测序。
1.3.4 数据分析获得序列后,使用美国斯坦福大学HIV db Program数据库9.0版本进行耐药判定,根据数据库系统将耐药程度分为敏感(S)、潜在耐药(P)、低度耐药(L)、中度耐药(I)和高度耐药(H)5个水平,其中后3个水平判定毒株为耐药毒株。
2 结果 2.1 基本情况2020年5月—2021年5月该院门诊共检测5 795例抗病毒治疗半年以上的HIV-1感染者的VL,其中诊断为LVL的HIV-1感染者527例(占9.09%),VL>1 000 copies/mL的HIV-1感染者211例(占3.64%)。依据纳入标准,共纳入26例研究对象,收集抗凝全血标本储存备用。26例HIV-1 LVL患者基本情况见表 1。
| 表 1 26例HIV-1 LVL患者基本情况及优势DRMs发生情况 Table 1 Basic information of 26 patients with HIV-1 LVL and occurrence of dominant DRMs |
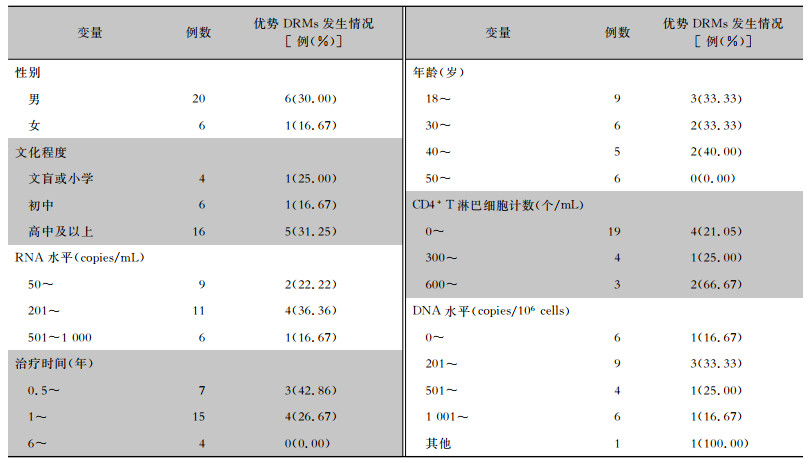
|
对已知pol区序列的26例患者的LVL标本进行逆转录酶、蛋白酶、整合酶区优势DRMs分析,病毒型别CRF01_AE发生率最高,为53.84%(14例),并且在蛋白酶、逆转录酶、整合酶区基因位点,均发生了优势DRMs。CRF07_BC、CRF55_01B、B+C、CRF67_01B、CRF08_BC、B的发生率分别为19.23%(5例)、7.69%(2例)、7.69% (2例)、3.85%(1例)、3.85%(1例)、3.85%(1例)。26例患者的LVL标本中确定7例携带优势DRMs。其中1例携核苷类逆转录酶抑制剂(nucleoside reverse transcriptase inhibitors, NRTIs)优势DRMs,发生率为3.85%(1例),4例携非核苷类逆转录酶抑制剂(non-nucleoside reverse transcriptase inhibitors, NNRTIs)优势DRMs,发生率为15.38%。蛋白酶抑制剂(protease inhibitors, PIs)优势DRMs与整合酶抑制剂(integrase inhibitors, INSTIs)优势DRMs各携1例,发生率均为3.85%。2号标本的病毒类型为B病毒亚型,其发生了多处优势DRMs。见表 2。
| 表 2 26例患者的HIV-1前病毒DNA优势DRMs结果 Table 2 Results of HIV-1 provirus DNA dominant DRMs in 26 patients |

|
7例出现优势DRMs的患者标本中,3例出现低中度耐药,2号标本对多拉韦林(DOR)、依非韦伦(EFV)、依曲韦林(ETR)的耐药程度为L,对奈韦拉平(NVP)、利匹韦林(RPV)的耐药程度为I。12号标本对阿巴卡韦(ABC)、替诺福韦(TDF)的耐药程度为L,13号标本对卡博特韦(CAB)、埃替拉韦(EVG)、拉替拉韦(RAL)的耐药程度为L。余4例的耐药程度均为P。2号标本中,目前使用的抗病毒方案为拉米夫定(3TC)+TDF+EFV,而其发生的优势DRMs对EFV的耐药程度为L,考虑为主要位点突变。余6例的优势DRMs考虑为次要位点突变,其对目前的抗病毒治疗方案可能无明显影响。在NNRTI区中V106L的优势DRMs发生率最高,为7.69%(2例)。NRTI区、PI区、INSTI区优势DRMs分别为K70KT、M46MI、H51Y,发生率均为3.85%(1例)。见表 3。
| 表 3 7例耐药突变患者的耐药程度及治疗情况 Table 3 Drug resistance and therapy of 7 patients with drug resistance mutation |
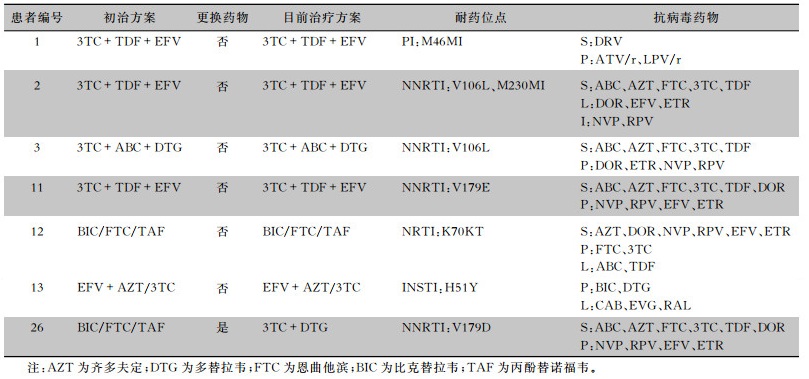
|
HIV-1病毒在感染人体后,病毒进入免疫细胞,脱外壳,RNA逆转录成DNA后进入细胞核,大多数HIV-1 DNA整合在人基因组上,形成稳定的病毒储存库(HIV-1 DNA)。HIV-1 DNA作为复制模板,转录子代RNA,翻译蛋白并包装成子代病毒。在病毒感染发生发展的过程中,病毒基因组的各种变化被持续记录在HIV-1前病毒DNA中,基因突变持续不断的进入潜伏病毒库。相较于HIV-1 RNA,HIV-1前病毒DNA具有更大的遗传异质性,可携带大量DRMs[10]。由于RNA耐药检测通常在VL>1 000 copies/mL才能实现扩增,因此对于HIV-1 LVL感染者的耐药检测研究不多,一般认为其出现病毒学失败以及耐药性可能与测序时无法有效摄取患者RNA中的DRMs以及未能及时更换抗病毒治疗方案有关[11-13]。
近年来,许多实验室开发了对低水平病毒复制有效的基因型耐药性分析的方法。在LVL的HIV-1感染者中,由于研究对象及目的不同,报道的DRMs发生率差异也较大,总体发生率约为49%~72%,在一些研究中也探讨了在低水平病毒复制时发生新的DRMs的可能性,结果证明会出现7%~46%新的DRMs[12.14-15]。在本研究中HIV-1病毒耐药基因PCR模板来源于全血中的HIV-1前病毒DNA,所采用的Sanger测序策略通过优先测序总序列中丰度占比最高的优势DNA序列,这些优势序列的占比理论上要超过总序列数的40%,更加倾向于检测优势DRMs,HIV-1 DNA水平的耐药突变信息,代表HIV-1感染者外周血HIV-1储存库中的优势DRMs。而本研究表明HIV-1前病毒DNA使用Sanger测序可在HIV-1 LVL患者外周血中发现优势DRMs,可为临床治疗方案的及时调整提供重要的参考信息。但是,该策略是否可有效逆转或避免治疗失败还需要更进一步的研究加以验证。目前有相关研究[16-19]表明HIV-1前病毒DNA与血浆游离RNA之间DRMs具有相关性,有研究[20]也初步阐述了其临床价值,在HIV-1前病毒DNA基因测序指导下更换ART方案不会导致病毒学失败,可能有助于增加长期安全性和改善生活质量。
DRMs的累积可能通过以下4个阶段[21]:①HIV DNA碱基出现DRMs;②HIV DNA的DRMs被复制扩增,开始出现耐药病毒;③随着DRMs积累及耐药病毒复制,可能出现LVL;④耐药病毒快速增加,临床表现为病毒反弹或治疗失败。尽管患者体内血浆HIV-1 RNA更能直接反映患者耐药情况,但HIV-1前病毒DNA也可以在一定程度上反映患者耐药情况,并且能将耐药发现的时间点提前,做到在第三阶段甚至第二阶段就能发现DRMs。
在本研究中,LVL的HIV-1感染者通过HIV-1前病毒DNA扩增的优势DRMs突变率较高,为26.92%。其中NNRTI携4例优势DRMs,NNRTI出现频数最高的基因突变位点V106L,该位点主要出现在未经治疗的HIV感染者的1%~2%的病毒中。若与其他突变位点相结合,将协同降低NNRTI敏感性。NNRTI在资源有限的情况中作为临床一线用药,具有较高的DRMs发生率[22]。PI的基因突变位点为M46MI,M46MI是相对非多态性的PI选择性突变,与降低除达芦那韦(darunavir,DRV)外的其他PI的敏感性有关。本研究中INSTIs出现1例优势DRMs,突变位点为H51Y,H51Y是一种罕见的非多态性附加突变,在接受RAL和EVG的患者中,H51Y最低限度地降低了EVG和可能的CAB敏感性。在我国,INSTIs耐药发生率较低,云南省艾滋病关爱中心邓雪媚等[23]收集了2015—2016年云南省14个地州(市)未接受过含INSTIs ART的531例HIV-1感染者的血浆,发现29例IN区基因突变的序列标本,9例表现出耐药,原发性INSTIs耐药率为1.7%。本研究中还出现了包含V106L、M230MI多耐药基因位点突变,是唯一1例出现中度耐药的标本,通常单个突变或仅对一种药物耐药的位点单独出现时耐药程度并不高,突变的累积增加了耐药程度,可导致严重的交叉耐药。
综上所述,本研究通过HIV-1前病毒DNA扩增对LVL的HIV-1感染者的PR/RT区基因片段以及IN区基因片段的序列进行分析,发现了使用HIV-1RNA耐药检测方法检测不到的优势DRMs,但本研究存在一定局限性,首先,标本量较小,可能会造成耐药结果的误差,使耐药率偏高。其次,本研究未对患者进行基线基因耐药突变检测,本次检测均为ART后,不排除耐药出现也可能为传播性耐药(transmissible drug resistance, TDR)。在HIV-1前病毒DNA上检测到的优势DRMs也可能是无法复制的缺陷病毒的一部分,仅仅根据HIV-1前病毒DNA中发现的突变来更换抗病毒治疗方案还有待商榷,需要更多标本量,以及提高研究精度,争取在LVL的HIV-1 RNA水平进行平行对照研究,从而为临床抉择提供科学依据。但对于存在优势DRMs的HIV-1 LVL感染者,有必要增加检测频率,以便尽早发现HIV-1感染者出现病毒学失败[24],为临床ART方案的制订和调整提供有效的参考意见。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Castillo-Mancilla JR, Morrow M, Coyle RP, et al. Low-level viremia is associated with cumulative adherence to antiretroviral therapy in persons with HIV[J]. Open Forum Infect Dis, 2021, 8(9): ofab463. DOI:10.1093/ofid/ofab463 |
| [2] |
中国疾病预防控制中心. 全国艾滋病检测技术规范(2015年修订版)[J]. 中国病毒病杂志, 2016, 6(6): 401-427. Chinese Center for Disease Control and Prevention. National guideline for detection of HIV/AIDS(the 2015 revision)[J]. Chinese Journal of Viral Diseases, 2016, 6(6): 401-427. |
| [3] |
NIH. Guidelines for the use of antiretroviral agents in adults and adolescents with HIV. 2018[EB/OL]. [2021-09-20]. https://aidsinfo.nih.gov/.
|
| [4] |
中国疾病预防控制中心性病艾滋病预防控制中心. 《全国艾滋病检测技术规范(2020年修订版)》正式发布[EB/OL]. (2020-05-18)[2021-09-20]. https://www.chinaaids.cn/xxgx/jszl/202005/t20200518_216798.htm. National Center for AIDS/STD Control and Prevention, China CDC. The National AIDS Testing Technical Specification (revised edition 2020) was officially released[EB/OL]. (2020-05-18)[2021-09-20]. https://www.chinaaids.cn/xxgx/jszl/202005/t20200518_216798.htm. |
| [5] |
Hebert PDN, Braukmann TWA, Prosser SWJ, et al. A sequel to sanger: amplicon sequencing that scales[J]. BMC Genomics, 2018, 19(1): 219. DOI:10.1186/s12864-018-4611-3 |
| [6] |
Wirden M, Todesco E, Valantin MA, et al. Low-level HIV-1 viraemia in patients on HAART: risk factors and management in clinical practice[J]. J Antimicrob Chemother, 2015, 70(8): 2347-2353. DOI:10.1093/jac/dkv099 |
| [7] |
Jones AD, Khakhina S, Jaison T, et al. CD8+ T-cell mediated control of HIV-1 in a unique cohort with low viral loads[J]. Front Microbiol, 2021, 12: 670016. DOI:10.3389/fmicb.2021.670016 |
| [8] |
岳永松, 王妮丹, 韩扬, 等. 合并带状疱疹病毒感染对HIV-1感染者外周血中HIV-1 DNA的影响[J]. 中国艾滋病性病, 2018, 24(8): 756-759. Yue YS, Wang ND, Han Y, et al. Impact of varicella-zoster virus coinfection on the decay of HIV-1 DNA in the peripheral blood of HIV-1 infected patients[J]. Chinese Journal of AIDS & STD, 2018, 24(8): 756-759. |
| [9] |
徐玲, 岳永松, 韩扬, 等. 基线极高HIV-1 RNA水平对初治HIV-1感染者外周血total HIV-1 DNA的影响[J]. 国际病毒学杂志, 2021, 28(2): 140-144. Xu L, Yue YS, Han Y, et al. Impact of very high baseline HIV-1 RNA level on the decay of total HIV-1 DNA in the peripheral blood of HAART-naive HIV-1 infected patients[J]. International Journal of Virology, 2021, 28(2): 140-144. |
| [10] |
Stultz RD, Cenker JJ, McDonald D. Imaging HIV-1 genomic DNA from entry through productive infection[J]. J Virol, 2017, 91(9): e00034-17. |
| [11] |
Jordan MR, Winsett J, Tiro A, et al. HIV drug resistance profiles and clinical outcomes in patients with viremia maintained at very low levels[J]. World J AIDS, 2013, 3(2): 71-78. DOI:10.4236/wja.2013.32010 |
| [12] |
Fleming J, Mathews WC, Rutstein RM, et al. Low-level viremia and virologic failure in persons with HIV infection treated with antiretroviral therapy[J]. AIDS, 2019, 33(13): 2005-2012. DOI:10.1097/QAD.0000000000002306 |
| [13] |
Crespo-Bermejo C, de Arellano ER, Lara-Aguilar V, et al. Persistent low-level viremia in persons living with HIV undertreatment: an unresolved status[J]. Virulence, 2021, 12(1): 2919-2931. DOI:10.1080/21505594.2021.2004743 |
| [14] |
Li JZ, Gallien S, Do TD, et al. Prevalence and significance of HIV-1 drug resistance mutations among patients on antiretroviral therapy with detectable low-level viremia[J]. Antimicrob Agents Chemother, 2012, 56(11): 5998-6000. DOI:10.1128/AAC.01217-12 |
| [15] |
Gallien S, Delaugerre C, Charreau I, et al. Emerging integrase inhibitor resistance mutations in raltegravir-treated HIV-1-infected patients with low-level viremia[J]. AIDS, 2011, 25(5): 665-669. DOI:10.1097/QAD.0b013e3283445834 |
| [16] |
De La Cruz J, Vardhanbhuti S, Sahoo MK, et al. Persistence of human immunodeficiency virus-1 drug resistance mutations in proviral deoxyribonucleic acid after virologic failure of efavirenz-containing antiretroviral regimens[J]. Open Forum Infect Dis, 2019, 6(3): ofz034. DOI:10.1093/ofid/ofz034 |
| [17] |
Musingwini TV, Zhou DT, Mhandire D, et al. Use of proviral DNA to investigate virus resistance mutations in HIV-infected Zimbabweans[J]. Open Microbiol J, 2017, 11: 45-52. DOI:10.2174/1874285801711010045 |
| [18] |
Amendola A, Sberna G, Forbici F, et al. The dual-target approach in viral HIV-1 viremia testing: an added value to virological monitoring?[J]. PLoS One, 2020, 15(2): e0228192. DOI:10.1371/journal.pone.0228192 |
| [19] |
Huruy K, Mulu A, Liebert UG, et al. HIV-1C proviral DNA for detection of drug resistance mutations[J]. PLoS One, 2018, 13(10): e0205119. DOI:10.1371/journal.pone.0205119 |
| [20] |
Ellis KE, Nawas GT, Chan C, et al. Clinical outcomes follo-wing the use of archived proviral HIV-1 DNA genotype to guide antiretroviral therapy adjustment[J]. Open Forum Infect Dis, 2020, 7(1): ofz533. DOI:10.1093/ofid/ofz533 |
| [21] |
Villalobos C, Ceballos ME, Ferrés M, et al. Drug resistance mutations in proviral DNA of HIV-infected patients with low level of viremia[J]. J Clin Virol, 2020, 132: 104657. DOI:10.1016/j.jcv.2020.104657 |
| [22] |
李敬云. HIV耐药的现状趋势与应对[J]. 中国艾滋病性病, 2018, 24(6): 635-638, 642. Li JY. Current state, trend and response to HIV drug resis-tance[J]. Chinese Journal of AIDS & STD, 2018, 24(6): 635-638, 642. |
| [23] |
邓雪媚, 刘家法, 张米, 等. 云南省HIV/AIDS病人原发性整合酶基因耐药突变情况[J]. 中国艾滋病性病, 2019, 25(4): 327-330, 341. Deng XM, Liu JF, Zhang M, et al. Mutations of primary integrase gene resistance of HIV/AIDS patients in Yunnan pro-vince[J]. Chinese Journal of AIDS & STD, 2019, 25(4): 327-330, 341. |
| [24] |
中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防与控制中心. 中国艾滋病诊疗指南(2018版)[J]. 传染病信息, 2018, 31(6): 481-499, 504. Chinese Society of Infectious Diseases Branch of the Chinese Medical Association, China Center for Disease Control and Prevention. Chinese guidelines for diagnosis and treatment of HIV/AIDS (2018)[J]. Infectious Disease Information, 2018, 31(6): 481-499, 504. |



