2. 国家药品监督管理局医用卫生材料及生物防护器械质量评价重点实验室, 山东 济南 250101;
3. 山东省医疗器械和药品包装检验研究院业务办公室, 山东 济南 250101
2. Key Laboratory for Quality Evaluation of Medical Materials and Biological Protective Devices, National Medical Products Administration, Jinan 250101, China;
3. Business Department, Shandong Institute of Medical Device and Pharmaceutical Packaging Inspection, Jinan 250101, China
无论是严重急性呼吸综合征(SARS)还是新型冠状病毒肺炎(简称新冠肺炎)疫情,都使我们深刻认识到医用生物防护器械在保护医务人员和患者乃至普通人群的健康和安全的重要性。特别是随着本次新冠肺炎疫情在全球的暴发,生物安全及个人防护更是迎来了前所未有的挑战,防护物资也成为阻止病毒传播的有效物品,如口罩、防护服、消毒液等[1]。目前国际上尚无医用生物防护器械对应的国际标准化组织,各国家/地区均采用本国家/地区的标准,而各国家/地区标准的不协调限制了全球防疫物资的互通性。在新冠肺炎疫情防控初期,由于我国医用生物防护器械标准与美国、欧盟等国家/地区标准的不一致、不协调,导致我国医用生物防护器械出口贸易受到阻碍。
国家卫生健康委员会印发的《新型冠状病毒感染不同风险人群防护指南和预防新型冠状病毒感染的肺炎口罩使用指南》中推荐进入人员密集或密闭公共场所佩戴医用外科口罩或颗粒物防护口罩[2]。由于各类普通口罩不能发挥防护作用,医用口罩备受关注。医用外科口罩对气溶胶、飞沫等具有良好的过滤阻隔效果,能够预防呼吸系统疾病[3-5],但同时由于其直接与佩戴者口鼻接触,自身的微生物污染直接影响佩戴者的身体健康[6]。目前,我国主要依据《医用外科口罩(YY 0469—2011)》[7]对外科口罩进行微生物控制;欧盟主要依据《医用口罩要求和试验方法(EN 14683—2019)》[8]进行微生物控制;美国目前没有外科口罩的国家标准,仅有《医用面罩材料的性能规范(ASTM F2100-19)》,将医用外科口罩分为3类,且对微生物清洁度、生物相容性、血液穿透性等作出了相关规定[9],其中并未规定微生物控制指标。我国标准中明确了为一次性使用产品,而欧洲和美国在其产品标准中则不局限于一次性产品[10]。本研究主要比较分析YY 0469—2011和EN 14683—2019的微生物试验方法回收率以及对检测结果的影响。
1 材料与方法 1.1 试验材料试样:无菌外科口罩数只。洗脱液:0.9%无菌氯化钠溶液,由华鲁技术股份有限公司提供;蛋白胨:由北京奥博星生物技术有限责任公司提供;氯化钠:由国药集团化学试剂有限公司提供;吐温20:由罗氏公司提供。培养基:胰酪大豆胨琼脂培养基平板由广东环凯微生物科技有限公司提供;营养琼脂培养基由北京陆桥技术有限责任公司提供。菌株:萎缩芽孢杆菌ATCC 9372芽孢悬液。仪器:往复式摇床(WIGGENS);微生物过滤装置(Millipore),配套水系微孔滤膜(直径50 mm,孔径0.45 μm);电子天平(METTLER TOLEDO),分度值0.1 g;立式压力蒸汽灭菌器(SYSTEC);培养箱(Memmert);生物安全柜(BIOBASE)。
1.2 试验方法 1.2.1 试验设计YY 0469—2011和EN 14683—2019规定的微生物计数方法见表 1。本研究依据《医疗器械的灭菌微生物学方法第1部分:产品上微生物总数的测定(GB/T 19973.1—2015)》,用产品接种法[11]制备人工污染试样,采用微生物回收的方法对两种计数方法进行回收率研究。另根据两种检测方法中洗脱液种类、洗脱方式及参数这两个关键方法与环节设计两组交叉试验,见表 1。
| 表 1 YY 0469—2011、EN 14683—2019及交叉试验计数方法比较 Table 1 Comparison of YY 0469-2011, EN 14683-2019 and counting method in cross-cover testing |
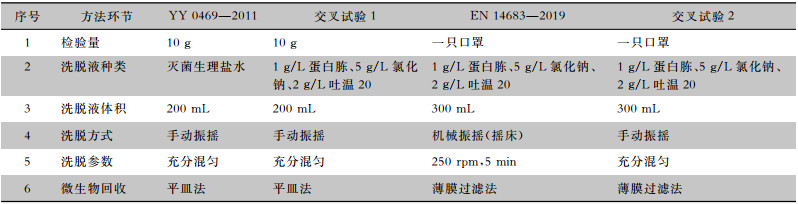
|
(1) 制备接种芽孢悬液。将萎缩芽孢杆菌ATCC 9372芽孢悬液稀释至约1 000 CFU/mL,精确测定0.1 mL芽孢悬液的芽孢数量。(2)制备人工污染试样。取无菌试样10 g,共10份,分别向试样上接种芽孢悬液0.1 mL,在生物安全柜中干燥。(3)供试液制备。将人工污染试样分别投入到200 mL洗脱液(0.9%无菌氯化钠溶液)中,手动震荡混匀,获得供试液。(4)微生物回收。各取供试液1 mL倾注营养琼脂,共5个平板。平板放置35℃培养48 h。点计平板上的菌落数并进行洗脱菌落数计算。(5)回收率计算。按式(1)计算每个试样的回收率。
| $ R=\frac{X}{Z} \times 100 \% $ | (1) |
式中:R—回收率;X—试样洗脱菌落数,CFU;Z—接种芽孢数,CFU。
1.2.3 EN 14683—2019方法回收率研究(1) 制备接种芽孢悬液。同YY0469—2011接种芽孢悬液的制备方法。(2)制备人工污染试样。取无菌口罩,共10个,分别向试样上接种芽孢悬液0.1 mL,在生物安全柜中干燥。(3)供试液制备。将人工污染试样分别投入到300 mL洗脱液(1 g/L蛋白胨、5 g/L氯化钠、2 g/L吐温20)中,250 rpm摇床振荡5 min,获得供试液。(4)微生物回收。各取供试液100 mL进行薄膜过滤,滤膜贴至胰酪大豆胨琼脂培养基平板上,平板放置30℃培养3 d。点计平板上的菌落数并进行洗脱菌落数计算。(5)回收率计算。见式(1)。
1.2.4 交叉试验组方法回收率研究具体试验操作参照1.2.2、1.2.3。
2 结果 2.1 四种试验方法结果EN 14683—2019方法的回收率高达65.1%,高于YY 0469—2011方法的回收率近4倍。且YY 0469—2011方法回收率仅14.4%。
根据YY 0469—2011、EN 14683—2019两种检测方法中洗脱液种类和洗脱方式及参数设计两组交叉试验,交叉试验组1与YY 0469—2011试验组比较,因更换洗脱液为1 g/L蛋白胨、5 g/L氯化钠、2 g/L吐温20,方法回收率提高到65.6%,表明加有活性成分吐温20的洗脱液能更好的洗脱微生物;交叉试验组2与EN 14683—2019试验组比较,因更换洗脱方式及参数为手动振摇,回收率提高到68.6%。且YY 0469—2011、交叉试验组1、交叉试验组2中采用的手动振摇的标准差(3.8、6.6、7.4)较EN 14683—2019中采用机械振摇方法(8.2)低,表明在微生物洗脱中手动振摇法重复性及稳定性较好。见表 2。
| 表 2 四种试验方法结果 Table 2 Results of four test methods |
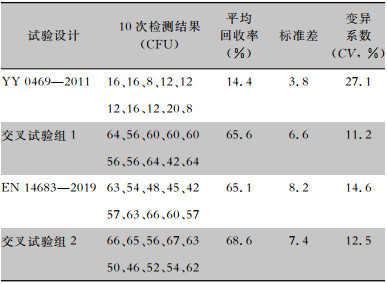
|
根据上述YY 0469—2011、EN 14683—2019方法的回收率结果,比较两种方法可接受标准的严格程度以及对检测结果的影响。YY 0469—2011要求细菌菌落总数≤100 CFU/g,真菌不得检出,即微生物总数≤100 CFU/g;EN 14683—2019要求微生物总数≤300 CFU/g。假设某产品A按照YY 0469—2011方法获得的试验结果为100 CFU/g,通过修正系数换算,结果见表 3。
| 表 3 修正系数换算结果 Table 3 Results of correction coefficient conversion |
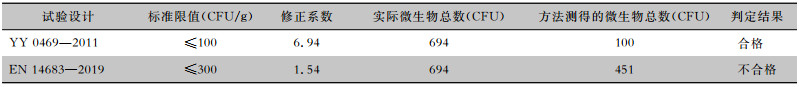
|
虽然产品A的实际微生物总数为694 CFU/g,但按照YY 0469—2011方法进行检测时,判定为合格产品,按照EN 14683—2019方法检测时,产品A获得的试验结果为451 CFU/g,此时已经超出EN 14683—2019规定的限值(300 CFU/g),此时可判定产品不合格。
3 讨论在试验方法方面,EN 14683—2019检测方法具有较高的回收率。方法回收率是定量检测方法的重要属性,回收率越高,方法计数准确度也越高。通过设计交叉试验组1,认为EN 14683—2019方法具有较高回收率的原因是在洗脱液中加入了表面活性剂(吐温20)。由于口罩的纤维结构不同于普通的膜或袋类,故通过常规的生理盐水洗脱污染微生物极其困难,YY 0469—2011试验使用生理盐水洗脱,微生物回收效率极低(14.4%),不符合《中国药典》2020年版四部非无菌产品微生物限度检查:微生物计数法中规定的“微生物回收率应在0.5~2范围内”的要求[12],表明该方法对微生物的洗脱效果不理想。ISO 11737—1:2018标准中指出,当用液体从固体表面洗脱微生物时,可考虑结合使用表面活性剂[13],吐温20是一种非离子型表面活性剂,具有较强的去污能力。马妮等[14]在对医用一次性防护服生物负载检测时,添加表面活性剂后的微生物回收率反而低于普通洗脱液,考虑到不适量的表面活性成分可能会对微生物有一定影响,因此需严加控制表面活性剂的使用量。通过设计交叉试验2,认为EN 14683—2019方法虽然具有较高的方法回收率,但仍有需要改进的地方,如洗脱方式及参数更换为手动振摇后,方法回收率也相对提高了5.4%,试验过程中也发现,EN 14683—2019方法中洗脱液在经过机械振摇后会出现大量泡沫,在一定程度上影响洗脱液的过滤,这也是手动振摇法具有较好洗脱效果的原因。
在可接受标准方面,EN 14683—2019的可接受标准(≤300 CFU/g)实际要严于YY 0469—2011的可接受标准(≤100 CFU/g)。产品实际微生物总数为694 CFU/g,EN 14683—2019的检测结果为不合格,而YY 0469—2011的检测结果为合格,认为方法回收率有较大差异,可一定程度影响各自的检测结论。
本研究通过对比分析,YY 0469—2011和EN 14683—2019因检测方法不同回收率存在较大差异,其中EN 14683—2019的微生物控制方式,包括微生物总数高回收率的检测方法以及较为严格的可接受标准,对我国医用外科口罩乃至其他非无菌医疗器械微生物污染指标的设计具有很大借鉴意义。
| [1] |
张传雄. 国内外医用防护服性能指标对比分析[J]. 高科技纤维与应用, 2021, 46(2): 68-73. Zhang CX. Comparative analysis of performance indexes of medical protective clothing in different countries[J]. Hi-Tech Fiber and Application, 2021, 46(2): 68-73. DOI:10.3969/j.issn.1007-9815.2021.02.011 |
| [2] |
万敏, 孙建军, 王文庆, 等. 模拟复用的医用外科口罩清洗和消毒后主要性能指标变化[J]. 中国感染控制杂志, 2020, 19(11): 1013-1018. Wan M, Sun JJ, Wang WQ, et al. Changes of main performance indicators of simulated reused surgical masks after cleaning and disinfection[J]. Chinese Journal of Infection Control, 2020, 19(11): 1013-1018. |
| [3] |
谭文君, 朱皓阳, 张娜娜, 等. 半肝切除术中不同组织产生手术烟雾PM 2.5浓度及防护措施的研究[J]. 护理研究, 2019, 33(18): 3258-3260. Tan WJ, Zhu HY, Zhang NN, et al. Study on concentration and protective measures of PM2.5 in surgery smoke generated by different tissues during hemihepatectomy[J]. Chinese Nursing Research, 2019, 33(18): 3258-3260. DOI:10.12102/j.issn.1009-6493.2019.18.039 |
| [4] |
Guha S, McCaffrey B, Hariharan P, et al. Quantification of leakage of sub-micron aerosols through surgical masks and facemasks for pediatric use[J]. J Occup Environ Hyg, 2017, 14(3): 214-223. DOI:10.1080/15459624.2016.1237029 |
| [5] |
全琼瑛, 应伟伟, 祝成炎. 非织造医用口罩防护性能评价[J]. 上海纺织科技, 2015, 43(4): 63-64, 68. Quan QY, Ying WW, Zhu CY. Evaluation on the protective property of non-woven medical-use face masks[J]. Shanghai Textile Science & Technology, 2015, 43(4): 63-64, 68. |
| [6] |
王莉, 闫新. 探析医用外科口罩[J]. 产品用纺织品, 2020, 38(9): 1-4. Wang L, Yan X. Analysis on surgical mask[J]. Technical Textiles, 2020, 38(9): 1-4. |
| [7] |
国家食品药品监督管理局. 医用外科口罩: YY 0469-2011[S]. 北京: 中国标准出版社, 2013. National Medical Products Administration. Surgical mask: YY 0469-2011[S]. Beijing: Standards Press of China, 2013. |
| [8] |
European Committee for Standardization. Medical face masks-requirements and test methods: EN 14683-2019[S]. European: BSI Standards Publication, 2019.
|
| [9] |
郑雯, 鲁明, 袁绍彦, 等. 国内外口罩标准介绍[J]. 塑料工业, 2021, 49(3): 13-16. Zheng W, Lu M, Yuan SY, et al. Introduction of domestic and foreign mask standards[J]. China Plastics Industry, 2021, 49(3): 13-16. DOI:10.3969/j.issn.1005-5770.2021.03.003 |
| [10] |
李桂梅, 李冠志, 李昱昊, 等. 中国防疫纺织品现状分析及创新发展建议[J]. 纺织导报, 2021(2): 83-87. Li GM, Li GZ, Li YH, et al. Analysis of the status quo of China's anti-pandemic textiles and suggestions for innovative development[J]. China Textile Leader, 2021(2): 83-87. |
| [11] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 医疗器械的灭菌微生物学方法第1部分: 产品上微生物总数的测定: GB/T 19973.1-2015[S]. 北京: 中国标准出版社, 2016. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration. Sterilization of medical devices-microbiological methods-part 1: determination of a population of microorganisms on products: GB/T 19973.1-2015[S]. Beijing: Standards Press of China, 2016. |
| [12] |
国家药典委员会. 中华人民共和国药典-四部[M]. 北京: 中国医药科技出版社, 2020. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China-part 4[M]. Beijing: China Medical Science and Technology Press, 2020. |
| [13] |
International Organization for Standardization. Sterilization of health care products-microbiological methods-part 1: determination of a population of microorganisms on products: ISO 11737-1: 2018[S]. Geneva: International Organization for Standardization, 2018.
|
| [14] |
马妮, 董慧明, 刘霓, 等. 医用一次性防护服生物负载量检测技术研究[J]. 中国医疗器械信息, 2020, 26(11): 9-11, 41. Ma N, Dong HM, Liu N, et al. Research on bioburden detection technology of new coronavirus pneumonia medical protective clothing[J]. China Medical Device Information, 2020, 26(11): 9-11, 41. |



