金黄色葡萄球菌(Staphylococcus aureus,SA)作为一种侵袭性细菌,可存在于不同组织类型中而引起多种疾病[1],从浅表皮肤损伤到危及生命的中毒或菌血症。SA广泛的致病性和对抗菌药物的耐药性均由所携带的毒力基因所致。毒力基因编码产物可以表达分泌多种与细胞表面相关的毒力因子,从而促进SA与宿主细胞外基质成分黏附、对宿主细胞的损伤、与宿主免疫系统的对抗[2]。已知SA至少有25种不同的毒素、15种微生物表面成分、20种免疫逃避分子和其他几种毒力因子。同时SA菌株又是异质性的,不同的耐药性和毒力模式决定宿主不同的临床感染程度和结局。鉴于SA,尤其是耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)对多种抗菌药物的耐药性,给临床治疗带来极大困难,因此,从基因水平阐述SA的致病机制,对于制定新的治疗措施至关重要。现将临床分离SA的临床特征、毒力基因携带情况及耐药情况报告如下。
1 材料与方法 1.1 菌株来源收集2018年1月—2020年12月包头市参加全国细菌耐药监测网11所成员医院临床分离的SA,标本主要来源于上述医院门诊及住院患者的临床送检标本,所有标本均来源于不同患者。将收集到的菌株按照医院进行分层抽样,从中抽取样本作为试验菌株进行毒力基因检测。质控菌株:金黄色葡萄球菌ATCC 25923,购于卫生部临床检验中心。
1.2 资料来源回顾性分析纳入菌株来源患者的病历资料,收集临床资料,包括年龄、性别、基础疾病、住院时间、预后和感染相关指标。
1.3 分组根据患者预后情况的不同将预后分为治愈:治愈出院;未治愈:自动出院(包括转院);死亡。
1.4 仪器及试剂XN-10(B4)全自动模块式血液体液分析仪、ACLTOP700全自动血凝仪、PA-990特定蛋白仪、Cobas e411罗氏电化学发光仪、PCR扩增仪(美国Bio-Rad)、凝胶成像仪及凝胶电泳仪(美国Bio-Rad)、VITEK 2 Compact微生物分析仪(法国梅里埃);MH琼脂和含5%脱纤维羊血MH琼脂为英国OXOID公司产品、抗菌药物纸片和利奈唑胺E试验条为法国生物梅里埃公司产品、青霉素和万古霉素E试验条为郑州安图生物工程股份有限公司产品;基因组提取试剂盒、PCR试剂、DNA marker以及PCR引物均来自北京瀚海拓新公司产品。
1.5 方法 1.5.1 感染相关指标的检测采用XN-10(B4)全自动模块式血液体液分析仪检测白细胞数(WBC)、C反应蛋白(CRP)、中性粒细胞计数(N)、中性粒细胞百分比(N%)、血小板计数(PLT);ACLTOP700全自动血凝仪检测纤维蛋白原(FIB)、D-二聚体(D-D)、纤维蛋白原降解产物(FDP)、凝血酶原时间(PT);PA-990特定蛋白仪检测血清淀粉样蛋白(SAA);Cobas e411罗氏电化学发光仪检测降钙素原(PCT)、白细胞介素-6(IL-6)。
1.5.2 细菌鉴定与药敏试验参照美国临床和实验室标准协会(CLSI)2019年版[3]文件推荐的方法进行判断,采用KB法联合全自动药敏仪法。采用法国生物梅里埃VITEK 2 Compact或美国BD公司的全自动细菌鉴定和药敏仪及配套检测卡进行细菌鉴定和药敏试验。
1.5.3 DNA提取将收集的金黄色葡萄球菌接种到血平板37℃过夜培养,挑取菌落至裂解液中制成菌悬液后,按照基因组提取试剂盒说明提取金黄色葡萄球菌基因组,-20℃保存备用。
1.5.4 毒力基因的检测采用PCR法检测毒力基因的表达情况。反应程序为预变性94℃ 5 min,变性94℃ 60 s,退火55℃ 60 s,延伸72℃ 60 s,共25个循环,最后延伸72℃ 10 min。同时设置阳性对照和阴性对照,阳性对照为人工合成的目标基因DNA片段,阴性对照为蒸馏水。PCR产物进行琼脂糖凝胶电泳,用凝胶成像仪观察和保存扩增结果。PCR引物序列及产物长度见表 1。
| 表 1 PCR引物序列和扩增片段大小 Table 1 PCR primer sequences and size of amplified fragments |
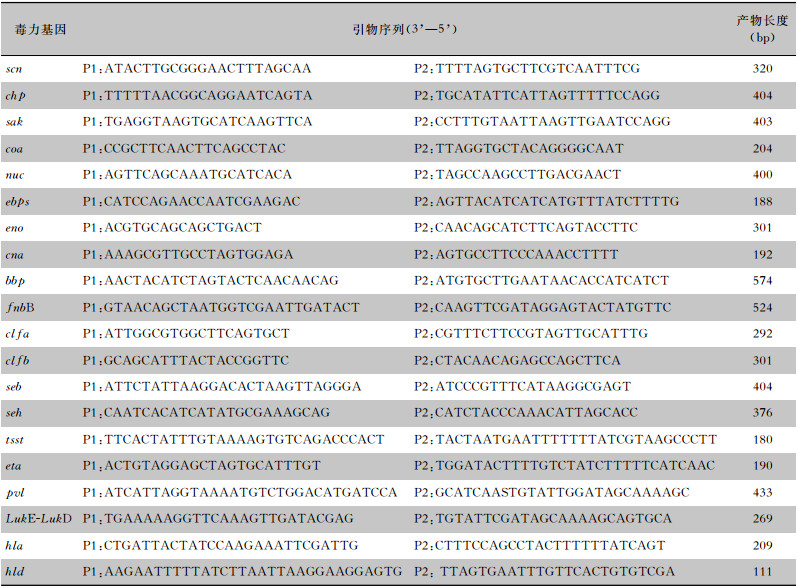
|
应用WHONET 5.6及SPSS 22.0统计软件对数据进行分析。采用χ2检验或χ2分割法进行比较;符合正态分布的计量资料以均数±标准差表示,非正态计量资料以中位数表示。P≤0.05表示差异有统计学意义。
2 结果 2.1 收集菌株情况2018年1月—2020年12月共收集SA 2 452株。2 452例SA感染患者中外科感染(包括脓肿、伤口感染)932例,呼吸道感染504例,血流感染172例,其他类型感染844例。
2.2 不同感染类型患者的临床特征2 452例SA感染患者以男性为主(68.23%),不同感染类型SA的患者人群分布也以男性为主。不同性别、年龄SA感染患者的感染类型分布情况比较,差异均有统计学意义(均P<0.001)。外科感染、呼吸道感染、血流感染主要以<60岁患者为主。外科感染患者住院时间>2周的比率较高,占39.21%。呼吸道感染SA患者的病死率较高,为76.39%。见表 2。
| 表 2 不同感染类型SA感染患者的临床特征 Table 2 Clinical characteristics of patients with different types of SA infection |
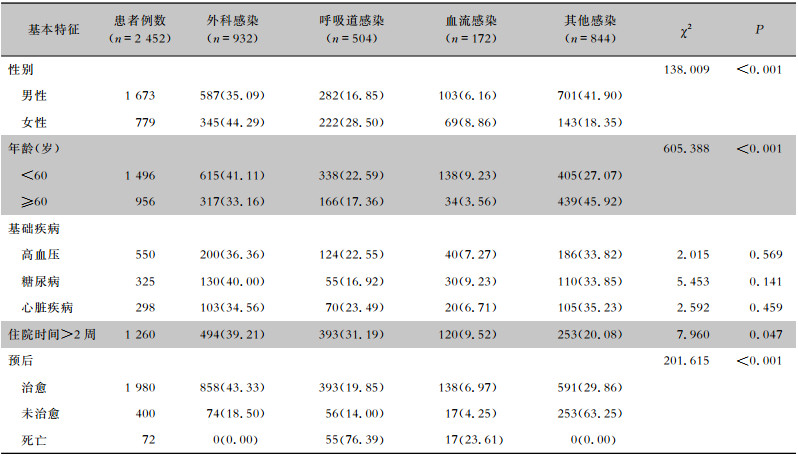
|
无论何种感染类型,WBC、N%、PLT、CRP、IL-6均高于正常范围。不同感染类型患者的WBC、N、N%、PLT、PT水平比较,差异均有统计学意义(均P<0.05),见表 3。不同感染类型患者的CRP、PCT、IL-6、D-D、FDP水平比较,差异均有统计学意义(均P<0.05),见表 4。
| 表 3 不同感染类型患者的感染相关指标特征(x±s) Table 3 Characteristics of infection-related indicators in patients with different types of infection(x±s) |
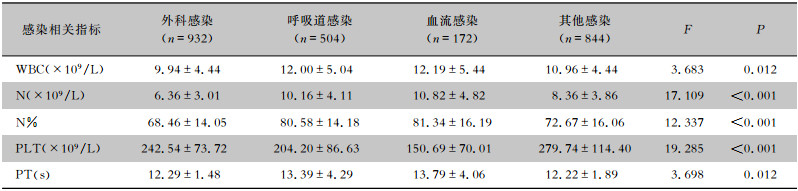
|
| 表 4 不同感染类型患者的感染相关指标特征[M(P25, P75)] Table 4 Characteristics of infection-related indicators in patients with different types of infection (M [P25, P75]) |
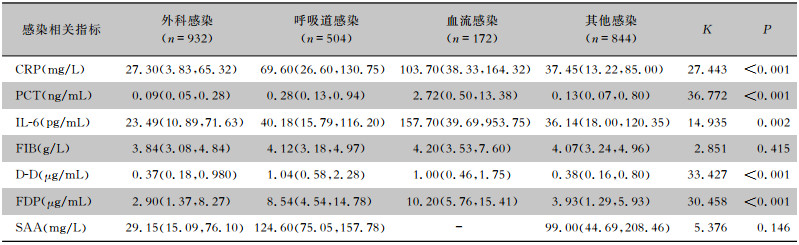
|
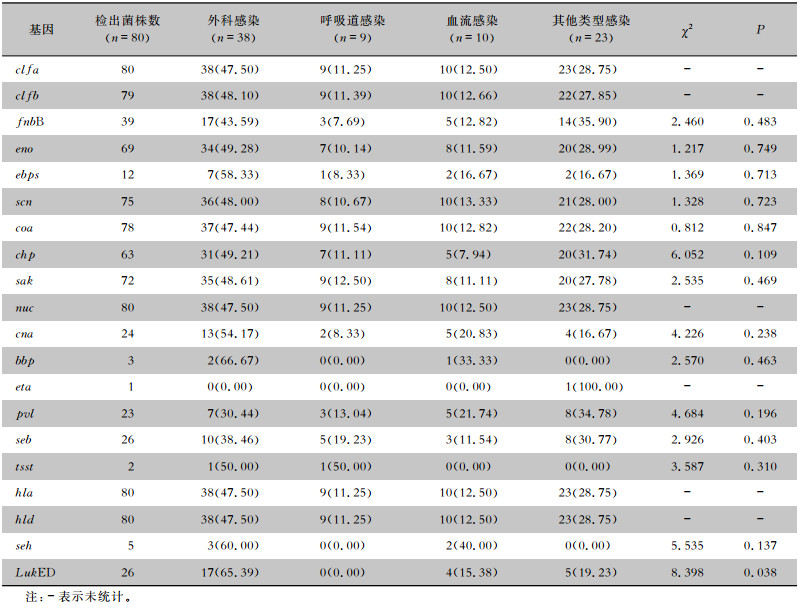
将2 452株SA按照医院进行分层抽样,从中抽取一个容量为80的样本作为试验菌株进行毒力基因检测。其中38株SA来源于外科感染标本,9株来源于呼吸道感染标本,10株来源于血流感染标本,23株来源其他感染标本。80株菌株几乎都携带clfa(100.00%)、clfb(98.75%)、scn(93.75%)、coa(97.50%)、nuc(100.00%)、hla(100.00%)、hld(100.00%)基因。sak基因阳性株72株(90.00%),fnbB基因阳性株39株(48.75%),eno基因阳性株69株(86.25%),ebps基因阳性株12株(15.00%),chp基因阳性株63株(78.75%),cna基因阳性株24株(30.00%)。bbp基因仅存在于外科感染和血流感染(共3株,3.75%),eta基因仅在其他感染中携带(1株,1.25%),pvl和seb基因阳性株分别为23株(28.75%)、26株(32.50%),tsst基因仅在外科感染和呼吸道感染中携带(2株,2.50%),seh基因存在于外科感染和血流感染(5株,6.25%)。LukED基因阳性株26株(32.50%),且在外科感染中的检出率高于其他3种感染类型,差异有统计学意义(P<0.05)。见表 5。毒力基因电泳图见图 1。
| 表 5 不同感染类型SA毒力基因检出情况[株(%)] Table 5 Detection of SA virulence genes in different infection types (No. of isolates[%]) |
|
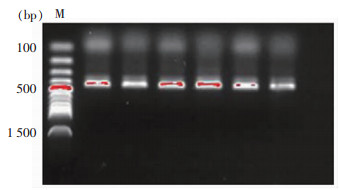 |
| 图 1 毒力基因pvl扩增产物电泳图 Figure 1 Electrophoretic map of amplified product of pvl virulence gene |
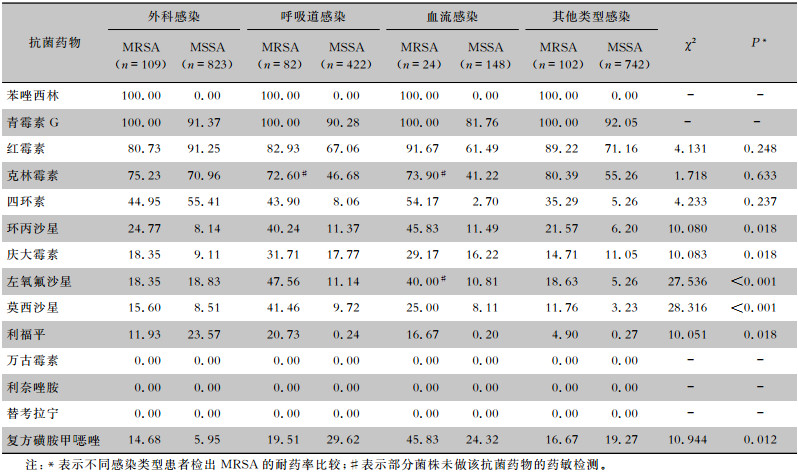
不同感染类型患者检出MRSA的耐药率大多高于MSSA。不同感染类型患者检出MRSA对青霉素G、克林霉素、红霉素的耐药率均高于72.60%。未发现对万古霉素、利奈唑胺、替考拉宁耐药的菌株。血流感染MRSA对环丙沙星、复方磺胺甲口恶唑的耐药率较高,均为45.8%;呼吸道感染MRSA对庆大霉素、左氧氟沙星、莫西沙星、利福平的耐药率较高,分别为31.71%、47.56%、41.46%、20.73%;差异均有统计学意义(均P<0.05)。见表 6。
| 表 6 不同感染类型检出MRSA与MSSA对常用抗菌药物的耐药率(%) Table 6 Resistance rates of MRSA and MSSA causing different types of infection to commonly used antimicrobial agents (%) |
|
本研究中,不同感染类型的SA感染患者人群分布以男性为主。Katoulis等[4]研究发现,化脓性汗腺炎/痤疮是一种好发于腋窝、腹股沟和肛门生殖器汗腺承载区域的毛囊皮肤病,患有该类疾病的人群,其SA定植率略高于普通人群。与女性相比,男性因雄激素作用,毛发长,油脂分泌多,使SA定植率更高[5],从而好发SA感染。研究[6]表明,SA感染随年龄增长而增加,而Anderson等[7]表明SA感染在年轻患者中更常见。本研究发现SA感染患者多数<60岁,此结果是否与SA体表携带有关还有待研究。
本研究发现,外科感染SA患者住院日数>2周的比率较高,其次为呼吸道感染;呼吸道感染SA患者的病死率较高,其次为血流感染。本研究2 452例病例中,血流感染SA患者多数患有血液病、免疫缺陷疾病等全身反应性疾病;而呼吸道感染SA患者多数合并其他疾病,如脑卒中、脑外伤等,多数长期卧床,易增加治疗难度,延长住院时间。国外研究[8-9]表明,长时间住院、中心静脉置管等是MRSA感染的危险因素,因此呼吸道感染及血流感染SA患者增加了MRSA感染的风险,常常预后不佳,病死率高。
血流感染SA患者感染时常导致全身炎症反应,使WBC、N、N%、PT、PLT等感染指标发生变化。本研究发现,血流感染WBC、N、N%、PT、CRP、PCT、IL-6和FDP水平均高于其他三种感染类型。研究[10]表明PCT水平能反映脓毒症患者病情的严重程度及评价后续治疗效果;而D-D、FDP水平在血流感染中升高后续可预测弥散性血管内凝血(DIC)。因此,积极监测血流感染SA患者的CRP、PCT、IL-6、D-D和FDP等感染指标,对感染的诊断及治疗具有重要意义。
本研究对80株SA的20个毒力基因进行检测,发现80株SA均携带clfa、nuc、hla、hld基因,90%以上的菌株携带clfb、scn、coa、sak基因。其中黏附素基因fnbB基因检出率为48.75%,bbp基因检出率为3.75%,白细胞毒素pvl基因检出率为28.75%,LukED基因在外科感染中的检出率高于其他三种感染类型。
SA生物被膜的形成可以使细菌躲避人体免疫系统的攻击,从而导致慢性感染和复发感染。研究[11]表明,70%以上的感染与生物膜的形成有关,而致病性的SA在表面形成生物膜的能力则更强。生物膜的形成通常被描述为两个主要阶段:黏附和增殖。黏附阶段主要由黏附素基因所介导,该基因主要包括clfa、clfb、fnbA、fnbB、cna、bbp、ebps和eno。clfa基因所表达的纤维蛋白原结合蛋白,能够与血小板结合,并促进SA在血浆中的聚集[12]。而clfb基因的表达使SA具有定植于鼻上皮细胞的能力[13],同时,该基因也是导致脓毒症转移性感染的关键毒力因子。本研究中,clfa基因的检出率为100%,与研究[14]结果一致。clfa和clfb基因的高流行率表明该基因在SA的致病性以及不同表面的定植中起决定性作用。
fnbA和fnbB基因表达的纤维连接蛋白结合蛋白可以作为信号细胞和肌动蛋白细胞骨架重排的中介物,同时该基因能够促进SA在组织中的侵袭[15]。fnbB基因在角膜炎、骨髓炎、医疗器械表面阳性率较高,在骨科感染患者分离的菌株中也常检测到。本研究fnbB基因的检出率为48.75%,在Soltani等[16]的研究中其检出率为43.6%,而在一项关于血流感染的研究[17]中其检出率为29.5%,表明fnbB基因具有异质性特点,在不同的临床标本中其检出率具有差异。
本研究bbp基因的检出率仅为3.75%,与Kot等[18]结论类似。既往研究[19]表明,SA携带bbp基因比携带其他生物膜相关的基因产生更强的生物膜,但由于其流行率较低导致研究受到限制。bbp基因可以编码一种与骨涎蛋白有亲和力的蛋白质,也有研究[20]表明其与血源性骨髓炎或关节炎显著相关。这一发现也解释了本研究中携带bbp基因的3例患者,其中2例腰椎管狭窄,另外1例患有急性骨髓炎。
白细胞毒素pvl是临床感染的内源性宿主,对中性粒细胞有重要的细胞毒作用[21]。在低浓度时会导致细胞凋亡,高浓度时会导致坏死。相关报道[22]显示,pvl基因的阳性率为2%~35%,本研究中28.75%的阳性率接近类似研究的上限。同时pvl基因表达水平的提高能增加MRSA的毒性,引起病死率高达75%的坏死性肺炎[22]。白细胞毒素LukED通过形成低聚孔隙样结构导致中性粒细胞和淋巴细胞的死亡。研究[23]表明,LukED基因在不同SA感染类型中的检出率存在差异,如血流感染中LukED基因的检出率高于呼吸道感染。本研究中LukED基因在外科感染(44.74%)和血流感染(40.00%)中的检出率均高于呼吸道感染(0)和其他类型感染(21.74%)。说明相比于呼吸道感染和其他类型感染,血流感染和外科感染的SA更容易携带LukED基因,可能具有更高的致病性。
分析不同感染类型MRSA药敏结果发现,不同感染类型MRSA的耐药率大多高于MSSA的耐药率。未发现对万古霉素、利奈唑胺、替考拉宁耐药的菌株。同时,不同感染类型MRSA对环丙沙星、庆大霉素、左氧氟沙星、莫西沙星等的耐药率比较,差异均有统计学意义(均P<0.05)。在4种感染类型中,呼吸道感染MRSA患者对多数常用抗菌药物的耐药率最高,表明应重视呼吸道感染MRSA的用药情况,同时表明痰培养及多次送检具有重要的参考意义。血流感染患者对多数抗菌药物耐药率较高,对复方磺胺甲口恶唑的耐药率在4种感染类型中最高,表明发生MRSA血流感染时可选用耐药率较低的莫西沙星和利福平作为治疗药物。外科感染相比较于血流感染和呼吸道感染,其MRSA耐药率较低,因此大环内酯类和喹诺酮类仍是外科感染时经验用药的首选。本研究表明,临床治疗MRSA感染时,应根据不同的感染类型、耐药特点,选用不同的治疗方案,针对性用药。
综上所述,不同感染类型SA携带多种毒力基因,且对多种抗菌药物耐药。临床医务人员应加强SA的耐药及毒力动态监测,合理选择抗菌药物,有效控制SA感染流行。同时本研究也存在一定的局限性,进行毒力基因检测的菌株数量少,仅对SA的耐药特点、临床特征及毒力基因的携带情况进行阐述,对SA产生高毒力的原因仍不明确,还需结合流行病学特征以及毒力调控系统等方面对SA致病机制进一步探索。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
纵帅, 徐银海, 丁兴龙, 等. 万古霉素对徐州地区2015-2019年MRSA最低抑菌浓度值飘移特征[J]. 中国感染控制杂志, 2021, 20(11): 991-995. Zong S, Xu YH, Ding XL, et al. Characteristics of minimum inhibitory concentration drift of vancomycin against methicillin-resistant Staphylococcus aureus in Xuzhou in 2015-2019[J]. Chinese Journal of Infection Control, 2021, 20(11): 991-995. DOI:10.12138/j.issn.1671-9638.20211277 |
| [2] |
Atshan SS, Hamat RA, Coolen MJL, et al. The role of subinhibitory concentrations of daptomycin and tigecycline in modulating virulence in Staphylococcus aureus[J]. Antibiotics (Basel), 2021, 10(1): 39. DOI:10.3390/antibiotics10010039 |
| [3] |
Clinical and Laboratory Standards Institute. Performance stan-dards for antimicrobial susceptibility testing: M100-S29[S]. CLSI, 2019.
|
| [4] |
Katoulis A, Koumaki V, Efthymiou O, et al. Staphylococcus aureus carriage status in patients with hidradenitis suppurativa: an observational cohort study in a tertiary referral hospital in Athens, Greece[J]. Dermatology, 2020, 236(1): 31-36. DOI:10.1159/000504537 |
| [5] |
Olsen K, Falch BM, Danielsen K, et al. Staphylococcus aureus nasal carriage is associated with serum 25-hydroxyvitamin D levels, gender and smoking status. The Tromsø staph and skin study[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(4): 465-473. DOI:10.1007/s10096-011-1331-x |
| [6] |
Chen TY, Anderson DJ, Chopra T, et al. Poor functional status is an independent predictor of surgical site infections due to methicillin-resistant Staphylococcus aureus in older adults[J]. J Am Geriatr Soc, 2010, 58(3): 527-532. DOI:10.1111/j.1532-5415.2010.02719.x |
| [7] |
Anderson DJ, Chen LF, Schmader KE, et al. Poor functional status as a risk factor for surgical site infection due to methicillin-resistant Staphylococcus aureus[J]. Infect Control Hosp Epidemiol, 2008, 29(9): 832-839. DOI:10.1086/590124 |
| [8] |
Yasmin M, El Hage H, Obeid R, et al. Epidemiology of bloodstream infections caused by methicillin-resistant Staphylococcus aureus at a tertiary care hospital in New York[J]. Am J Infect Control, 2016, 44(1): 41-46. DOI:10.1016/j.ajic.2015.08.005 |
| [9] |
Atmaca O, Zarakolu P, Karahan C, et al. Risk factors and antibiotic use in methicillin-resistant Staphylococcus aureus bacteremia in hospitalized patients at Hacettepe University Adult and Oncology Hospitals (2004-2011) and antimicrobial susceptibilities of the isolates: a nested case-control study[J]. Mikrobiyol Bul, 2014, 48(4): 523-537. DOI:10.5578/mb.8280 |
| [10] |
Cimmino L, Dolgalev I, Wang YB, et al. Restoration of TET2 function blocks aberrant self-renewal and leukemia progression[J]. Cell, 2017, 170(6): 1079-1095. DOI:10.1016/j.cell.2017.07.032 |
| [11] |
Xu YJ, Larsen LH, Lorenzen J, et al. Microbiological diagnosis of device-related biofilm infections[J]. APMIS, 2017, 125(4): 289-303. DOI:10.1111/apm.12676 |
| [12] |
Herman-Bausier P, Labate C, Towell AM, et al. Staphylococcus aureus clumping factor A is a force-sensitive molecular switch that activates bacterial adhesion[J]. Proc Natl Acad Sci U S A, 2018, 115(21): 5564-5569. DOI:10.1073/pnas.1718104115 |
| [13] |
Ganesh VK, Barbu EM, Deivanayagam CCS, et al. Structural and biochemical characterization of Staphylococcus aureus clumping factor B/ligand interactions[J]. J Biol Chem, 2011, 286(29): 25963-25972. DOI:10.1074/jbc.M110.217414 |
| [14] |
Ghasemian A, Najar Peerayeh S, Bakhshi B, et al. Comparison of biofilm formation between methicillin-resistant and methicillin-susceptible isolates of Staphylococcus aureus[J]. Iran Biomed J, 2016, 20(3): 175-181. |
| [15] |
Stepanović S, Vuković D, Hola V, et al. Quantification of biofilm in microtiter plates: overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci[J]. APMIS, 2007, 115(8): 891-899. DOI:10.1111/j.1600-0463.2007.apm_630.x |
| [16] |
Soltani E, Farrokhi E, Zamanzad B, et al. Prevalence and distribution of adhesins and the expression of fibronectin-binding protein (FnbA and FnbB) among Staphylococcus aureus isolates from Shahrekord Hospitals[J]. BMC Res Notes, 2019, 12(1): 49. DOI:10.1186/s13104-019-4055-0 |
| [17] |
Li XH, Fang F, Zhao J, et al. Molecular characteristics and virulence gene profiles of Staphylococcus aureus causing bloodstream infection[J]. Braz J Infect Dis, 2018, 22(6): 487-494. DOI:10.1016/j.bjid.2018.12.001 |
| [18] |
Kot B, Szweda P, Frankowska-Maciejewska A, et al. Virulence gene profiles in Staphylococcus aureus isolated from cows with subclinical mastitis in eastern Poland[J]. J Dairy Res, 2016, 83(2): 228-235. DOI:10.1017/S002202991600008X |
| [19] |
Silva V, Almeida L, Gaio V, et al. Biofilm formation of multidrug-resistant MRSA strains isolated from different types of human infections[J]. Pathogens, 2021, 10(8): 970. DOI:10.3390/pathogens10080970 |
| [20] |
Niek WK, Teh CSJ, Idris N, et al. Investigation of biofilm formation in methicillin-resistant Staphylococcus aureus associated with bacteraemia in a tertiary hospital[J]. Folia Microbiol (Praha), 2021, 66(5): 741-749. DOI:10.1007/s12223-021-00877-x |
| [21] |
Ying H, Mahmudiono T, Alghazali T, et al. Molecular chara-cterization, virulence determinants, and antimicrobial resis-tance profile of methicillin-resistant Staphylococcus aureus in the north of Iran; a high prevalence of ST239-SCCmec III/t037 clone[J]. Chemotherapy, 2022, 67: 37-46. DOI:10.1159/000520482 |
| [22] |
van der Meeren BT, Millard PS, Scacchetti M, et al. Emergence of methicillin resistance and panton-valentine leukocidin positivity in hospital- and community-acquired Staphylococcus aureus infections in Beira, Mozambique[J]. Trop Med Int Health, 2014, 19(2): 169-176. DOI:10.1111/tmi.12221 |
| [23] |
He CY, Xu S, Zhao HQ, et al. Leukotoxin and pyrogenic toxin superantigen gene backgrounds in bloodstream and wound Staphylococcus aureus isolates from eastern region of China[J]. BMC Infect Dis, 2018, 18(1): 395. DOI:10.1186/s12879-018-3297-0 |



