2. 山东省医疗器械和药品包装检验研究院物理室, 山东 济南 250101;
3. 山东省医疗器械和药品包装检验研究院, 山东 济南 250101;
4. 国家药品监督管理局医用卫生材料及生物防护器械质量评价重点实验室, 山东 济南 250101
2. Physical Inspection Department, Shandong Institute of Medical Device and Pharmaceutical Packaging Inspection, Jinan 250101, China;
3. Shandong Institute of Medical Device and Pharmaceutical Packaging Inspection, Jinan 250101, China;
4. Key Laboratory for Quality Evaluation of Medical Materials and Biological Protective Devices, National Medical Products Administration, Jinan 250101, China
静脉输液是临床上常见的治疗手段,研究[1]显示,超过90%的住院患者需要静脉输液治疗。静脉输液治疗为患者带来益处的同时,也存在细菌感染的风险及隐患[2]。研究[3]表明,部分输液污染可来自空气中的微生物,故为降低感染风险,GB 8368—2018《一次性使用输液器重力输液式》国家标准提出,需要对输液器的进气器件增加空气过滤器,阻止输液环境中的微生物进入输液瓶,从而阻止细菌进入人体内[4]。尽管该标准提出增加空气过滤器的要求,但目前并没有提供空气过滤器细菌截留能力的具体评价方法,在医疗器械行业中也鲜有相关评价方法的报道。
制药行业中有评价空气过滤器细菌截留能力的方法,包括液体细菌截留试验、气溶胶细菌截留试验和气溶胶病毒截留试验[5]。由于输液器中使用的空气过滤器一般是有效过滤面积特别小的膜式过滤器,与制药行业中的空气过滤器在用途和结构上完全不一致,因此无法直接采用制药行业空气过滤器的评价方法。本研究借鉴制药行业空气过滤器的评价模式,模拟输液器进气器件的临床使用情况,设计开发气溶胶细菌截留试验系统及其试验方法,将金黄色葡萄球菌混悬液气溶胶化对样品进行气溶胶挑战,对可能穿透的细菌用收集液进行收集,并进行细菌计数分析,以此评价输液器进气器件的气溶胶细菌截留能力,现将研究结果报告如下。
1 材料与方法 1.1 材料主要材料包括预制胰酪大豆胨琼脂(TSA,广东环凯微生物科技有限公司)培养基平板、胰酪大豆胨液体(TSB,广东环凯微生物科技有限公司)培养基、0.9%无菌氯化钠溶液(山东华鲁制药有限公司)、分析薄膜(孔径0.45 μm、直径约47 mm);仪器设备包括气溶胶细菌截留试验系统(见图 1)、生物安全柜(Nuaire NU-437-600S)、立式高压蒸汽灭菌器(SYSTEC VE-75)、低温培养箱(MMM FRIOCELL 400L)等;试验菌种为金黄色葡萄球菌(ATCC 6538)。选取5个生产厂家(A~E)的空气过滤器(分为一体式和分体式),每个生产厂家选取3个批次,每批次选取5个样品,共75个样品进行测试。
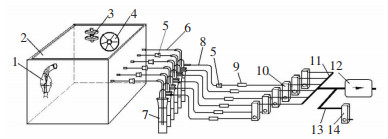 |
| 1:微生物气溶胶发生器;2:气溶胶室;3:装有空气过滤器的通气口;4:风扇;5:样品挑战组件;6:阳性对照支路(进气管路);7:液体撞击采样器;8:抽吸管路;9:终端过滤器;10:带有调节阀的浮子流量计(用以调节和指示各路流量);11:六支路管;12:负压泵;13:气体平衡管道;14:带有调节阀的浮子流量计(用以调节总流量)。 图 1 气溶胶截留试验系统示意图 Figure 1 Schematic diagram of aerosol retention testing system |
从TSA中挑取金黄色葡萄球菌ATCC 6538接种到TSB中,(36±1)℃下培养18~24 h。用0.9 %无菌氯化钠溶液稀释至108 CFU/mL。
1.2.2 样品挑战试验挑战试验前,样品挑战组件及液体撞击采样器在121℃下灭菌15 min,并以无菌操作的方式连接试验管路、装入供试空气过滤器、加入细菌挑战混悬液等。启动微生物气溶胶发生器,向气溶胶室内喷射金黄色葡萄球菌气溶胶,同时打开风扇。3 min后启动负压泵,调节各支路流量至50 mL/min,同时观察各液体撞击采样器的气泡逸出情况;3 min后关闭微生物气溶胶发生器,27 min后关闭负压泵。
1.2.3 细菌计数每次取下阳性对照支路上的液体撞击采样器,用0.9%无菌氯化钠溶液对阳性对照支路收集液进行10倍梯度稀释,采用薄膜过滤法过滤稀释后的收集液,并将薄膜放置TSA培养基平板上,在(36±1)℃下培养18 ~24 h后观察是否有菌生长并进行计数。每次取下5个样品挑战支路上的液体撞击采样器,采用薄膜过滤法过滤样品挑战支路收集液,并将薄膜放置TSA培养基平板上,在(36±1)℃下培养18~24 h后观察是否有菌生长并进行计数。
1.2.4 结果判定阳性对照支路金黄色葡萄球菌总数应>104 CFU,否则试验无效。每5个样品挑战支路收集液均无菌生长,判为符合要求,否则不符合要求。
2 结果 2.1 气溶胶细菌截留能力情况共选取5个生产厂家(A~E)15个批次75个样品进行测试,结果显示,生产厂家A~D 12个批次60个样品的支路收集液均无菌生长,符合要求;生产厂家E 3个批次15个样品的支路收集液菌落数均>100 CFU,不符合要求。见表 1。
| 表 1 空气过滤器样品气溶胶挑战试验结果 Table 1 Aerosol challenge testing results of air filter specimens |
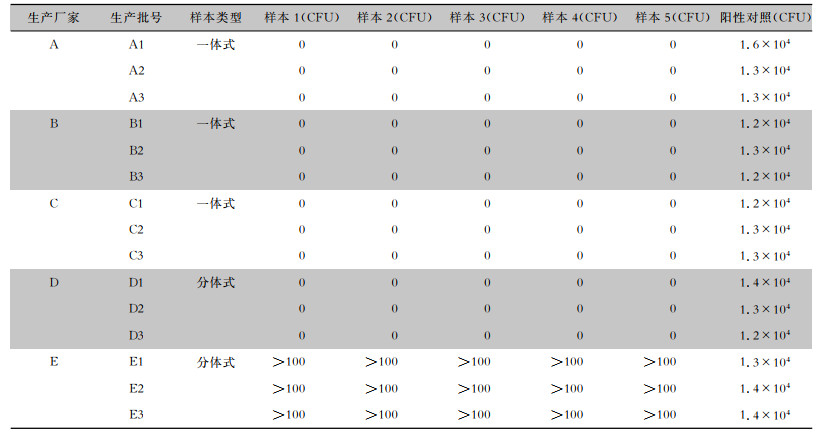
|
生产厂家A~E的空气过滤器的材质分别为聚四氟乙烯、聚偏氟乙烯、聚丙烯、聚四氟乙烯、玻璃纤维,孔径分别为0.22、0.22、2、2、5 μm。
3 讨论研究检测5个生产厂家的典型空气过滤器,结果显示,生产厂家A~D的样品均符合要求,而生产厂家E的样品不符合要求,进一步分析发现厂家E的样品滤膜材质为玻璃纤维,孔径为5 μm,不适用于输液器进气器件的空气过滤器;A~D厂家样品材质种类各异,但其孔径偏小(均<2.5 μm),检测符合要求,适合用于输液器进气器件的空气过滤器。
试验系统使用人工制备的气溶胶而非自然污染的气溶胶,增加了检测条件的可控性和检测结果的重复性和再现性。试验系统采用的Collison喷雾器激发的气溶胶能模拟普通空气环境中微生物状态[6]。Collison喷雾器是被广泛认可的对液体或者混悬液进行气溶胶化的技术,目前广泛应用于空气生物学[7]、气溶胶研究[8]、生物安全柜测试[9]以及过滤器评价[10]等。Collison喷雾器激发的气溶胶颗粒的质量中值粒径为2.5 μm。据报道,空气中与疾病有关的带菌粒子直径一般为4~20 μm[11]。故认为进气器件的空气过滤器能拦截2.5 μm的气溶胶颗粒,可以有效拦截空气中的微生物气溶胶。
本试验中使用金黄色葡萄球菌作为挑战微生物是基于以下考虑:(1)金黄色葡萄球菌是临床血源性感染常见菌之一[12];(2)在防护服、口罩、手套等细菌挑战试验中也普遍采用金黄色葡萄球菌[13-15];(3)金黄色葡萄球菌容易获得且有明显的生长特征,易识别。
本次试验方法设计采用高于临床水平的试验参数。首先,试验方法规定50 mL/min的测试流量和30 min的测试时间,相应地,试样共经受1 500 mL的测试总气流量,三项挑战参数均严于临床;其次,由于试验方法规定的挑战水平为不低于104 CFU,也就是说,1 500 mL的挑战总气流量中含有不低于104 CFU的微生物数量,相当于每1 m3环境空气中含有不低于107 CFU的微生物数量,远高于普通临床输液环境中的微生物浓度[16-17]。
为保证试验的有效性,本试验系统在使用前应进行试验系统确认,保证挑战水平达到104 CFU, 并保证6个支路挑战水平具有一致性。经过多次试验研究,发现菌悬液的浓度达到108 CFU/mL时,试验系统每个支路的挑战水平均能达到104 CFU, 6个支路检测结果的变异系数为3.5%~12.7%。
本试验方法和试验系统适用于评价输液、输血器具中一体式和分体式进气器件的空气过滤器。由于本试验方法设计为定性试验,无法给出定量的过滤效率数据,故本方法仅作为评价空气过滤器是否适合作为输液、输血器具进气器件的基准要求,不能对空气过滤器的细菌截留能力进行分级、分类。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
王建荣. 输液治疗护理实践指南与实施细则[M]. 北京: 人民军医出版社, 2009: 16-17. Wang JR. Nursing practice guide and implementation rules for infusion therapy[M]. Beijing: People's Military Medical Publishing House, 2009: 16-17. |
| [2] |
孙红, 王蕾, 关欣, 等. 全国部分三级甲等医院静脉治疗护理现状分析[J]. 中华护理杂志, 2014, 49(10): 1232-1237. Sun H, Wang L, Guan X, et al. A survey of the status of infusion therapy in tertiary hospitals in China[J]. Chinese Journal of Nursing, 2014, 49(10): 1232-1237. DOI:10.3761/j.issn.0254-1769.2014.10.018 |
| [3] |
林梅娟, 熊少娟, 姚志红, 等. 消毒配药后的输液瓶口放置时间与污染的关系[J]. 齐齐哈尔医学院学报, 2010, 31(21): 3519-3520. Lin MJ, Xiong SJ, Yao ZH, et al. The relationship between sterilization storage time of infusion bottle mouth after disinfected dispensing and pollution[J]. Journal of Qiqihar Medical University, 2010, 31(21): 3519-3520. |
| [4] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 一次性使用输液器-重力输液式: GB 8368-2018[S]. 北京: 中国标准出版社, 2018. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Infusion sets for single use-gravity feed: GB 8368-2018[S]. Beijing: Standards Press of China, 2018. |
| [5] |
PDA International Association for Pharmaceutical Science and Technology. Sterilizing filtration of gases. Technical report no. 40. Parenteral Drug Association[J]. PDA J Pharm Sci Technol, 2005, 58(1 Suppl TR40): 7-44. |
| [6] |
May KR. The Collison nebulizer: description, performance and application[J]. J Aerosol Sci, 1973, 4(3): 235-238. DOI:10.1016/0021-8502(73)90006-2 |
| [7] |
Thomas RJ, Webber D, Hopkins R, et al. The cell membrane as a major site of damage during aerosolization of Escherichia coli[J]. Appl Environ Microbiol, 2011, 77(3): 920-925. DOI:10.1128/AEM.01116-10 |
| [8] |
Ibrahim E, Harnish D, Kinney K, et al. An experimental investigation of the performance of a Collison nebulizer generating H1N1 influenza aerosols[J]. Biotechnol Biotechnol Equip, 2015, 29(6): 1142-1148. DOI:10.1080/13102818.2015.1059736 |
| [9] |
Hino S, Sato H. Collison 6-jet nebulizer: choice for the certification test of the class Ⅱ biological safety cabinet[J]. Jpn J Exp Med, 1984, 54(1): 29-38. |
| [10] |
Hata M, Thongyen T, Bao L, et al. Development of a high-volume air sampler for nanoparticles[J]. Environ Sci Process Impacts, 2013, 15(2): 454-462. DOI:10.1039/C2EM30392B |
| [11] |
于玺华. 现代空气微生物学[M]. 北京: 人民军医出版社, 2002: 7-8. Yu XH. Modern air microbiology[M]. Beijing: People's Military Medical Publishing House, 2002: 7-8. |
| [12] |
O'Grady NP, Alexander M, Burns LA, et al. Guidelines for the prevention of intravascular catheter-related infections[J]. Am J Infect Control, 2011, 39(4 Suppl 1): S1-S34. |
| [13] |
British Standards Institution. Medical face masks-requirements and test methods: EN 14683-2014[S]. BSI Standards Limi-ted, 2014.
|
| [14] |
ASTM International. Standard specification for performance of materials used in medical face masks: ASTM F2100-11(2018)[S]. West Conshohocken, PA, USA: ASTM International, 2018.
|
| [15] |
International Organization for Standardization. Surgical drapes, gowns and clean air suits, used as medical devices, for patients, clinical staff and equipment-test method to determine the resistance to wet bacterial penetration: ISO 22610: 2018[S]. Switzerland: International Organization for Standardization, 2018.
|
| [16] |
尹湘毅, 张皖瑜, 丁艳, 等. 医院重点部门空气微生物含量的监测及分析[J]. 医学研究生学报, 2005, 18(11): 1031-1033. Yin XY, Zhang WY, Ding Y, et al. Monitoring and analysis of air-microorganism content in important hospital departments[J]. Journal of Medical Postgraduates, 2005, 18(11): 1031-1033. |
| [17] |
王伟, 石磊, 薛红, 等. 医院空气微生物分布情况调查[J]. 中国当代医药, 2012, 19(32): 101-102. Wang W, Shi L, Xue H, et al. Survey of airborne microbes distribution in hospital[J]. China Modern Medicine, 2012, 19(32): 101-102. |



