S100蛋白家族是一类低分子量(9~14 kDa)的钙结合胞质蛋白,1965年作为神经蛋白首次提取于牛的大脑,因其在100%饱和硫酸铵中的溶解性而得名S100[1]。目前已发现该蛋白家族至少有27个序列和结构高度相似的成员。大多数S100蛋白通常以二聚体形式存在,这些蛋白既可以由两个相同的蛋白[(S100A1)2、(S100B)2、(S100A11)2]组成同源二聚体,也可以由两个不同成员(S100A1/S100B、S100A8/S100A9)组成异源二聚体。
最典型的异源二聚体S100A8/A9(calprotectin, MRP8/MRP14),因表面疏水基导致的核间非共价作用,以及较相应的同源二聚体相对较大的埋藏表面积(<10%),使其较同源二聚体更易形成(约占二聚体总数的64.5%)[2]。钙卫蛋白(calprotectin,CP)最早被发现于中性粒细胞中,表达具有组织和细胞特异性,主要表达在髓样细胞(myeloid cells)内,在中性粒细胞内表达最多,占中性粒细胞胞浆可溶性成分的40%~50%[3],在单核细胞中约占5%,活化的上皮细胞[4]、内皮细胞及角质形成细胞[5]中也有表达。其核心功能结构域EF-hand可结合Ca2+,使蛋白的构象发生改变,暴露出与靶蛋白相互作用的位点,从而参与细胞骨架重排和花生四烯酸代谢等,发挥相应的生物学功能[6]。在炎症过程中,CP被主动释放,通过触发Toll样受体(toll-like receptor,TLR)4或晚期糖基化终末产物受体(receptor for advanced glycation end produ-cts,RAGE)介导的多种炎症途径,调节G-CSF的产生和诱导白细胞介素(IL)-8、肿瘤坏死因子(TNF)-α等促炎细胞因子的表达,是炎症启动和维持的关键介质。
脓毒症是由感染引发的机体反应失控导致的危及生命的器官功能障碍[7]。据我国2020年一项针对全国44所医院重症监护病房(ICU)的研究报告[8]显示,ICU患者脓毒症的发病率为20.6%,病死率为35.5%,严重脓毒症病例的病死率高达50%以上。感染是重要的始动因素,失控的炎症级联反应,以及随之而来的细胞因子风暴和免疫抑制,是脓毒症不断进展以及不良预后的关键所在,切断感染发展,成为阻断器官功能衰竭的重要环节[9]。
1 感染初期CP对病原体的清除及营养免疫作用在不同环境中,曾三次独立发现CP,均具有Ca2+结合活性,并与炎症反应相关,且后续研究中发现,CP对真菌和细菌具有广谱的生长抑制作用,故得此命名[10]。大多数S100家族的编码基因聚集在1号染色体长臂的1q21区域[11-12],在哺乳动物中高度保守,S100蛋白家族成员的氨基酸序列有25%~65%的相似性,但在功能上有所差异。每个单体通常包含C端的经典EF-hand和N端的假EF-hand,由铰链区连接,组成两个螺旋-环-螺旋(helix-loop-helix)EF-hand的结构,以反平行的同源/异源二聚体形式存在[13-14]。中性粒细胞胞质中Ca2+浓度较低时(<0.1 μM),以异源二聚体形式存在的CP,在受到刺激后胞内Ca2+浓度升高约100倍,或从胞质释放至高钙离子浓度的胞外时,则将以四聚体形式存在[15]。S100A8、S100A9蛋白质的三级、四级结构见图 1。
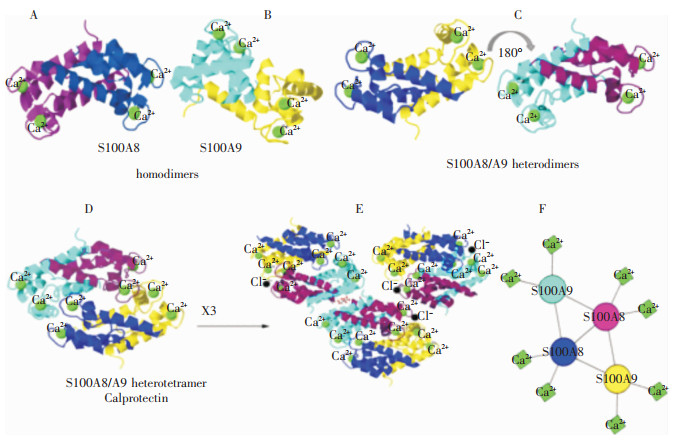 |
| 注:A为S100A8同源二聚体,单个亚基以紫色和深蓝色表示;B为S100A9同源二聚体,亚基以海蓝和黄色表示;C为S100A8/A9异二聚体,在两个旋转180°的投影中显示;D为S100A8/A9异四聚体钙保护素;E为由3个钙保护素组装而成的S100A8/A9十二聚体;F为钙保护素中S100SA8和S100A9的排列示意图。亚基以单独的颜色表示,如A和B所示。 图 1 S100A8、S100A9蛋白质的三级、四级结构[16] |
CP具有卓越的金属螯合能力。病原微生物感染宿主后,感染部位的宿主细胞将CP释放到胞外空间,通过EF-hand结构域竞争螯合Fe2+、Mn2+、Zn2+、Ni2+等病原微生物繁殖所需的微量金属离子,隔离病原微生物的金属营养,即通过营养免疫这一先天固有的免疫方式,来限制病原微生物生长增殖。
在感染部位,组织性表达CP的单核/巨噬细胞、中性粒细胞、树突状细胞、成纤维细胞、血管内皮细胞和激活的角质形成细胞[17],通过主动、被动两种方式分泌S100A8/A9。主动分泌类似于高尔基体非依赖性细胞因子的分泌,但通常ATP依赖途径分泌需要完整的微管网络;被动分泌则多以胞外陷阱方式呈现,体外大约有三分之一的CP通过中性粒细胞胞外陷阱(NETs)释放[18]。当释放到感染部位的CP超过该环境下生物有效的金属离子浓度时,存在于感染部位所有生物可利用的二价过渡金属离子都可以被CP捕获。
目前已知影响CP抑菌能力的因素包括但不限于Ca2+浓度、pH以及物理结合,前两者主要通过调节CP的构象影响其金属螯合能力实现。研究[19]发现,CP在20 μg/mL的高浓度下对金黄色葡萄球菌和肺炎克雷伯菌的生长起到抑制作用。CP还是唯一已知的可隔离Mn2+的宿主防御蛋白。在Ca2+存在的情况下,抗菌活性在10 μg/mL时变得显著,Mn2+耗竭为主要抗菌机制。CP使金黄色葡萄球菌失去Mn2+,并抑制其超氧化物歧化酶活性,表明CP通过增加金黄色葡萄球菌对氧化应激的敏感性来减弱其毒力[20]。由于局部水平的Zn2+和Mn2+可以调节CP与包括细菌在内的靶细胞之间的亲和力,且CP在不同于Ca2+结合位点的其他结合位点与Zn2+和Mn2+结合[21],因此在不同的病理状态下,其抗菌潜力可能存在差异。Ca2+的结合对促炎活性的调节至关重要,CP被释放到细胞外,在胞外的高钙环境或Zn2+等阳离子诱导下低聚化[22],蛋白螺旋和结合环等结构域构象改变[16],由四聚体发挥生物活性,因此,Ca2+、Zn2+和Mn2+等的结合通过调节蛋白质构象实现其抗菌活性及不同的功能特性。另外可能的影响因素是pH。研究[23]发现S100A12的金属螯合能力具有pH依赖性,而S100A8/A9异源二聚体与其金属结合位点相同、基序相似,且与Ca2+结合后Zn2+亲和力增强,因此pH变化也可能调节过渡金属与S100A8/A9的结合。即使S100A8/A9与模式识别受体(PRRs)的结合被抑制时,Zn2+和Mn2+等结合介导的抗菌效应仍可能发生,高水平的CP在感染中起到不可忽视的抗菌作用。不同于耗尽大肠埃希菌胞内的Zn2+和Mn2+,CP通过与细菌物理结合的机制来抑制伯氏杆菌的生长[24],说明CP除金属螯合作用外,根据微生物和宿主生态位的不同,尚有其他复杂机制有待探明。
1.2 提高抑菌能力CP在吞噬细胞NADPH氧化酶的激活中起关键作用。在Ca2+存在的情况下,CP与胞质中花生四烯酸结合,并将其转移到中性粒细胞质膜中的NADPH氧化酶复合物,诱导ROS产生。CP通过激活TNF-α上游的细胞TLR-4来增强吞噬细胞的激活。试验证明,S100A9通过诱导单核细胞和中性粒细胞中p38、Syk、ERK1/2和PI3K/Akt等磷酸化[25],提高机体中性粒细胞的吞噬效率,从而增强其对肺炎克雷伯菌和大肠埃希菌的抗菌活性[26]。纯化的CP具有广谱的抗菌活性,包括大肠埃希菌、白念珠菌、金黄色葡萄球菌、肺炎克雷伯菌、鼠伤寒沙门菌和单核细胞增生性李斯特菌等[19, 27-28]。黏膜液、气道分泌物、龈沟液和组织脓肿中存在的CP,有助于限制共生微生物的生长和防止病原体的入侵。三分之一的细菌与表达CP的细胞结合,而在表达CP的细胞中,胞内微生物存在仅占十分之一,这表明胞浆中的CP可以保护其免受牙龈卟啉单胞菌、单核细胞增生李斯特菌和鼠伤寒沙门菌的黏附与侵袭。也有学者认为,CP结合的Ca2+可能破坏生物膜藻酸盐的聚合,从而增加生物膜表面细菌对中性粒细胞吞噬的易感性[29]。
CP还可通过ROS依赖的方式影响LC3-Ⅱ的转换,诱导自噬发生,从而促进细胞内牛型结核分枝杆菌的清除,沉默CP会增加牛型结核分枝杆菌的存活率[30]。还有研究[31]表明,在细菌代谢物丁酸盐存在下,分化的巨噬细胞显示出增强的抗菌活性,丁酸盐的存在,驱动了抗微生物LC3相关宿主防御及抗微生物肽如CP等产生的协同作用,共同促进细胞抗微生物活性。尚有其他CP诱导的自噬途径如Beclin1等有待探索[32]。
综上所述,S100A8/A9在感染初期通过金属螯合、促进NADPH氧化酶活化和ROS产生、诱导自噬等多重机制抑制感染部位病原体的生长,为吞噬细胞的募集提供时间,此后S100A9增强浸润的白细胞的吞噬活性,加速病原体的清除。下一步研究应关注CP在体外环境下对中性粒细胞及巨噬细胞的局部作用。
2 CP在脓毒症发生发展中的作用机制Ca2+作为第二信使,参与肌肉收缩、细胞分化或死亡的一系列细胞过程,CP复杂的生物学功能,使其既可作为细胞内介质,又可作为细胞外信号蛋白[33],以旁分泌或自分泌的方式调节靶细胞的活动[34]。脓毒症的核心机制是机体促炎/抗炎反应动态调控的失衡,由前期的炎症风暴逐渐转换成晚期的免疫麻痹。在脓毒症发生、发展过程中,CP从炎症的起始阶段作为DAMP激活炎性细胞、趋化及放大炎症的级联反应,到后期调节促炎介质的产生并捕获体外促炎细胞因子,其调节炎症免疫的作用贯穿始终。脓毒症促炎阶段到免疫抑制阶段的转换及特征见图 2。
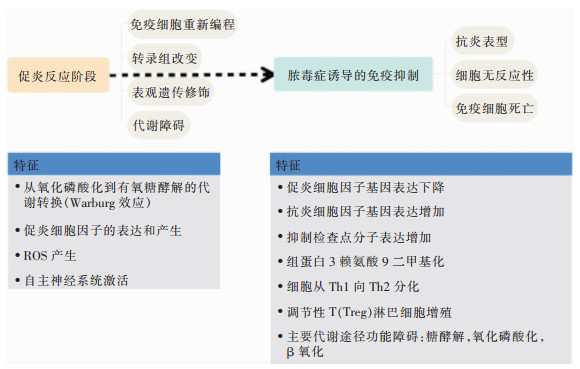 |
| 图 2 脓毒症促炎阶段到免疫抑制阶段的转换及特征 |
CP在静息吞噬细胞的微管聚合和稳定中起重要作用。在细胞内,其与p38MAPK和Ca2+信号通路调控微管的相互作用,介导细胞骨架的快速重排,这是细胞成功迁移、吞噬和胞吐的先决条件。
2.1.1 正向调控S100A8首先被命名为趋化蛋白(CP-10),是第一个在体内外发现对吞噬细胞具有趋化因子样活性的S100家族成员,可直接与微管蛋白结合,吸引浓度在10~11 M至10~13 M范围内的中性粒细胞[35]。动物试验表明,注射mS100A8可促进白细胞募集,4~6 h出现中性粒细胞,24 h后出现单核细胞,其动力学类似于抗原注入致敏宿主引起的迟发性超敏反应[26]。
S100A9是CP复合物的调节亚基。通过微管网络分泌的S100A9激活蛋白激酶C,Ca2+依赖性蛋白激酶C水平的升高,促进S100A9的异二聚化和易位到膜,S100A9还可通过p38MAPK途径消除微管蛋白的聚合[36]。炎症过程中,S100A9通过Ca2+和p38MAPK信号的磷酸化逆转微管的形成,导致细胞骨架重排,其主要通过RAGE途径[25]介导THP1细胞和主要白细胞群的有效迁移。一项癌症相关试验[37]表明,Annexin A1蛋白作为细胞骨架重塑因子,可以通过促进细胞迁移/侵入细胞内来调节肿瘤转移,S100A9则通过Ca2+的收集对Annexin-A1的膜聚集有积极作用。S100A8和S100A9还可以诱导成纤维细胞增殖分化,并与角蛋白丝相互作用,加速伤口修复[38]。
胞质CP与激活的吞噬细胞和上皮细胞中的微管蛋白、微丝和角蛋白、中间丝、F-肌动蛋白等细胞骨架蛋白的相互作用及向质膜的移位都依赖于Ca2+。在吞噬细胞的活化过程中,微管蛋白结合位点较多的四聚体在微管的捆绑和交联方面优于二聚体,伴随着Ca2+内流,Ca2+诱导的CP异源四聚体直接与微管结合,在稳定微管网络中起着关键作用,对发挥其胞内生物学功能至关重要[39]。
2.1.2 负向调控尽管CP在白细胞趋化中作用机制丰富,但在炎症失控时,尚可起到负向调节作用,即排斥炎症部位的白细胞,并使巨噬细胞失活。研究[40]证明,S100A8在正常的宿主体内抑制中性粒细胞募集,在体外S100A8和S100A9也对中性粒细胞产生化学排斥效应;然而诸如感染等因素诱发的氧化应激,可能会通过中和其氧化状态使该活性失效[41]。也有研究[42]发现,对白细胞具有强烈趋化性的是还原的而非氧化的S100A8同源二聚体。CP不同功能背后的机制尚不清楚,推测可能由特定的寡聚形式或翻译后修饰决定其功能。
CP还可以通过上调黏附分子的表达和诱导整合素的激活,来调节白细胞募集的级联反应。白细胞经历募集、着边、捕获并通过与内皮细胞紧密黏附等一系列过程,产生大量细胞因子,并激活黏附分子所致的内皮损伤,是脓毒症微循环障碍的主要原因。白细胞滚动过程中的细胞相互作用,触发CP分泌,CP释放可诱导内皮细胞表达VCAM-1和ICAM-1[43],并通过TLR-4介导、RAP1-GTPase依赖的途径增强白细胞Mac-1(CD11b/CD18)与内皮细胞ICAM-1结合能力,从而降低滚动速度并加强黏附,促进跨内皮细胞迁移[44]。而S100A9敲除(S100A9-/-)的中性粒细胞表现出MAC-1表达受损和通过内皮细胞的迁移能力降低。S100A8和S100A9还可以通过p38信号通路,增加侵袭性伪足的形成和激活促进黏附[45]。这些蛋白也改变了内皮细胞之间的紧密连接,破坏内皮屏障的完整性,降低细胞间连接蛋白cadherin的表达,增加血管的通透性,促进白细胞的外渗,诱导微血管内皮细胞血栓形成和炎症反应[46]。
2.2 促炎/抑炎的双向调节S100A8在细胞外与G蛋白偶联受体(GPCR)、TLR4、清道夫受体CD36交互;在细胞内则与端粒酶交互;S100A9在胞外作用于RAGE、TLR4、清道夫受体CD36,在胞内调节异源二聚体的活动[17]。二者均具有细胞内外活性,在正常状态下发挥抗炎作用,氧化应激则激活其促炎功能。
2.2.1 促炎作用在胞内,CP通过调节NADPH氧化酶的活性,诱导活性氧(ROS)的生成,引发炎症,同时通过细胞因子转录调控的S100A8/A9-NF-κB轴参与中性粒细胞脱颗粒过程[47],调节多种促炎细胞因子的分泌。在胞外,公认其可作为内源性配体,通过与TLR4或RAGE结合,发挥损伤相关分子模式(DAMP)的作用来调节炎症过程,并诱导炎性细胞因子、ROS和一氧化氮(NO)产生,从而放大急性和慢性炎症免疫反应。TLR存在多种亚型,其中TLR2、TLR4是与感染免疫相关的主要受体。TLR4是首个被发现的TLR蛋白,其受体与病原相关分子模式(PAMP)结合,通过NF-κB信号转导调控下游炎症基因,在机体抗炎免疫反应过程中起着重要作用[48];晚期糖基化终末产物(AGEs)及其受体(RAGEs)则与慢性疾病,尤其是长期炎症有关。
CP主要经NF-κB途径调节细胞因子分泌,通过TLR4信号激活髓分化因子88(MyD88),TIRAP/MyD88复合物将IL-1R相关激酶(IRAKs)和TNF-α受体相关因子6(TRAF6)募集到受体,激活TAK1后,使IKKs磷酸化,然后IκB与NF-κB分离,NF-κB易位诱导促炎细胞因子(IL-6、IL-8和TNF-α等)的转录[49]。因此,CP不仅是反应炎症的生物标志物,而且还通过多种功能促进炎症过程的进展,在炎症性疾病的病理生理学中具有重要意义。
研究[50]表明,S100A8和S100A9在体内外均能促进单钠尿酸盐(MSU)晶体诱导吞噬细胞中IL-1β的分泌,用S100A9处理人单核细胞也出现IL-1β、IL-6和TNF-α分泌增加[51];在fMLP和GM- CSF刺激的中性粒细胞中,S100A9可以分别间接增强NF-κB、CREB-1和STAT3/STAT5途径的IL-8分泌[52],S100A9还可能充当坏死性凋亡信号的下游参与者,在肝脏的坏死性炎症轴中发挥作用[53]。
炎症失衡状态下,S100A8/A9的过度表达可继续放大炎症反应,加速中性粒细胞和巨噬细胞释放更多的细胞因子,从而导致恶性循环。还有学者用甲型流感病毒(IAV)感染小鼠[54],发现由DDX21-TRIF途径诱导的S100A9,通过TLR/MyD88从未受损的巨噬细胞中释放出来,可以单独作为促炎因子激活TLR,导致过度的炎症反应和细胞凋亡。目前推测,细胞外S100A9调节炎症反应独立于细胞内S100A9,作为有效病毒感染/复制所需的宿主因子起效。有试验证明使用小分子靶向抑制剂或抗体(Narciclasine、CAP37等)阻断CP活性或下游信号通路可减少促炎细胞因子的分泌,减轻过度炎症,改善感染和损伤状况[55-57],因此这种异源二聚体具有作为治疗靶点的潜力。
2.2.2 抗氧化损伤与抑炎作用尽管S100蛋白的过度表达与疾病的恶化密切相关,但适当水平的S100蛋白可能有助于防御能力和免疫稳态。与前文促进ROS形成相反,S100A8同时具有强大的氧化剂清除活性。研究[58]表明,S100A8能通过清除活化白细胞产生的ROS来抑制IgE介导的MC脱粒和IL-6、IL-4、GM-CSF等细胞因子的产生,外源性S100A8蛋白可以抑制血小板衍生生长因子(PDGF)诱导的气道平滑肌细胞(ASMC)增殖,在减少和逆转慢性呼吸道疾病气道重塑的治疗中存在开发价值。S100A8还可促进气道上皮细胞抗炎因子IL-10的表达,降低脂多糖(LPS)诱导的促炎因子表达和中性粒细胞浸润。在免疫调节作用方面,同源二聚体S100A8比CP异源二聚体更有效,而Ca2+诱导(S100A8/A9)2四聚体的形成隐藏了TLR4结合位点并阻断异二聚体进一步结合TLR4的能力,从而防止不良的全身效应[59]。
许多不同的研究也揭示了CP在特定条件下控制失控炎症、避免过度炎症造成组织损伤的保护作用。CP与促炎因子IL-1β、IL-6和TNF-α的非共价和高亲和力结合表明,CP具有捕获细胞因子的能力[60]。研究[61]发现,在感染所致的不稳定慢性阻塞性肺疾病(COPD)患者中,S100A9的表达未见增加,这可能是机体免疫功能低下的表现,是疾病恶化的原因;其他因素诱发的重度COPD患者S100A9高表达,提示免疫反应失控。研究[62]将S100A8/A9和S100A9单体以鼻内吸入方式给药小鼠,发现由LPS引起的急性肺损伤(ALI)中的中性粒细胞流入有所改善,LPS介导的ALI信号通路转导受到抑制,S100A9的预处理可能有助于正常的肺内稳态和防止过度暴发性炎症,减轻急性肺损伤。还有研究[63]表明,甲基强的松龙显著增加患者血清中CP表达水平,并通过GR β信号传导使骨髓源性抑制细胞扩增,从而缓解急性期多发性硬化症症状。
综上所述,不同状态的S100A8、S100A9和S100A8/A9参与了炎症过程中体内稳态的调节和恢复,是维持炎症过程动态平衡的关键靶点,目前对其抗炎的具体机制所知甚少,在脓毒症期间阻断可溶性CP形成或分泌、调节其磷酸化修饰及氧化应激状态,构建针对性的疫苗,诱导的自身耐受和交叉耐受可能为预防脓毒症期间炎性因子风暴提供一种新策略。
3 展望目前CP水平升高是炎症性疾病的特征,但现有研究对异二聚体、同源二聚体和异源四聚体混合物功能分别分析的固有困难,使CP的研究仍较为局限,关于S100A8、S100A9单体及其多种寡聚体(同源/异源二聚体、四聚体、六聚体等)存在形式的不同水平,以及在不同形式之间相互转换的条件将是解释其行为功能的关键。暂时地控制S100A8/A9的作用,通过有条件的控制基因表达或药物抑制S100A8/A9或其受体,或对S100A9进行细胞特异性敲除,从特定的细胞来源确定S100A8/A9表达的重要性,是进一步研究的主要手段,CP不仅可以作为炎症相关疾病的诊断和预后的生物标志物,还可以作为疾病疗效的检测指标,这一领域未来的发展方向在挖掘其潜在机制的基础上,可能集中在针对CP作为早期疾病检测和预后的生物标志物,以及验证CP在临床前和临床环境中的治疗潜力及相关治疗方法的开发。期待未来能在疾病不同阶段、不同部位对CP发挥的作用进行区分调控,实现精准医疗的目的。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Moore BW. A soluble protein characteristic of the nervous system[J]. Biochem Biophys Res Commun, 1965, 19(6): 739-744. DOI:10.1016/0006-291X(65)90320-7 |
| [2] |
Spratt DE, Barber KR, Marlatt NM, et al. A subset of calcium-binding S100 proteins show preferential heterodimerization[J]. FEBS J, 2019, 286(10): 1859-1876. DOI:10.1111/febs.14775 |
| [3] |
Edgeworth J, Gorman M, Bennett R, et al. Identification of p8, 14 as a highly abundant heterodimeric calcium binding protein complex of myeloid cells[J]. J Biol Chem, 1991, 266(12): 7706-7713. DOI:10.1016/S0021-9258(20)89506-4 |
| [4] |
Yoshida M, Worlock KB, Huang N, et al. Local and systemic responses to SARS-CoV-2 infection in children and adults[J]. Nature, 2022, 602(7896): 321-327. DOI:10.1038/s41586-021-04345-x |
| [5] |
Qin MQ, Zou YT, Zhong KH, et al. Expression of S100A8 is induced by interleukin-1α in TR146 epithelial cells through a mechanism involving CCAAT/enhancer binding protein β[J]. Mol Med Rep, 2019, 19(3): 2413-2420. |
| [6] |
Weisz J, Uversky VN. Zooming into the dark side of human annexin-S100 complexes: dynamic alliance of flexible partners[J]. Int J Mol Sci, 2020, 21(16): 5879. DOI:10.3390/ijms21165879 |
| [7] |
Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [8] |
Xie JF, Wang HL, Kang Y, et al. The epidemiology of sepsis in Chinese ICUs: a national cross-sectional survey[J]. Crit Care Med, 2020, 48(3): e209-e218. DOI:10.1097/CCM.0000000000004155 |
| [9] |
中国医疗保健国际交流促进会急诊医学分会, 中华医学会急诊医学分会, 中国医师协会急诊医师分会, 等. 中国脓毒症早期预防与阻断急诊专家共识[J]. 中国急救医学, 2020, 40(7): 577-588. Emergency Medicine Branch of China Association for the Promotion of International Exchange of Medical Care, Emergency Medicine Branch of Chinese Medical Association, Emergency Physician Branch of Chinese Medical Doctor Association, et al. Expert consensus on early prevention and prevention of emergency sepsis in China[J]. Chinese Journal of Critical Care Medicine, 2020, 40(7): 577-588. DOI:10.3969/j.issn.1002-1949.2020.07.001 |
| [10] |
McNamara MP, Wiessner JH, Collins-Lech C, et al. Neutrophil death as a defence mechanism against Candida albicans infections[J]. Lancet, 1988, 2(8621): 1163-1165. |
| [11] |
Pruenster M, Vogl T, Roth J, et al. S100A8/A9:from basic science to clinical application[J]. Pharmacol Ther, 2016, 167: 120-131. DOI:10.1016/j.pharmthera.2016.07.015 |
| [12] |
Henry J, Toulza E, Hsu CY, et al. Update on the epidermal differentiation complex[J]. Front Biosci (Landmark Ed), 2012, 17(4): 1517-1532. |
| [13] |
Carafoli E, Krebs J. Why calcium? How calcium became the best communicator[J]. J Biol Chem, 2016, 291(40): 20849-20857. DOI:10.1074/jbc.R116.735894 |
| [14] |
Kawasaki H, Kretsinger RH. Structural and functional diversity of EF-hand proteins: evolutionary perspectives[J]. Protein Sci, 2017, 26(10): 1898-1920. DOI:10.1002/pro.3233 |
| [15] |
Hoskin TS, Crowther JM, Cheung J, et al. Oxidative cross-linking of calprotectin occurs in vivo, altering its structure and susceptibility to proteolysis[J]. Redox Biol, 2019, 24: 101202. DOI:10.1016/j.redox.2019.101202 |
| [16] |
Vogl T, Gharibyan AL, Morozova-Roche LA. Pro-inflammatory S100A8 and S100A9 proteins: self-assembly into multifunctional native and amyloid complexes[J]. Int J Mol Sci, 2012, 13(3): 2893-2917. DOI:10.3390/ijms13032893 |
| [17] |
Gonzalez LL, Garrie K, Turner MD. Role of S100 proteins in health and disease[J]. Biochim Biophys Acta Mol Cell Res, 2020, 1867(6): 118677. DOI:10.1016/j.bbamcr.2020.118677 |
| [18] |
Urban CF, Ermert D, Schmid M, et al. Neutrophil extracellular traps contain calprotectin, a cytosolic protein complex involved in host defense against Candida albicans[J]. PLoS Pathog, 2009, 5(10): e1000639. DOI:10.1371/journal.ppat.1000639 |
| [19] |
Pirr S, Richter M, Fehlhaber B, et al. High amounts of S100-alarmins confer antimicrobial activity on human breast milk targeting pathogens relevant in neonatal sepsis[J]. Front Immunol, 2017, 8: 1822. DOI:10.3389/fimmu.2017.01822 |
| [20] |
Zygiel EM, Nolan EM. Transition metal sequestration by the host-defense protein calprotectin[J]. Annu Rev Biochem, 2018, 87: 621-643. DOI:10.1146/annurev-biochem-062917-012312 |
| [21] |
Heizmann CW. Ca2+-binding proteins of the EF-hand superfamily: diagnostic and prognostic biomarkers and novel therapeutic targets[J]. Methods Mol Biol, 2019, 1929: 157-186. |
| [22] |
Signor L, Paris T, Mas C, et al. Divalent cations influence the dimerization mode of murine S100A9 protein by modulating its disulfide bond pattern[J]. J Struct Biol, 2021, 213(1): 107689. DOI:10.1016/j.jsb.2020.107689 |
| [23] |
Wang Q, Aleshintsev A, Jose AN, et al. Calcium regulates S100A12 zinc sequestration by limiting structural variations[J]. Chembiochem, 2020, 21(9): 1372-1382. DOI:10.1002/cbic.201900623 |
| [24] |
Besold AN, Culbertson EM, Nam L, et al. Antimicrobial action of calprotectin that does not involve metal withholding[J]. Metallomics, 2018, 10(12): 1728-1742. DOI:10.1039/C8MT00133B |
| [25] |
Chen B, Miller AL, Rebelatto M, et al. S100A9 induced inflammatory responses are mediated by distinct damage associa-ted molecular patterns (DAMP) receptors in vitro and in vivo[J]. PLoS One, 2015, 10(2): e0115828. DOI:10.1371/journal.pone.0115828 |
| [26] |
Hsu K, Champaiboon C, Guenther BD, et al. Anti-infective protective properties of S100 calgranulins[J]. Antiinflamm Antiallergy Agents Med Chem, 2009, 8(4): 290-305. DOI:10.2174/187152309789838975 |
| [27] |
Ross KF, Herzberg MC. Autonomous immunity in mucosal epithelial cells: fortifying the barrier against infection[J]. Microbes Infect, 2016, 18(6): 387-398. DOI:10.1016/j.micinf.2016.03.008 |
| [28] |
Sorenson BS, Khammanivong A, Guenther BD, et al. IL-1 receptor regulates S100A8/A9-dependent keratinocyte resistance to bacterial invasion[J]. Mucosal Immunol, 2012, 5(1): 66-75. DOI:10.1038/mi.2011.48 |
| [29] |
Trøstrup H, Lerche CJ, Christophersen L, et al. Immune modulating topical S100A8/A9 inhibits growth of Pseudomonas aeruginosa and mitigates biofilm infection in chronic wounds[J]. Int J Mol Sci, 2017, 18(7): 1359. DOI:10.3390/ijms18071359 |
| [30] |
Wang JL, Huang CY, Wu MH, et al. MRP8/14 induces autophagy to eliminate intracellular Mycobacterium bovis BCG[J]. J Infect, 2015, 70(4): 415-426. DOI:10.1016/j.jinf.2014.09.013 |
| [31] |
Schulthess J, Pandey S, Capitani M, et al. The short chain fatty acid butyrate imprints an antimicrobial program in macrophages[J]. Immunity, 2019, 50(2): 432-445.e7. DOI:10.1016/j.immuni.2018.12.018 |
| [32] |
Sun ZW, Zeng B, Liu DD, et al. S100A8 transported by SEC23A inhibits metastatic colonization via autocrine activation of autophagy[J]. Cell Death Dis, 2020, 11(8): 650. DOI:10.1038/s41419-020-02835-w |
| [33] |
Jarlborg M, Courvoisier DS, Lamacchia C, et al. Serum calprotectin: a promising biomarker in rheumatoid arthritis and axial spondyloarthritis[J]. Arthritis Res Ther, 2020, 22(1): 105. DOI:10.1186/s13075-020-02190-3 |
| [34] |
Pepper RJ, Draibe JB, Caplin B, et al. Association of serum calprotectin (S100A8/A9) level with disease relapse in proteinase 3-antineutrophil cytoplasmic antibody-associated vasculitis[J]. Arthritis Rheumatol, 2017, 69(1): 185-193. DOI:10.1002/art.39814 |
| [35] |
Cesaro A, Defrêne J, Lachhab A, et al. Enhanced myelopoiesis and aggravated arthritis in S100a8-deficient mice[J]. PLoS One, 2019, 14(8): e0221528. DOI:10.1371/journal.pone.0221528 |
| [36] |
Gouin E, Balestrino D, Rasid O, et al. Ubiquitination of Listeria virulence factor InlC contributes to the host response to infection[J]. mBio, 2019, 10(6): e02778-19. |
| [37] |
Xiao Y, Ouyang CJ, Huang WG, et al. Annexin A1 can inhibit the in vitro invasive ability of nasopharyngeal carcinoma cells possibly through annexin A1/S100A9/vimentin interaction[J]. PLoS One, 2017, 12(3): e0174383. DOI:10.1371/journal.pone.0174383 |
| [38] |
Montoya A, López MC, Vélez ID, et al. Label-free quantitative proteomic analysis reveals potential biomarkers for early healing in cutaneous leishmaniasis[J]. PeerJ, 2019, 6: e6228. DOI:10.7717/peerj.6228 |
| [39] |
Wei LL, Liu MW, Xiong HF. Role of calprotectin as a biomarker in periodontal disease[J]. Mediators Inflamm, 2019, 2019: 3515026. |
| [40] |
Sroussi HY, Lu Y, Zhang QL, et al. S100A8 and S100A9 inhibit neutrophil oxidative metabolism in-vitro: involvement of adenosine metabolites[J]. Free Radic Res, 2010, 44(4): 389-396. DOI:10.3109/10715760903431434 |
| [41] |
Sroussi HY, Berline J, Palefsky JM. Oxidation of methionine 63 and 83 regulates the effect of S100A9 on the migration of neutrophils in vitro[J]. J Leukoc Biol, 2007, 81(3): 818-824. DOI:10.1189/jlb.0706433 |
| [42] |
Sparvero LJ, Asafu-Adjei D, Kang R, et al. RAGE (receptor for advanced glycation endproducts), RAGE ligands, and their role in cancer and inflammation[J]. J Transl Med, 2009, 7: 17. DOI:10.1186/1479-5876-7-17 |
| [43] |
Sreejit G, Abdel Latif A, Murphy AJ, et al. Emerging roles of neutrophil-borne S100A8/A9 in cardiovascular inflammation[J]. Pharmacol Res, 2020, 161: 105212. DOI:10.1016/j.phrs.2020.105212 |
| [44] |
Pruenster M, Kurz ARM, Chung KJ, et al. Extracellular MRP8/14 is a regulator of β2 integrin-dependent neutrophil slow rolling and adhesion[J]. Nat Commun, 2015, 6(1): 6915. DOI:10.1038/ncomms7915 |
| [45] |
Aguado BA, Bushnell GG, Rao SS, et al. Engineering the pre-metastatic niche[J]. Nat Biomed Eng, 2017, 1: 0077. DOI:10.1038/s41551-017-0077 |
| [46] |
Wang LQ, Luo HH, Chen XH, et al. Functional characterization of S100A8 and S100A9 in altering monolayer permeability of human umbilical endothelial cells[J]. PLoS One, 2014, 9(3): e90472. DOI:10.1371/journal.pone.0090472 |
| [47] |
Zhou Y, Hann J, Schenten V, et al. Role of S100A8/A9 for cytokine secretion, revealed in neutrophils derived from ER-Hoxb8 progenitors[J]. Int J Mol Sci, 2021, 22(16): 8845. DOI:10.3390/ijms22168845 |
| [48] |
朱宏亮, 陈帆, 吴豫, 等. 铜绿假单胞菌外膜囊泡经TLR4/NF-κB通路诱导巨噬细胞炎症反应[J]. 国际免疫学杂志, 2020, 43(3): 257-262. Zhu HL, Chen F, Wu Y, et al. Pseudomonas aeruginosa outer membrane vesicles induces the inflammatory response in macrophages via the TLR4/NF-κB pathways[J]. International Journal of Immunology, 2020, 43(3): 257-262. |
| [49] |
Daseke MJ 2nd, Chalise U, Becirovic-Agic M, et al. Neutrophil signaling during myocardial infarction wound repair[J]. Cell Signal, 2021, 77: 109816. DOI:10.1016/j.cellsig.2020.109816 |
| [50] |
Tardif MR, Chapeton-Montes JA, Posvandzic A, et al. Secretion of S100A8, S100A9, and S100A12 by neutrophils involves reactive oxygen species and potassium efflux[J]. J Immunol Res, 2015, 2015: 296149. |
| [51] |
Jukic A, Bakiri L, Wagner EF, et al. Calprotectin: from biomarker to biological function[J]. Gut, 2021, 70(10): 1978-1988. DOI:10.1136/gutjnl-2021-324855 |
| [52] |
Simard JC, Noël C, Tessier PA, et al. Human S100A9 potentiates IL-8 production in response to GM-CSF or fMLP via activation of a different set of transcription factors in neutrophils[J]. FEBS Lett, 2014, 588(13): 2141-2146. DOI:10.1016/j.febslet.2014.04.027 |
| [53] |
Bai L, Kong M, Duan ZP, et al. M2-like macrophages exert hepatoprotection in acute-on-chronic liver failure through inhibiting necroptosis-S100A9-necroinflammation axis[J]. Cell Death Dis, 2021, 12(1): 93. DOI:10.1038/s41419-020-03378-w |
| [54] |
Tsai SY, Segovia JA, Chang TH, et al. DAMP molecule S100A9 acts as a molecular pattern to enhance inflammation during influenza A virus infection: role of DDX21-TRIF-TLR4-MyD88 pathway[J]. PLoS Pathog, 2014, 10(1): e1003848. DOI:10.1371/journal.ppat.1003848 |
| [55] |
Kingsley MK, Bhat BV, Badhe BA, et al. Narciclasine improves outcome in sepsis among neonatal rats via inhibition of calprotectin and alleviating inflammatory responses[J]. Sci Rep, 2020, 10(1): 2947. DOI:10.1038/s41598-020-59716-7 |
| [56] |
Kasus-Jacobi A, Land CA, Stock AJ, et al. Antimicrobial peptides derived from the immune defense protein CAP37 inhibit TLR4 activation by S100A9[J]. Invest Ophthalmol Vis Sci, 2020, 61(4): 16. |
| [57] |
Ding ZY, Du FF, Averitt V RG, et al. Targeting S100A9 reduces neutrophil recruitment, inflammation and lung damage in abdominal sepsis[J]. Int J Mol Sci, 2021, 22(23): 12923. |
| [58] |
Xu YD, Wang Y, Yin LM, et al. S100A8 inhibits PDGF-induced proliferation of airway smooth muscle cells dependent on the receptor for advanced glycation end-products[J]. Biol Res, 2017, 50(1): 23. |
| [59] |
Viemann D. S100-alarmins are essential pilots of postnatal innate immune adaptation[J]. Front Immunol, 2020, 11: 688. |
| [60] |
Wang SW, Song R, Wang ZY, et al. S100A8/A9 in inflammation[J]. Front Immunol, 2018, 9: 1298. |
| [61] |
Pouwels SD, Nawijn MC, Bathoorn E, et al. Increased serum levels of LL37, HMGB1 and S100A9 during exacerbation in COPD patients[J]. Eur Respir J, 2015, 45(5): 1482-1485. |
| [62] |
Hiroshima Y, Hsu K, Tedla N, et al. S100A8/A9 and S100A9 reduce acute lung injury[J]. Immunol Cell Biol, 2017, 95(5): 461-472. |
| [63] |
Wang ZK, Zheng G, Li GJ, et al. Methylprednisolone allevia-tes multiple sclerosis by expanding myeloid-derived suppressor cells via glucocorticoid receptor β and S100A8/9 up-regulation[J]. J Cell Mol Med, 2020, 24(23): 13703-13714. |



