慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种世界范围内常见的慢性气道疾病,持续性呼吸道症状与气流受限为其主要特征[1],目前全球患病人数已达2.62亿人,被列为全球第三大死因[2]。吸入糖皮质激素(Inhaled corticosteroids, ICS)能明显改善中、重度COPD患者的肺功能,并减少急性加重的发生[1],因此在临床中广泛应用于相应患者群体的治疗。在我国《慢性阻塞性肺疾病诊治指南(2021年修订版)》[3]中,ICS使用的强推荐指征为:①有COPD急性加重住院史和(或)≥2次/年中度急性加重;②外周血嗜酸性粒细胞计数≥300个/μL;③合并哮喘或具备哮喘特征。然而,ICS的使用与肺部感染密切相关[4],也是肺结核发生的独立危险因素[5-6]。中国为结核病高负担国家,相关流行病学研究[7]显示,2016年我国新发肺结核的发病率达52例/10万人。中国COPD人群中是否存在ICS相关的肺结核,以及COPD合并陈旧性肺结核患者使用ICS后是否存在肺结核复燃,目前尚缺乏相关研究。本文拟通过中南大学湘雅二医院收治的3例老年COPD患者,长期使用ICS后出现肺结核典型症状、影像学变化,并最终诊断为继发性肺结核的诊疗经过,探讨我国COPD患者中ICS相关肺结核发生现状及应对策略。
1 临床资料 1.1 病例1患者张某,男性,63岁,退休职员,2015年6月因“反复咳嗽、咳痰、气促10余年,再发加重7 d”入住该院呼吸与危重症医学科。患者2005年起劳累后出现咳嗽、咳痰,痰为白色黏液痰,不易咳出,伴胸闷、气促,秋冬季发作,持续数月。2006年因上述症状再发加重就诊于该院呼吸与危重症医学科,诊断为COPD。入院时肺功能检查:一秒率(FEV1/FVC)42%, FEV1/pre 36%,舒张试验(-),予以抗感染及吸入治疗后好转出院。此后,因上述症状反复发作,多次就诊于外院,每次予抗感染、解痉平喘等对症支持治疗后好转出院。2011年起进行家庭氧疗,间断使用呼吸机。2013年起长期使用沙美特罗/氟替卡松(舒利迭)50 μg/500 μg,2次/d,每次1吸;噻托溴铵粉雾剂(思力华)18 μg,1次/d,每次1吸。患者本次入院1周前自觉咳嗽、咳痰加重,胸闷、气促明显,活动后气促加重,在家间断使用无创呼吸机,氨溴索15 mg、布地奈德混悬液1 mg及吸入用复方异丙托溴铵溶液(可比特)2.5 mL,雾化吸入,3次/d;头孢地尼、多索茶碱、氨溴索口服治疗,气促未见明显好转就诊于该院呼吸与危重症医学科。患者起病来,精神、食欲、睡眠一般,大小便正常,体重无明显变化。
入院后完善相关检查,血常规:白细胞计数8.67×109/L,红细胞计数4.50×1012/L,血红蛋白105 g/L(下降),血小板计数265×109/L,中性粒细胞百分比71.40%,嗜酸性粒细胞计数0.01×109/L;尿、粪便常规未见异常。血气分析: pH 7.39,PCO2 52 mmHg,PO2 67 mmHg。炎症指标:降钙素原0.34 ng/mL,C反应蛋白19.70 mg/L,D-二聚体0.29 μg/mL。痰涂片镜检:未见真菌,红细胞0/HP,白细胞1~4/HP,脓球0/HP。痰革兰染色发现革兰阳性(G+)球菌、革兰阴性(G-)杆菌、G-球菌,痰抗酸染色阴性。多次痰培养均为多重耐药鲍曼不动杆菌。胸片示双肺多发渗出。入院后先后予头孢哌酮/舒巴坦(3 g,静脉滴注,q8h)、美罗培南(1.0 g,静脉滴注,q8h)、替加环素(50 mg,静脉滴注,q12h)、米诺环素(100 mg,口服,q12h)、多粘菌素B(50万单位,静脉滴注,q12h)抗感染,特布他林、布地奈德雾化,多索茶碱解痉,氨溴索化痰,患者病情无明显改善,血氧饱和度持续下降遂进行气管插管有创机械通气。气管插管后行支气管镜检,留取肺泡灌洗液2次抗酸染色(液基夹层杯法)均发现大量抗酸杆菌。最终诊断为:①COPD急性加重期;②继发性肺结核,双肺,初治,痰涂片(+);③医院获得性肺炎;④气管插管术后。患者停用ICS,改为噻托溴铵粉雾剂18 μg,1次/d, 每次1吸,转入结核病专科医院接受HRZE四联抗结核治疗1年,治疗后咳嗽、咳痰减轻。
1.2 病例2患者宋某,男性,85岁,退休干部,2016年出现“反复咳嗽、咳痰、活动后气促”,多次于外院就诊,诊断为“COPD、支气管扩张”,每次入院均予以抗感染(具体方案不详)及吸入治疗,症状可部分缓解。患者自2016年开始长期使用沙美特罗/氟替卡松(舒利迭)50 μg/500 μg,2次/d, 每次1吸;噻托溴铵粉雾剂(思力华)18 μg,1次/d, 每次1吸。于2019年5月因上述症状加重,伴咯血半个月入住该院呼吸与危重症医学科。患者起病以来,精神一般,睡眠、食欲可,尿、粪便常规检查正常,体重无明显变化。既往有“陈旧性肺结核、冠心病、持续性心房纤颤、陈旧性脑出血、腰椎压缩性骨折、腰椎椎间盘突出、骨质疏松、前列腺增生”等病史。2007年因头部外伤曾于该院行手术治疗。生于湖南省长沙市雨花区,久居本地。吸烟60余年,1~2包/d,戒烟5年。婚育史、家族史无特殊。查体:血压125/72 mmHg。慢性病容,双肺可闻及湿啰音,余未见异常。
血常规:白细胞计数6.83×109/L,红细胞计数3.46×1012/L,血红蛋白108 g/L,血小板计数278×109/L,中性粒细胞百分比85.40%,淋巴细胞百分比3.10%,嗜酸性粒细胞计数0.06×109/L,嗜酸性粒细胞百分比0.10%。血气分析提示代谢性碱中毒:pH 7.49(升高),PCO2 49.30 mmHg(升高),PO2 82.40 mmHg(下降), SaO2 97.10%,实际碳酸氢根37.30 mmol/L(升高),标准碳酸氢根36.10 mmol/L(升高),实际碱剩余12.40 mmol/L(升高),标准碱剩余13.00 mmol/L(升高)。心脏彩超:升主动脉增宽,左室壁运动幅度不协调,主动脉瓣退行性变并返流(轻度),肺动脉高压,房颤。肺部CT: ①双肺多发多形态病灶,纵膈及双肺门部分淋巴结钙化,双侧胸膜增厚、黏连;②双肺多发支气管扩张并感染,肺气肿,左侧胸腔少量积液。肺功能:①极重度混合性肺通气功能障碍;②支气管舒张试验阴性。FEV1/FVC:51 %;FEV1 /Pre 27.1%;呼出气一氧化氮(FeNO):47 ppb;CAT19分;mMRC 4级。T-SPOT:ESAT-6 20,CFP-10 45;结核分枝杆菌抗体(PDD-Ab)IgM阴性,PDD-Ab IgG阳性,结明试验阳性。PDD皮试阴性。痰抗酸染色发现:抗酸杆菌高倍镜视野下(+++),痰结核分枝杆菌核酸测定(PCR)阳性(Ct值34.82)。
诊断为:①继发性肺结核,双肺,初治,痰涂片(+);②COPD急性加重期,慢性肺源性心脏病Ⅱ型呼吸衰竭;③左下叶及右中叶支气管扩张;④冠状动脉粥样硬化性心脏病,缺血性心肌病,心房颤动,心功能Ⅲ级;⑤室性期前收缩。因患者高龄,难以耐受经典HRZE四联抗结核治疗,予以异烟肼(300 mg,qd)、乙胺丁醇(750 mg,qd) 抗结核治疗1年。并停用ICS,改为乌美溴铵维兰特罗吸入粉雾剂(欧乐欣)62.5 μg/25 μg,1次/d,每次1吸。治疗后咯血、咳嗽症状消失,肺部CT较前吸收好转,见图 1。
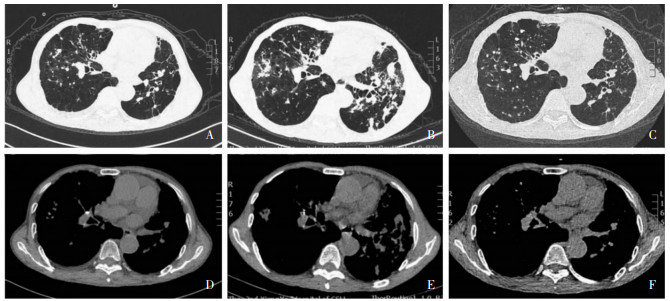 |
| 注:A为2016年12月23日肺部CT(肺窗)显示纤维条索影及数个小钙化灶;B为2019年5月24日肺部CT(肺窗)可见双肺多发多形性病灶;C为2021年1月22日肺部CT(肺窗)可见双肺病灶较前明显吸收减少;D为2016年12月23日肺部CT(纵隔窗)见明显淋巴结钙化;E为2019年5月24日肺部CT(纵隔窗)示肺门淋巴结钙化;F为2021年1月22日肺部CT(纵隔窗)肺门淋巴结钙化仍存在。 图 1 病例2肺部CT检查图像 Figure 1 CT image of lung in case 2 |
患者肖某,男性,80岁,退休干部,2021年3月因“反复咳嗽、咳痰5年,加重伴气促9个月”入住该院呼吸与危重症医学科。患者2016年下半年无明显诱因出现咳嗽,咳少量白黏痰,偶有痰中带血,为鲜红血丝,无气促、胸闷、胸痛,无呼吸困难、心悸等,后多次就诊于当地医院,诊断为:①支气管扩张;②COPD。患者自诉2016年下半年起规律吸入沙美特罗/氟替卡松(舒利迭, 50 μg/500 μg,2次/d,每次1吸)+ 噻托溴铵粉雾剂(思力华,18 μg,1次/d,每次1吸),症状明显改善。自2021年1月起,日常活动即出现气促,就诊于当地医院,诊断考虑为支气管扩张并感染、COPD急性加重,予以解痉平喘,祛痰,抗感染等治疗(具体不详)后,上述症状未见明显好转,仍继续前述吸入治疗并长期家庭氧疗。为求进一步诊治,就诊于该院呼吸与危重症医学科。患者近9个月体重减轻10 kg,既往50余年前有肺结核病史,抗结核治疗1年后治愈。有高压病史、白癜风病史多年。患者吸烟66年,20支/d,戒烟5年。查体:慢性病容,全身多发色素缺失斑块,口腔黏膜可见少许白斑。桶状胸,双肺呼吸音降低,双肺可闻及较多干啰音及湿性啰音。余无异常。
患者入院后完善实验室检查,血常规:白细胞计数14.67×109/L,中性粒细胞计数11.55×109/L,中性粒细胞百分比78.70%,嗜酸性粒细胞计数0.35×109/L。血气分析提示Ⅰ型呼吸衰竭;pH 7.43,PO2 55 mmHg(降低),PCO2 36 mmHg,SaO2 89%(降低)。炎症指标:血沉94 mm/h,降钙素原0.162 ng/mL,C反应蛋白76.70 mg/L;D-dimer阴性。痰标本检测:颜色乳白色,性状泡沫状;涂片镜检发现真菌孢子,白细胞3+/HP,脓球+/HP;革兰染色镜检白细胞大于25/LP,G+球菌+/油镜,G+杆菌+/油镜。痰真菌免疫荧光染色发现真菌孢子及假菌丝;呼吸道病原学检测9项(非典型病原体+病毒)阴性;(1, 3)-β-D葡聚糖检测(G试验)和半乳甘露聚糖检测(GM试验)阴性;PDD-Ab IgG阴性,PDD-Ab IgM阴性,γ-干扰素释放试验结果阳性。PPD 1∶2 000(+),1∶10 000(-)。心电图及心脏彩超未见明显异常。肺功能:①极重度混合性通气功能障碍;②支气管舒张试验阳性。用药后:FEV1/Pre 29%,FEV1/FVC 51.8%;FeNO:16 ppb;CAT22分;mMRC2级;6分钟步行测试(6MWT)300 m(预计值470 m)。肺部CT:①双肺多形性病灶、上叶为甚,左肺多发空洞形成;②双肺支气管扩张。考虑患者为支气管扩张、COPD并感染,多次痰培养检出真菌考虑为口腔真菌感染所致,予以左氧氟沙星(500 mg,静脉滴注,qd)抗感染,采用雾化吸入(异丙托溴铵溶液+硫酸特布他林,q8h)、康复治疗、复方替硝唑漱口及其他对症治疗后,患者症状稍好转。患者入院6 d后痰抗酸染色发现:抗酸杆菌高倍镜视野下(+++),痰结核分枝杆菌核酸测定(PCR)阳性(Ct值35.58)。最终诊断为:①继发性肺结核,双肺,复治,痰涂片(+);②支气管扩张并感染,Ⅰ型呼吸衰竭;③ COPD,D组GOLD4级;④高血压Ⅲ级,极高危组;⑤口腔真菌感染;⑥白癜风。患者停用ICS,改为噻托溴铵粉雾剂(思力华)18 μg,1次/d, 每次1吸,转入结核病专科医院接受异烟肼(300 mg,qd)、乙胺丁醇(750 mg,qd)治疗1年。治疗后,患者咯血消失,咳嗽、咳痰减轻。
2 讨论糖皮质激素具有免疫抑制作用,长期接受ICS治疗的患者面临较高的肺部感染风险[8],增加患结核病风险[5]。Lee等[6]在韩国开展的一项全国性的队列研究结果显示,17 991例接受布地奈德或氟替卡松治疗的患者,患活动性肺结核的风险增加,且在停止使用ICS后,与ICS使用相关的结核分枝杆菌感染风险仍持续存在。
回顾性队列研究[5]发现,在胸片无既往肺结核征象的COPD患者中,使用ICS增加肺结核发生风险(HR为9.079,95%CI:1.012~81.431,P=0.049)。本文病例1,既往无结核病史,胸片无陈旧性肺结核征象,自2013年起长期规律使用ICS,2015年于该院治疗期间两次抗酸染色发现大量抗酸杆菌,考虑为ICS使用相关的继发性肺结核。病例1在病程初期痰抗酸染色阴性,干扰了肺结核的早期诊断,可能与患者痰标本非深部标本有关。后期在支气管肺泡灌洗液中检出大量抗酸杆菌,也证实了深部气道分泌物标本对病原学诊断的重要性。因此,在使用ICS的COPD人群进行痰标本实验室检查时,需仔细鉴别标本来源。有条件进行支气管镜检查的患者可考虑进行支气管肺泡灌洗液检查,若无法耐受支气管镜检查,可考虑进行诱导痰获取深部痰标本,避免漏诊ICS相关肺结核。
陈旧性肺结核患者长期使用ICS将增加肺结核复燃风险。Kim等[5]回顾性队列研究显示,在合并陈旧性肺结核的COPD患者中,使用ICS组相较于其他药物治疗组肺结核复燃的比率明显增加[8.6%(12/139) VS 1.8%(2/114),P<0.001]。本文病例2、3均为既往肺结核患者,在ICS治疗后出现肺结核临床症状和/或相关阳性实验室结果,且无糖尿病、成人获得性免疫缺陷等自身免疫缺陷性疾病;与上述学者观点一致,笔者考虑病例2、3为使用ICS引起的肺结核复燃。
全球COPD倡仪(Global Initiative for Chronic Obstructive Lung Disease,GOLD)2022将合并有结核分枝杆菌感染病史,无论既往是非活动性还是活动性肺结核均列为使用ICS的禁忌证[1]。我国《慢性阻塞性肺疾病诊治指南(2021年修订版)》[3]中指出,对于合并结核分枝杆菌感染的COPD患者不推荐使用ICS,活动性肺结核为ICS使用的绝对禁忌证。因此,病例1、2、3在确诊继发性肺结核之后,均停用ICS。而对于病例2此类中重度COPD合并陈旧性肺结核患者,无ICS使用的强指征,ICS治疗需谨慎,在启动吸入治疗时可优先考虑无ICS方案,如长效支气管扩张剂;随访过程中治疗调整可优先考虑其他药物或改善因素,如联合使用两种长效支气管扩张剂或肺康复治疗等。
Wang等[9]流行病学研究结果显示,我国4.8%的GOLD Ⅲ~Ⅳ级COPD患者合并有结核病史。对于合并陈旧性肺结核、同时具有使用ICS强指征的COPD患者,如本文病例3,是否应使用/停用ICS,如何选择、决定药物剂型与用量已成为COPD治疗中不可忽视的问题。欧洲呼吸协会强烈建议[10],不应在血嗜酸性粒细胞计数≥300/μL的患者中停用ICS,对于停用ICS的COPD患者则应使用1种或2种长效支气管扩张剂进行治疗。由于陈旧性肺结核患者临床表现隐匿,易诊断为已愈合的病灶而被忽视;此外,在陈旧性肺结核患者中,部分有或无免疫受损人群具备PPD阳性或强阳性或具备结核分枝杆菌潜伏感染(latent tuberculosis infection, LTBI)的证据,应被归类为非活动性肺结核患者,该类人群发展为活动性肺结核风险高,应接受同LTBI一致的预防性化学抗结核或免疫性治疗[11]。因此,笔者认为具备ICS使用强指征的COPD患者启动治疗前,应仔细询问结核病史,完善、监测结核病原学检查(痰涂片抗酸染色显微镜检查、分枝杆菌培养和核酸检测)及结核分枝杆菌感染检查(PPD皮肤试验、新型结核菌素皮肤试验、γ-干扰素释放试验)。若诊断为非活动性肺结核应预防性治疗后再予以ICS治疗;若上述检查均为阴性,可考虑使用相对低剂量的ICS剂型。但对于合并陈旧性肺结核的COPD患者,ICS的药物用量、疗程及具体监测指标,仍需要多中心、大样本的随机对照试验提供参考与指导。
综上所述,在COPD的临床诊疗工作中,需警惕ICS相关肺结核发生,应详细询问病史、积极完善相关检查,以早期发现合并的结核分枝杆菌感染或既往陈旧性肺结核。COPD合并陈旧性肺结核患者,应谨慎使用ICS,并严密监测病程。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease(2022 report)[EB/OL]. [2022-02-20]. https://goldcopd.org/wp-content/uploads/2021/12/GOLD-POCKET-GUIDE-2022-v1.1-22Nov2021_WMV.pdf.
|
| [2] |
World Health Organization. The top 10 causes of death[EB/OL]. (2020-12-09)[2022-02-20]. https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death.
|
| [3] |
中华医学会呼吸病学分会慢性阻塞性肺疾病学组, 中国医师协会呼吸医师分会慢性阻塞性肺疾病工作委员会. 慢性阻塞性肺疾病诊治指南(2021年修订版)[J]. 中华结核和呼吸杂志, 2021, 44(3): 170-205. Chronic Obstructive Pulmonary Disease Group of Chinese Thoracic Society, Chronic Obstructive Pulmonary Disease Committee of Chinese Association of Chest Physician Diagnostic and Treatment Protocols. Guidelines for the diagnosis and management of chronic obstructive pulmonary disease (revised version 2021)[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2021, 44(3): 170-205. |
| [4] |
Suissa S, Patenaude V, Lapi F, et al. Inhaled corticosteroids in COPD and the risk of serious pneumonia[J]. Thorax, 2013, 68(11): 1029-1036. DOI:10.1136/thoraxjnl-2012-202872 |
| [5] |
Kim JH, Park JS, Kim KH, et al. Inhaled corticosteroid is associated with an increased risk of TB in patients with COPD[J]. Chest, 2013, 143(4): 1018-1024. DOI:10.1378/chest.12-1225 |
| [6] |
Lee CM, Heo J, Han SS, et al. Inhaled corticosteroid-related tuberculosis in the real world among patients with asthma and COPD: a 10-year nationwide population-based study[J]. J Allergy Clin Immunol Pract, 2019, 7(4): 1197-1206. DOI:10.1016/j.jaip.2018.10.007 |
| [7] |
Jiang H, Liu MY, Zhang YJ, et al. Changes in incidence and epidemiological characteristics of pulmonary tuberculosis in mainland China, 2005-2016[J]. JAMA Netw Open, 2021, 4(4): e215302. DOI:10.1001/jamanetworkopen.2021.5302 |
| [8] |
Martinez-Garcia MA, Faner R, Oscullo G, et al. Inhaled ste-roids, circulating eosinophils, chronic airway infection, and pneumonia risk in chronic obstructive pulmonary disease. a network analysis[J]. Am J Respir Crit Care Med, 2020, 201(9): 1078-1085. DOI:10.1164/rccm.201908-1550OC |
| [9] |
Wang C, Xu JY, Yang L, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health[CPH] study): a national cross-sectional study[J]. Lancet, 2018, 391(10131): 1706-1717. DOI:10.1016/S0140-6736(18)30841-9 |
| [10] |
Chalmers JD, Laska IF, Franssen FME, et al. Withdrawal of inhaled corticosteroids in COPD: a European Respiratory Society guideline[J]. Eur Respir J, 2020, 55(6): 2000351. DOI:10.1183/13993003.00351-2020 |
| [11] |
中国防痨协会. 非活动性肺结核诊断及预防发病专家共识[J]. 结核与肺部疾病杂志, 2021, 2(3): 197-201. Chinese Antituberculosis Association. Expert consensus on dia- gnosis and prevention of inactive pulmonary tuberculosis[J]. Journal of Tuberculosis and Lung Disease, 2021, 2(3): 197-201. |



