2. 德州市妇幼保健院医院感染管理科, 山东 德州 253015;
3. 南昌大学第一附属医院感染控制处, 江西 南昌 330006;
4. 六安市中医院医院感染管理办公室, 安徽 六安 237000;
5. 楚雄彝族自治州妇幼保健院感控科, 云南 楚雄 675000
2. Department of Healthcare-associated Infection Ma-nagement, Maternity and Child Care Center of Dezhou, Dezhou 253015, China;
3. Department of Healthcare-associated Infection Control, The First Affiliated Hospital of Nanchang University, Nanchang 330006, China;
4. Department of Healthcare-associated Infection Management, Traditional Chinese Hospital of Luan, Luan 237000, China;
5. Department of Healthcare-associated Infection Control, Chuxiong Yi Autonomous Prefecture Maternal and Child Health Care Hospital, Chuxiong 675000, China
医疗机构中污染的环境物体表面和医务人员手是致病菌传播的重要媒介,也是多重耐药菌传播、医院感染暴发的重要诱因及隐患[1-2]。对医疗机构物体表面和医务人员手等进行的卫生学评价中,细菌污染监测是常规监测项目,采样方法的优劣直接影响到检测结果。目前,最准确的评价方法是细菌定量检测即活菌计数法,为了有效评价环境表面污染程度,采用既灵敏又有效的采样方法至关重要。
传统的环境物体表面菌落总数采样方法为棉拭子涂抹法[3]。近年来,新的医院感染监测方法不断出现[4-5],为了选择更合适的环境物体表面监测方法,2020年11月1—30日我们对三磷酸腺苷(ATP)生物荧光法、棉拭子涂抹法、载体压印法及滤膜法4种采样方法进行对比研究,为不同物体表面选择方法简便、结果可靠、价格较低的环境物体表面监测方法提供依据。现报告如下。
1 材料与方法 1.1 材料与仪器SystemSURE Plus型手持式ATP生物荧光检测仪及配套的试剂与采样拭子,PT/SFM-3C型全自动抽滤机(孔径0.45 μm)、一次性使用无菌拭子、一次性使用无菌规格板由重庆庞通医疗器械有限公司生产提供,梅里埃Densichek plus电子比浊仪,普通营养琼脂培养基及培养器材,一次性无菌接种环,灭菌不锈钢板,灭菌无纺布,灭菌无尘吸水纸,试验目标细菌为腐生葡萄球菌标准菌株ATCC 49453。
1.2 研究方法 1.2.1 表面染菌制作菌悬液:按照《全国临床检验操作规程(第3版)》操作,将腐生葡萄球菌标准菌株(ATCC 49453)接种到血琼脂平板,质谱鉴定验证无杂菌污染,将目标菌株增菌培养,用电子比浊仪制备成0.5麦氏单位的菌悬液(1.5×108 CFU/mL),用生理盐水分别稀释成含菌量为105、106、107 CFU/mL菌悬液。灭菌不锈钢板染菌:将灭菌无尘吸水纸浸于不同浓度菌液中,确保完全浸湿,取出后稍拧干,在灭菌不锈钢板表面均匀涂抹,确保不锈钢板表面染菌均匀,将钢板置于超净工作台内干燥。灭菌无纺布染菌:将灭菌后无纺布浸于不同浓度菌液中,确保充分浸湿,取出后拧干,置于超净工作台内干燥。
1.2.2 采样方法将灭菌不锈钢板、无纺布染菌后,在同一不锈钢板、无纺布表面同时用棉拭子涂抹法、滤膜法、载体压印法及ATP生物荧光法进行采样,确保检测结果的可比性。棉拭子涂抹法:用5 cm×5 cm一次性使用无菌规格板放在被检物体表面,用浸有生理盐水的棉拭子1支,在规格板内横竖往返各涂抹5次,并随之转动棉拭子,连续采样2个规格板面积,采样面积为50 cm2,将采样的棉拭头以无菌方式剪入含5 mL生理盐水的试管内待检。载体压印法:打开平皿盖,将琼脂平板反扣于物体表面,勿再移动,按压10 s采样,力度以3~5 N为宜,确保将琼脂与采样表面充分接触,然后盖上平皿盖,每个载片采样面积为25 cm2,连续采集2个载片,采样面积为50 cm2,采样后送细菌培养。ATP生物荧光法:检测仪器为System SURE Plus手持式ATP荧光检测仪及其拭子,使用ATP荧光仪专用无菌棉拭子沾湿含荧光素酶的采样液(为仪器配套专用),将5 cm×5 cm一次性使用无菌规格板放在被检物体表面,在规格板内横竖往返各涂抹5次,并随之转动棉拭子进行采样,连续采集2个载片,采样面积为50 cm2。采样后将采样棒在管内折断,然后震荡使荧光素酶液充分浸湿棒头,将检测管插入手持式ATP生物荧光检测仪进行检测,15 s内读取数据,结果以相对发光单位值(RLU)表示。每组试验重复10次,样本量均为10。
1.3 培养及检测方法棉拭子涂抹法:将采样液用漩涡振荡器充分振荡,取0.5 mL接种于普通营养琼脂平皿(Φ9 cm),于(36±1)℃培养48 h后菌落计数。菌落总数(CFU/cm2)=平板菌落数×稀释倍数/采样面积,计算总菌落数。滤膜法:将涂抹法用后剩余采样液在无菌条件下采用滤膜(0.45 μm)过滤浓缩,将滤膜贴在普通营养琼脂平皿(Φ9 cm)上,置(36±1)℃温箱培养48 h后菌落计数。当滤膜上的菌落可计数时:菌落总数(CFU/cm2)=(平皿菌落数+滤膜上菌落数)/采样面积;当滤膜上的菌落不可计数时,菌落总数(CFU/cm2)=平皿菌落数×稀释倍数/采样面积。载体压印法:采样完成后,将平皿置于(36±1)℃培养48 h进行活菌计数,计算采样细菌总数(CFU/cm2)。ATP生物荧光法:采样后将采样棒置于检测仪器中,读取RLU数值。
1.4 结果评价比较棉拭子涂抹法、载体压印法、滤膜法的细菌总数;比较4种采样方法的合格率(%),物体表面细菌菌落总数≤10 CFU/cm2为合格,ATP荧光法检测的RLU值<30为合格;将常规细菌定量检测法的细菌总数和ATP荧光法检测的RLU数值的相关性进行分析。
1.5 统计学方法应用SPSS 18.0进行统计分析,计数资料以n或%表示,组间比较采用χ2检验Fisher's确切概率法;计量资料以x ±s表示,组间比较采用方差分析,组间两两比较采用LSD法,相关性分析采用Pearson直线相关分析,P≤0.05为差异有统计学意义。
2 结果 2.1 物体表面不同染菌浓度下菌落计数比较试验结果显示,不同污染浓度下,不锈钢板和无纺布均是载体压印法检出菌落数最高,其次为滤膜法,棉拭子涂抹法检出菌落数最低。染菌浓度为105 CFU/mL时,对不锈钢表面采样,载体压印法菌落总数高于滤膜法和棉拭子涂抹法,差异有统计学意义(P<0.05);对无纺布表面采样,载体压印法检出菌落总数高于棉拭子涂抹法(P<0.05)。染菌浓度为106 CFU/mL时,对不锈钢板表面采样,三者菌落检出数比较,差异无统计学意义(P>0.05);对无纺布表面进行采样,载体压印法检出菌落总数高于滤膜法和棉拭子涂抹法(P<0.05)。染菌浓度为107 CFU/mL时,对不锈钢表面和无纺布表面采样均只有棉拭子涂抹法可以进行菌落计数,滤膜法与载体压印法均无法计数。见表 1。
| 表 1 不同采样方法检测不同浓度染菌物体表面的菌落总数比较 Table 1 Comparison of different sampling methods for detecting the total number of colonies on object surface contaminated by different concentrations of bacteria |
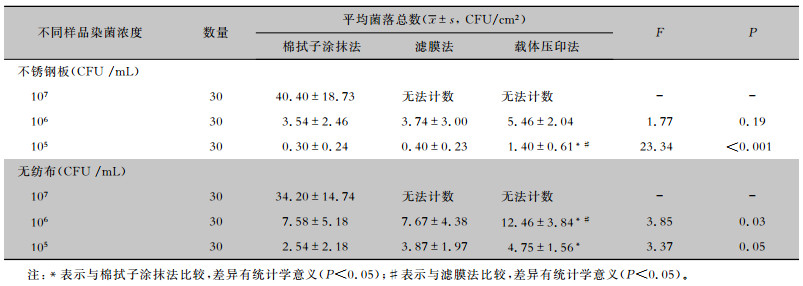
|
对不锈钢板采样,染菌浓度为105 CFU/mL时,4种采样方法检测的合格率均为100%;染菌浓度为106 CFU/mL时,4种采样方法检测的合格率比较,差异无统计学意义(P>0.05);染菌浓度为107 CFU/mL时,ATP生物荧光法出现假阴性结果。对无纺布表面采样,染菌浓度为105 CFU/mL时,4种采样方法检测的合格率均为100%;染菌浓度为107 CFU/mL时,4种采样方法检测的合格率均为0;染菌浓度为106 CFU/mL时,棉拭子涂抹法、滤膜法、ATP生物荧光法检测合格率比较,差异有统计学意义(P<0.05),载体压印法合格率低于滤膜法、棉拭子涂抹法和ATP生物荧光法,差异有统计学意义(P<0.05),载体压印法检测合格率最低,ATP生物荧光法检测合格率最高,载体压印法较其他方法更灵敏。见表 2。
| 表 2 4种采样方法检测不同染菌浓度物体表面的合格率比较 Table 2 Comparison of four sampling methods for detecting the qualified rates of object surfaces contaminated by different concentrations of bacteria |
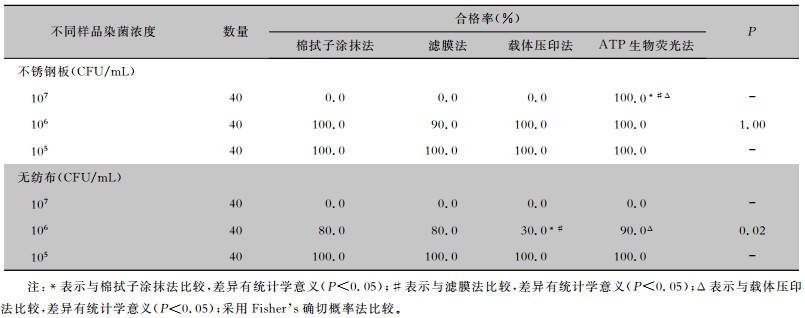
|
将不同采样方法检测的细菌总数和ATP荧光法检测的RLU数值进行相关性分析。分析结果表明,在染菌浓度为107 CFU/mL时,棉拭子涂抹法与ATP生物荧光法对无纺布表面采样检测结果的Pearson相关系数为0.838(P=0.002),两种采样方法的检测结果具有良好的相关性。见图 1。
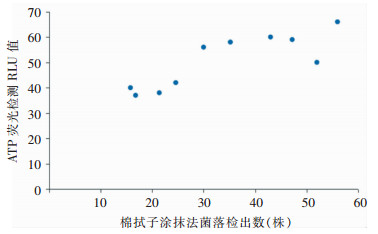 |
| 图 1 棉拭子涂抹法和ATP生物荧光法检测结果数据图 Figure 1 Data chart of detection results of cotton swab smearing method and ATP biofluorescence method |
根据中华人民共和国药典微生物限度检测[6],常用的细菌接种方法为倾注法、涂抹法以及滤膜法。传统棉拭子涂抹法操作繁琐,步骤较多,检测周期长,读取培养结果进行菌落计数的方法不够直观精细。ATP生物荧光检测仪利用“荧光素酶—荧光素体系”快速检测ATP,利用ATP含量的多少推断出菌落总数含量,具有快速、高效、灵敏度高等特点,越来越受到国内外医疗机构的关注[7]。近年来,载体压印法也受到越来越多监督人员的青睐,载体压印法是将含有营养琼脂的培养基直接按压于采样物体表面,按压数秒即完成采样[8],简单方便易于操作,取样后可直接培养,平板自带格子线方便菌落计数,大大缩短检测时间。滤膜法最早由Taylor等[9]提出,采用滤膜过滤器将样品中细菌截留在滤膜上,然后将滤膜贴于培养基上进行培养,检测结果较平皿法更准确、可靠,适用于低浓度液体标本的培养,能提高细菌检出率。
本研究对4种采样方法进行比较,结果显示,不同污染浓度下,不锈钢板和无纺布均是载体压印法检出菌落数最高,其次为滤膜法,棉拭子涂抹法菌落数检出最低。与Claro等[10]报道的平皿接触在棉垫、聚丙烯和不锈钢制品表面采集艰难梭菌的采样率明显高于植绒尼龙拭子和普通棉拭子的检出率结果相符。当不锈钢板染菌量适中时,棉拭子涂抹法和载体压印法的菌落检出数基本一致,与李晔等[11]的研究结果相似。当无纺布染菌量适中时,载体压印法对腐生葡萄球菌的细菌检测灵敏度高于棉拭子涂抹法、滤膜法及ATP生物荧光法,与Obee等[12]的研究结果一致。载体压印法使用方便,采样和培养方法较棉拭子涂抹法和滤膜法简单,菌落检出数及灵敏度高于其他采样方法,因此可以用于医疗机构环境物体表面和手表面的快速监测。但是载体压印法所用载片采样面积相对较小,会出现漏检现象,因此,在实际监测过程中可以适当增加采样数量以提高检出率。但是,当采样表面不平整时应使用棉拭子涂抹法代替载体压印法。
利用ATP生物荧光法快速检测物体表面菌落数时容易出现假阴性结果。说明ATP生物荧光检测法需要一定的样本浓度,样本量过低会影响检测的准确性[13]。邢书霞等[14-15]研究中证明ATP生物荧光法与传统细菌平板培养法对清洁物品微生物污染的检测具有良好的相关性。本文研究结果发现染菌浓度为107 CFU /mL时ATP生物荧光法与棉拭子涂抹法对人工污染的无纺布表面检测结果具有良好的相关性,但由于ATP生物荧光法检测灵敏度低,检测结果与采样方式、监测环境等有关,因此,在实际应用中还有一定的挑战。本研究的局限性在于无法保证不同不锈钢板或无纺布表面染菌浓度完全相同,因此,不同批次之间检测结果会有差异。
医院的工作环境是医务人员需要经常接触的地方,由于无自净能力,极易受到病原微生物的污染,对患者健康构成重大威胁[16]。医院微生物学检测工作者应对细菌的种类、数量进行及时、准确的检测,并及时将检测结果反馈至临床,可以更好的指导临床做好消毒灭菌工作,从而减少医院感染的发生。
| [1] |
Weber DJ, Rutala WA, Miller MB, et al. Role of hospital surfaces in the transmission of emerging health care-associated pathogens: norovirus, Clostridium difficile, and Acinetobacter species[J]. Am J Infect Control, 2010, 38(5 Suppl 1): S25-S33. |
| [2] |
谷继荣. 环境及物体表面消毒在预防和控制医院感染中的作用[J]. 中国感染控制杂志, 2012, 11(3): 231-235. Gu JR. The benefits of surface disinfection in prevention and control of healthcare associated infection[J]. Chinese Journal of Infection Control, 2012, 11(3): 231-235. DOI:10.3969/j.issn.1671-9638.2012.03.022 |
| [3] |
申桂娟, 王李华, 祝进, 等. ICU物体表面的消毒效果监测[J]. 中华医院感染学杂志, 2015, 25(3): 710-712. Shen GJ, Wang LH, Zhu J, et al. Monitoring the effect of surface disinfection on frequently touched objects in ICU[J]. Chinese Journal of Nosocomiology, 2015, 25(3): 710-712. |
| [4] |
张平, 丁丽丽, 喻玲丽, 等. 重症监护科室高频接触物体表面清洁消毒监测及干预效果[J]. 中国消毒学杂志, 2015, 32(12): 1258-1259. Zhang P, Ding LL, Yu LL, et al. Monitoring and intervention effects of cleaning and disinfection of high-frequency contact surfaces in the intensive care unit[J]. Chinese Journal of Di-sinfection, 2015, 32(12): 1258-1259. |
| [5] |
黄茜莎, 刘波, 张翔, 等. 滤膜法与涂抹法检测内镜清洗消毒效果及成本比较[J]. 中国感染控制杂志, 2019, 18(6): 571-576. Huang QS, Liu B, Zhang X, et al. Comparison in detection efficacy and cost of endoscope cleaning and disinfection between membrane filtration method and smear method[J]. Chinese Journal of Infection Control, 2019, 18(6): 571-576. |
| [6] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Medical Science and Technology Press, 2015. |
| [7] |
唐毅, 糜琛蓉, 何景雄, 等. ATP检测系统在临床清洁消毒效果评价中的应用[J]. 中华医院感染学杂志, 2011, 21(12): 2523-2525. Tang Y, Mi CR, He JX, et al. Application of ATP detection system in evaluation of effect of clinical clea-ning and disinfection[J]. Chinese Journal of Nosocomiology, 2011, 21(12): 2523-2525. |
| [8] |
彭少杰, 李洁, 张磊, 等. Hygicult载片培养法快速检测表面大肠菌群的效果评价[J]. 中国食品卫生杂志, 2006, 18(2): 119-122. Peng SJ, Li J, Zhang L, et al. Evaluation of hygicult CF dipslides method in rapid examination of coliform on surfaces in food production areas[J]. Chinese Journal of Food Hygiene, 2006, 18(2): 119-122. DOI:10.3969/j.issn.1004-8456.2006.02.008 |
| [9] |
Taylor RH, Geldreich EE. A new membrane filter procedure for bacterial counts in potable water and swimming pool samples[J]. J Am Water Works Assoc, 1979, 71(7): 402-405. DOI:10.1002/j.1551-8833.1979.tb04382.x |
| [10] |
Claro T, Daniels S, Humphreys H. Detecting Clostridium difficile spores from inanimate surfaces of the hospital environment: which method is best?[J]. J Clin Microbiol, 2014, 52(9): 3426-3428. DOI:10.1128/JCM.01011-14 |
| [11] |
李晔, 陆烨, 蔡冉, 等. 载体压印法对医疗机构环境和手表面细菌采样效果研究[J]. 中国消毒学杂志, 2019, 36(8): 561-563, 567. Li Y, Lu Y, Cai R, et al. Study on bacterial sampling effect of dipslides on environment and hand surfaces in medical institutions[J]. Chinese Journal of Disinfection, 2019, 36(8): 561-563, 567. |
| [12] |
Obee P, Griffith CJ, Cooper RA, et al. An evaluation of different methods for the recovery of meticillin-resistant Staphylococcus aureus from environmental surfaces[J]. J Hosp Infect, 2007, 65(1): 35-41. DOI:10.1016/j.jhin.2006.09.010 |
| [13] |
胡凌飞, 李娜, 张柯, 等. ATP生物荧光法检测空气中细菌浓度的研究[J]. 中国消毒学杂志, 2020, 37(7): 491-495. Hu LF, Li N, Zhang K, et al. Determination of microbial aerosol concentration by ATP biofluorescence method[J]. Chinese Journal of Disinfection, 2020, 37(7): 491-495. |
| [14] |
邢书霞, 马玲, 王志, 等. ATP生物荧光法评价医疗器械清洗质量[J]. 中国消毒学杂志, 2008, 25(3): 245-248. Xing SX, Ma L, Wang Z, et al. Study on ATP biolum inescence assay for evaluating bacterial residues on medical instruments after cleaning[J]. Chinese Journal of Disinfection, 2008, 25(3): 245-248. DOI:10.3969/j.issn.1001-7658.2008.03.006 |
| [15] |
邢书霞, 张流波. 医疗器械的清洗及清洗效果评价方法[J]. 中国消毒学杂志, 2009, 26(5): 546-547. Xing SX, Zhang LB. Cleaning of medical equipment and evaluation method of cleaning effect[J]. Chinese Journal of Disinfection, 2009, 26(5): 546-547. |
| [16] |
Andersson P, Beckingham W, Gorrie CL, et al. Vancomycin-resistant Enterococcus (VRE) outbreak in a neonatal intensive care unit and special care nursery at a tertiary-care hospital in Australia-a retrospective case-control study[J]. Infect Control Hosp Epidemiol, 2019, 40(5): 551-558. DOI:10.1017/ice.2019.41 |



