2. 首都医科大学附属北京朝阳医院儿科, 北京 100043;
3. 华中科技大学同济医学院附属武汉儿童医院急诊科, 湖北 武汉 430000;
4. 国家儿童医学中心 首都医科大学附属北京儿童医院 北京市儿科研究所微生物研究室, 北京 100045;
5. 上海复旦大学附属儿童医院细菌实验室, 上海 201102
2. Department of Pediatrics, Beijing Chaoyang Hospital, Capital Medical University, Beijing 100043, China;
3. Department of Emergency, Wuhan Children's Hospital, Tongji Medical College, Huazhong University of Science&Technology, Wuhan 430000, China;
4. Microbiology Laboratory, Beijing Pediatric Research Institute, Beijing Children's Hospital, Capital Medical University, National Center for Children's Health, Beijing 100045, China;
5. Department of Bacteria Laboratory, Shanghai Children's Hospital Affiliated to Fudan University, Shanghai 201102, China
A族链球菌(group A Streptococcus, GAS)又称为酿脓链球菌或化脓性链球菌,作为一种重要的人类病原体,在世界范围内广泛分布,与多种疾病有关,如咽扁桃体炎、败血症、坏死性筋膜炎、蜂窝织炎、脑膜炎、链球菌感染后肾小球肾炎和风湿性心脏病等多种疾病[1]。上呼吸道黏膜和皮肤上皮是GAS的主要定植区域[2]。我国乙类法定传染病—猩红热即是由GAS引起的5~15岁儿童常见的急性呼吸道传染病,临床上以发热、咽峡炎及皮疹为典型症状,严重者可引起链球菌中毒休克综合征(STSS)等侵袭性感染,甚至死亡[3-4]。近些年,猩红热在世界范围内卷土重来[5-8],加之仍无可上市使用的疫苗,已引起国内外学者的关注。而猩红热“再现”的原因尚未完全明确,推测与GAS遗传变异,产生新的感染性更强、致病力更高的GAS菌株或克隆群有关[9]。分型是微生物流行病学研究的重要方法。毒力因子在微生物致病性中起着关键作用[10]。超抗原是由GAS合成分泌的细胞外毒力因子蛋白,可诱导多种细胞因子释放和免疫反应,从而引发严重的临床症状[11]。GAS毒力因子分布与其emm基因分型和流行的地域之间存在密切的关系[12-13],但国内尚未充分重视菌株流行地域对GAS毒力因子和emm基因型分布的影响。本研究分析北京和上海两地区猩红热患儿所携带的emm1.0型和emm12.0型GAS菌株超抗原基因分布、emm分型及其流行地域,比较超抗原、emm分型与地域之间的关系,为指导GAS疾病尤其是猩红热的防控提供理论依据。
1 材料与方法 1.1 菌株来源GAS菌株分离自2007年在北京和上海两所儿童专科医院门诊就诊的猩红热患儿咽拭子标本,标本采集后常温下2 h内送至微生物研究室。本研究纳入的猩红热患儿均无猩红热相关的严重并发症及死亡情况。
1.2 菌株分离与鉴定咽拭子标本采集后常温下2 h内送至微生物研究室,微生物研究室收到咽拭子标本后立即接种于含5%脱纤维羊血的胰酶琼脂(TRYPTIC SOY AGAR, TSA)平皿上,于含5%CO2的恒温孵育箱中37℃条件下孵育18~24 h。根据TSA血平皿中菌落的形态及β溶血环对标本初筛,应用英国OXOID公司的链球菌分群诊断试剂盒进行GAS菌株鉴定。经分离与鉴定后的GAS菌株收集到冻存管中冻存备用。
1.3 DNA提取按照北京生工生物工程公司DNA提取试剂盒说明书操作。
1.4 emm基因分型采用美国疾病控制与预防中心(CDC)(https://www2a.cdc.gov/ncidod/biotech/strepblast.asp)的方法,对GAS分离株进行emm分型检测。将扩增合格的产物送至华大基因进行一代测序。将获得的5’端可变区序列上传至CDC数据库(https://www2.cdc.gov/vaccines/biotech/strepblast.asp),进行emm基因序列同源性比较,确定emm基因分型。
1.5 种毒力基因检测通过聚合酶链式反应(Polymerase chain reaction,PCR)扩增11种超抗原(speA、speC、speG、speH、speI、speJ、speK、speL、speM、ssa和smeZ),以及2种既往被误认为超抗原,目前常常和超抗原一起被研究的毒力因子蛋白—链球菌半胱氨酸蛋白酶(streptococcal cysteine proteinase, speB)和有丝分裂因子(mitogenic factor, speF)基因。PCR反应混合物体系(25 μL)包含20 mmol DNA模板1 μL,10 mmol上、下游引物各1 μL(由广州生工生物技术有限公司合成),12.5 μL的Taq PCR Mix和9.5 μL双蒸水。扩增反应:94℃预变性1 min,94℃变性1 min,退火30 s(温度为每个引物相应的退火温度),72℃延伸30 s,共30个循环,最后72℃延伸5 min。毒力因子基因的引物序列参照文献报道[14]。取PCR扩增后产物5 μL,并在含有GoldView核酸染色剂(购自广州生工生物技术有限公司)的1.5%琼脂糖凝胶上,0.5×TAE缓冲液中,120 V条件下进行电泳分离30 min,然后进行可视化和图像采集。
1.6 统计学处理应用SPSS 22.0软件对数据进行Mann-Whitney U test统计分析,以P≤0.05为差异有统计学意义。
2 结果 2.1 一般情况对114株GAS菌株进行emm分型,其中emm1.0型60株,emm12.0型54株;52株分离自北京(emm1.0型31株,emm12.0型21株),62株分离自上海(emm1.0型29株,emm12.0型33株)。GAS菌株speA、speC、speG、speH、speI、speJ、speK、ssa和smeZ超抗原基因携带率分别为52.6%、76.3%、80.7%、43.9%、55.3%、57.0%、75.4%、97.4%、93.0%,speB和speF超抗原基因携带率均为98.2%,未检出speL、speM超抗原基因。见表 1。
| 表 1 北京和上海地区不同emm型GAS菌株超抗原基因携带情况[株(%)] Table 1 Carrying status of superantigen genes of different emm GAS strains isolated from Beijing and Shanghai (No. of islolates[%]) |
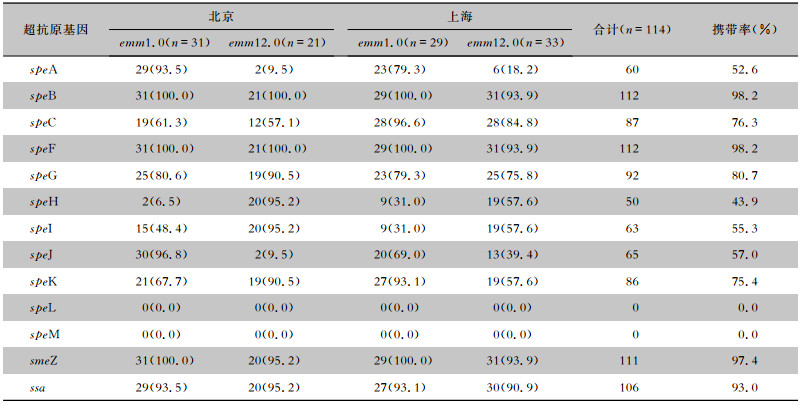
|
北京地区:emm1.0型、emm12.0型GAS菌株4种(speA、speH、speI和speJ)超抗原基因携带率各组比较,差异均有统计学意义(均P<0.05),其他毒力基因比较均未见统计学差异(均P>0.05);上海地区:emm1.0型、emm12.0型GAS菌株5种(speA、speH、speI、speJ和speK)超抗原基因携带率各组比较,差异均有统计学意义(均P<0.05),其他毒力基因比较,均未见明显统计学差异(均P>0.05)。见表 2。
| 表 2 北京、上海地区不同emm型GAS菌株超抗原基因携带情况比较 Table 2 Comparison of carrying status of superantigen genes of different emm GAS strains from Beijing and Shanghai |
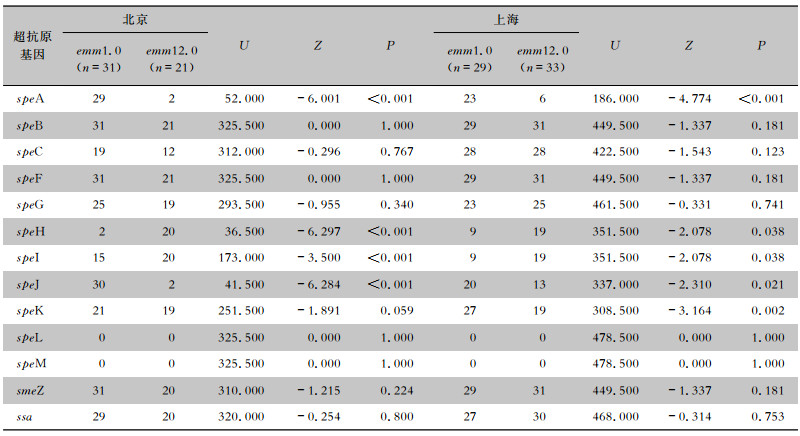
|
北京与上海来源的emm1.0型GAS菌株speC、speH、speJ和speK超抗原基因携带率比较,差异均有统计学意义(均P<0.05);北京与上海来源的emm12.0型GAS菌株speC、speH、speI、speJ和speK超抗原基因携带率比较,差异均有统计学意义(均P<0.05)。见表 3。
| 表 3 emm1.0、emm12.0型GAS菌株不同地区超抗原基因携带情况比较 Table 3 Comparison of carrying status of superantigen genes between emm1.0 strains and emm12.0 GAS strains from diffe-rent regions |
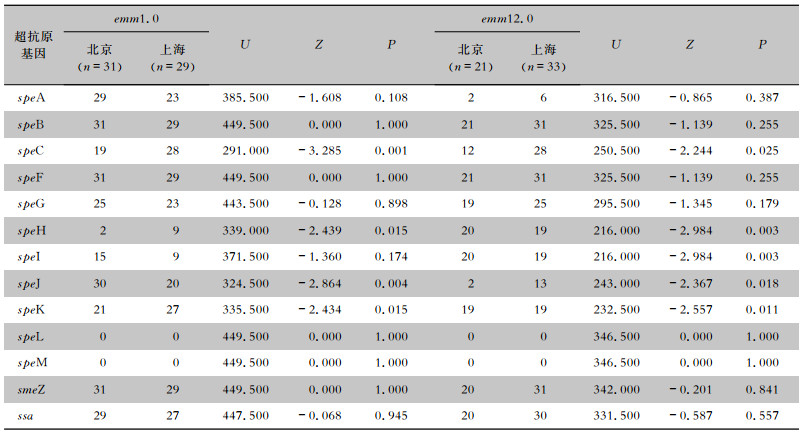
|
GAS可引起多种临床表现,从轻度局部感染到危及生命的侵袭性感染,对公共卫生产生重大影响。GAS感染是儿童患病和死亡的主要原因[15]。2011年在中国香港暴发的猩红热事件中,多例患儿出现STSS、败血症、咽后壁脓肿等并发症,且有2例并发STSS患儿死亡[3]。儿童猩红热为GAS所致疾病中最常见的病种之一,具有传染性,易引起暴发流行,且接触过猩红热患者的家庭成员患侵袭性GAS感染的风险增加[4]。在过去的十余年中,猩红热在亚洲、欧洲多个国家出现严峻的“再现”现象[5-7],已引起国内外学者的关注。中国GAS的整体流行趋势和欧美国家一致,2008—2017年中国6 ~ 22岁群体患猩红热病例数翻了一番[16],但在分析中国研究数据时应考虑地域因素,中国幅员辽阔,拥有34个省级行政区,猩红热发病率的区域性数据与整体数据之间会略有差异,如2011—2015年上海地区猩红热年发病率为7.5~19.4/10万人口[17],远高于2011—2016年全国平均水平(4.1/10万)[18]。猩红热是细菌感染性疾病研究的热点课题,关注、研究和防控儿童感染GAS导致的猩红热成为降低儿童感染性疾病发生、发展及降低儿童死亡率的重点。
GAS作为具有全球重要性的人类特异性细菌病原体,具有多种分型方法,可以分泌多种毒力因子。emm基因分型是目前全世界公认的GAS分型的现代分子方法,是基于对指示M血清型的emm基因进行的序列分析。不同年代及地区流行的GAS有不同的emm型别。本团队前期研究结果显示,1993—1994年中国大陆流行的GAS型别依次为M3.1、M1、M4和M12,2005—2006年M12和M1成为最流行型别[19]。本研究数据显示,虽然emm1型和emm12型是2007年北京和上海两地区导致儿童猩红热的主要GAS菌株克隆群,但北京地区以emm1型位居首位,上海地区则是emm12型。在2011年猩红热暴发期间,北京地区流行的首位GAS菌株emm型别却为emm12型(76.4%)[20]。且自2012年开始,北京地区emm1型GAS菌株数量开始上升,并于2013—2014年超过emm12型,再次成为北京地区首位GAS菌株流行克隆群,直至2018年[21]。自2011年开始,上海地区导致15岁以下儿童发生猩红热的emm1型GAS分离株数量呈上升趋势,在2014年达到顶峰,于2015年趋于下降,但最终没能超越emm12型成为上海首位流行克隆群[17]。2011—2018年国家疾病预防控制中心整体数据显示,emm12型是我国猩红热流行的主要型别[22-23]。上述数据证实,GAS流行emm型别具有时间和地域的差异性,北京地区GAS菌株的emm型别波动性高于上海地区。
链球菌毒力因子在GAS感染的发病机制中起关键作用。目前常见的链球菌毒力因子包括11种高效促细胞分裂原(speA、C、G、H、I、J、K、L、M、smeZ和ssa)和两种蛋白质(speB[24]和speF[25])。超抗原基因的分布在不同emm基因分型之间存在很大差异[12, 26]。本研究结果显示,在emm1.0型和emm12.0型GAS菌株之间,无论是北京地区,还是上海地区,speA、speH、speI和speJ的携带率比较差异均有统计学意义(均P<0.05)。本研究中北京地区GAS菌株的分析结果与2012—2013年[27]及2015—2017年[28]北京地区GAS菌株超抗原的携带特点一致,但上海地区GAS菌株的分析结果与同期北京地区GAS菌株超抗原的携带特点存在差别,也不同于2012—2016年天津地区GAS菌株超抗原的携带特点[29],GAS菌株获取年代、地域也可能影响其超抗原基因的分布。
GAS超抗原基因的分布不仅与其克隆流行的地域密切相关,还与疾病种类密切相关[30]。本次猩红热单病种(为排除疾病病种因素对结论的影响)两地区研究结果表明,北京与上海GAS菌株之间,emm1.0型菌株中speC、speH、speJ和speK携带率比较差异有统计学意义,但在emm12.0型GAS菌株中,此种差异发生在speC、speH、speI、speJ和speK基因中。在emm1.0与emm12.0型GAS菌株之间,北京地区GAS菌株speA、speH、speI和speJ携带率比较差异有统计学意义,而上海地区GAS菌株speA、speH、speI、speJ和speK携带率比较则差异无统计学意义,说明不同地理位置GAS毒力基因分布存在差异。
本文不足之处在于,既往研究表明时间迁移可影响GAS毒力因子的分布。本研究未对两地区GAS菌株进行连续动态监测,未能体现时间对毒力特征的影响。
综上所述,本研究发现不同地域及emm基因型GAS菌株毒力因子基因分布状态存在差异,此结论对猩红热的防控及疫苗的研制有一定的理论指导意义。
致谢: 感谢上海复旦大学附属儿童医院王艺教授对本研究所作出的贡献。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Chaudhary P, Kumar R, Sagar V, et al. Assessment of Cpa, Scl1 and Scl2 in clinical group A Streptococcus isolates and patients from north India: an evaluation of the host pathogen interaction[J]. Res Microbiol, 2018, 169(1): 11-19. DOI:10.1016/j.resmic.2017.09.002 |
| [2] |
Rouchon CN, Ly AT, Noto JP, et al. Incremental contributions of FbaA and other impetigo-associated surface proteins to fitness and virulence of a classical group a streptococcal skin strain[J]. Infect Immun, 2017, 85(11): e00374-17. |
| [3] |
Luk EYY, Lo JYC, Li AZL, et al. Scarlet fever epidemic, Hong Kong, 2011[J]. Emerg Infect Dis, 2012, 18(10): 1658-1661. DOI:10.3201/eid1810.111900 |
| [4] |
Watts V, Balasegaram S, Brown CS, et al. Increased risk for invasive group A Streptococcus disease for household contacts of scarlet fever cases, England, 2011-2016[J]. Emerg Infect Dis, 2019, 25(3): 529-537. DOI:10.3201/eid2503.181518 |
| [5] |
Liu YH, Chan TC, Yap LW, et al. Resurgence of scarlet fever in China: a 13-year population-based surveillance study[J]. Lancet Infect Dis, 2018, 18(8): 903-912. DOI:10.1016/S1473-3099(18)30231-7 |
| [6] |
Lamagni T, Guy R, Chand M, et al. Resurgence of scarlet fever in England, 2014-16: a population-based surveillance study[J]. Lancet Infect Dis, 2018, 18(2): 180-187. DOI:10.1016/S1473-3099(17)30693-X |
| [7] |
Brockmann SO, Eichner L, Eichner M. Constantly high incidence of scarlet fever in Germany[J]. Lancet Infect Dis, 2018, 18(5): 499-500. |
| [8] |
沈艳, 邱海岩, 陈海明, 等. 2005—2018年张家港市猩红热流行特征及趋势预测[J]. 中国感染控制杂志, 2020, 19(9): 791-797. Shen Y, Qiu HY, Chen HM, et al. Epidemiological characteristics and trend prediction of scarlet fever in Zhangjiagang city from 2005 to 2018[J]. Chinese Journal of Infection Control, 2020, 19(9): 791-797. |
| [9] |
Barnett TC, Bowen AC, Carapetis JR. The fall and rise of group A Streptococcus diseases[J]. Epidemiol Infect, 2018, 147: e4. |
| [10] |
Kozińska A, Sitkiewicz I. Detection of Streptococcus pyogenes virulence factors[J]. Methods Mol Biol, 2020, 2136: 3-16. |
| [11] |
Shannon BA, McCormick JK, Schlievert PM. Toxins and superantigens of group A Streptococci[J]. Microbiol Spectr, 2019, 7(1): 1-15. |
| [12] |
Gergova R, Muhtarova A, Mitov I, et al. Relation between emm types and virulence gene profiles among Bulgarian Streptococcus pyogenes clinical isolates[J]. Infect Dis, 2019, 51(9): 668-675. DOI:10.1080/23744235.2019.1638964 |
| [13] |
Berman HF, Tartof SY, Reis JN, et al. Distribution of superantigens in group A streptococcal isolates from Salvador, Brazil[J]. BMC Infect Dis, 2014, 14: 294. DOI:10.1186/1471-2334-14-294 |
| [14] |
Rivera A, Rebollo M, Miró E, et al. Superantigen gene profile, emm type and antibiotic resistance genes among group A streptococcal isolates from Barcelona, Spain[J]. J Med Microbiol, 2006, 55(Pt 8): 1115-1123. |
| [15] |
Walker MJ, Barnett TC, McArthur JD, et al. Disease manifestations and pathogenic mechanisms of group A Streptococcus[J]. Clin Microbiol Rev, 2014, 27(2): 264-301. DOI:10.1128/CMR.00101-13 |
| [16] |
Dong YH, Wang LP, Burgner DP, et al. Infectious diseases in children and adolescents in China: analysis of national surveillance data from 2008 to 2017[J]. BMJ, 2020, 369: m1043. |
| [17] |
Chen ML, Cai JH, Davies MR, et al. Increase of emm1 isolates among group A Streptococcus strains causing scarlet fever in Shanghai, China[J]. Int J Infect Dis, 2020, 98: 305-314. DOI:10.1016/j.ijid.2020.06.053 |
| [18] |
You YH, Davies MR, Protani M, et al. Scarlet fever epidemic in China caused by Streptococcus pyogenes serotype M12: epidemiologic and molecular analysis[J]. EBioMedicine, 2018, 28: 128-135. DOI:10.1016/j.ebiom.2018.01.010 |
| [19] |
Yu DL, Liang YM, Ma YL, et al. Changes in M types of Streptococcus pyogenes in Chinese children with scarlet fever[J]. Lancet Infect Dis, 2020, 20(7): 780. DOI:10.1016/S1473-3099(20)30441-2 |
| [20] |
Yang P, Peng XM, Zhang DT, et al. Characteristics of group A Streptococcus strains circulating during scarlet fever epide-mic, Beijing, China, 2011[J]. Emerg Infect Dis, 2013, 19(6): 909-915. DOI:10.3201/eid1906.121020 |
| [21] |
You YH, Peng XM, Yang P, et al. 8-year M type surveillance of Streptococcus pyogenes in China[J]. Lancet Infect Dis, 2020, 20(1): 24-25. |
| [22] |
You YH, Qin Y, Walker MJ, et al. Increased incidence of scarlet fever-China, 1999-2018[J]. China CDC Wkly, 2019, 1(5): 63-66. DOI:10.46234/ccdcw2019.019 |
| [23] |
You YH, Song YY, Yan XM, et al. Molecular epidemiological characteristics of Streptococcus pyogenes strains involved in an outbreak of scarlet fever in China, 2011[J]. Biomed Environ Sci, 2013, 26(11): 877-885. |
| [24] |
张波, 李学如, 江南屏, 等. 链球菌致热外毒素SpeB致病性研究进展[J]. 中国感染控制杂志, 2012, 11(4): 316-318. Zhang B, Li XR, Jiang NP, et al. Advances in pathogenesis of streptococcal exotoxin B in Streptococcus pyogenes[J]. Chinese Journal of Infection Control, 2012, 11(4): 316-318. DOI:10.3969/j.issn.1671-9638.2012.04.024 |
| [25] |
Ferretti JJ, Stevens DL, Fischetti VA. Streptococcus pyo genes: basic biology to clinical manifestations[M]. Oklahoma City (OK): University of Oklahoma Health Sciences Center, 2016.
|
| [26] |
Abraham T, Sistla S. Decoding the molecular epidemiology of group A Streptococcus-an Indian perspective[J]. J Med Microbiol, 2019, 68(7): 1059-1071. DOI:10.1099/jmm.0.001018 |
| [27] |
吴双胜, 彭晓旻, 马春娜, 等. 北京市猩红热患者A组链球菌M蛋白基因型别与超抗原基因特征的相关性研究[J]. 中华传染病杂志, 2015, 33(10): 611-614. Wu SS, Peng XM, Ma CN, et al. Study on the relationship between M protein gene-types and superantigen genes of group A Streptococcus pyogenes strains isolated from scarlet fever patients in Beijing[J]. Chinese Journal of Infectious Diseases, 2015, 33(10): 611-614. DOI:10.3760/cma.j.issn.1000-6680.2015.10.006 |
| [28] |
马春娜, 彭晓旻, 吴双胜, 等. 北京市2015—2017年猩红热及咽部感染患者A组链球菌超抗原基因特征研究[J]. 中华流行病学杂志, 2018, 39(10): 1375-1380. Ma CN, Peng XM, Wu SS, et al. Study on the super-antigen genes of group A Streptococcus pyogenes strains isolated from patients with scarlet fever and pharyngeal infection, in Beijing, 2015-2017[J]. Chinese Journal of Epidemiology, 2018, 39(10): 1375-1380. DOI:10.3760/cma.j.issn.0254-6450.2018.10.016 |
| [29] |
阴杰莹, 张维, 杨东靖, 等. 2012—2016年天津市猩红热患儿A组链球菌病原学特征分析[J]. 中华预防医学杂志, 2018, 52(10): 1045-1049. Yin JY, Zhang W, Yang DJ, et al. Etiological characteristics of Streptococcus pyogenes isolated from children with scarlet fever in Tianjin from 2012 to 2016[J]. Chinese Journal of Preventive Medicine, 2018, 52(10): 1045-1049. DOI:10.3760/cma.j.issn.0253-9624.2018.10.015 |
| [30] |
Meehan M, Murchan S, Gavin PJ, et al. Epidemiology of an upsurge of invasive group A streptococcal infections in Ireland, 2012-2015[J]. J Infect, 2018, 77(3): 183-190. DOI:10.1016/j.jinf.2018.05.010 |



