2. 徐州医科大学附属医院感染管理科, 江苏 徐州 221000;
3. 徐州医科大学附属医院血液透析中心, 江苏 徐州 221000
2. Department of Healthcare-associated Infection Management, The Affiliated Hospital of Xuzhou Medical University, Xuzhou 221000, China;
3. Center of Hemodialysis, The Affiliated Hospital of Xuzhou Medical University, Xuzhou 221000, China
血液透析是应用最广泛的肾替代治疗方法,随着终末期肾病患者人数的持续增加,血液透析的应用也日益广泛化[1]。但是鉴于血液透析患者的易感性以及门诊的复杂性,门诊血液透析中心成为医院感染防控的重点部门[1-3]。美国疾病控制与预防中心(CDC)为控制血液透析相关感染发生,由美国国家健康照护安全网络(NHSN)对门诊血液透析机构开展血液透析事件(dialysis event, DE)监测,并取得有效成果[4]。而国内相关研究缺乏,且仅依赖人工监测方法[5]。徐州医科大学附属医院顺应信息化发展需求,借鉴美国DE监测方法,开发信息化软件,实现数据信息化处理,并取得相应研究成果[6-7]。但监测过程中发现软件仍存在不足之处,因此依据软件现存缺陷对其进行必要优化,为进一步完善监测体系,本研究基于优化后的软件开展DE监测,以期获取更准确的基线数据并验证优化效果。
1 研究方法 1.1 监测工具 1.1.1 信息化监测软件的建立[7]自2017年起该院感染管理科根据美国NHSN的DE监测定义,基于华墨血液透析管理系统,通过在系统终端“肾病移动工作站”中增加DE调查模块,建立DE信息化监测软件。软件分为平板电脑端及计算机终端,可从医生工作站及肾病移动工作站自动获取需要监测的患者基本信息。护理平板端主要用于数据的录入,以列表形式显示患者的相关信息,每个患者对应有“操作”和“事件”两个模块,点击进入“事件”板块,即可进行数据录入。计算机终端兼有DE统计表和门诊血液透析患者列表,具备数据收集和基础统计、数据导出功能,自定义时间段进行数据自动统计分析并采取多种格式进行结果输出。
1.1.2 软件优化DE信息化监测软件在应用过程中仍存在不足,基于目前存在的问题,联合监测软件的开发公司及医院信息科对软件进行能力范围内的优化升级。优化于2019年上半年完成。见表 1。
| 表 1 软件优化前存在的问题及优化内容 Table 1 Problems before software optimization and optimization contents |

|
根据美国NHSN的DE监测定义[8]并结合国内用药特征,选取2019年8月—2020年7月每月前2个工作日在血液透析中心进行维持性血液透析的门诊患者,基于优化的信息化监测软件,对DE进行监测,DE类型主要包括3种。
1.2.1 使用抗菌药物口服/静脉/肌注使用抗细菌药物或抗真菌药物,但不包括抗病毒药物,无论治疗时间和用药目的如何。
1.2.2 血管通路部位感染指血管通路部位(包括隧道口、穿刺点、穿刺点周围皮肤)出现超过预期的发红、肿胀或有脓液渗出,但并未发生血流感染。
1.2.3 血培养阳性患者在门诊或住院后1 d内(住院当日和住院第2天)送检血培养且为阳性的报告,包括怀疑为污染的报告。
1.3 监测方法每日需要监测的血液透析患者上机后,护理平板与透析机连机自动获取患者信息列表,需要进行DE监测的患者会出现“事件”版块,由床旁护士开展对患者三类DE的问询、观察和评估,对疑似局部感染表现患者与临床医生进行讨论确诊,并将监测结果即时录入肾病移动工作站中的“事件”板块中。每月研究人员通过电脑终端导出DE发生情况并反馈。数据统计可自动生成不同血管通路类型DE发生情况表及使用抗菌药物原因分布表,并可从患者DE发生情况的总览表中获取送检血培养患者名单,利用血培养查询系统追踪血培养结果。
1.4 统计方法依据美国NHSN统计DE发生率的方法,使用DE事件数/每月前2个工作日患者数×患者·月×100。分别统计不同类型血管通路DE发生率,使用卡方检验比较软件优化前后监测数据的差异,P≤0.05为差异有统计学意义。
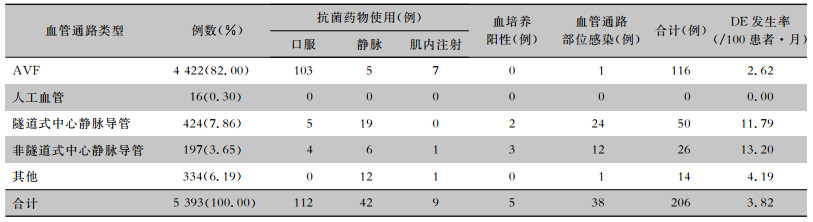
2 结果 2.1 不同血管通路门诊血透患者DE发生情况共监测门诊血液透析患者5 393例,其中动静脉内瘘(autogenous arteriovenous fistula,AVF)4 422例、人工血管16例、隧道式中心静脉置管424例、非隧道式中心静脉置管197例、其他通路(如直接穿刺等)334例,研究期间共206例患者发生DE,DE发生率为3.82/100患者·月。抗菌药物使用163例次,其中口服112例次,静脉使用42例次,肌内注射9例次;血培养阳性5例次;血管通路部位感染38例次。按不同血管通路类型分类,DE发生率分别为AVF 2.62/100患者·月、人工血管0、隧道式中心静脉导管11.79/100患者·月、非隧道式中心静脉导管13.20/100患者·月,其他通路类型4.19/100患者·月。见表 2。
| 表 2 不同血管通路门诊血透患者DE发生情况 Table 2 Occurrence of DE in hemodialysis outpatient with different vascular access |
|
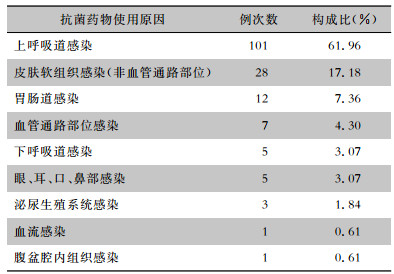
抗菌药物使用最主要的原因为上呼吸道感染(101例次),其次为皮肤软组织感染(非血管通路部位,28例次)、胃肠道感染(12例次)。见表 3。
| 表 3 163例次抗菌药物使用原因分布 Table 3 Causes of antimicrobial use in 163 cases of DE |
|
监测期间共9例患者送血培养,其中5例血培养阳性,3例检出金黄色葡萄球菌,2例检出表皮葡萄球菌。排除污染,5例血培养阳性均被诊断为血流感染,且均发生于导管置管患者,即5例患者发生导管相关血流感染。
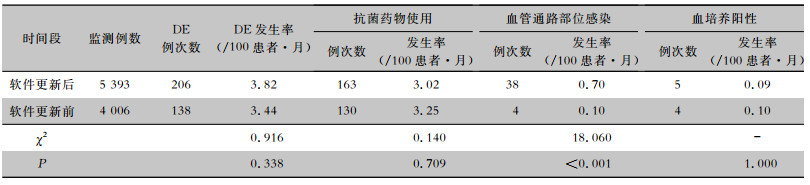
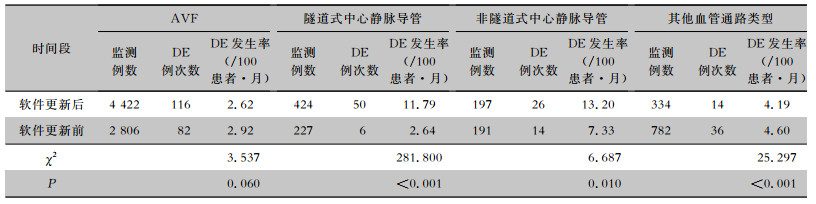
2.4 与软件优化前监测数据的比较2017年基于初始的信息化软件对该院DE数据进行监测[6]。与2017年数据相比,使用优化后的监测软件对DE监测发现,本次监测DE总体发生率略高,但差异并无统计学意义(P > 0.05)。按照不同DE类型比较,软件更新后血管通路部位DE发生率升高(0.70/100患者·月VS 0.10/100患者·月),差异具有统计学意义(P < 0.001);按照不同血管通路类型比较,软件更新后其他血管通路类型DE发生率下降(4.19/100患者·月VS 4.60/100患者·月),而隧道式和非隧道式导管DE发生率升高(11.79/100患者·月VS 2.64/100患者·月,13.20/100患者·月VS 7.33/100患者·月),差异均有统计学意义(均P < 0.05),见表 4、5。
| 表 4 软件更新前后DE发生情况 Table 4 Occurrence of DE before and after the software was updated |
|
| 表 5 软件更新前后不同血管通路类型DE发生情况 Table 5 Occurrence of DE in different vascular access types before and after software was updated |
|
2019年8月患者DE发生率最高(9.51/100患者·月),监测期间DE发生率呈下降趋势,至2020年7月,下降至1.05/100患者·月。见表 6。
| 表 6 不同月份DE发生情况 Table 6 Occurrence of DE in different months |
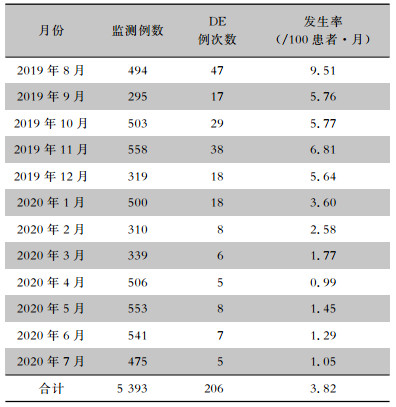
|
在2017年的监测中,本血液透析中心AVF患者构成比仅为70%[6]。相较于以前,本次监测患者AVF构成比 > 80%,且隧道式导管患者构成比 < 10%,已符合《第二版血管通路专家共识》[9]中提出的关于血管通路构成比例目标。软件的更新实现了对患者存在两种及两种以上血管通路时的数据准确抓取,即尽管有患者使用AVF进行透析,但当其仍有导管置入时,则将其纳入导管患者统计的分母数据。统计更加准确后,AVF比例仍然处于升高水平,更能体现AVF使用的改善。据报道[10],目前超过60%的患者首次透析所采用的通路仍然为中心静脉置管(central vein catheter,CVC)。与AVF相比,CVC显著增加血液透析患者发生血流感染等并发症及死亡的风险[11]。本次监测共包含近600余例次导管的使用,因此需要临床更多的努力来减少使用率,相关指南[12-13]建议慢性肾脏病(CKD)患者在CKD4期时就建立AVF,在医患知晓“内瘘第一”原则的基础上,不断强化通路管理。此外,本次监测中新增人工血管通路类型,但其透析例次较少,并且均未发生DE。
2014年美国NHSN对6 005所透析机构监测的DE发生率为3.52/100患者·月[4],Zhang等[14]研究中DE发生率为1.47/100患者·月,张菊等[15]监测的发生率为5.50/100患者·月。本研究中监测DE发生率为3.82/100患者·月。与Zhang等[14]的研究及美国NHSN的监测结果相比,发生率较高,可能与本研究中增加了口服与肌内注射使用抗菌药物监测相关。与软件更新前的监测数据比较,本研究中血管通路部位局部感染的发生率有显著升高,分析原因可能为护理人员对DE评估准确性及积极性的提高。软件更新后对血培养结果的追踪更加完善,但血培养阳性发生率并未显著提高,并且与国外[4, 16]血培养阳性率相比,也始终处于较低水平。分析可能由于经济限制等原因,国内门诊血液透析患者拒绝进行血培养,多数要求经验性用药,造成门诊血液透析中心血培养送检率低,检出阳性率降低。
比较不同血管通路DE发生率,本次监测非隧道式中心静脉导管发生率最高,其次为隧道式、其他血管通路、AVF,排除人工血管的发生率,同美国CDC以及国内外相关研究结果一致[17-18]。与2017年数据相比,非隧道式、隧道式血管通路DE发生率显著升高,AVF和其他血管通路类型发生率降低。优化后的软件对存在多种血管通路患者的统计归类进行了规则限制,填补了之前在信息追踪中存在的漏洞,实现了对患者血管通路的精准抓取,可能是此次监测结果中导管患者DE发生率显著升高,AVF患者DE发生率下降的重要原因之一。研究[19]建议颈部静脉临时置管使用时间原则上不得超过4周,股静脉原则上不超过1周,在调查过程中发现本研究中心临时导管患者多数因瘘管尚未成熟等原因无法及时拨出,导致留置时间普遍过长,部分患者使用甚至达3个月,可能是造成其感染发生率高的主要原因。此外研究[20-21]指出置管部位、置管时间、多次置管史、置管者以及导管护理操作不当都会增加患者感染风险,因此临床工作者需要持续优化对导管的置管操作及后期的护理维护来降低感染发生风险。
软件优化后对抗菌药物使用原因诊断的修改,有利于更准确的定位患者存在的感染问题。同2017年结果一致,上呼吸道感染是使用抗菌药物最主要的原因,应重视对门诊血液透析患者上呼吸道的管理,如要求佩戴口罩等。本次监测发现非血管通路部位的皮肤软组织感染原因占比增加,糖尿病肾病患者人数的增加,使微血管循环障碍造成的皮肤软组织破损,炎症甚至坏疽日益增多,因此增加感染风险,应合理控制患者血糖水平,降低感染发生率。使用抗菌药物是监测中发生次数最多的事件类型,其中约70%以口服方式使用,且多数患者缺乏充足的临床依据,Balkhy等[22]研究也指出中国患者口服抗菌药物风险是静脉使用抗菌药物的2.3倍,上呼吸道感染为口服抗菌药物主要原因。相关研究[23]证实血液透析患者抗菌药物使用约有30%是不必要的或不合适的。对于血液透析患者而言,服用抗菌药物的积极作用大于消极影响,因此由于担心发生感染,其常常在没有用药指征的情况下口服抗菌药物,甚至要求医生开具抗菌药物处方[24]。这些原因增加了血液透析患者暴露于抗菌药物的时间和频率,还会增加多重耐药菌感染的发病率,导致病死率显著增加。因此,提示需要重点关注门诊血液透析患者不合理使用抗菌药物的防控,减少不良结局发生,通过监测抗菌药物的使用以及采取相应的措施来减少多重耐药菌的播散。
国外研究[21-22]均发现通过实施长期的监测干预措施,DE发生率下降,且对发现感染及预防血流感染有益。本研究同样监测到明显的DE发生率下降趋势,一方面提示监测可有效降低感染的发生,通过监测获得疾病发生的基线数据,发现感染防控工作中的不足之处,并且随着监测的不断进行,数据的反馈及不断的培训,临床护理人员对血液透析患者的感染管理意识不断强化,实施患者合理用药指导,手卫生教育等预防措施。另一方面,由于2019年先后发生了血液透析感染暴发事件及新型冠状病毒肺炎(COVID-19)疫情,医疗环境复杂,血液透析患者感染的高风险,为临床医护人员及患者敲响警钟,使其更加重视感染防控措施如手卫生、导管消毒等的执行,此外为了预防COVID-19的传播,患者需要佩戴口罩在门诊进行透析,同时也减少了其他呼吸道病毒传播风险,因而在门诊防控措施的有力实施下,门诊患者得到有效保护,达到了包括降低因上呼吸道感染服用抗菌药物等风险的效果。
血液透析感染相关监测至关重要,实现信息化也是大势所趋。信息化监测软件不仅使DE监测工作便利,也便于数据统计与分析,获得的相关数据有利于感染控制部门对临床工作进行有效的指导。依据本研究的信息化监测数据发现,DE发生率高,但通过长期监测可有效降低事件风险,但在信息化监测期间,不断的优化升级、完善监测漏洞是十分必要的。DE信息化监测软件在国内的适用性有待进一步验证,本研究为单中心研究,缺乏代表性,信息化软件在本研究中心的良好应用能否适用于其他研究,需要进一步构建优化的监测系统,开展多中心大样本的监测,获得更优化的数据才能真正实现血液透析相关感染监测的意义。
| [1] |
Khatib ST, Hemadneh MK, Hasan SA, et al. Quality of life in hemodialysis diabetic patients: a multicenter cross-sectional study from Palestine[J]. BMC Nephrol, 2018, 19(1): 49. DOI:10.1186/s12882-018-0849-x |
| [2] |
Kazakova SV, Baggs J, Apata IW, et al. Vascular access and risk of bloodstream infection among older incident hemodialysis patients[J]. Kidney Med, 2020, 2(3): 276-285. DOI:10.1016/j.xkme.2019.12.010 |
| [3] |
Ganz T, Aronoff GR, Gaillard CAJM, et al. Iron administration, infection, and anemia management in CKD: untangling the effects of intravenous iron therapy on immunity and infection risk[J]. Kidney Med, 2020, 2(3): 341-353. DOI:10.1016/j.xkme.2020.01.006 |
| [4] |
Nguyen DB, Shugart A, Lines C, et al. National healthcare safety network (NHSN) dialysis event surveillance report for 2014[J]. Clin J Am Soc Nephrol, 2017, 12(7): 1139-1146. DOI:10.2215/CJN.11411116 |
| [5] |
张慧, 尹维佳, 李超, 等. 医院门诊血液透析患者血液透析事件的监测分析[J]. 中华医院感染学杂志, 2015, 25(21): 4925-4928. |
| [6] |
张冰, 茅一萍, 刘秉诚, 等. 基于信息化的单中心门诊血液透析事件监测[J]. 中国感染控制杂志, 2019, 18(7): 638-642. |
| [7] |
张冰, 茅一萍, 刘秉诚, 等. 门诊血液透析事件监测软件的开发与应用[J]. 中国医院管理, 2018, 38(2): 64-65. |
| [8] |
Wise ME, Lovell C. Public health surveillance in the dialysis setting: opportunities and challenges for using electronic health records[J]. Semin Dial, 2013, 26(4): 399-406. DOI:10.1111/sdi.12098 |
| [9] |
中国医院协会血液净化中心分会血管通路工作组. 中国血液透析用血管通路专家共识(第2版)[J]. 中国血液净化, 2019, 18(6): 365-381. DOI:10.3969/j.issn.1671-4091.2019.06.001 |
| [10] |
Schwanke AA, Danski MTR, Pontes L, et al. Central venous catheter for hemodialysis: incidence of infection and risk factors[J]. Rev Bras Enferm, 2018, 71(3): 1115-1121. DOI:10.1590/0034-7167-2017-0047 |
| [11] |
Pisoni RL, Zepel L, Port FK, et al. Trends in US vascular access use, patient preferences, and related practices: an update from the US DOPPS practice monitor with international comparisons[J]. Am J Kidney Dis, 2015, 65(6): 905-915. DOI:10.1053/j.ajkd.2014.12.014 |
| [12] |
Kamar F, Quinn RR, Oliver MJ, et al. Outcomes of the first and second hemodialysis fistula: a cohort study[J]. Am J Kidney Dis, 2019, 73(1): 62-71. DOI:10.1053/j.ajkd.2018.06.007 |
| [13] |
Balkhy HH, El-Saed A, Al Hejaili F, et al. Decreasing but differential trends of adverse events among dialysis outpatient following re-enforcement of infection control measures; 20-month surveillance study[J]. BMC Proc, 2011, 5(Suppl 6): P208. |
| [14] |
Zhang H, Li LY, Jia HX, et al. Surveillance of dialysis events: one-year experience at 33 outpatient hemodialysis centers in China[J]. Sci Rep, 2017, 7(1): 249. DOI:10.1038/s41598-017-00302-9 |
| [15] |
张菊, 李刚, 巫惠敏, 等. 某院血液透析事件监测结果分析[J]. 中华医院感染学杂志, 2019, 29(12): 1882-1885. |
| [16] |
Lyman M, Nguyen DB, Shugart A, et al. Risk of vascular access infection associated with buttonhole cannulation of fistulas: data from the National Healthcare Safety Network[J]. Am J Kidney Dis, 2020, 76(1): 82-89. DOI:10.1053/j.ajkd.2019.11.006 |
| [17] |
徐珍, 邓琼, 章琦, 等. 门诊血液透析患者血管通路感染目标性监测[J]. 中国感染控制杂志, 2017, 16(11): 1044-1047. DOI:10.3969/j.issn.1671-9638.2017.11.012 |
| [18] |
Bueloni TNV, Marchi D, Caetano C, et al. Cefazolin-gentamicin versus taurolidine-citrate for the prevention of infection in tunneled central catheters in hemodialysis patients: a quasi-experimental trial[J]. Int J Infect Dis, 2019, 85: 16-21. DOI:10.1016/j.ijid.2019.05.017 |
| [19] |
George A, Tokars JI, Clutterbuck EJ, et al. Reducing dialysis associated bacteraemia, and recommendations for surveillance in the United Kingdom: prospective study[J]. BMJ, 2006, 332(7555): 1435. DOI:10.1136/bmj.332.7555.1435 |
| [20] |
Soi V, Moore CL, Kumbar L, et al. Prevention of catheter-related bloodstream infections in patients on hemodialysis: challenges and management strategies[J]. Int J Nephrol Renovasc Dis, 2016, 9: 95-103. |
| [21] |
Fan PY, Schwab SJ. Vascular access: concepts for the 1990s[J]. J Am Soc Nephrol, 1992, 3(1): 1-11. DOI:10.1681/ASN.V311 |
| [22] |
Balkhy HH, El Beltagy KE, El-Saed A, et al. Benchmarking of percutaneous injuries at a teaching tertiary care center in Saudi Arabia relative to United States hospitals participating in the Exposure Prevention Information Network[J]. Am J Infect Control, 2011, 39(7): 560-565. DOI:10.1016/j.ajic.2010.10.022 |
| [23] |
Wu YL, Zhang JJ, Li RJ, et al. Prevalence of infections and antimicrobial use among hemodialysis outpatients: a prospective multicenter study[J]. Semin Dial, 2020, 33(2): 156-162. DOI:10.1111/sdi.12869 |
| [24] |
Snyder GM, McCoy C, D'Agata EMC. Quantifying antimicrobial exposure: hazards in populations with end-stage renal disease[J]. Infect Control Hosp Epidemiol, 2017, 38(3): 360-363. DOI:10.1017/ice.2016.290 |



