细菌耐药(antimicrobial resistance,AMR)已经成为全球公共卫生安全危机,世界卫生组织(WHO)要求全球各国积极行动,采取系统性措施遏制AMR,否则将导致感染性疾病卷土重来,成为威胁人类健康与生命安全的首要因素。WHO在2015年颁布的“全球耐药控制行动计划”中明确指出,优化抗菌药物使用和感染防控是控制耐药的重要策略[1];我国政府颁布的“遏制细菌耐药国家行动计划(2016-2020)”也明确指出需要实施抗菌药物管理和控制耐药的综合措施[2]。国内外的经验告诉我们控制细菌耐药必须同时开展抗菌药物临床应用管理(antimicrobial stewardship, AMS)和感染控制(infection prevention & control, IPC),两者相互协同才能取得成功。
1 细菌耐药的发生和传播与抗菌药物使用、感染控制息息相关AMR的发生是自然选择的结果,AMR的流行与其传播和扩散有关。抗生素是源于自然的产物,部分微生物天然产生抗生素,而与之共生的其他微生物则能产生耐药机制以确保种族的延续,两类微生物之间始终处于平衡状态;当人类大量使用抗菌药物之后,敏感细菌被杀灭,耐药细菌被筛选富集,再通过人类的活动得以扩散,见图 1。
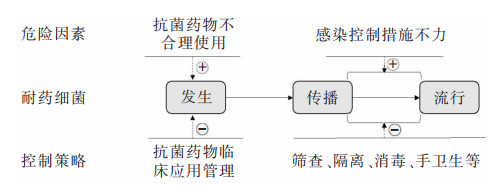 |
| 图 1 耐药细菌发生过程与危险因素和控制策略 |
医疗机构是患者集中场所,也是抗菌药物使用最为频繁的地方,历史上许多耐药细菌都首先发生在医院,然后逐渐流行并向社区传播。如在青霉素应用一年之后的1942年,青霉素耐药金黄色葡萄球菌首先在美国的医院发现,耐甲氧西林金黄色葡萄球菌(MRSA)在1968年英国的医院被检出,耐万古霉素金黄色葡萄球菌(VRSA)也于2002年在美国的医院被确认[3]。各种耐药监测数据[4]显示,医疗机构也是耐药细菌检出较为突出之地,全球关注的各种多重耐药菌感染也大多发生在住院患者。研究还发现,抗菌药物的使用与AMR的发生息息相关,抗菌药物使用越合理,细菌耐药发生也就越少。对140余家医院AMR和抗菌药物应用进行相关分析发现,医疗机构第三代头孢菌素的使用量与产超广谱β-内酰胺酶大肠埃希菌和肺炎克雷伯菌的发生率密切相关[5]。同样,医院感染高发的国家和医疗机构抗菌药物使用也欠合理,欧洲开展的抗菌药物应用-细菌耐药-医院感染时点横断面调查发现,北欧国家医院抗菌药物使用量最低,细菌耐药率和医院感染发生率也较低,而南欧国家抗菌药物使用量大,细菌耐药率和医院感染发生率都较高[6]。研究充分证明,细菌耐药的发生、扩散和流行与不同危险因素相关,抗菌药物的使用犹如耐药触发器,感染控制不力更像耐药流行的加速器。
2 感染控制与抗菌药物管理对耐药控制的相互促进控制细菌耐药已经成为医疗机构主要的工作内容,我国卫生管理部门已经把IPC、AMS纳入医院核心管理内容,是医疗机构质量评价和评级的指标,在此过程中抗菌药物管理团队和感染控制团队必须相互协作,最大限度地发挥医疗机构耐药控制作用。
2006年美国疾病控制与预防中心(CDC)制定的多重耐药菌感染控制指南中明确地把AMS和IPC作为主要的策略,甚至在其推荐的AMS核心要素中,IPC也占有十分重要的地位[7-8]。有关感染控制措施包括警示、接触隔离、手卫生、患者队列等。美国纽约皇后医院采取AMS和IPC相结合的综合措施,包括逐日细菌敏感性数据分析、耐药监测、强化接触隔离、分子生物学流行病学调查、医护人员教育等措施,控制多重耐药鲍曼不动杆菌流行成效明显[9]。
以色列在耐碳青霉烯类肠杆菌控制方面所采取的感染控制措施效果显著,已经成为国际典范。以色列2006年发现耐碳青霉烯类肺炎克雷伯菌在医院暴发流行,据估计2007年有1 000例感染和10 000例定植患者,其后以色列政府实施了以IPC为主的综合控制措施:要求医疗机构实时报告感染和定植患者,建立医护和患者队列,隔离患者,对新入院患者实施耐药菌筛查,实施接触隔离,使用手套和隔离衣等防护措施,3个月后全国耐碳青霉烯类肺炎克雷伯菌分离率大幅减少,发病率从最高60/10万住院日降低至20/10万住院日,并且感染人数极少,主要分离菌都为定植[10]。以色列的经验充分展示了IPC对AMR控制的重要作用。
3 感染控制团队的耐药控制责任我国AMR形势依然十分严峻,特别是耐碳青霉烯类肠杆菌目细菌的发生率仍呈上升态势,虽然管理部门已经要求医疗机构加强AMS工作,严格控制抗菌药物使用率和使用强度,但部分地区耐碳青霉烯类肺炎克雷伯菌检出率已超过30%。研究[4, 11]发现,医疗机构耐碳青霉烯类肺炎克雷伯菌存在院内克隆传播,主要分子型别为ST11型。实施有效的感染控制措施,与抗菌药物管理相互配合才是最终控制这类耐药细菌的有效办法。
医院感染控制团队需要加强自身能力建设,积极参与AMS工作,以IPC为抓手,促进耐药控制工作的不断发展。感染控制团队需要结合自身优势和工作内容,参考国外成功耐药控制经验,强化医务人员教育培训,提高医务人员手卫生、无菌操作、接触隔离等认识和依从性;与临床微生物专家积极配合,实时掌握医疗机构耐药菌流行与感染发生情况,及时发现耐药菌感染暴发事件,深入开展耐药菌感染与分子流行病特征调查,明确感染来源,实施有效控制策略;与AMS团队合作,发现抗菌药物应用中非适应证抗菌药物应用、过度预防应用、无必要联合用药,以及不规范用药等错误现象,把耐药监测、感染监测与用药监测等相互关联,确认耐药菌发生与传播危险因素并加以纠正。在耐药菌感染暴发事件中,实施多学科协作机制,采取诸如患者筛查、隔离、医护人员防护、去定植、特殊级药物使用管理等措施,及时遏制耐药流行。
| [1] |
World Health Organization. Global action plan on antimicro-bial resistance[EB/OL]. (2016-01-01)[2021-04-20]. https://www.who.int/publications/i/item/9789241509763.
|
| [2] |
中华人民共和国国家卫生健康委员会医政管理局. 关于印发遏制细菌耐药国家行动计划(2016-2020年)的通知[EB/OL]. (2016-08-25)[2021-04-20]. http://www.nhc.gov.cn/yzygj/s3593/201608/f1ed26a0c8774e1c8fc89dd481ec84d7.shtml.
|
| [3] |
Lowy FD. Antimicrobial resistance: the example of Staphylococcus aureus[J]. J Clin Invest, 2003, 111(9): 1265-1273. DOI:10.1172/JCI18535 |
| [4] |
Xiao YH. Antimicrobial stewardship in China: systems, actions and future strategies[J]. Clin Infect Dis, 2018, 67(Suppl 2): S135-S141. |
| [5] |
Yang P, Chen YB, Jiang SP, et al. Association between the rate of third generation cephalosporin-resistant Escherichia coli and Klebsiella pneumoniae and antibiotic consumption based on 143 Chinese tertiary hospitals data in 2014[J]. Eur J Clin Microbiol Infect Dis, 2020, 39(8): 1495-1502. DOI:10.1007/s10096-020-03856-1 |
| [6] |
European Centre for Disease Prevention and Control. Point prevalence survey of healthcare-associated infections and antimicrobial use in European acute care hospitals[EB/OL]. (2017-01-19)[2021-04-20]. https://op.europa.eu/en/publication-detail/-/publication/39a84b73-dee0-11e6-ad7c-01aa75ed71a1/language-en#_publicationDetails_PublicationDetailsPortlet_relatedPublications.
|
| [7] |
Center for Disease Control and Prevention. Multidrug-resis-tant organisms (MDRO) management[EB/OL]. (2015-11-05)[2021-04-20]. https://www.cdc.gov/infectioncontrol/guidelines/mdro/.
|
| [8] |
Center for Disease Control and Prevention. Core elements of hospital antibiotic stewardship programs[EB/OL]. (2021-04-28)[2021-04-20]. https://www.cdc.gov/antibiotic-use/core-elements/hospital.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fantibiotic-use%2Fhealthcare%2Fimplementa-tion%2Fcore-elements.html.
|
| [9] |
Urban C, Segal-Maurer S, Rahal JJ. Considerations in control and treatment of nosocomial infections due to multidrug-resis-tant Acinetobacter baumannii[J]. Clin Infect Dis, 2003, 36(10): 1268-1274. DOI:10.1086/374847 |
| [10] |
Solter E, Adler A, Rubinovitch B, et al. Israeli national policy for carbapenem-resistant Enterobacteriaceae screening, carrier isolation and discontinuation of isolation[J]. Infect Control Hosp Epidemiol, 2018, 39(1): 85-89. DOI:10.1017/ice.2017.211 |
| [11] |
吕继芳, 郑焙文, 张静, 等. 耐碳青霉烯类肺炎克雷伯菌分子流行病学和耐药基因分析[J]. 中国抗生素杂志, 2016, 41(5): 356-361. DOI:10.3969/j.issn.1001-8689.2016.05.008 |



