2. 安徽医科大学第一附属医院国家中医药管理局中药化学三级实验室, 安徽 合肥 230022;
3. 安徽医科大学第一附属医院血液内科, 安徽 合肥 230022
2. Third-grade Pharmaceutical Chemistry Laboratory of State Administration of Traditional Chinese Medicine, The First Affiliated Hospital of Anhui Medical University, Hefei 230022, China;
3. Department of Hematology, The First Affiliated Hospital of Anhui Medical University, Hefei 230022, China
血液系统恶性肿瘤患者因原发病、化学治疗(化疗)、造血干细胞移植及免疫抑制剂治疗的应用等导致免疫功能低下,是感染的高危人群。感染是血液系统恶性肿瘤患者死亡的重要原因,其中革兰阴性(G-)菌是血液科患者感染的主要致病菌,以大肠埃希菌、肺炎克雷伯菌多见,非发酵菌呈逐年上升趋势[1]。近年来,随着临床上各类抗菌药物的广泛应用,细菌耐药率呈现逐年上升的趋势,大幅度地增加了抗感染治疗的难度。耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales,CRE)已经成为临床面临的重大挑战,非发酵菌对碳青霉烯类耐药率也呈上升趋势。在CRE感染联合治疗方案中,不同城市的医生均首选碳青霉烯类联合替加环素[2]。替加环素为一种新型甘氨酰四环素类抗生素,除对大多数革兰阳性(G+)需氧菌、G-需氧菌及厌氧菌具有良好的抗菌活性外,还对CRE、耐碳青霉烯类非发酵菌(铜绿假单胞菌对替加环素天然耐药)均有很高的敏感性[3],为临床多重耐药菌感染提供一种新的治疗选择。但替加环素治疗血液系统恶性肿瘤并发感染的临床报道较少,其有效性和影响因素仍缺乏充分的临床证据。本研究对某院血液科182例血液系统恶性肿瘤合并感染应用替加环素的患者实施集中监测,初步探讨替加环素治疗血液系统恶性肿瘤并发感染的临床疗效及其影响因素,以期为临床合理应用替加环素提供参考依据。
1 对象与方法 1.1 研究对象某三甲医院血液科2016年6月1日—2019年12月31日出院的血液系统恶性肿瘤并发感染的患者,使用碳青霉烯类等一线治疗方案无效后应用替加环素。排除标准:(1)替加环素应用时间不足3 d无法评价疗效者;(2)应用替加环素的目的为控制细菌感染,后证实为真菌感染者。
1.2 研究方法借助医院电子病历系统和合理用药监测系统对应用替加环素的血液科住院患者进行集中监测,采集患者基本信息(病历号、年龄、性别、出入院时间等)、疾病情况(出入院诊断、感染部位、是否存在粒细胞缺乏及持续时间、病原学检查及药敏试验)、替加环素用药情况(单次剂量、用药频次、用药途径、用药疗程、联合用药)等,并进行疗效评价及影响因素分析。
1.3 判定标准根据患者症状、体征、影像学及实验室检查结果评价替加环素治疗的临床疗效。临床疗效评价[4]分为临床治愈(患者在治疗结束后,症状、体征均已消失或完全恢复正常,且影像学和实验室检查等非微生物学指标均已恢复正常)和临床无效(患者在治疗结束后,症状、体征持续或不完全消失或恶化;或者出现了此疾病新的症状或体征和/或使用了其他的针对此疾病的抗菌药物治疗措施)。
1.4 统计学方法应用SPSS 23.0进行统计学分析,计量资料以x±s表示,计数资料以例数(n)及百分率(%)表示。采用二元logistic回归模型进行影响因素分析,将单因素分析有统计学意义的变量全部纳入多因素logistic回归分析,计算比值比(OR)值和95%置信区间(CI),P≤0.05为差异有统计学意义。
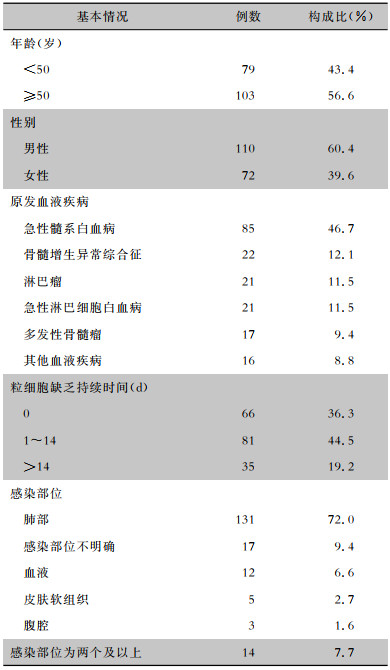
2 结果 2.1 一般情况纳入血液系统恶性肿瘤并发感染使用替加环素治疗的患者182例,平均年龄为(50.1±16.0)岁,原发血液疾病以急性髓系白血病最常见,63.7%患者合并粒细胞缺乏,感染部位以肺部为主(72.0%),部分患者合并肺部、血液等两个及以上部位的感染。见表 1。
| 表 1 182例血液系统恶性肿瘤并发感染使用替加环素治疗患者的基本情况 Table 1 Characteristics of 182 patients with hematological malignancies complicated with infection and treated with tigecycline |
|
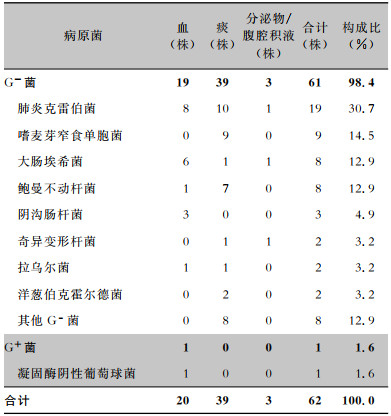
180例患者在使用抗菌药物前送病原体检测,送检率为98.9%。有49例患者检出病原菌,分离菌株62株(剔除同一患者分离的重复菌株),其中G-菌61株。送检标本主要是血和痰,其中血培养占32.3%,病原菌主要为肺炎克雷伯菌、大肠埃希菌及阴沟肠杆菌;痰培养占62.9%,病原菌主要为肺炎克雷伯菌、嗜麦芽窄食单胞菌和鲍曼不动杆菌。见表 2。药敏结果显示:8株为CRE,占G-菌的13.1%,其中肺炎克雷伯菌6株,阴沟肠杆菌1株,大肠埃希菌1株。
| 表 2 血液系统恶性肿瘤患者感染病原菌及来源分布情况 Table 2 Distribution and source of pathogenic bacteria causing infection in patients with hematological malignancies |
|
替加环素初始治疗时,70例(38.5%)患者使用负荷剂量;维持治疗时,69例(37.9%)患者应用替加环素常规剂量(50 mg,q12 h,静脉滴注),113例(62.1%)患者应用高剂量(100 mg,q12 h,静脉滴注);平均给药疗程为(11.6±6.5)d,疗程≥7 d者占79.7%;168例(92.3%)患者联合应用抗真菌感染药物,173例(95.1%)患者联合其他抗细菌感染药物,联合最多的抗菌药物为头孢哌酮/舒巴坦(71例)。
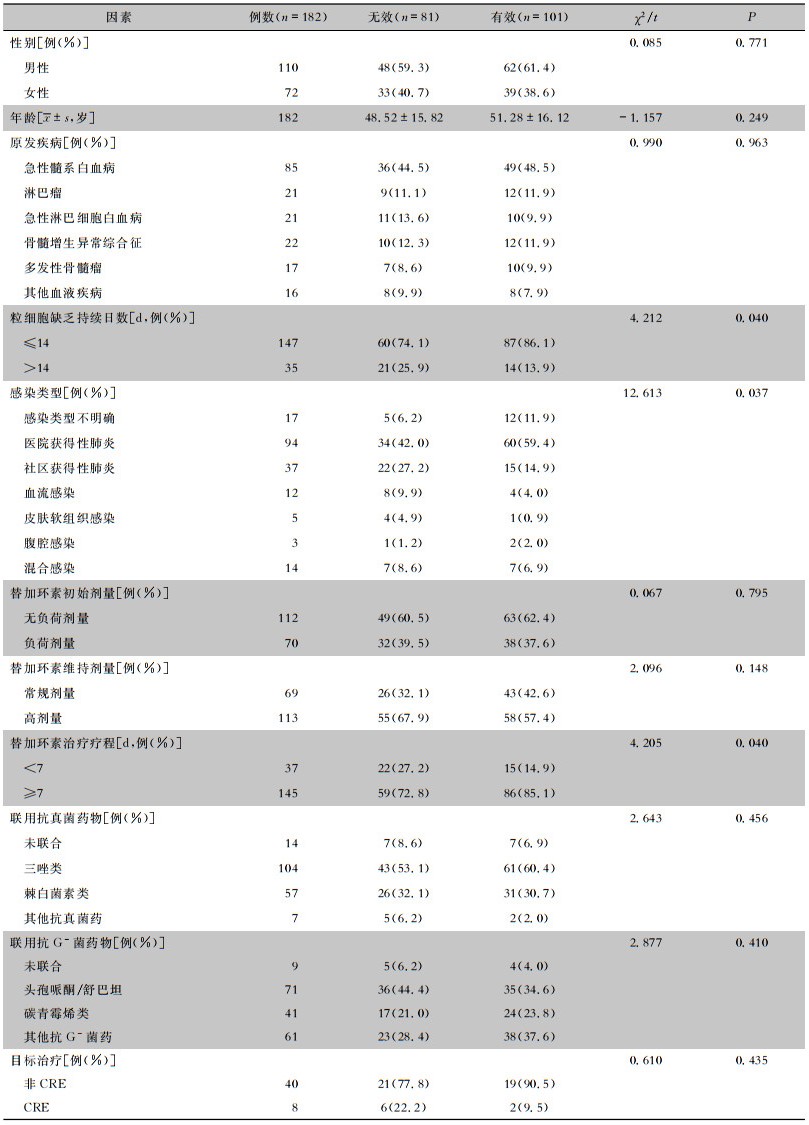
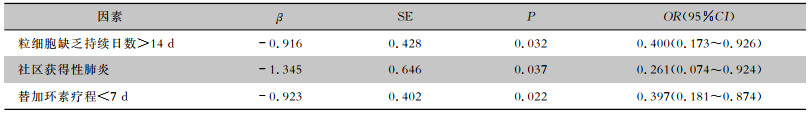
2.4 临床疗效及影响因素182例患者中临床治愈101例,有效率为55.5%。将性别、年龄、原发疾病等因素与药物疗效进行单因素分析。结果显示,不同性别、年龄、原发疾病、替加环素剂量、联合用药及感染病原菌的患者疗效比较,差异均无统计学意义(均P>0.05)。不同粒细胞缺乏持续日数、替加环素疗程以及不同感染部位的患者疗效比较,差异均有统计学意义(均P < 0.05)。见表 3。对单因素分析有统计学差异的变量进行多因素logistic回归分析,结果表明粒细胞缺乏持续日数>14 d、替加环素疗程 < 7 d以及社区获得性肺炎是替加环素治疗血液系统恶性肿瘤并发感染患者失败的独立危险因素(均P < 0.05)。见表 4。
| 表 3 替加环素治疗血液系统恶性肿瘤并发感染患者疗效的单因素分析 Table 3 Univariate analysis on therapeutic efficacy of tigecycline in patients with hematological malignancies complicated with infection |
|
| 表 4 替加环素治疗血液系统恶性肿瘤并发感染患者疗效的多因素logistic回归分析 Table 4 Multivariate logistic regression analysis on therapeutic efficacy of tigecycline in patients with hematological malignancies complicated with infection |
|
本研究中血液病并发感染的患者应用替加环素的有效率为55.5%,与文献[5]报道结果类似,但较文献[6]报道的替加环素治疗医院获得性肺炎、社区获得性肺炎、复杂性腹腔感染、复杂性皮肤软组织感染的有效率低,说明替加环素治疗血液系统恶性肿瘤并发感染的整体疗效低于其他感染,可能与本研究中多为应用碳青霉烯类等多种抗菌药物无效的病例有关。
本研究中患者均为血液系统恶性肿瘤,经大剂量化疗和/或造血干细胞移植,63.7%患者出现粒细胞缺乏伴发热,部分患者无法明确感染部位,最常见的感染部位为肺部、血液及皮肤软组织。不同的感染部位病原菌也有差异,其中肺部感染的病原菌主要为肺炎克雷伯菌、嗜麦芽窄食单胞菌和鲍曼不动杆菌,血流感染的病原菌主要为肺炎克雷伯菌和大肠埃希菌,与相关文献[7-8]报道结果类似。本研究中检出8株CRE,其中肺炎克雷伯菌6株、阴沟肠杆菌和大肠埃希菌各1株,均来源于血标本,CRE检出率为13.1%。一项纳入全球1995—2016年来自21个国家共计30项研究的荟萃分析显示:中性粒细胞减少患者感染G-菌对碳青霉烯类的耐药率最高可达53%(2%~53%,平均9%)[9]。江苏一项血液病患者病原菌分布及耐药状况的多中心研究显示,CRE占比达6.68%[10]。本研究中CRE检出率较高,可能与本研究的患者中大多数使用过碳青霉烯类有关[9]。目前我国上市的替加环素药品说明书中记载的适应证为复杂性皮肤软组织感染、复杂性腹腔感染及社区获得性肺炎,无医院获得性肺炎的适应证。2016年版美国感染病学会制定的《2016年成人医院获得性肺炎和呼吸机相关性肺炎的处理临床实践指南》[11]中指出,不动杆菌属导致的医院获得性肺炎/呼吸机相关肺炎,不宜使用替加环素。但本研究中替加环素治疗医院获得性肺炎的有效率为63.8%,且大多数患者为碳青霉烯类治疗失败者。因此,对于耐药菌导致的医院获得性肺炎,及时给予替加环素仍是可供选择的抗感染方案之一。
3.2 影响因素分析 3.2.1 粒细胞缺乏的持续时间根据logistic回归分析的结果,不同粒细胞缺乏持续日数患者使用替加环素的疗效比较,差异有统计学意义(P < 0.05)。Schwab等[12]的研究结果也表明长期粒细胞缺乏患者(≥28 d)使用替加环素的疗效明显降低(13% VS 79%,P=0.001),提示粒细胞缺乏可能是影响替加环素抗感染疗效的原因之一。但一项针对替加环素挽救性治疗血液系统恶性肿瘤粒细胞缺乏伴发热患者的前瞻性多中心临床研究结果显示,粒细胞缺乏持续时间≥7 d与疗效无关[13],可能与其纳入的病例粒细胞缺乏持续时间均较短有关。
3.2.2 感染部位本研究结果显示,社区获得性肺炎会影响替加环素对血液系统恶性肿瘤并发感染患者的治疗有效率(P < 0.05);血流感染也影响替加环素的治疗有效率,但差异无统计学意义(P>0.05)。以前的不同研究甚至得出了相反的结论,Zhou等[13]研究发现,替加环素治疗肺炎患者的有效率为73.1%,治疗血流感染患者的有效率为35.3%。而一项纳入110例肿瘤(血液肿瘤占58%)伴严重感染的回顾性研究[14]却发现,替加环素治疗血流感染有效率较肺炎高(79% VS 51%,P=0.029)。而在非血液系统恶性肿瘤患者中,有研究[15]认为替加环素治疗血流感染的治愈率高于对照组(OR=1.76,P=0.001),亚组分析显示398例耐碳青霉烯类肺炎克雷伯菌血流感染患者,替加环素组的病死率也低于对照组。因此,鉴于血液科多重耐药菌或广泛耐药菌发生率高且可替代治疗方案有限,在未来应对血液病粒细胞缺乏合并血流感染患者进行替加环素应用的相关研究。
3.2.3 剂量本研究结果显示,与标准剂量组相比,接受高剂量替加环素治疗的有效率比较,差异并无统计学意义。目前关于大剂量替加环素的治疗有效性和安全性,现有数据有限。一项国际多中心、双盲、随机对照Ⅱ期临床试验,共筛选75个研究中心的114例医院获得性肺炎或呼吸机相关肺炎患者,研究结果表明替加环素中剂量组(75 mg,q12 h)的治疗有效率为69.6%,替加环素高剂量组(100 mg,q12 h)的治疗有效率为85.0%,亚胺培南/西司他丁组治疗有效率为75.0%,由此可见使用高剂量替加环素的患者疗效高于使用低剂量替加环素及亚胺培南/西司他丁的患者[16]。但替加环素的一项队列研究[17]显示,大剂量组(100 mg,q12 h)患者的病死率为8.3%~26%,低剂量组(50 mg,q12 h)患者的病死率为8%~61%,此取决于潜在感染的严重程度。最近一项Meta分析[18]显示,使用高剂量替加环素较常规剂量的有效率高,病死率低。
3.2.4 替加环素的用药疗程本研究发现适当延长替加环素的用药疗程能提高替加环素的治愈率。《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南》[19]中针对医院获得性肺炎与呼吸机相关肺炎的推荐抗感染疗程为≥7 d,对于初始抗感染治疗无效、多重耐药或泛耐药菌感染者,应酌情延长疗程。本研究的结果显示,替加环素的疗程在7 d以上才能取得较好的治疗效果,因此,建议临床应用替加环素应适当的延长其治疗疗程,不可随意替换或停药。目前对替加环素治疗血液恶性肿瘤粒细胞缺乏疗效的影响因素研究较少,且结论不统一[12-13, 15, 20]。由于本研究为单中心且为回顾性研究,具有一定的局限,不同地区病原菌耐药情况不同,且分层分析时,个别亚组样本量较少,一定程度上影响结果的可靠性,因此,需要大样本、多中心、前瞻性随机对照的研究进一步证实。
综上所述,血液系统恶性肿瘤患者多重耐药菌感染问题突出,替加环素为临床提供了一种新的治疗选择。替加环素对血液恶性肿瘤伴感染患者有较好的疗效,但社区获得性肺炎、粒细胞缺乏时间>14 d和替加环素疗程 < 7 d会显著影响其疗效。因此,临床应用时,应适当延长替加环素疗程以提高其疗效。
| [1] |
宋晓超, 杨海飞, 陈凯, 等. 2013-2018年恶性血液病患者血流感染病原菌与耐药性变迁[J]. 中华医院感染学杂志, 2018, 28(11): 1641-1644, 1692. |
| [2] |
史庆丰, 胡必杰, 沈燕, 等. 不同城市临床医师对碳青霉烯耐药肠杆菌认知和实践的调查[J]. 中华医院感染学杂志, 2018, 28(20): 3141-3144, 3159. |
| [3] |
吴小脉, 朱业飞, 龚柳阳, 等. 替加环素治疗碳青霉烯类耐药革兰阴性菌医院获得性肺炎的临床研究[J]. 中华医院感染学杂志, 2016, 26(23): 5376-5378. |
| [4] |
《抗菌药物临床试验技术指导原则》写作组. 抗菌药物临床试验技术指导原则[J]. 中国临床药理学杂志, 2014, 30(9): 844-856. |
| [5] |
高苏, 李正, 仇惠英, 等. 替加环素治疗血液病粒细胞缺乏患者感染疗效分析[J]. 中华医院感染学杂志, 2014, 24(4): 860-862. |
| [6] |
Shen FC, Han QP, Xie D, et al. Efficacy and safety of tigecycline for the treatment of severe infectious diseases: an updated Meta-analysis of RCTs[J]. Int J Infect Dis, 2015, 39: 25-33. DOI:10.1016/j.ijid.2015.08.009 |
| [7] |
李志超, 朱骏, 王椿, 等. 上海地区粒细胞缺乏伴肺部感染血液病患者呼吸道分离细菌及耐药性多中心回顾性研究[J]. 中国感染控制杂志, 2019, 18(11): 1025-1031. |
| [8] |
张国扬, 吴裕丹, 谢双锋, 等. 2012-2016年血液病患者血流感染病原菌分布及耐药性[J]. 中国感染控制杂志, 2018, 17(10): 853-859. |
| [9] |
Righi E, Peri AM, Harris PN, et al. Global prevalence of carbapenem resistance in neutropenic patients and association with mortality and carbapenem use: systematic review and Meta-analysis[J]. J Antimicrob Chemother, 2017, 72(3): 668-677. |
| [10] |
万一柯, 桑威, 陈兵, 等. 2014至2015年江苏省血液科病房病原菌分布及耐药状况的多中心回顾性研究[J]. 中华血液学杂志, 2017, 38(7): 602-606. |
| [11] |
Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society[J]. Clin Infect Dis, 2016, 63(5): e61-e111. DOI:10.1093/cid/ciw353 |
| [12] |
Schwab KS, Hahn-Ast C, Heinz WJ, et al. Tigecycline in febrile neutropenic patients with haematological malignancies: a retrospective case documentation in four university hospitals[J]. Infection, 2014, 42(1): 97-104. DOI:10.1007/s15010-013-0524-x |
| [13] |
Zhou XP, Ye XJ, Shen JP, et al. Salvage tigecycline in high risk febrile neutropenic patients with hematological malignancies: a prospective multicenter study[J]. Leuk Lymphoma, 2018, 59(11): 2679-2685. DOI:10.1080/10428194.2018.1436173 |
| [14] |
Chemaly RF, Hanmod SS, Jiang Y, et al. Tigecycline use in cancer patients with serious infections: a report on 110 cases from a single institution[J]. Medicine (Baltimore), 2009, 88(4): 211-220. DOI:10.1097/MD.0b013e3181af01fc |
| [15] |
Wang J, Pan YP, Shen JL, et al. The efficacy and safety of tigecycline for the treatment of bloodstream infections: a systematic review and Meta-analysis[J]. Ann Clin Microbiol Antimicrob, 2017, 16(1): 24. DOI:10.1186/s12941-017-0199-8 |
| [16] |
Ramirez J, Dartois N, Gandjini H, et al. Randomized phase 2 trial to evaluate the clinical efficacy of two high-dosage tigecycline regimens versus imipenem-cilastatin for treatment of hospital-acquired pneumonia[J]. Antimicrob Agents Chemother, 2013, 57(4): 1756-1762. DOI:10.1128/AAC.01232-12 |
| [17] |
Falagas ME, Vardakas KZ, Tsiveriotis KP, et al. Effectiveness and safety of high-dose tigecycline-containing regimens for the treatment of severe bacterial infections[J]. Int J Antimicrob Agents, 2014, 44(1): 1-7. DOI:10.1016/j.ijantimicag.2014.01.006 |
| [18] |
Zha L, Pan LL, Guo J, et al. Effectiveness and safety of high dose tigecycline for the treatment of severe infections: a systematic review and meta-analysis[J]. Adv Ther, 2020, 37(3): 1049-1064. DOI:10.1007/s12325-020-01235-y |
| [19] |
中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. DOI:10.3760/cma.j.issn.1001-0939.2018.04.006 |
| [20] |
Bucaneve G, Micozzi A, Picardi M, et al. Results of a multicenter, controlled, randomized clinical trial evaluating the combination of piperacillin/tazobactam and tigecycline in high-risk hematologic patients with cancer with febrile neutropenia[J]. J Clin Oncol, 2014, 32(14): 1463-1471. DOI:10.1200/JCO.2013.51.6963 |



