近年来,病毒性呼吸道感染是引起全球感染性疾病中发病率和病死率较高的原因之一,其中包括甲型流感病毒、副流感病毒、呼吸道合胞病毒、冠状病毒等。分子即时检验(POCT,point-of-care testing)具有快速、准确、方便、可靠等优点,逐渐用于呼吸道病原体的诊断,可缩短患者住院时间,减少不必要的抗菌药物使用,对于患者病情诊疗及预后具有重要意义。本文主要介绍病毒性呼吸道感染POCT的临床应用现状及前景,为临床病毒性呼吸道感染诊断提供参考依据。
1 病毒性呼吸道感染疾病的现状呼吸道感染疾病是致病微生物侵入呼吸道进行繁殖,并引起相应症状的一类疾病[1],病毒是急性呼吸道疾病中最常检测到的病原体[2]。成人病毒性呼吸道感染疾病的住院率为(5~20)/100 000[3],高龄患者甚至高达1 200/100 000,其中流感病毒会产生季节性流感,可导致住院人数激增并且容易引起老年人死亡[4]。此外,病毒性感染并发症也通常可引起住院率和病死率增高,如肺炎、病毒性心肌炎、病毒性脑炎和潜在的心肺疾病恶化症[5-6]。
常见的流感病毒、呼吸道合胞病毒、副流感病毒、人间质肺病毒和冠状病毒均会引起急性阻塞性肺疾病(COPD)、哮喘急性加重以及其他急性呼吸道疾病[7]。除急性呼吸性疾病外,病毒性呼吸道感染还可能表现为失代偿心血管疾病、糖尿病紧急情况等[8],导致大规模的住院治疗,并给医疗保健系统带来重大的负担。而在呼吸道病毒的诊治过程中,仅有少部分患者能被正确、快速诊断为某种病毒感染[9]。
2 POCT的概述POCT具有即时检验、床旁检验、就地检验等含义,指临床实验室外,临近或在患者护理现场直接进行标本检测、分析,现也包括患者的家庭自我监测[10]。POCT能够就近、快速地提供结果,医务人员可以根据检测结果尽快采取措施。经时间的推进和技术的发展,POCT快速检测、方便携带、容易使用的特点对医疗、护理和实验室工作人员都具有强大吸引力。
POCT关键驱动因素是样本被送到临床实验室时可能会延迟临床决策。有研究[11]评估POCT和临床实验室检测的区别,对急诊患者标本分别行上述两种检测,发现相比临床实验室检测,POCT可缩短结果检测时间和患者就诊时间。POCT比临床传统实验室检测在时间上更具有优势,且POCT的使用将减少部分临床鉴别诊断和治疗决策所用的时间,对患者预后具有重要意义。在当代社会,随着POCT可检测的项目不断增多,质量的不断进步,设备的不断更新完善,其在呼吸道感染的诊断及治疗中日益发挥重要作用。
3 病毒性呼吸道感染的检测方法病毒性呼吸道感染的检测方法主要分为常规检测和FilmArray呼吸道测试条检测。常规病原检测主要为分离培养、血清学、分子生物学等方法,结果可靠,但耗时较长,延迟临床决策。近年来,新兴设备利用分子技术,在足够小的POCT设备中快速检测呼吸道病原体,如FilmArray呼吸道测试条,其可靠性、实用性和准确度均能满足临床诊断,在提高病原体检出率及患者个性化治疗方面发挥重要作用。
3.1 常规检测流感快速诊断试验和其他呼吸道病毒检测一样,均是基于抗原检测鼻咽样品,但是在成人检测中其灵敏度仅50%。基于抗原试验的敏感度差,限制了此类试验在临床上的应用,且不能减少临床上对抗菌药物的使用[12-13]。此外,常规病原学鉴定和培养是病原学诊断的基础,但其耗时长且结果滞后,易延误临床决策,难以满足临床需要。目前,用于呼吸道病毒检测的黄金诊断试验是聚合酶链反应(PCR),该方法具有高敏感性和高特异性,且不受患者感染时间和免疫功能的限制,但PCR试验操作繁琐,结果易受检测环境影响,周转时间至少为24 h, 且需要专业的实验室设施和专业知识[14]。
3.2 POCT-FilmArray呼吸道测试条最近开发的新的快速分子检测方法包括FilmArray呼吸道测试条[15]。FilmArray呼吸道检测系统是经美国及欧洲食品药品监督管理局(FDA)批准、有CE-IVD标记的多重巢式PCR以及自动化体外诊断系统, 该检测系统集样品制备、扩增、检测和分析功能于一体,作为体外诊断(IVD)设备,现已在国外大量投入临床使用。FilmArray可以靶向20种病原体,包括17种病毒(及其亚型)和3种非典型病原体,包括甲型流感病毒(H1亚型、H1-2009亚型、H3亚型)、乙型流感病毒、腺病毒、冠状病毒(HKU1、NL63、229E、OC43)、人类肺病毒、人类鼻病毒/肠病毒、副流感病毒(1型、2型、3型、4型)和呼吸道合胞病毒(RSV),并能检测出3种非典型病原体包括百日咳鲍特菌、肺炎衣原体和肺炎支原体[16-17]。该测定过程始于将300 mL未处理的生物/临床样品加入反应盒中,进行核酸提取、纯化、反转录和多重聚合酶链反应、熔解曲线分析,最后是单个PCR阶段。该仪器与软件连接,实时分析熔解曲线变化与荧光曲线变化。该系统通过分析样品扩增的DNA熔解曲线,从相应的扩增中自动识别病原体,最终报告每种病原体的阴性或阳性结果[18]。见图 1。
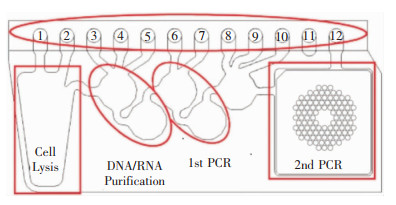 |
| 操作说明:将水合溶液和未知样本加入1号试剂管中,FilmArray工具依次进行提取和纯化核酸、反转录和多重聚合酶链反应。使用端点熔解曲线数据,FilmArray软件自动为每个目标生成结果。其中1号孔中为控制物质(裂殖酵母),2、3、4、5号孔中均为清洗缓冲液,6号孔为核酸清洗缓冲液,7号孔为逆转录/第一阶段PCR预混液,8号孔为稀释缓冲液,9、10号孔为第二阶段PCR预混液,11号孔空、12号孔为第二阶段PCR混合物的溢流容器[18]。 图 1 FilmArray检测系统示意图 |
FilmArray呼吸道检测系统综合检测阳性率高达90%以上,且其检测灵敏度和特异度高达95%以上。与病原体培养鉴定和传统PCR法相比,FilmArray呼吸道检测系统检测速度快、检测结果基本一致[18-19]。FilmArray检测手工操作耗时2 min,最后报告结果仅用1 h,在新生儿或感染百日咳鲍特菌的患者中,可以减少病原体的传播概率,有助于快速将患者隔离[20]。国内一项研究[21]表明,FilmArray检测肺炎支原体阳性的标本,经PCR检测也均为阳性;FilmArray检测肺炎支原体阴性但血清学阳性的标本或均为阴性的标本,经PCR检测均为阴性,说明FilmArray呼吸道检测和PCR法一致性较好。
呼吸道病毒感染往往不是单一的病毒感染,可合并其他病原体感染。研究[22]发现,肺炎支原体感染在儿童中的患病率最高,其中以肺炎支原体合并呼吸道合胞病毒感染最为常见,因此对呼吸道感染患者的检测不能仅仅局限于某个病毒的检测,也要考虑混合感染的可能,FilmArray可检测20种呼吸道病原体,能更高效的检测患者感染的病原体种类。此外,在患有急性呼吸道疾病患者中,病毒是最常见的可检测病原体,虽然可能存在普遍使用抗菌药物的现象,但是检测出细菌比病毒的概率要低。抗菌药物过度使用的部分原因是急性呼吸道疾病病原体的不确定性,因此,可以通过FilmArray检测早期识别病原体,从而减少抗菌药物的过度使用。临床研究[23]表明,使用FilmArray可缩短抗菌药物使用的持续时间、患者住院时间和隔离时间。
FilmArray检测相比其他检测方法更有优势。一项大型儿童医院FilmArray检测评估[24]结果显示,FilmArray比直接免疫荧光法具有更高的敏感性。一项国外研究[25]收集315份急性呼吸道感染患者的呼吸道样本,用免疫荧光法和FilmArray检测法分别检测8种呼吸道病毒,检测结果显示阳性率分别为75%和92%,两种方法阳性一致率为70.5%,阴性一致率为99.6%。虽然诊断呼吸道病毒最常用的方法仍然是免疫荧光法,但将分子方法纳入常规程序将大大提高感染的诊断率。FilmArray检测还能够检测其他病毒,如冠状病毒NL63、229E、OC43、HKU1和博卡病毒[26],由此可知FilmArray检测优于传统的免疫荧光法。虽然多重PCR也可以同时检测多种呼吸道病毒,但FilmArray检测操作更简单、检测时间更短、检测混合病毒感染的敏感性更高[27]。
综上所述,FilmArray检测为呼吸道感染的早期诊断提供了一种很好的检测方法, 可以帮助临床医生快速诊断病毒性呼吸道感染性疾病,有助于合理地应用抗病毒药物, 减少抗菌药物滥用以及减轻患者的经济负担。
4 总结与展望呼吸道感染性疾病严重危害着中老年人及儿童的健康。快速及准确地检出病原体,对患者个性化治疗及预后有着重要作用。病原体培养及常规PCR检测结果准确度高,但耗时较长,POCT能够简化操作环节,缩短检测时间,能够快速、有效地诊断呼吸道感染性疾病,该技术是当前转化研究的热点,不断更新迭代。其中FilmArray呼吸道检测能提高呼吸道病原体的检出率,有助于合理使用抗病毒药物,减少不必要的抗菌药物使用,为早期诊断及治疗提供良好的依据,将是以后医疗机构内检测呼吸道感染性疾病的重要手段之一。
虽然FilmArray可靠性、实用性和准确性均能满足临床诊断需求,但是标本采集方式不当也会影响检测结果,应重视影响检测结果的分析前因素,避免干扰;此外,由于每个实验室检测结果还不能统一标准化,检测项目的不同方法之间尚存在差异,因此,POCT检测结果应定期与临床实验室检测结果进行比对,确保医疗机构内检测结果的一致性;并且检测人员应经过规范的培训,按照厂商规定的要求进行操作,以保证检测安全有效;最后还需要相关高质量的临床随机对照试验进行确认,以及质量控制及临床监管。
| [1] |
Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet, 2012, 380(9859): 2095-2128. DOI:10.1016/S0140-6736(12)61728-0 |
| [2] |
Clark TW, Medina MJ, Batham S, et al. Adults hospitalised with acute respiratory illness rarely have detectable bacteria in the absence of COPD or pneumonia; viral infection predominates in a large prospective UK sample[J]. J Infect, 2014, 69(5): 507-515. DOI:10.1016/j.jinf.2014.07.023 |
| [3] |
Widmer K, Zhu Y, Williams JV, et al. Rates of hospitalizations for respiratory syncytial virus, human metapneumovirus, and influenza virus in older adults[J]. J Infect Dis, 2012, 206(1): 56-62. DOI:10.1093/infdis/jis309 |
| [4] |
Malosh RE, Martin ET, Ortiz JR, et al. The risk of lower respiratory tract infection following influenza virus infection: a systematic and narrative review[J]. Vaccine, 2018, 36(1): 141-147. DOI:10.1016/j.vaccine.2017.11.018 |
| [5] |
Sellers SA, Hagan RS, Hayden FG, et al. The hidden burden of influenza: a review of the extra-pulmonary complications of influenza infection[J]. Influenza Other Respir Viruses, 2017, 11(5): 372-393. DOI:10.1111/irv.12470 |
| [6] |
Mauskopf J, Klesse M, Lee S, et al. The burden of influenza complications in different high-risk groups: a targeted literature review[J]. J Med Econ, 2013, 16(2): 264-277. DOI:10.3111/13696998.2012.752376 |
| [7] |
Miravitlles M, Anzueto A. Chronic respiratory infection in patients with chronic obstructive pulmonary disease: what is the role of antibiotics?[J]. Int J Mol Sci, 2017, 18(7): 1344. DOI:10.3390/ijms18071344 |
| [8] |
Bouneb R, Mellouli M, Bensoltane H, et al. Characteristics and outcome of ill critical patients with influenza A infection[J]. Pan Afr Med J, 2018, 29: 174. |
| [9] |
Schanzer DL, Schwartz B. Impact of seasonal and pandemic influenza on emergency department visits, 2003-2010, Ontario, Canada[J]. Acad Emerg Med, 2013, 20(4): 388-397. DOI:10.1111/acem.12111 |
| [10] |
Shimetani N. Potential of next-generation POCT in infectious disease rapid test[J]. Med Mycol J, 2017, 58(3): J91-J94. DOI:10.3314/mmj.17.012 |
| [11] |
Gilkar A, Fink R, Eardley P, et al. The effect of 'On-Line' POCT on patient waiting times in an accident and emergency department[J]. BMJ Qual Improv Rep, 2013, 2(1): u201027.w685. DOI:10.1136/bmjquality.u201027.w685 |
| [12] |
王辉, 曹彬. 新的微生物诊断技术对呼吸道感染诊治的影响: 现状与展望[J]. 中华检验医学杂志, 2011, 34(8): 673-675. DOI:10.3760/cma.j.issn.1009-9158.2011.08.001 |
| [13] |
Chartrand C, Leeflang MM, Minion J, et al. Accuracy of rapid influenza diagnostic tests: a Meta-analysis[J]. Ann Intern Med, 2012, 156(7): 500-511. DOI:10.7326/0003-4819-156-7-201204030-00403 |
| [14] |
Mustafa MI, Al-Marzooq F, How SH, et al. The use of multiplex real-time PCR improves the detection of the bacterial etio-logy of community acquired pneumonia[J]. Trop Biomed, 2011, 28(3): 531-544. |
| [15] |
Brendish NJ, Malachira AK, Clark TW. Molecular point-of-care testing for respiratory viruses versus routine clinical care in adults with acute respiratory illness presenting to secondary care: a pragmatic randomised controlled trial protocol (ResPOC)[J]. BMC Infect Dis, 2017, 17(1): 128. DOI:10.1186/s12879-017-2219-x |
| [16] |
Leber AL, Everhart K, Daly JA, et al. Multicenter evaluation of BioFire FilmArray respiratory panel 2 for detection of viruses and bacteria in nasopharyngeal swab samples[J]. J Clin Microbiol, 2018, 56(6): e01945-17. |
| [17] |
BioFire Diagnostics. BioFire® FilmArray® system documents[EB/OL].[2020-05-02]. https://www.biofiredx.com/support/documents.
|
| [18] |
Poritz MA, Blaschke AJ, Byington CL, et al. FilmArray, an automated nested multiplex PCR system for multi-pathogen detection: development and application to respiratory tract infection[J]. PLoS One, 2011, 6(10): e26047. DOI:10.1371/journal.pone.0026047 |
| [19] |
Pierce VM, Elkan M, Leet M, et al. Comparison of the Idaho technology FilmArray system to real-time PCR for detection of respiratory pathogens in children[J]. J Clin Microbiol, 2012, 50(2): 364-371. DOI:10.1128/JCM.05996-11 |
| [20] |
Butt SA, Maceira VP, McCallen ME, et al. Comparison of three commercial RT-PCR systems for the detection of respiratory viruses[J]. J Clin Virol, 2014, 61(3): 406-410. DOI:10.1016/j.jcv.2014.08.010 |
| [21] |
李锦, 干驰, 赵瑞珂, 等. FilmArray呼吸道测试条快速检测肺炎支原体的临床应用[J]. 中华检验医学杂志, 2018, 41(5): 390-394. DOI:10.3760/cma.j.issn.1009-9158.2018.05.013 |
| [22] |
Kompanikova J, Zumdick A, Neuschlova M, et al. Microbiologic methods in the diagnostics of upper respiratory tract pathogens[J]. Adv Exp Med Biol, 2017, 1020: 25-31. |
| [23] |
Rogers BB, Shankar P, Jerris RC, et al. Impact of a rapid respiratory panel test on patient outcomes[J]. Arch Pathol Lab Med, 2015, 139(5): 636-641. DOI:10.5858/arpa.2014-0257-OA |
| [24] |
Couturier MR, Barney T, Alger G, et al. Evaluation of the FilmArray® respiratory panel for clinical use in a large children's hospital[J]. J Clin Lab Anal, 2013, 27(2): 148-154. DOI:10.1002/jcla.21576 |
| [25] |
Marcone DN, Carballal G, Ricarte C, et al. Respiratory viral diagnosis by using an automated system of multiplex PCR (FilmArray) compared to conventional methods[J]. Rev Argent Microbiol, 2015, 47(1): 29-35. |
| [26] |
Xu M, Qin X, Astion ML, et al. Implementation of FilmArray respiratory viral panel in a core laboratory improves testing turnaround time and patient care[J]. Am J Clin Pathol, 2013, 139(1): 118-123. DOI:10.1309/AJCPH7X3NLYZPHBW |
| [27] |
赵莉, 李贵霞, 赵民, 等. 多重荧光定量PCR方法在呼吸道合胞病毒和腺病毒检测中的Meta分析[J]. 中华实验和临床病毒学杂志, 2018, 32(5): 548-552. DOI:10.3760/cma.j.issn.1003-9279.2018.05.021 |



