2. 湖南中医药大学药学院食品药品工程系, 湖南 长沙 410208
2. Department of Food and Drug Engineering, School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China
抗生素相关性腹泻(antibiotic-associated diarrhea,AAD)是应用抗生素后引起的腹泻,根据是否由特定病原菌引起,可分为感染AAD和非感染性AAD,感染性AAD的常见致病菌为艰难梭菌(CD, Clostridium difficile)。约5%~35%患者接受抗生素治疗后发生AAD [1],且随着抗生素的广泛使用,AAD的发病率呈现上升趋势,其发病原因复杂多样,目前认为AAD主要是由于抗生素的使用破坏了肠道微生态平衡所致[2]。
CD又名难辨梭状芽孢杆菌,是一种多重耐药性厌氧的条件致病菌,随着艰难梭菌感染(Clostridium difficile infection, CDI)的事件和严重程度显著增加,已被公认为全球医院AAD的主要病原体[3]。CD可通过形成孢子引发和传播疾病,并导致疾病复发,复发率高达30%[4-5]。在结肠中,孢子萌发成营养细胞,在肠道主要产生毒素A(TcdA) 和毒素B(TcdB),以及艰难梭菌转移酶毒素等[5]。研究[6]表明,AAD与CD感染相关,大量使用抗生素会引起肠道菌群失调,进而增加肠道氨基酸水平,抑制次级胆汁酸产生,为CD定植创造条件。此外CD还可通过结合纤溶酶原(hPLG)和抑制血红素毒性促进腹泻[7-8]。
AAD发病方式复杂多样,其发病机制还有待进一步研究[5, 9]。随着高毒力菌株027和078的出现,以及克林霉素、头孢菌素等抗生素的大量使用, 艰难梭菌相关腹泻已成为全球关注的问题[10]。加拿大、美国以及一些欧洲国家多次出现CDI的暴发流行,给各国的医疗保健系统带来沉重负担。本文通过综述AAD与CD相关的研究进展,旨在从CD的角度对AAD防治提供新的思路和方法,以期改进AAD的治疗与预防。
1 CD是引起AAD的主要致病菌CD是引起AAD的主要原因,其并发症也存在不同程度的腹泻(见表 1)[11]。AAD患者发生CDI,抑制肠道内有益菌的生长,耐药性CD过度增殖[3]。相比其他原因引起的腹泻,CD致AAD有较为严重临床症状,表现为结肠炎和假膜性肠炎而引起黏液、脓血便以及全身症状,严重感染可致死。因此,随着抗生素的广泛使用,不但要预防AAD的发生,更应该关注由CD引起的AAD。
| 表 1 抗生素相关CDI并发症及其临床特征 |
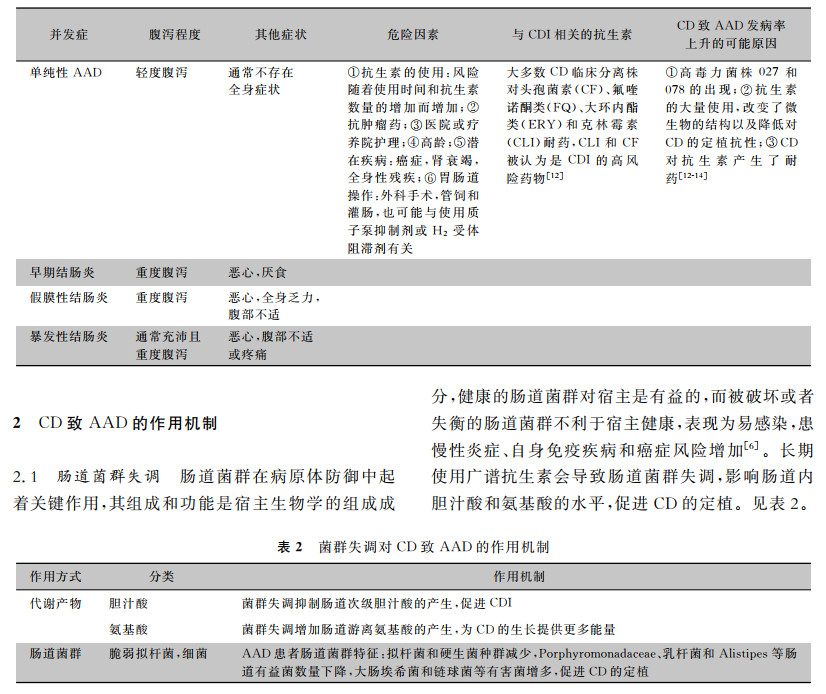
|
肠道菌群在病原体防御中起着关键作用,其组成和功能是宿主生物学的组成成分,健康的肠道菌群对宿主是有益的,而被破坏或者失衡的肠道菌群不利于宿主健康,表现为易感染,患慢性炎症、自身免疫疾病和癌症风险增加[6]。长期使用广谱抗生素会导致肠道菌群失调,影响肠道内胆汁酸和氨基酸的水平,促进CD的定植。见表 2。
| 表 2 菌群失调对CD致AAD的作用机制 |

|
健康的肠道微生物能建立和维持对CD的定植抗性,而AAD患者肠道菌群很大一个特点就是菌群失调,且肠道代谢产物和肠道微生物群落结构都发生了改变,表现为抑制CD生长的代谢产物和肠道菌群多样性减少,降低了肠道菌群对CD的定植抗性,而肠道内氨基酸(脯氨酸:CD生长能量来源之一)增加,为CD的定植创造了条件[6, 13]。因此菌群失调可促进CD导致AAD的发生。
2.1.2 菌群失调促进CD致AAD的方式肠道中的某些细菌可分泌色氨酸衍生的抗生素(1-乙酰基-β-咔啉和turbomycin A),两种抗生素均可通过抑制CD分裂时隔膜的形成,抑制CD生长繁殖,次级胆汁酸(脱氧胆酸和石胆酸)可增强这些抗生素的抑制活性,菌群失调引起肠道内分泌次级胆汁酸菌群减少。因此菌群失调可以通过抑制次级胆汁酸的产生从而促进CD生长[15, 6]。
CD可从氨基酸分解代谢中获得能量,在低浓度次级胆汁酸条件下,氨基酸明显促进CD的生长繁殖[15, 10]。菌群失调引起肠道游离氨基酸(尤其是脯氨酸)含量增加,从而促进CD生长[10]。Battaglioli等[6]将AAD患者肠道菌群移植给无菌小鼠,小鼠感染CD后,肠道氨基酸浓度增加,且CD易感性升高, 而将健康人类粪便菌群移植到小鼠肠道内,游离脯氨酸的浓度降低,CD定植受到抑制。即菌群失调可以促进肠道氨基酸合成,为CD定植提供能量,提示可以通过调节人体对氨基酸的摄取,改善CD引起的AAD。
2.2 CD与AAD的相互作用CD与AAD之间存在相互作用。研究[16-17]指出,使用抗生素导致肠道巨噬细胞对细菌刺激反应过度,产生过量的炎症因子,同时改变肠道代谢组成,为CD创造有益的生长环境,且由于抗生素常见的副作用是肠道菌群失衡,肠道内抑制CD生长的物质和抑制色氨酸衍生的抗生素的菌群均减少,促进CD繁殖和毒素释放,加重AAD的症状。且随着一种高毒力流行菌株BI/NAP1/027的出现,以及广谱抗生素的广泛使用,特别是克林霉素、氟喹诺酮类和头孢菌素,AAD的发病率显著升高。
微生物对抗生素产生耐药的情况很多,近年研究发现,一些微生物耐药机制受到群体感应系统的调控。群体感应是指细菌细胞间可通过互相通信联系以协调基因的表达, 以群体的形式对不断变化的环境条件作出反应。Darkoh等[18]发现CD毒素的产生主要受新型硫代内酯群体信号肽的控制,而这种肽独立于tcdC基因的调控。毒素A和B受辅助基因调节剂(Agr)群体信号系统控制,Agr系统转录包含agrA,-B,-C和-D的四基因操纵子,agrB1和argD1基因座负责产生TI信号(肽硫代内酯AIP称为TI信号),TI信号是激活毒素产生硫代内酯信号肽所必须的[19]。AAD患者肠道的微生物群发生改变,促进耐药的CD在肠道中增殖,并迅速形成细胞群后释放TI信号,激活AgrA2和AgrC2两组分系统,直接或间接诱导毒素基因发生转录,刺激毒素产生[20, 13]。
细菌生物被膜是附着在生物或者非生物表面并由胞外基质所包裹的系统化、组织化的多细胞群落,对细菌有保护作用,能避免细菌受不利环境(如抗生素)的影响, 此也是细菌对抗生素产生耐药的原因之一[12]。研究发现,CD对抗生素产生耐药可能是由于刺激了生物膜的形成,通过形成多层结构化生物膜提高CD的抗微生物能力,该生物膜的形成主要是由CD固有的机制驱动,但暴露于环境中抗生素的选择性压力也会刺激生物膜形成,然而,梭菌生物膜如何有助于CD获得抗药性的具体机制尚不十分清楚[20]。因此,滥用抗生素会加重CDI,在使用抗生素治疗疾病时,应该预防CD感染。
2.3 CD与肠道菌群相互作用CD引起的AAD抗药性不能归因于单一菌群作用,而是多种微生物以及与环境相互作用的结果。健康的肠道菌群能抑制CD生长,可以产生抑制CD的代谢产物,而肠道菌群失衡时促进CD的生长,如滥用抗生素改变了肠道菌群结构,主要表现为变形杆菌增加,拟杆菌和硬生菌种群减少,Porphyromonadaceae、乳杆菌和Alistipes等有益菌数量下降,大肠埃希菌和链球菌等有害菌增多,从而促进CD的高水平定植。肠道菌群的代谢产物改变也能够影响CD的生长繁殖和发病机制,包括影响CD孢子萌发,营养物质摄取和毒素产生等过程[13]。由于多种菌群都表现出对CD的定植抗性,而有关抗生素、肠道菌群和CD之间相互作用的研究很少,因此需要进一步的研究[21]。
2.4 CD导致AAD的物质 2.4.1 细胞毒素A和细胞毒素BCD本身没有侵袭性,主要通过分泌TcdA和TcdB致病,分别由基因tcdA和tcdB编码,基因tcdC和tcdD调控,CDI患者存在tcdC部分碱基缺失和多态性,引起毒素A和毒素B的产生增加[21]。TcdA可以结合细菌DNA激活Toll样受体9(TLR9),TLR9可识别细菌DNA以促进炎症反应,TcdA还可通过与肠道黏膜受体结合诱导固有层巨噬细胞产生白介素-1、6、8和α肿瘤坏死因子及环氧合酶-2,导致上皮细胞破裂坏死和单层肠上皮细胞的紧密连接断裂,从而导致腹泻[22, 17];TcdB可以刺激单核细胞释放炎症因子,直接破坏肠壁细胞, 引起炎症反应进而使肠黏膜细胞变性、凋亡、坏死和脱落,导致腹泻[23]。医院腹泻患者的临床分离株通常同时产生毒素A和B,但是越来越多的报告提到毒素A阴性,毒素B阳性(A-/B+)菌株能引起严重感染[14]。此外,毒素刺激固有免疫细胞和中毒上皮细胞生成促炎因子和趋化因子,增强炎症免疫应答,促进CDI[5, 24]。
2.4.2 hPLGhPLG是纤溶酶的前体,是哺乳动物的丝氨酸蛋白酶之一,在纤维蛋白溶解、细胞迁移和组织重塑、基底膜和细胞外基质(ECM) 的降解中起重要作用[7, 25]。hPLG在毒素诱导的肠道损伤部位表达,导致IL-1A、IL-1B、IL-3、IL-10、IL-12B、G-CSF、GM-CSF等细胞因子上调,促进组织降解,此外,CD的孢子可特异性结合hPLG及活化后的纤溶酶,纤溶酶原被招募至肠道损伤部位并与CD的孢子表面结合,在被激活为纤溶酶后切割孢子表面蛋白以促进CD的孢子萌发,从而恶化CD诱导的腹泻[7]。研究发现,抗纤溶酶抗体可有效抑制hPLG的激活,从而降低CDI,提示靶向纤溶酶原活化是治疗CDI的潜在策略[7]。
2.4.3 血红素以往研究中,CDI患者胃肠腔裂解红细胞中检测到高浓度血红蛋白,血红素是血红蛋白的含铁原卟啉辅因子,在许多氧化还原反应中起到酶催化的作用,包括参与呼吸过程和抗氧化应[26, 8]。血红素对CD具有一定毒性,CD可通过HatRT外排系统减少毒性,但HatRT对CD定植和肠道内维持并不起作用,表明存在另外应对血红素的机制[26]。研究发现,CD存在一个CD血红素感应膜蛋白(HsmRA)系统,能通过转录因子HsmR和HsmA感知血红素,转录因子HsmR通过结合血红素激活HsmA,后者可降低血红素毒性并利用血红素降低氧化应激,从而促进CD在肠道内定植并赋予其对抗菌药物的抗性,表明靶向HsmR或HsmA的药物开发可用于CDI治疗[8]。3 CDI引起AAD的治疗
3.1 非药物治疗 3.1.1 粪便菌群移植粪便菌群移植是指将健康人粪便菌群移入患者肠道内,通过增加肠道定植抗性和恢复保护作用,抑制CD生长,此治疗方法的优点是快速、经济、有效,并且有助于根除CD的抗生素耐药菌株,是治疗CDI和复发性CDI(rCDI)最有效的方法,一次治愈率高达91%。而对于患肿瘤及接受造血干细胞移植的青少年儿童,推荐使用各类抗生素治疗,不推荐粪菌移植[27]。菌群移植能使患者的菌群趋向于供体菌群,重新恢复肠道菌群平衡和增加短链脂肪酸水平[28]。粪便移植可改善CDI的治疗效果,但捐献者菌群转移到接受者的同时可能导致其他病原体的感染和传播[29]。
3.1.2 益生菌益生菌作为肠道菌群的一大类别,能够通过抑制致病菌帮助机体维持肠道平衡,还可能刺激免疫系统防止病原体黏附和入侵,清除肠道中的病原体和毒素[30]。鲍氏酵母菌(S. boulardii) 是一种特异性酵母来源的益生菌,可通过上调TcdA的总抗体和特异性肠道抗体(IgA),或通过释放一种蛋白酶水解CD毒素预防CDI[31-32]。分析8 000多份住院期间使用抗生素的患者资料发现,补充鲍氏酵母菌可降低CDI的发病率,且在使用抗生素后24 h之内补充效果更好[21, 33]。临床试验证实,特定益生菌能预防AAD和CDI复发[34]。因此使用益生菌可以预防和改善CD引起的AAD。
3.1.3 靶向CD毒素制剂CDI由分泌型蛋白毒素介导,其毒力由肌醇己糖磷酸(IP6) 变构激活其蛋白酶结构域后的细胞内自身蛋白水解调节。研究发现,TcdB进入细胞后发生构象变化,葡糖基转移酶及邻近的半胱氨酸蛋白酶结构域进入细胞质,此时胞内IP6作为变构激活剂触发毒素自身蛋白发生水解,释放出游离的葡糖基转移酶[35]。肠道中的高浓度钙离子可螯合IP6,CDI小鼠口服对钙络合敏感性降低的IP6类似物后,进入细胞葡糖基转移酶减少,从而抑制了CDI引起的炎症[35]。因此设计了一种在生理条件的钙离子浓度下维持变构活性的IP6类似物,可抑制CDI,且靶向CD毒素能避免对细菌施加选择性压力,从而降低发生耐药的可能性。
3.2 药物治疗甲硝唑或万古霉素是治疗CDI腹泻的常用药,患者口服甲硝唑(500 mg, 每日3次或250 mg, 每日4次)和口服万古霉素(125 mg,每日4次)具有相似的效果,两种药物对轻症感染者的治疗无差异,但对于重症患者,万古霉素效果更好,甲硝唑能避免院内病例中产生耐万古霉素肠球菌的风险[36-37]。近年来,国外相继出现了耐甲硝唑和万古霉素CD的报道,且发现使用这两种药物后复发率较高,约10%~40%的患者被改善后复发CDI[38]。
中医在中国已经有3000多年的历史,而且由于中药资源丰富,成本低、副作用少等特点,已经逐渐获得医学界的认可,中西结合治疗疾病在中国医疗体系中发挥着越来越重要的作用。在临床实践中, 中药治疗AAD有很好的疗效[39]。与使用安慰剂的小鼠相比,用中药治疗的CDI小鼠粪便中的毒素明显减少[39]。研究发现,中药小檗碱和万古霉素联合治疗可以协同抑制CD生长和调节肠道菌群平衡,且能预防万古霉素治疗引起的CDI复发[40]。体外试验证实,某些传统中医复方制剂可以抑制CD生长和毒素的产生,如在tcdA+tcdB+CD中,参苓白术散组和理中汤组对tcdA和tcdB基因的表达分别表现为显著抑制和完全抑制;而对于tcdA-tcdB+CD, 两种中药复方制剂则完全抑制tcdB基因的表达[41]。因此,可以运用中药复方制剂或中西药相结合的方式治疗CD导致的AAD。
4 总结研究显示,AAD发病率在全国乃至国外呈现逐年上升趋势,且随着高毒力菌株027和078的出现,CD的致病性和致死率提高,CDI的风险也显著升高。AAD发病率的逐年增长可能与抗生素在国内外大量使用密切相关。随着国内外医院对抗生素的需求增加,抗生素滥用的现象屡见不鲜,应严格限制抗生素的使用量,同时改善肠道菌群失衡,预防CD所致AAD的发生[42]。近年来,围绕AAD与CDI之间的研究已成为热点,研究结果也证实了AAD与CD密切相关[18]。AAD患者存在菌群失调,表现为产生抑制CD生长物质和色氨酸衍生的抗生素菌群减少,肠道代谢产物次级胆汁酸的产生减少,而游离氨基酸含量增加,为CD的定植创造条件。CD主要通过分泌TcdA和TcdB诱导AAD,也可以通过hPLG和血红素促进CDI导致AAD的发生。粪便移植可以帮助机体恢复肠道菌群平衡,口服益生菌能够抑制CD生长,西药治疗复发率高且易产生耐药性,但相关中医药可以有效预防CDI的复发,中药复方制剂在抑制CD生长和其毒素产生方面疗效也十分显著。
综上所述,AAD发生与CD密切相关,研究AAD与CD之间的相关性有望从CDI的角度揭示AAD的发病机制。且由于AAD的发病方式复杂多样,CD致AAD的相关机制还有待更深入的研究。全面和深入地了解CD与AAD之间的关系,可以为临床更合理、有效的治疗和预防CD导致的AAD提供参考。
| [1] |
Bartlett JG. Antibiotic-associated diarrhea[J]. Br J Surg, 2002, 89(S1): 77. |
| [2] |
Ackermann G, Thomalla S, Ackermann F, et al. Prevalence and characteristics of bacteria and host factors in an outbreak situation of antibiotic-associated diarrhoea[J]. J Med Microbiol, 2005, 54(Pt 2): 149-153. |
| [3] |
Britton RA, Young VB. Role of the intestinal microbiota in resistance to colonization by Clostridium difficile[J]. Gastroenterology, 2014, 146(6): 1547-1553. DOI:10.1053/j.gastro.2014.01.059 |
| [4] |
Seekatz AM, Young VB. Clostridium difficile and the microbiota[J]. J Clin Invest, 2014, 124(10): 4182-4189. DOI:10.1172/JCI72336 |
| [5] |
Abt MC, McKenney PT, Pamer EG. Clostridium difficile colitis: pathogenesis and host defence[J]. Nat Rev Microbiol, 2016, 14(10): 609-620. DOI:10.1038/nrmicro.2016.108 |
| [6] |
Battaglioli EJ, Hale VL, Chen J, et al. Clostridioides difficile uses amino acids associated with gut microbial dysbiosis in a subset of patients with diarrhea[J]. Sci Transl Med, 2018, 10(464): eaam7019. DOI:10.1126/scitranslmed.aam7019 |
| [7] |
Awad MM, Hutton ML, Quek AJ, et al. Human plasminogen exacerbates Clostridioides difficile enteric disease and alters the spore surface[J]. Gastroenterology, 2020, 159(4): 1431-1443. DOI:10.1053/j.gastro.2020.06.032 |
| [8] |
Knippel RJ, Wexler AG, Miller JM, et al. Clostridioides difficile senses and hijacks host heme for incorporation into an oxidative stress defense system[J]. Cell Host Microbe, 2020, 28(3): 411-421. DOI:10.1016/j.chom.2020.05.015 |
| [9] |
VanInsberghe D, Elsherbini JA, Varian B, et al. Diarrhoeal events can trigger long-term Clostridium difficile colonization with recurrent blooms[J]. Nat Microbiol, 2020, 5(4): 642-650. DOI:10.1038/s41564-020-0668-2 |
| [10] |
Zucca M, Scutera S, Savoia D. Novel avenues for Clostridium difficile infection drug discovery[J]. Expert Opin Drug Discov, 2013, 8(4): 459-477. DOI:10.1517/17460441.2013.770466 |
| [11] |
Bartlett JG. Clostridium difficile: history of its role as an enteric pathogen and the current state of knowledge about the organism[J]. Clin Infect Dis, 1994, 18(Suppl 4): S265-S272. |
| [12] |
Spigaglia P, Mastrantonio P, Barbanti F. Antibiotic resistances of Clostridium difficile[J]. Adv Exp Med Biol, 2018, 1050: 137-159. |
| [13] |
Theriot CM, Young VB. Interactions between the gastrointestinal microbiome and Clostridium difficile[J]. Annu Rev Microbiol, 2015, 69: 445-461. DOI:10.1146/annurev-micro-091014-104115 |
| [14] |
Schubert AM, Sinani H, Schloss PD. Antibiotic-induced altera- tions of the murine gut microbiota and subsequent effects on colonization resistance against Clostridium difficile[J]. mBio, 2015, 6(4): e00974. |
| [15] |
Kang JD, Myers CJ, Harris SC, et al. Bile acid 7α-dehydroxylating gut bacteria secrete antibiotics that inhibit Clostridium difficile: role of secondary bile acids[J]. Cell Chem Biol, 2019, 26(1): 27-34. e4. DOI:10.1016/j.chembiol.2018.10.003 |
| [16] |
Scott NA, Andrusaite A, Andersen P, et al. Antibiotics induce sustained dysregulation of intestinal T cell immunity by perturbing macrophage homeostasis[J]. Sci Transl Med, 2018, 10(464): eaao4755. DOI:10.1126/scitranslmed.aao4755 |
| [17] |
Bartlett JG. Clinical practice. Antibiotic-associated diarrhea[J]. N Engl J Med, 2002, 346(5): 334-339. DOI:10.1056/NEJMcp011603 |
| [18] |
Darkoh C, DuPont HL, Norris SJ, et al. Toxin synthesis by Clostridium difficile is regulated through quorum signaling[J]. mBio, 2015, 6(2): e02569. |
| [19] |
Darkoh C, Odo C, DuPont HL. Erratum for Darkoh, et al. "accessory gene regulator-1 locus is essential for virulence and pathogenesis of Clostridium difficile"[J]. mBio, 2017, 8(5): e01643-17. |
| [20] |
Peng Z, Jin DZ, Kim HB, et al. Update on antimicrobial resistance in Clostridium difficile: resistance mechanisms and antimicrobial susceptibility testing[J]. J Clin Microbiol, 2017, 55(7): 1998-2008. DOI:10.1128/JCM.02250-16 |
| [21] |
Loo VG, Poirier L, Miller MA, et al. A predominantly clonal multi-institutional outbreak of Clostridium difficile-associa-ted diarrhea with high morbidity and mortality[J]. N Engl J Med, 2005, 353(23): 2442-2449. DOI:10.1056/NEJMoa051639 |
| [22] |
Chen XH, Yang XT, de Anda J, et al. Clostridioides difficile toxin a remodels membranes and mediates DNA entry into cells to activate toll-like receptor 9 signaling[J]. Gastroente-rology, 2020, 159(6): 2181-2192. e1. DOI:10.1053/j.gastro.2020.08.038 |
| [23] |
章黎华, 董丹凤, 江岑, 等. 院内感染艰难梭菌的毒素检测及核糖体分型研究[J]. 上海交通大学学报(医学版), 2012, 32(11): 1436-1439. DOI:10.3969/j.issn.1674-8115.2012.11.009 |
| [24] |
Kelly CP, Kyne L. The host immune response to Clostridium difficile[J]. J Med Microbiol, 2011, 60(Pt 8): 1070-1079. |
| [25] |
Law RHP, Abu-Ssaydeh D, Whisstock JC. New insights into the structure and function of the plasminogen/plasmin system[J]. Curr Opin Struct Biol, 2013, 23(6): 836-841. DOI:10.1016/j.sbi.2013.10.006 |
| [26] |
Knippel RJ, Zackular JP, Moore JL, et al. Heme sensing and detoxification by HatRT contributes to pathogenesis during Clostridium difficile infection[J]. PLoS Pathog, 2018, 14(12): e1007486. DOI:10.1371/journal.ppat.1007486 |
| [27] |
Diorio C, Robinson PD, Ammann RA, et al. Guideline for the management of Clostridium difficile infection in children and adolescents with cancer and pediatric hematopoietic stem-cell transplantation recipients[J]. J Clin Oncol, 2018, 36(31): 3162-3171. DOI:10.1200/JCO.18.00407 |
| [28] |
Kellingray L, Gall GL, Defernez M, et al. Microbial taxonomic and metabolic alterations during faecal microbiota transplantation to treat Clostridium difficile infection[J]. J Infect, 2018, 77(2): 107-118. DOI:10.1016/j.jinf.2018.04.012 |
| [29] |
Gough E, Shaikh H, Manges AR. Systematic review of intestinal microbiota transplantation (fecal bacteriotherapy) for recurrent Clostridium difficile infection[J]. Clin Infect Dis, 2011, 53(10): 994-1002. DOI:10.1093/cid/cir632 |
| [30] |
Liew CH. Dietary fibre for the prevention of cardiovascular disease[J]. Ir Med J, 2020, 113(5): 76. |
| [31] |
Parkes GC, Sanderson JD, Whelan K. The mechanisms and efficacy of probiotics in the prevention of Clostridium difficile-associated diarrhoea[J]. Lancet Infect Dis, 2009, 9(4): 237-244. DOI:10.1016/S1473-3099(09)70059-3 |
| [32] |
Qamar A, Aboudola S, Warny M, et al. Saccharomyces boulardii stimulates intestinal immunoglobulin A immune response to Clostridium difficile toxin A in mice[J]. Infect Immun, 2001, 69(4): 2762-2765. DOI:10.1128/IAI.69.4.2762-2765.2001 |
| [33] |
Wombwell E, Patterson ME, Bransteitter B, et al. The effect of Saccharomyces boulardii primary prevention on risk of hospital onset Clostridioides difficile infection in hospitalized patients administered antibiotics frequently associated with Clostridioides difficile infection[J]. Clin Infect Dis, 2021, 73(9): e2512-e2518. DOI:10.1093/cid/ciaa808 |
| [34] |
Goldenberg JZ, Yap C, Lytvyn L, et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children[J]. Cochrane Database Syst Rev, 2017, 12(12): CD006095. |
| [35] |
Ivarsson ME, Durantie E, Huberli C, et al. Small-molecule allosteric triggers of Clostridium difficile toxin B auto-proteo-lysis as a therapeutic strategy[J]. Cell Chem Biol, 2019, 26(1): 17-26. e13. DOI:10.1016/j.chembiol.2018.10.002 |
| [36] |
Zar FA, Bakkanagari SR, Moorthi KMLST, et al. A comparison of vancomycin and metronidazole for the treatment of Clostridium difficile-associated diarrhea, stratified by disease severity[J]. Clin Infect Dis, 2007, 45(3): 302-307. DOI:10.1086/519265 |
| [37] |
Johnson S, Sanchez JL, Gerding DN. Metronidazole resistance in Clostridium difficile[J]. Clin Infect Dis, 2000, 31(2): 625-626. DOI:10.1086/313955 |
| [38] |
Peláez T, Alcalá L, Alonso R, et al. Reassessment of Clostridium difficile susceptibility to metronidazole and vancomycin[J]. Antimicrob Agents Chemother, 2002, 46(6): 1647-1650. DOI:10.1128/AAC.46.6.1647-1650.2002 |
| [39] |
Guo YN, Wang J, Zhang HJ, et al. Traditional Chinese medicine QPYF as preventive treatment for Clostridium difficile associated diarrhea in a mouse model[J]. Evid Based Complement Alternat Med, 2016, 2016: 3759819. |
| [40] |
Lv Z, Peng GL, Liu WH, et al. Berberine blocks the relapse of Clostridium difficile infection in C57BL/6 mice after stan-dard vancomycin treatment[J]. Antimicrob Agents Chemo-ther, 2015, 59(7): 3726-3735. DOI:10.1128/AAC.04794-14 |
| [41] |
舒青龙, 彭淑红, 封勇, 等. 中药复方对艰难梭菌毒素基因tcdA/tcdB体外表达的影响[J]. 中国微生态学杂志, 2013, 25(4): 373-375, 380. |
| [42] |
McDonald LC, Killgore GE, Thompson A, et al. An epide-mic, toxin gene-variant strain of Clostridium difficile[J]. N Engl J Med, 2005, 353(23): 2433-2441. DOI:10.1056/NEJMoa051590 |



