腿伤克斯特菌(Kerstersia gyiorum,简称K. gyiorum)又名肢体凯斯特菌,是一种革兰阴性杆菌。2003年Coenye等[1]学者首次报道了K. gyiorum,该菌能导致慢性中耳炎、泌尿道感染、腿部溃疡、菌血症和败血症等临床疾病,但国内文献却罕有报道。为加强广大医务工作者对该菌的认识,本文就K. gyiorum致阑尾脓肿1例进行报告。
1 病历资料 1.1 病史患者男性,56岁,入院前1+d,无明显诱因突然出现中上腹胀痛不适,呈阵发性,平躺后症状稍缓解,伴恶心、呕吐胃内容物1次,无畏寒、发热、腹泻、咳嗽等不适,病程中腹痛逐渐转移至右下腹。既往高血压病史5+年,最高达180/100 mmHg,口服富马酸比索洛尔片(2.5 mg/d)、苯磺酸氨氯地平片(10 mg/d),未规律监控血压,无吸烟喝酒等不良嗜好。
1.2 体格检查入院后体格检查:体温36.9℃,脉搏74次/分,呼吸20次/分,血压124/88 mmHg。右下腹扪及压痛、反跳痛及局部肌紧张,肝脾肋下未扪及,全腹未扪及确切包块,肠鸣音不活跃,双下肢不肿。急查腹腔彩超提示:右下腹指状弱回声(肿大阑尾?)。
1.3 实验室血液及体液检查血常规:白细胞计数10.86×109/L,中性粒细胞百分比85.2%,超敏C反应蛋白(hs-CRP)128.93 mg/L(正常范围0.5~10 mg/L),血清淀粉样蛋白A(SAA)>300 mg/L(正常范围≤10 mg/L)。术前感染性疾病筛查:乙型肝炎表面抗体119.814 mIU/mL。血清电解质、血糖、血清肝肾功能、心肌损伤标志物、凝血功能检测、尿粪便常规等检查未见明显异常。
1.4 微生物学检查患者入院当日行急诊手术切除阑尾,送阑尾脓液标本行细菌培养及鉴定。将所送脓液标本直接涂片革兰染色镜检:可见大量革兰阴性杆菌。
1.4.1 阑尾脓液培养将脓液接种于麦康凯平板和血琼脂平板,置于5% CO2孵育箱、35℃培养24 h,血平板出现两种菌落形态。第一种菌落(分离菌1)呈现扁平、浅灰色、表面干燥、不透明、边缘呈扩散状的菌落形态,在麦康凯平板上菌落呈现薰衣草色素,菌量3+(呈优势生长),将该菌落分纯后行革兰染色可见革兰阴性杆菌,见图 1。手工辅助生化显示:氧化酶试验阴性,尿酶阴性,过氧化氢酶强阳性,β-半乳糖苷酶阴性。第二种菌落(分离菌2)呈灰白色、凸起,菌量2+。
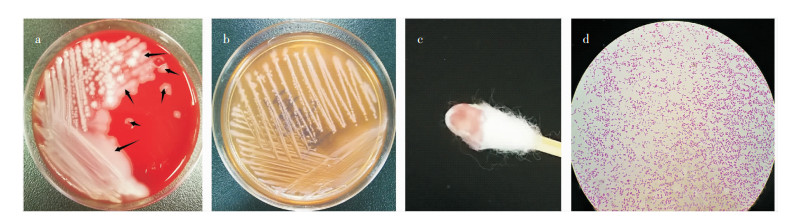 |
| 注:a为分离菌1(K. gyiorum)在血平板上形态(黑色箭头所指区域);b为分离菌1(K. gyiorum)在麦康凯平板上形态呈现薰衣草样色素;c为用棉签蘸取麦康凯上的菌落(K. gyiorum)后,薰衣草样色素更加明显;d为1 000倍显微镜下分离菌1(K. gyiorum)的革兰染色形态。 图 1 分离菌1(K. gyiorum)在血平板及麦康凯平板上的形态 Figure 1 Morphology of the isolated strain 1 (K. gyiorum) on the blood agar plate and MacConkey agar plate |
根据分离菌1的菌落形态特征及革兰染色结果,用VITEK 2 Compact系统GN卡鉴定结果是少动鞘氨醇单胞菌(可信度90%)。而用MALDI-TOF MS质谱系统分析多次鉴定结果为K. gyiorum(MALDI得分2.40,鉴定到种,见图 2)。进一步采用16S rRNA基因测序技术测定,将所测分离菌1的基因序列与GenBanK数据库中的序列进行同源性分析,该菌株与已知的Kerstersia gyiorum LMG 5906的16S rRNA的基因相似性为99.87%,登录号为NR025669.1,鉴定为K. gyiorum。所测分离菌1与Kerstersia gyiorum LMG 5906在同一分支上,属于同一种,该菌为K. gyiorum,见图 3。分离菌2经相同的质谱仪鉴定为大肠埃希菌。
 |
| 图 2 分离菌1(K. gyiorum)的蛋白指纹图谱 Figure 2 Protein fingerprint of the isolated strain 1 (K. gyiorum) |
 |
| 图 3 分离菌1(K. gyiorum)的系统进化树 Figure 3 Phylogenetic tree of the isolated strain 1 (K. gyiorum) |
使用Phoenix 50对分离的K. gyiorum进行药敏试验,根据美国临床实验室标准协会(CLSI)其他非肠杆菌目细菌MIC折点判断标准,结果显示K. gyiorum对头孢曲松、头孢他啶、哌拉西林/他唑巴坦、庆大霉素、阿米卡星、环丙沙星、左氧氟沙星、美罗培南、复方磺胺甲口恶唑敏感,对四环素中介,对磷霉素、氨曲南耐药。使用相同仪器对分离的大肠埃希菌进行药敏试验,根据CLSI肠杆菌目细菌MIC折点判断标准,结果显示大肠埃希菌对头孢曲松、头孢他啶、头孢吡肟、阿莫西林/克拉维酸、头孢哌酮/舒巴坦、亚胺培南、米诺环素敏感,对头孢呋辛、环丙沙星、四环素耐药。
1.5 诊疗过程患者于2月28日入院,初步诊断为“急性阑尾炎”,根据《国家抗微生物指南》予以静脉输入头孢曲松钠2 g抗感染治疗,结合该患者检查结果,排除手术禁忌后,当天即实施“腹腔镜阑尾切除术、腹腔引流术”,术中可见右下腹腔小肠充血水肿明显,表面覆有脓苔,阑尾中部坏疽,大小约8 cm×3 cm×2 cm,充血水肿明显,伴恶臭味,盆腔约100 mL脓液,术中送阑尾脓液行细菌培养及鉴定,同时送切除阑尾行病理检查,并在右侧髂窝-盆腔安置血浆引流管1根。术后患者禁饮禁食,临时予以静脉滴入葡萄糖氯化钠注射液500 mL,15%氯化钾注射液10 mL支持治疗,并修正诊断为“急性坏疽性阑尾炎伴局限性腹膜炎”。3月1日继续给予患者静脉输入头孢曲松钠(2 g/d)抗感染治疗,并加强换药(1次/日),口服富马酸比索洛尔片(2.5 mg/d)、苯磺酸氨氯地平片(10 mg/d)积极控制血压,嘱患者流质饮食,床旁适当活动。3月2日患者脓液培养结果显示:大肠埃希菌菌量2+,K. gyiorum菌量3+。药敏结果显示,大肠埃希菌及K. gyiorum均对头孢曲松敏感,继续当前抗感染治疗,密切观察。3月3日病理结果显示急性蜂窝织炎性阑尾炎。3月4日患者复查血常规、降钙素原、hs-CRP等检查未见明显异常,患者病情稳定,故停止输入头孢曲松钠,拔除引流管,于当日下午出院。出院后第2周门诊随访,患者手术切口愈合良好,复查相关炎性指标未见明显异常。
2 文献复习以“Kerstersia gyiorum、腿伤克斯特菌、肢体凯斯特菌”为关键词在万方数据库、维普数据库、中国知网数据库、PubMed、Medline进行搜索,从2003年首次报道到2021年共检出15篇[2-16]与人类疾病相关的英文文献(共19个案例),其中包括12例男性,7例女性。年龄16~85岁,平均年龄49岁。检出的感染类型为:耳道感染9例,腿部/脚部伤口或溃疡感染6例,血流感染1例,尿路感染1例,呼吸道感染2例;多种菌混合感染12例,单纯K. gyiorum感染7例。引起耳道及下肢感染的主要症状有耳漏、下肢肿胀、流脓等,部分患者还伴随听力的损伤,根据药敏结果选择敏感抗菌药物治疗3~14 d后,大部分患者均可治愈。此外Vandamme等[17]学者还从颈部脓肿中检出1例与K. gyiorum有亲缘关系的细菌Kerstersia similis。见表 1。
| 表 1 K. gyiorum感染性疾病的临床特点 Table 1 Clinical characteristics of infectious diseases caused by K. gyiorum |

|
2003年Coenye等[1]学者首次分离鉴定了K. gyiorum。由于该菌最初经常从腿部伤口中分离出来,所以采用“gyiorum”命名,意思是“来自于肢体”[3]。K. gyiorum属于产碱杆菌科,与产碱杆菌属、鲍特氏菌属、无色杆菌属等菌属细菌有关。K. gyiorum在环境中分布广泛,不仅在骆驼胃内、长江江豚、野猪精液及海参养殖的水体环境中均有检出[18-21],还在分泌物、尿、血、粪便等人类临床标本中大量被检出,查阅文献确定本研究为首次由K. gyiorum感染阑尾的病例报告。在由K. gyiorum引起的感染性疾病中,患者年龄主要集中在中老年阶段,慢性中耳炎及反复下肢溃疡/伤口感染等慢性感染病例占绝大部分,很多患者同时合并有糖尿病、慢性静脉功能不全等多种慢性基础疾病,并且部分患者还存在吸烟等不良生活习惯[3, 5, 10, 13],推测K. gyiorum感染可能与患者年龄、慢性感染、生活习惯及合并疾病存在较大关系,本组病例为中老年男性,自身抵抗力下降,合并高血压病史,存在由肠道感染K. gyiorum的可能,而且阑尾的解剖位置较为特殊,容易出现管腔阻塞等问题,为细菌入侵创造条件,从而引起急性炎症[22]。本文中K. gyiorum与大肠埃希菌还呈现混合感染的状态,与较多文献报道一致(混合感染的病例占半数以上),Aisenberg等[23]学者认为无色杆菌属和产碱杆菌属细菌都更容易与其他细菌一起引起混合感染,特别是在免疫力低下的患者中更是常见,因此推测具有亲缘关系的K. gyiorum也具有同样的倾向[9-10]。
急性阑尾炎是常见的急腹症之一,其中阑尾坏疽及穿孔是最为严重的并发症,手术切除阑尾是治疗急性阑尾炎的最佳方案,但阑尾切除术后切口感染率较高,占术后所有并发症的45.0%~83.8%[24],应采用抗菌药物积极预防感染。本组病例感染重,炎症指标高,查体及相关辅助检查符合急性阑尾炎的表现,因此急诊手术切除阑尾。积极搜寻致病菌,结合《国家抗微生物指南》和药敏结果给予头孢曲松钠(共4 d) 抗感染治疗,病程中采取控制血压、加强补液等对症支持治疗,术后鼓励患者适当下床活动及尽早流质饮食以促进胃肠功能恢复,患者术后恢复良好,出院后回访显示手术切口愈合良好,成功治愈。药敏结果显示K. gyiorum对氨基糖苷类、环丙沙星、美罗培南和广谱头孢菌素类敏感,与文献[1-2]报道相同,但与学者[3-7, 15]报道有所不同(K. gyiorum对环丙沙星耐药)。研究[14]显示,K. gyiorum含有潜在的喹诺酮耐药基因(gyrB、gyrA)和多种药物外排泵,从而导致相关抗菌药物耐药。K. gyiorum中也检测出完整的鞭毛调节基因,导致K. gyiorum能在复杂不利的环境中生存并产生致病性[14],应引起广大医务人员的重视。
大量使用抗菌药物可能使急性阑尾炎的病原菌耐药率逐渐增加,并且会造成病原菌的变迁[25],因此对病原菌的正确鉴定显得尤为重要。本案例分离的K. gyiorum菌落形态与相关学者[3, 15-16]报道相同,在麦康凯平板上具有薰衣草样色素。鉴于K. gyiorum独特的形态特征,Baran等[10]学者认为若是由慢性炎症部位培养出具有扁平、浅灰色、表面干燥、不透明、边缘呈扩散状的菌落形态,同时在麦康凯平板上出现薰衣草样色素,鉴定时应考虑K. gyiorum的可能。K. gyiorum的生化表型特征与粪产碱杆菌相似,但K. gyiorum的氧化酶、尿酶和β-半乳糖苷酶阴性,过氧化氢酶强阳性,没有水果味,可以此区分,但仍然无法明确鉴定为K. gyiorum。VITEK 2 Compact系统也属于生化表型鉴定,受多种因素,包括菌悬液浓度、培养液的营养成分等影响,容易误鉴定K. gyiorum[26]。MALDI-TOF MS质谱系统具有快速、简便、准确等特点,MALDI-TOF MS质谱系统可对粪产碱杆菌、K. gyiorum等产碱杆菌科细菌进行有效鉴定[27],为临床正确诊断及合理用药提供有力的支持。但由于VITEK MS质谱系统菌库不包含K. gyiorum,所以有学者[3, 7, 16]使用该系统不能正确鉴定K. gyiorum。目前16S rRNA基因测序检测是细菌鉴定的金标准,但对实验室人员及环境设备要求较高,而且成本高,操作复杂,较难在基层实验室推广。因此若是怀疑K. gyiorum,应综合考虑选择合适的鉴定方法。
综上所述,对于由K. gyiorum感染引起的阑尾脓肿,应重视病原菌的搜寻,灵活应用MALDI-TOF MS质谱系统等鉴定手段,并通过手术及使用敏感抗菌药物,可治愈阑尾脓肿。但由于传统的鉴定技术及常见的自动化细菌鉴定仪不能对K. gyiorum正确鉴定,客观上导致该菌的报道较少,因此K. gyiorum的致病性可能被低估,相关致病机制及耐药机制还有待进一步研究。
| [1] |
Coenye T, Vancanneyt M, Cnockaert MC, et al. Kerstersia gyiorum gen. nov., sp. nov., a novel Alcaligenes faecalis-like organism isolated from human clinical samples, and reclassification of Alcaligenes denitrificans Rüger and Tan 1983 as Achromobacter denitrificans comb. nov[J]. Int J Syst Evol Microbiol, 2003, 53(Pt 6): 1825-1831. |
| [2] |
Almuzara MN, Barberis CM, Traglia GM, et al. Isolation of Kerstersia gyiorum from a patient with cholesteatomatous chronic otitis media[J]. J Clin Microbiol, 2012, 50(11): 3809-3811. DOI:10.1128/JCM.02051-12 |
| [3] |
Pence MA, Sharon J, McElvania Tekippe E, et al. Two cases of Kerstersia gyiorum isolated from sites of chronic infection[J]. J Clin Microbiol, 2013, 51(6): 2001-2004. DOI:10.1128/JCM.00829-13 |
| [4] |
Deutscher M, Severing J, Balada-Llasat JM. Kerstersia gyiorum isolated from a bronchoalveolar lavage in a patient with a chronic tracheostomy[J]. Case Rep Infect Dis, 2014, 2014: 479581. |
| [5] |
Mwalutende A, Mshana SE, Mirambo MM, et al. Two cases of chronic suppurative otitis media caused by Kerstersia gyiorum in Tanzania: is it an underappreciated pathogen in chronic otitis media?[J]. Int J Infect Dis, 2014, 29: 251-253. DOI:10.1016/j.ijid.2014.10.022 |
| [6] |
Uysal EB, Çelik C, Tuzcu N, et al. A case of chronic suppurative otitis media caused by Kerstersia gyiorum[J]. APMIS, 2015, 123(11): 986-989. DOI:10.1111/apm.12434 |
| [7] |
Bostwick AD, Zhang C, Manninen K, et al. Bacteremia caused by Kerstersia gyiorum[J]. J Clin Microbiol, 2015, 53(6): 1965-1967. DOI:10.1128/JCM.03625-14 |
| [8] |
Greninger AL, Kozyreva V, Truong CL, et al. Draft genome sequence of Kerstersia gyiorum CG1, isolated from a leg ulcer[J]. Genome Announc, 2015, 3(5): e01036-15. |
| [9] |
Ogawa Y, Lee ST, Kasahara K, et al. A first case of isolation of Kerstersia gyiorum from urinary tract[J]. J Infect Chemother, 2016, 22(4): 265-267. DOI:10.1016/j.jiac.2015.11.003 |
| [10] |
Baran I, Düzgün AP, Mumcuoǧ luİ, et al. Chronic lower extremity wound infection due to Kerstersia gyiorum in a patient with Buerger's disease: a case report[J]. BMC Infect Dis, 2017, 17(1): 608. DOI:10.1186/s12879-017-2711-3 |
| [11] |
Lan Y, Yan Q, Yan YY, et al. First case of Kerstersia gyiorum isolated from a patient with chronic osteomyelitis in China[J]. Front in Lab Med, 2017, 1(3): 141-143. DOI:10.1016/j.flm.2017.08.003 |
| [12] |
Kim JH, Lee E, Lee Y. The first case of chronic otitis media due to Kerstersia gyiorum in Korea[J]. Ann Lab Med, 2018, 38(6): 607-609. DOI:10.3343/alm.2018.38.6.607 |
| [13] |
Özcan N, Saat N, Yildirim Baylan M, et al. Three cases of chronic suppurative otitis media (CSOM) caused by Kerstersia gyiorum and a review of the literature[J]. Infez Med, 2018, 26(4): 364-368. |
| [14] |
Li Y, Tang M, Wang GX, et al. Genomic characterization of Kerstersia gyiorum SWMUKG01, an isolate from a patient with respiratory infection in China[J]. PLoS One, 2019, 14(4): e0214686. DOI:10.1371/journal.pone.0214686 |
| [15] |
Pires BMFB, de Oliveira BGRB, deOliveira FP, et al. Ciprofloxacin-resistant Kerstersia gyiorum isolated from a chronic wound in Brazil: a case report[J]. Wound Manag Prev, 2020, 66(10): 42-45. DOI:10.25270/wmp.2020.10.4245 |
| [16] |
Kitagawa D, Kurimoto T, Oyama S, et al. A case of Bordetella trematum and Kerstersia gyiorum infections in a patient with congestive dermatitis[J]. J Infect Chemother, 2021, 27(5): 740-746. DOI:10.1016/j.jiac.2020.12.008 |
| [17] |
Vandamme P, De Brandt E, Houf K, et al. Kerstersia similis sp. nov., isolated from human clinical samples[J]. Int J Syst Evol Microbiol, 2012, 62(Pt 9): 2156-2159. |
| [18] |
王慧. 骆驼瘤胃内纤维素降解菌的选育[D]. 呼和浩特: 内蒙古农业大学, 2014.
|
| [19] |
Wan XL, McLaughlin RW, Zhou JY, et al. Isolation of culturable aerobic bacteria and evidence of Kerstersia gyiorum from the blowhole of captive Yangtze finless porpoises[J]. Antonie Van Leeuwenhoek, 2016, 109(8): 1167-1175. DOI:10.1007/s10482-016-0713-6 |
| [20] |
Dalmutt AC, Moreno LZ, Gomes VTM, et al. Characterization of bacterial contaminants of boar semen: identification by MALDI-TOF mass spectrometry and antimicrobial susceptibi-lity profiling[J]. J Appl Anim Res, 2020, 48(1): 559-565. DOI:10.1080/09712119.2020.1848845 |
| [21] |
于琪. 基于海参养殖水体净化的益生菌筛选与应用[D]. 大连: 大连理工大学, 2019.
|
| [22] |
吴在德, 吴肇汉. 外科学[M]. 7版. 北京: 人民卫生出版社, 2008: 466-472.
|
| [23] |
Aisenberg G, Rolston KV, Safdar A. Bacteremia caused by Achromobacter and Alcaligenes species in 46 patients with cancer (1989-2003)[J]. Cancer, 2004, 101(9): 2134-2140. DOI:10.1002/cncr.20604 |
| [24] |
甘强, 李娜, 王萍, 等. 急性阑尾炎患者阑尾分泌物细菌培养及药敏实验结果分析[J]. 国际检验医学杂志, 2017, 38(12): 1703-1704. DOI:10.3969/j.issn.1673-4130.2017.12.049 |
| [25] |
张卫星. 肺炎克雷伯菌感染的临床分布及耐药性分析[J]. 中华医院感染学杂志, 2012, 22(23): 5391-5392. |
| [26] |
李继霞, 公衍文, 张月娥, 等. 用VITEK 2 Compact系统鉴定准确率低的临床少见病原菌评价焦磷酸测序技术鉴定能力[J]. 生物医学工程与临床, 2016, 20(6): 626-630. |
| [27] |
黄林, 顾迟, 唐沪强. Vitek 2 Compact系统鉴定临床少见疑难细菌的应用及评价[J]. 检验医学, 2014, 29(11): 1175-1177. DOI:10.3969/j.issn.1673-8640.2014.11.022 |



