2. 郴州市二医院结核科, 湖南 郴州 423000
2. Department of Tuberculosis, Chenzhou Second People's Hospital, Chenzhou 423000, China
我国是普通结核病与耐药结核病高负担国家之一。据世界卫生组织(WHO)估计,2019年我国利福平耐药结核病(rifampicin-resistant tuberculosis, RR-TB)和耐多药结核病(multidrug-resistant tuberculosis,MDR-TB) 新发患者数为6.6万例,仅次于印度,位居全球第二[1]。MDR-TB治疗疗程长、费用高、不良反应多,预后差[2-4],被称为“会传染的癌症”。目前全球RR/MDR-TB平均治疗成功率为56%,广泛耐药结核病(extensively drug-resistant tuberculosis,XDR-TB) 治疗成功率仅39%。在我国2016年一项队列研究中,仅有52%的RR/MDR-TB患者治愈或完成了18~24个月疗程,XDR-TB的治疗效果则更差[1]。
贝达喹啉(bedaquiline,BDQ)是一种通过抑制分枝杆菌5’-三磷酸腺苷合成酶而发挥抗菌及杀菌作用的二芳基喹啉类药物[5],是近45年来第一种上市的抗结核病新药,于2012年在美国上市,主要用于治疗耐药结核病,目前已在全球100多个国家广泛使用。在一项针对MDR/XDR-TB队列的随机Ⅱ b期试验中,与安慰剂相比,BDQ联合方案24周痰结核分枝杆菌培养阴转率(79% VS 58%)和120周治愈率(62% VS 44%)均有所提高,然而BDQ组的全因死亡率较高[6-7]。根据以上数据,WHO于2013年建议对BDQ实施积极的药物安全管理和监测[8]。我国引入BDQ时间相对较晚,对BDQ的研究报道较少,使用经验有限。本研究分析本院含BDQ方案治疗的69例MDR/XDR-TB患者24周临床疗效,为BDQ在我国安全有效地使用提供临床经验和依据。
1 对象与方法 1.1 研究对象纳入2018年3月—2019年9月30日南华大学附属长沙中心医院收治的结核病患者,随访至2020年3月30日。本研究经本院伦理委员会讨论并批准。
1.2 纳入与排除标准纳入标准:(1)有实验室诊断依据的MDR/XDR-TB患者;(2)年龄≥18岁;(3)按照2016版WHO MDR-TB治疗原则,需加入BDQ才可组成有效治疗方案;(4)无明确的心律失常表现,心电图QTc≤450 ms(QTc按心率校正、采用Fridericia公式计算QT值,以下简称QTcF);(5)签署知情同意书。排除标准:(1)有BDQ过敏史;(2)近三个月内参加其他未上市新药临床试验者;(3)有高风险的心脏合并症病史(如室性心率失常,近期心肌梗死等),出现过导致QT间期延长的风险因素;(4)在治疗、随访期间不能按照项目要求服药和监测,不能及时向负责医生报告不良反应。
1.3 治疗方案及BDQ使用患者的治疗方案由BDQ加背景治疗方案组成,背景方案的制定由本院结核科3名主任医师依据2016版WHO耐药结核病治疗指南的选药原则,结合患者药敏结果、既往用药史及药物耐受性情况并经集体讨论后确定。BDQ通用名为富马酸BDQ片(Bedaquiline Fumarate Tablets),100 mg/片;药品批号为TMCl8021A,由全球药物机构(Global Drug Facility,GDF)捐赠。按照推荐剂量予BDQ 400 mg口服,一次/日,持续2周;然后200 mg,3次/每周(每次服药至少间隔48 h),持续22周,总疗程24周。
1.4 治疗结果评估 1.4.1 有效性评估在治疗前1周,治疗第2、4周,之后每4周一次对患者痰标本进行分枝杆菌快速培养,直至疗程结束。以治疗24周内痰培养阴转为主要疗效指标,以痰菌阴转时间及肺部空洞闭合为次要疗效指标。培养阴转是指治疗基线时痰培养阳性,治疗期间至少连续两次痰培养为阴性,且每次间隔28 d以上。培养阴转时间是指患者出现培养阴转后从基线到首次转阴的时间。肺部病灶转归评估:(1)完全吸收;(2)显著吸收,病灶吸收面积≥原病灶1/2;(3)吸收,病灶吸收面积<原病灶1/2;(4)不变,病灶无明显改变;(5)恶化,病灶扩大或播散。
1.4.2 安全性评估治疗期间监测患者血常规、尿常规、肝肾功能、电解质、心电图及不良事件(adverse event,AE)。出现450 ms ≤QTc间期<500 ms时,每周复查一次心电图;大于500 ms时停用BDQ,每周复查一次,直至恢复450 ms以下。出现电解质紊乱症状及QTcF间期延长≥450 ms时随时复查。治疗前记录听力、视力状态,详细询问近亲中是否有失聪患者,必要时请专科评估;治疗过程中出现相关不适主诉时及时转专科检查。AE的严重程度按照美国传染病研究所艾滋病部门修改的关于成人和儿童不良事件严重程度分级表最新版本进行分级。
1.4.3 治疗转归评估24周治疗结局包括:(1)好转,24周治疗结束后连续2次痰培养阴性,每次间隔至少28 d,无治疗失败证据。(2)完成疗程,完成24周治疗结束后无治疗失败证据。(3)治疗失败,在24周治疗结束后痰菌未阴转或阴转后再次出现细菌学阳性。(4)死亡,在治疗过程中由于各种原因所致的死亡。(5)丢失,患者未治疗或者治疗过程中由于任何原因中断治疗连续2个月以上。(6)退组,因不良反应中断治疗2个月以上。
1.5 资料收集方法从医院病例系统中收集患者的人口学及临床数据,包括年龄、性别、身高、身体质量指数(body mass index,BMI)、病史和用药、实验室检测结果、AE、病原学和影像学结果以及合并疾病等信息。
1.6 相关定义MDR-TB是指结核病患者感染的分枝杆菌经体外药敏试验证实至少同时对异烟肼和利福平耐药;准广泛前耐药(Pre-XDR-TB)是指结核病患者感染的分枝杆菌经体外药敏试验证实在耐多药(至少同时对异烟肼和利福平耐药)的基础上对1种氟喹诺酮类或1种二线注射类抗结核药物耐药;XDR-TB是指结核病患者感染的分枝杆菌经体外药敏试验证实在耐多药的基础上至少同时对1种氟喹诺酮类和1种二线注射类抗结核药物耐药。
1.7 资料统计方法应用SPSS 21.0软件对数据进行统计学分析。分类变量以频率和百分比表示,连续变量以中位数和四分位数间距表示(interquartile range,IQR)。分类变量的比较采用卡方检验或Fisher’s确切概率检验,连续变量的比较采用Wilcoxon秩和检验,P≤ 0.05为差异有统计学意义。
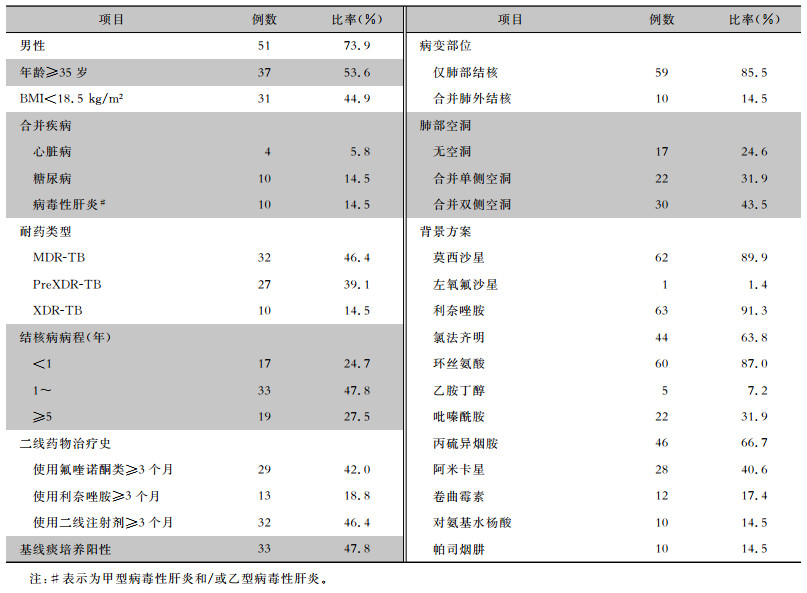
2 结果 2.1 患者基线特征共纳入69例经培养确诊的MDR/XDR-TB患者,男性51例,中位年龄39(27,51)岁,BMI中位数19.0(17.3~21.2)kg/m2。MDR-TB、preXDR-TB、XDR-TB患者比率分别为46.4%、39.1%、14.5%,33例患者在治疗基线时培养呈阳性。所有患者均患有肺结核,其中10例合并肺外结核,52例合并肺部空洞。在二线药物治疗史方面,使用氟喹诺酮类药物、利奈唑胺和二线注射剂超过3个月的患者分别有29、13、32例。21例患者至少合并一种疾病(1例患者同时合并冠心病和糖尿病,1例患者同时合并糖尿病和乙型病毒性肝炎)。根据WHO 2019年更新的RR/MDR-TB治疗指南,使用A组药物氟喹诺酮类和利奈唑胺的患者各63例,分别有44、60例患者接受了B组药物氯法齐明和环丝氨酸的治疗,分别有46、40例患者接受了C组丙硫异烟胺和二线注射剂治疗,患者治疗方案中使用的药物平均种数为6.14(5,8)种。见表 1。
| 表 1 69例MDR/XDR-TB患者治疗基线特征 Table 1 Baseline characteristics of treatment of 69 patients with MDR/XDR-TB |
|
63例(91.3%)完成了24周治疗,其中29例(46.0%)入组时痰培养阳性,BDQ治疗2、4、8周时痰培养阴转率分别为69.0% (20例)、75.9%(22例)、93.1%(27例),12周时痰培养阴转率均为100.0%(29例);24周时2例复阳,痰培养阴转率为93.1%(27例)。痰菌阴转中位时间为24(14,61)d。36例入组时痰培养阴性患者在治疗期间痰菌均保持阴性。10例合并2型糖尿病的患者中,6例(60.0%)在入组时培养为阳性,24周治疗后均实现痰菌阴转。52例合并肺部空洞的患者中,48例(92.3%)完成了24周的治疗,12、24周时肺部空腔闭合率分别为37.5%(18例)、64.6%(31例)。1例32岁患者1年前因咳嗽、咳痰、发热和咯血就诊,诊断为肺结核、支气管结核,予一线抗结核药物治疗1年后症状无缓解,痰涂片及培养仍阳性,表型药敏结果提示为XDR-TB,纳入BDQ治疗组,其背景方案为:莫西沙星、利奈唑胺、氯法齐明、环丝氨酸、丙硫酰胺、吡嗪酰胺。治疗基线时其右下肺可见4.6 cm×2.9 cm空洞(见图 1a),治疗4周后症状缓解,治疗12周后空洞明显缩小(见图 1b),治疗24周后空洞闭合(见图 1c)。
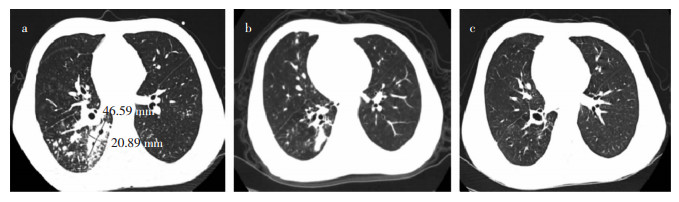 |
| 注:a为治疗基线时,右下肺可见4.6 cm×2.9 cm空洞;b为治疗12周后空洞明显缩小;c为治疗24周后空洞闭合。 图 1 1例32岁XDR-TB患者24周治疗期间肺部CT检查结果 Figure 1 Pulmonary CT findings of a 32-year-old XDR-TB patient during 24 weeks of treatment |
61例患者好转或完成24周治疗,获得良好转归;8例患者(11.6%)在24周治疗期间出现不良结局,其中2例患者分别因心脏骤停、呼吸衰竭死亡,3例患者因不良反应退组,1例患者失访,2例患者治疗失败(1例合并支气管瘘患者痰菌在第4周时阴转,但在24周时复阳;另1例患者仅规律服用BDQ,未规律服用背景方案药物,痰菌在阴转16周后复阳)。
2.3 AE发生情况69例患者中,39例(56.5%)患者报告了108次AE,大部分AE被归为1级或2级(75次,69.4%),最常见的AE为QT间期延长、周围神经病变和肝毒性,最常见的3级及以上AE为QT间期延长,10例患者报告了21次。18例患者报告了44次(40.7%)与BDQ相关的AE。3例患者分别在入组后第8周、20周和24周出现QT间期>500 ms,第8周出现QT间期>500 ms患者未停用BDQ,第20周出现QT间期>500 ms患者QT间期恢复正常后继续使用BDQ,第24周出现QT间期>500 ms患者发生在24周复查时,已服用完24周BDQ。2例患者出现晕厥,其中1例患者QTcF较基线延长19 ms,且合并频繁的多灶性室性早搏,不排除与BDQ相关,永久停用BDQ治疗;另1例患者因抗利尿激素不当综合征而晕厥,考虑与BDQ不相关,患者症状好转后继续服用BDQ。2例患者分别因丙硫异烟胺、吡嗪酰胺引起的肝损伤而暂停BDQ治疗,肝功能好转后继续恢复使用。在2例死亡的患者中,1例患者合并肺心病,于16周时在家因心脏骤停死亡,无法确定是否与BDQ相关;另1例患者19周时因细菌感染导致呼吸衰竭死亡,死因与BDQ无相关性。所有与BDQ相关的AE中,除了QT间期延长和频繁的多灶性室性早搏外,未报告其他的与BDQ相关的3级及以上AE。见表 2。
| 表 2 69例患者24周治疗期间发生的108次AE分类 Table 2 Classification of 108 adverse event in 69 patients during 24 weeks of treatment |

|
因莫西沙星、氯法齐明均已被证实能够导致QT间期延长,进一步分析背景方案中使用上述两种药物的患者QT间期变化。69例患者中,37例(53.6%)患者在背景方案中联合使用莫西沙星和氯法齐明(BDQ-莫西沙星-氯法齐明组),25例(36.2%) 患者仅使用莫西沙星而未使用氯法齐明(BDQ-莫西沙星组),7例(10.2%)患者仅使用氯法齐明而未使用莫西沙星(BDQ-氯法齐明组),三组患者QTcF的基线均值分别为(408.2±30.0)、(415.1±31.0)、(407.9±15.0)ms,三组患者QTcF的基线均值比较,差异无统计学意义(P>0.05)。在24周治疗期间,三组患者中出现QTcF>450 ms、≥500 ms及延长≥60 ms患者比例比较,差异均无统计学意义(均P>0.05)。见表 3。
| 表 3 三组患者24周治疗期间QT间期延长情况 Table 3 QT interval prolongation of three groups of patients during 24 weeks of treatment |

|
中国耐药结核病患者数较多,但中国使用BDQ新药治疗耐药结核病的时间较晚,目前国内含BDQ方案治疗耐药结核病患者的有效性和安全性临床研究及报道较少。本研究隶属BDQ在我国上市后的Ⅳ期临床研究,主要观察69例患者在24周BDQ治疗期间的有效性及安全性。
韩国研究[9]报道,使用BDQ治疗MDR/XDR-TB,患者6个月痰菌阴转率为80%(n=21);另一项来自法国、格鲁吉亚、亚美尼亚和南非的多中心研究[10]结果显示,患者6个月痰菌阴转率为78%(n=537)。在本研究中,29例完成24周BDQ治疗的痰培养基线阳性患者中,27例患者实现痰菌阴转,痰菌阴转率达93.1%,高于国外研究结果。2例患者痰菌24周时复阳,其中1例患者在第12周时痰菌阴转,但在12周后仅规律服用BDQ,未规律服用背景方案中其他药物,导致在24周时痰菌复阳,提示患者服药依从性对治疗结局有重要影响,在治疗过程中应加强对患者服药依从性宣教;另1例患者合并支气管胸膜瘘,该患者在第8周时痰菌阴转,但因支气管胸膜瘘病情较重,其痰菌在24周时复阳,提示对于合并胸膜瘘患者,应适时适当的加以外科干预改善治疗结局。早期痰菌阴转可降低耐药结核分枝杆菌传播风险,对控制结核病意义重大,但痰菌阴转时间的快慢主要取决于基线治疗方案。本研究中,得益于大部分患者同时还接受了2019版WHO最新指南[11]中推荐的核心药物联合治疗(如莫西沙星、利奈唑胺、环丝氨酸和氯法齐明)。患者痰菌阴转中位时间为24(14,61)d,短于印度、美国及欧洲和非洲的多中心研究[12-14]报道结果。
在BDQ IIb期试验中,BDQ组患者的全因死亡率高于对照组[6],因此对使用BDQ安全性的担忧伴随BDQ治疗全过程。本研究中,2例患者死亡,全因死亡率2.9%,低于IIb期试验全因死亡率[6]。2例死亡患者均为女性,1例患者在入组19周时因合并重症肺炎导致呼吸衰竭死亡,分析死因与BDQ无关;另1例患者肺结核反复治疗,左肺毁损并右肺巨大空洞,并发肺源性心脏病,入组时轻微体力活动受限,入组后症状逐步改善,其在治疗12周时复查肺部CT提示右肺空洞显著吸收,但不幸于16周时在家中突发心脏骤停死亡,因患者为突发死亡,且死于家中,故对其死因无法进行详细分析。导致QT间期延长是BDQ最常见和最主要的AE[13],与BDQ相关的QT间期延长在本研究中也最为常见。然而,本研究患者背景方案中同时使用了可导致QT间期延长的药物如莫西沙星[15]和氯法齐明[16]比例较高,故无法全面评估单用BDQ对QT间期延长的影响。莫西沙星和左氧氟沙星均属于氟喹诺酮类药物,为2019版WHO推荐的治疗RR/MDR-TB A组核心药物之一。莫西沙星抗结核病效果强于左氧氟沙星,但莫西沙星可导致QT间期延长,因此不建议与BDQ联合使用[8]。在本研究中,纳入的患者或因耐药程度高,或因既往已反复使用二线药物治疗,或因不良反应而对其他药物耐受性差和(或)存在用药禁忌证,患者均面临治疗难度大,药物选择性小的困局。为提高患者治疗效果,结合患者药敏结果、既往用药史,在充分评估患者QT间期延长风险的前提下,优先选择莫西沙星为患者背景方案用药之一,并且在治疗过程中严密监测患者心电图。本研究结果显示,与BDQ-莫西沙星-氯法齐明组和BDQ-氯法齐明组患者比较,BDQ-莫西沙星组患者发生3级及以上QT间期延长的AE次数与其他两组患者相比,无明显差别,安全性在可接受范围。因此,为提高患者治愈率,经患者QT间期延长风险评估后,在密切监测患者QT间期情况下,是否应推荐莫西沙星与BDQ联合使用,而不是左氧氟沙星,但因本研究样本量较小,尚需扩大样本量进一步证实。
研究[17]发现,糖尿病是肺结核不良愈后的影响因素,可影响肺结核患者痰菌阴转,增加患者复发率和病死率。本研究中,10例合并糖尿病患者,其中6例在治疗基线时培养阳性的患者24周治疗结束时均实现痰菌阴转,故合并糖尿病患者使用BDQ是否可获得与非糖尿病患者同样满意疗效,此问题值得扩大样本量进一步探索。
本研究还存在以下不足:(1)因本研究纳入的患者病情较为严重或者对某些二线药物过敏,均需加入BDQ才能组成有效方案,故为单臂研究,未设置对照组。(2)因耐药结核病治疗疗程较长,大部分患者尚未完成巩固期治疗,故暂无法收集最终结果。(3)样本量较少可能会导致结果的偏差,需扩大样本量证实相关结论。后续将继续追踪本队列的最终治疗结果,并扩大样本量进一步验证。
尽管存在以上局限性,但本研究结果表明,与既往国内MDR/XDR-TB治疗方案相比,含BDQ方案可提高患者24周痰菌阴转率,在安全性方面,需重视与BDQ相关的QT间期监测管理。
| [1] |
World Health Organization. Global tuberculosis report 2019[EB/OL]. (2019-10-15)[2021-04-20]. https://apps.who.int/iris/handle/10665/329368.
|
| [2] |
Jacobson KR, Tierney DB, Jeon CY, et al. Treatment outcomes among patients with extensively drug-resistant tuberculosis: systematic review and Meta-analysis[J]. Clin Infect Dis, 2010, 51(1): 6-14. DOI:10.1086/653115 |
| [3] |
Falzon D, Gandhi N, Migliori GB, et al. Resistance to fluoroquinolones and second-line injectable drugs: impact on multidrug-resistant TB outcomes[J]. Eur Respir J, 2013, 42(1): 156-168. DOI:10.1183/09031936.00134712 |
| [4] |
Migliori GB, Sotgiu G, Gandhi NR, et al. Drug resistance beyond extensively drug-resistant tuberculosis: individual patient data Meta-analysis[J]. Eur Respir J, 2013, 42(1): 169-179. DOI:10.1183/09031936.00136312 |
| [5] |
Chahine EB, Karaoui LR, Mansour H. Bedaquiline: a novel diarylquinoline for multidrug-resistant tuberculosis[J]. Ann Pharmacother, 2014, 48(1): 107-115. DOI:10.1177/1060028013504087 |
| [6] |
Diacon AH, Pym A, Grobusch M, et al. The diarylquinoline TMC207 for multidrug-resistant tuberculosis[J]. N Engl J Med, 2009, 360(23): 2397-2405. DOI:10.1056/NEJMoa0808427 |
| [7] |
Diacon AH, Donald PR, Pym A, et al. Randomized pilot trial of eight weeks of bedaquiline (TMC207) treatment for multidrug-resistant tuberculosis: long-term outcome, tolerability, and effect on emergence of drug resistance[J]. Antimicrob Agents Chemother, 2012, 56(6): 3271-3276. DOI:10.1128/AAC.06126-11 |
| [8] |
World Health Organization. The use of bedaquiline in the treatment of multidrug-resistant tuberculosis: Interim policy gui-dance[EB/OL]. [2021-04-20]. https://apps.who.int/iris/bitstream/handle/10665/84879/9789241505482_eng.pdf;sequence=1.
|
| [9] |
Kim JH, Kwon OJ, Kim YS, et al. Bedaquiline in multidrug-resistant tuberculosis treatment: safety and efficacy in a Korean subpopulation[J]. Respir Investig, 2020, 58(1): 45-51. DOI:10.1016/j.resinv.2019.08.004 |
| [10] |
Mbuagbaw L, Guglielmetti L, Hewison C, et al. Outcomes of bedaquiline treatment in patients with multidrug-resistant tuberculosis[J]. Emerg Infect Dis, 2019, 25(5): 936-943. DOI:10.3201/eid2505.181823 |
| [11] |
World Health Organization. WHO consolidated guidelines on drug-resistant tuberculosis treatment[EB/OL]. (2019-03-20)[2021-04-20]. https://apps.who.int/iris/handle/10665/311389.
|
| [12] |
Salhotra VS, Sachdeva KS, Kshirsagar N, et al. Effectiveness and safety of bedaquiline under conditional access program for treatment of drug-resistant tuberculosis in India: an interim analysis[J]. Indian J Tuberc, 2020, 67(1): 29-37. DOI:10.1016/j.ijtb.2019.10.002 |
| [13] |
Borisov SE, Dheda K, Enwerem M, et al. Effectiveness and safety of bedaquiline-containing regimens in the treatment of MDR- and XDR-TB: a multicentre study[J]. Eur Respir J, 2017, 49(5): 1700387. DOI:10.1183/13993003.00387-2017 |
| [14] |
Mase S, Chorba T, Parks S, et al. Bedaquiline for the treatment of multidrug-resistant tuberculosis in the United States[J]. Clin Infect Dis, 2020, 71(4): 1010-1016. DOI:10.1093/cid/ciz914 |
| [15] |
Briasoulis A, Agarwal V, Pierce WJ. QT prolongation and torsade de pointes induced by fluoroquinolones: infrequent side effects from commonly used medications[J]. Cardiology, 2011, 120(2): 103-110. DOI:10.1159/000334441 |
| [16] |
Yoon HY, Jo KW, Nam GB, et al. Clinical significance of QT-prolonging drug use in patients with MDR-TB or NTM disease[J]. Int J Tuberc Lung Dis, 2017, 21(9): 996-1001. DOI:10.5588/ijtld.17.0174 |
| [17] |
Lutfiana NC, van Boven JFM, Masoom Zubair MA, et al. Dia- betes mellitus comorbidity in patients enrolled in tuberculosis drug efficacy trials around the world: a systematic review[J]. Br J Clin Pharmacol, 2019, 85(7): 1407-1417. DOI:10.1111/bcp.13935 |



