感染性心内膜炎(infective endocarditis,IE)是由不同微生物感染引起的影响某一心脏瓣膜或多个心脏瓣膜功能的疾病,临床主要表现为发热、心脏杂音、多脏器栓塞脓肿及皮肤黏膜损伤,可出现心力衰竭、脑卒中、肾功能衰竭、多器官栓塞、动脉瘤、菌血症性休克等多种并发症。根据病原体选择合适的抗菌药物疗是治疗IE的主要方式,待病情平稳或急性加重时可联合心脏瓣膜修复或置换等手术治疗,目前有近一半的IE患者接受手术治疗,表明外科手术是IE患者选择的主要治疗途径之一[1-4]。IE是一种罕见的致命性疾病,年发病率约为1.5/10万~11.6/10万,尽管在诊断和治疗上不断改善,但仍预后差、病死率高[5-7]。与没有IE的传统瓣膜置换手术相比,IE患者手术的难度更大,手术后病死率增加,中期预后也受影响[8-9]。目前,对于外科瓣膜置换手术(surgical aortic valve replacement,SAVR)治疗自体瓣膜IE远期疗效的相关研究较少,尤其是自体主动脉瓣IE。因此,本研究通过回顾性研究及随访,旨在探讨自体主动脉瓣膜单独受累的IE患者行SAVR的远期效果。
1 对象与方法 1.1 研究对象收集2013年1月—2017年12月就诊于首都医科大学附属北京安贞医院的IE患者及同期于该院行主动脉瓣(机械瓣或生物瓣)置换术的瓣膜病(非IE)患者的病历资料。纳入标准:符合改良Duke标准的自体主动脉瓣单独受累的IE患者及非IE的心脏主动脉瓣膜病变患者,并首次于该院进行了SAVR。排除标准:(1)既往曾行心脏手术的患者;(2)同时行二尖瓣置换、三尖瓣置换、肺动脉瓣置换、大血管人工血管置换手术的患者;(3)人工机械瓣或生物瓣膜受累的IE患者;(4)合并其他瓣膜受累的IE患者,如二尖瓣受累、肺动脉瓣受累、三尖瓣受累。病例入组流程见图 1。
 |
| 图 1 研究对象入组流程图 Figure 1 Grouping flow chart of studied subjects |
收集所有入组患者的临床资料,包括性别、年龄、既往史、临床特征、手术方式、术后并发症等。所有患者均行经胸超声心动图,部分IE患者行经食管超声心动图检查。采用PSM方法对IE患者和配对对照组研究对象进行长期手术后随访,随访时间到2021年2月截止,中位随访时间为69个月,最长随访时间为97个月。研究的主要结果是了解SAVR后患者的生存情况,次要结果是分析术后发生缺血性脑卒中、大出血和主动脉瓣膜再次手术的情况。次要结果分析不包括围手术期事件的发生。大出血定义为出现脑出血、黑便或血便。
1.3 统计学方法应用SPSS 25.0统计软件进行数据分析。正态分布的计量资料采用x±s表示,组间比较采用t检验,计数资料用n(%)表示,组间比较采用χ2检验。采用倾向性评分匹配(PSM)±0.1进行1∶1卡尺匹配。手术后并发症累积发生和生存分析采用Kaplan-Meier法、Log-Rank检验和Cox回归分析。以P≤0.05为差异有统计学意义。
2 结果 2.1 基线特征在研究期间,共有2 875例患者首次于该院行SAVR,排除非主动脉瓣膜单独受累的IE患者(n=43)及在随访过程中失联的患者(n=11),共有2 821例患者入组,其中IESAVR患者143例(IE组),非IESAVR患者2 678例(对照组)。与对照组相比,IE组患者年龄较小,男性较多,差异均有统计学意义(均P<0.05)。既往史中,IE组患者患高血压、冠心病的比例低于对照组,而患脑血管病的比例高于对照组,差异均有统计学意义(均P<0.05)。与对照组相比,IE组患者行机械瓣膜置换术的频率更高,差异有统计学意义(P=0.037)。经PSM匹配(1∶1)确定了143对主动脉瓣单独受累IESAVR患者和非IESAVR对照患者,这些患者具有平衡的基线特征。见表 1。
| 表 1 PSM匹配前后IE组与对照组患者基线特征 Table 1 Baseline characteristics of SAVR patients with native-valve IE patients and non-IE controls before and after PSM matching |
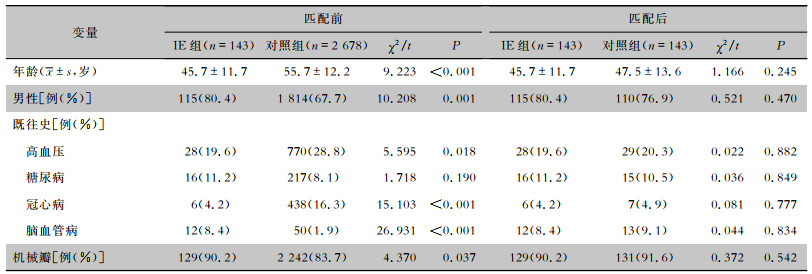
|
配对队列在随访期间,共有39例死亡(IE组25例,对照组14例)。IE组患者中1例于手术后48 h内因脑疝死亡,1例于手术3个月后因心力衰竭加重死亡。IE组手术后30 d及6、12、36、60、84个月的生存率分别为99.3%(142例)、98.6%(141例)、97.2%(139例)、93.7%(134例)、88.1%(126例)、83.9%(120例),对照组为100.0%(143例)、100.0%(143例)、99.3%(142例)、97.2%(139例)、90.9%(130例)、90.2%(129例)。IE组患者手术后长期生存率低于配对对照组,差异有统计学意义(P=0.044)。见图 2。
 |
| 图 2 IE组与对照组患者SAVR手术后长期生存率Kaplan-Meier分析 Figure 2 Kaplan-Meier analysis on long-term survival rate after SAVR in patients in IE group and control group |
随访期间,共有23例患者出现缺血性脑卒中,其中IE组16例,对照组7例。两组患者最长随访97个月,IE组缺血性脑卒中累积发生率高于对照组,差异有统计学意义(P=0.035)。IE组中有2例患者因缺血性脑卒中引起死亡。缺血性脑卒中为影响患者生存的独立危险因素(P=0.014),发生缺血性脑卒中患者的死亡风险更高(HR=2.811;95%CI:1.233~6.408)。见图 3。
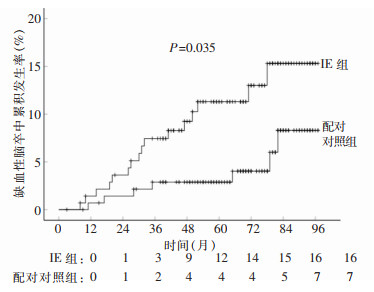 |
| 图 3 IE组与对照组患者SAVR术后缺血性脑卒中累积发生率Kaplan-Meier分析 Figure 3 Kaplan-Meier analysis on cumulative incidence of ischemic stroke after SAVR in patients in IE group and control group |
共34例患者(IE患者19例)在随访期间发生大出血事件。其中IE组患者中,有11例患者出现消化道出血,8例患者出现脑出血;对照组患者中,有9例出现消化道出血,6例出现脑出血。随访期间,IE组的大出血累积发生率与对照组比较,差异无统计学意义(P=0.315)。大出血不是影响患者生存的独立危险因素(P=0.644),两组患者的死亡风险差异无统计学意义(HR=1.249;95%CI:0.487~3.201)。见图 4。
 |
| 图 4 IE组与对照组患者SAVR术后大出血累积发生率Kaplan-Meier分析 Figure 4 Kaplan-Meier analysis on cumulative incidence of massive hemorrhage after SAVR in patients in IE group and control group |
在随访中,共11例患者(IE组5例)进行了SAVR术后的主动脉瓣再手术。IE组患者中,1例因术后主动脉瓣狭窄再次手术,其余4例因重度瓣周漏再次手术,其中1例在首次手术后4个月不仅出现重度瓣周漏,同时机械瓣再次有赘生物形成。6例对照组患者均因重度瓣周漏再次行手术。随访期间IE组与对照组患者再次行主动脉瓣手术的累积发生率比较,差异无统计学意义(P=0.850)。主动脉瓣再手术不是影响患者生存的独立危险因素(P=0.458),两组患者死亡风险比较差异无统计学意义(HR=0.583;95%CI:0.140~2.430)。见图 5。
 |
| 图 5 IE组与对照组患者SAVR术后主动脉瓣累积再手术率Kaplan-Meier分析 Figure 5 Kaplan-Meier analysis on cumulative re-operation rate of aortic valve after SAVR in patients in IE group and control group |
近年来,IE患者的发病数量持续增多[3, 10],除进行积极的抗感染及对症支持等药物治疗外,绝大多数IE患者需要心脏手术干预以完全清除所有感染病灶。即使是经验丰富的外科医生,患者手术后病死率及复发率仍较高[11]。Østergaard等[12]对5 576例IE患者进行回顾性分析,发现在10年随访期间,仅接受药物治疗的IE患者病死率为63.1%,同时接受药物和外科心脏手术治疗的IE患者病死率为41.6%。此外,Pang等[13]发现接受手术治疗的IE患者10年生存率为75%。然而上述两项研究中,进行SAVR的IE患者占手术治疗患者总数的30%~50%[12-13]。Chauvette等[9]对IE患者SAVR术后的中期预后进行研究,发现患者手术后5年生存率为80%,10年生存率为71%。此外,Luehr等[10]最近研究发现,IE患者(包括自体瓣膜、人工瓣膜)SAVR术后1、3、5、10年总生存率分别为80.6%、77.8%、71.6%、66.1%,且人工瓣膜IE患者手术后的生存率明显低于自体瓣膜IE患者。本研究中发现,与对照组患者相比,IE患者即使最初治疗成功,其术后长期生存率仍偏低,该结果与上述研究的结果基本一致。
缺血性脑卒中是心脏手术后常见的并发症之一,其在IE患者心脏手术后的发生率为4%~16%[9, 14]。一项回顾性研究[15]发现,单独二尖瓣受累的IE患者行二尖瓣置换术后缺血性脑卒中累积发生率与对照组相比无明显变化。而Kytö等[16]发现,行生物瓣置换术的IE患者术后5年病死率及缺血性脑卒中发生率高于行SAVR的IE患者。本研究发现IE患者手术后缺血性脑卒中累积发生率高于非IE配对对照组,IE患者的大部分缺血性脑卒中事件发生在术后随访过程的早中期, 同时发现缺血性脑卒中患者的死亡风险更高,考虑手术操作、术后凝血机制异常、心脏基础疾病(风湿性心脏病、心房颤动)及其他心脏瓣膜可能合并微小赘生物等因素均可能引起手术后发生缺血性脑卒中,需扩充样本量,延长随访时间进一步验证。
手术后抗凝治疗是IE患者发生出血性事件的主要危险因素,同时合并颅内感染性动脉瘤亦是IE患者发生脑出血的原因。Anttila等[15]发现在长期随访中,二尖瓣受累IE患者行二尖瓣置换术后大出血累积发生率高于对照组。而在对性别[17]、置换瓣膜类型[16]的主动脉瓣受累IE患者进行回顾性研究时,发现随访过程中两组患者之间的大出血事件发生率无统计学差异,与本研究结果一致,大出血不是引起IE患者死亡的独立危险因素。
IE患者行SAVR治疗后可能因瓣周漏、瓣膜重度狭窄或反流、置换的瓣膜上再形成赘生物而需要再次手术治疗。一项研究[18]对1 844例IE患者行SAVR术后长期随访(最长12年),显示复发感染率为9.4%~10%,行SAVR术后的再手术率高达20.6%。也有研究[16]表明主动脉瓣IE患者在行SAVR后的1、5年时主动脉瓣再手术率分别为3.7%、6.1%。在本研究中,IE患者在首次SAVR后需要再进行主动脉瓣手术的情况并不多,不排除与国内IE患者存在静脉吸毒的情况少见有关。
目前,对于自体瓣膜IE行SAVR治疗后远期疗效的相关研究很少,且均为国外研究。本研究通过回顾性研究,首次发现国内自体主动脉瓣单独受累IE患者行SAVR后发生死亡、缺血性卒中的风险更高,证实IE患者行SAVR后存在发生并发症的高风险。但该研究还存在局限性和不足:样本量小,研究人群单一,仅包括主动脉瓣单独受累IE患者,而不包括其他瓣膜IE和植入心脏装置IE患者,且患者病情较平稳,选择择期手术的居多,会对结果产生一定的偏倚;本研究为回顾性研究,少部分病历资料中存在数据不全及病历描述模糊的现象,基础疾病史可能存在误差;尽管本研究中使用倾向性评分匹配来控制混杂变量,但仍不排除存在其他混杂因素可能会影响结果;另外本研究为单中心的观察性研究,患者虽来自全国各地,但多数来自北方地区,尚不能代表全国现状。
综上所述,IE患者在行SAVR后的长期随访中,发生缺血性脑卒中和死亡的风险增高。应加强对IE患者行SAVR手术后的密切随访,重点预防脑卒中等并发症。
| [1] |
Varela Barca L, López-Menéndez J, Navas Elorza E, et al. Long-term prognosis after surgery for infective endocarditis: distinction between predictors of early and late survival[J]. Enferm Infecc Microbiol Clin, 2019, 37(7): 435-440. DOI:10.1016/j.eimc.2018.10.017 |
| [2] |
Yanagawa B, Elbatarny M, Verma S, et al. Surgical management of tricuspid valve infective endocarditis: a systematic review and Meta-analysis[J]. Ann Thorac Surg, 2018, 106(3): 708-714. DOI:10.1016/j.athoracsur.2018.04.012 |
| [3] |
Chambers HF, Bayer AS. Native-valve infective endocarditis[J]. N Engl J Med, 2020, 383(6): 567-576. DOI:10.1056/NEJMcp2000400 |
| [4] |
AATS Surgical Treatment of Infective Endocarditis Consensus Guidelines Writing Committee Chairs, Pettersson GB, Coselli JS, et al. 2016 The American Association for Thoracic Surgery (AATS) consensus guidelines: surgical treatment of infective endocarditis: executive summary[J]. J Thorac Cardiovasc Surg, 2017, 153(6): 1241-1258. DOI:10.1016/j.jtcvs.2016.09.093 |
| [5] |
Ahtela E, Oksi J, Porela P, et al. Trends in occurrence and 30-day mortality of infective endocarditis in adults: population-based registry study in Finland[J]. BMJ Open, 2019, 9(4): e026811. DOI:10.1136/bmjopen-2018-026811 |
| [6] |
Ahtela E, Oksi J, Sipilä J, et al. Occurrence of fatal infective endocarditis: a population-based study in Finland[J]. BMC Infect Dis, 2019, 19(1): 987. DOI:10.1186/s12879-019-4620-0 |
| [7] |
Cahill TJ, Baddour LM, Habib G, et al. Challenges in infective endocarditis[J]. J Am Coll Cardiol, 2017, 69(3): 325-344. DOI:10.1016/j.jacc.2016.10.066 |
| [8] |
Volk L, Verghis N, Chiricolo A, et al. Early and intermediate outcomes for surgical management of infective endocarditis[J]. J Cardiothorac Surg, 2019, 14(1): 211. DOI:10.1186/s13019-019-1029-1 |
| [9] |
Chauvette V, Comtois MO, Stevens LM, et al. Mid-term outcomes in nonelderly adults undergoing surgery for isolated aortic valve infective endocarditis: results from two Canadian centers[J]. Can J Cardiol, 2019, 35(11): 1475-1482. DOI:10.1016/j.cjca.2019.06.027 |
| [10] |
Luehr M, Bauernschmitt N, Peterss S, et al. Incidence and surgical outcomes of patients with native and prosthetic aortic valve endocarditis[J]. Ann Thorac Surg, 2020, 110(1): 93-101. DOI:10.1016/j.athoracsur.2019.10.029 |
| [11] |
David TE, Gavra G, Feindel CM, et al. Surgical treatment of active infective endocarditis: a continued challenge[J]. J Thorac Cardiovasc Surg, 2007, 133(1): 144-149. DOI:10.1016/j.jtcvs.2006.08.060 |
| [12] |
Østergaard L, Oestergaard LB, Lauridsen TK, et al. Long-term causes of death in patients with infective endocarditis who undergo medical therapy only or surgical treatment: a nationwide population-based study[J]. Eur J Cardiothorac Surg, 2018, 54(5): 860-866. DOI:10.1093/ejcts/ezy156 |
| [13] |
Pang PYK, Sin YK, Lim CH, et al. Surgical management of infective endocarditis: an analysis of early and late outcomes[J]. Eur J Cardiothorac Surg, 2015, 47(5): 826-832. DOI:10.1093/ejcts/ezu281 |
| [14] |
Weber C, Petrov G, Luehr M, et al. Surgical results for prosthetic versus native valve endocarditis: a multicenter analysis[J]. J Thorac Cardiovasc Surg, 2021, 161(2): 609-619. DOI:10.1016/j.jtcvs.2019.09.186 |
| [15] |
Anttila V, Malmberg M, Gunn J, et al. Infective endocarditis and outcomes of mitral valve replacement[J]. Eur J Clin Invest, 2021, 51(9): e13577. |
| [16] |
Kytö V, Ahtela E, Sipilä J, et al. Mechanical versus biological valve prosthesis for surgical aortic valve replacement in patients with infective endocarditis[J]. Interact Cardiovasc Thorac Surg, 2019, 29(3): 386-392. DOI:10.1093/icvts/ivz122 |
| [17] |
Myllykangas ME, Aittokallio J, Gunn J, et al. Sex differences in long-term outcomes after surgical aortic valve replacement: a nationwide propensity-matched study[J]. J Cardiothorac Vasc Anesth, 2020, 34(4): 932-939. DOI:10.1053/j.jvca.2019.10.011 |
| [18] |
Toyoda N, Itagaki S, Tannous H, et al. Bioprosthetic versus mechanical valve replacement for infective endocarditis: focus on recurrence rates[J]. Ann Thorac Surg, 2018, 106(1): 99-106. DOI:10.1016/j.athoracsur.2017.12.046 |



