2. 桂林医学院附属医院胃肠外科, 广西 桂林 541001
2. Department of Gastrointestinal Surgery, Affiliated Hospital of Guilin Medical College, Guilin 541001, China
腹腔感染(intra-abdominal infection,IAI)是直肠癌术后最危险的并发症之一,其不仅增加患者的住院费用,且严重影响患者的预后,已成为困扰胃肠外科医生的一道难题,如何减少直肠癌前切除术后IAI的发生率尤为重要[1]。关于术后IAI危险因素的报道非常多,然而,准确预测术后IAI仍是一项困难的工作。列线图又称Nomogram图,是一种图形模型,具有准确预测患者风险的优势。在各种疾病中,包括直肠癌,有许多列线图被用作预测工具[2]。构建一个有效、直观的风险预测模型,用于准确识别高风险人群和制定围手术期IAI的预防与控制方案尤为重要。此研究旨在建立直观的列线图预测模型,为临床工作中减少直肠癌Dixon术后IAI的发生提供一定的理论依据。
1 对象与方法 1.1 研究对象2017年12月—2020年9月于该院胃肠外科进行Dixon手术治疗,且临床资料完整的247例直肠癌患者。
1.2 纳入与排除标准纳入标准:①进行直肠癌Dixon手术;②术后病理确诊为直肠癌;③术前无IAI;④术后在该院住院日数≥3 d;⑤术前、术后资料及手术记录完整。排除标准:①局部切除术,经腹/腹腔镜会阴联合直肠癌根治术(Miles手术),经腹直肠癌切除、近端造口、远端封闭手术(Hartman手术)等;②术前即诊断有IAI;③术后3 d内死亡或转院治疗;④临床资料不完整。
1.3 手术方式Dixon手术方式:操作按照全直肠系膜切除原则, 使用切割闭合器于肿瘤远端2~3 cm处离断肠管,行直肠和近端结肠的端端吻合,确定吻合口的完整,常规放置腹腔引流管,关闭腹腔,根据情况是否行预防性造口。
1.4 诊断标准病例符合以下IAI诊断标准[3]之一即诊断IAI。①白细胞(WBC)计数>10×109, 发热(体温>38.0℃),腹痛、腹胀,有明显的腹膜炎体征;②术区腹腔引流液为脓性且细菌学培养呈阳性;③经影像学手段或者再次手术证实腹腔内存在感染灶,如脓性渗出、脓肿等(图 1)。
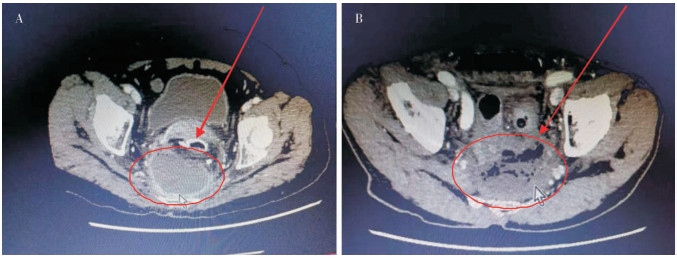 |
| A:显示直肠后方见68 mm×72 mm×60 mm脓液包裹,术中探查见约50 mL黄色脓液;B:显示直肠后方及周围可见明显积液积气感染灶,术中探查见吻合口瘘,周围可见黄色脓液。 图 1 腹部CT检查影像图 Figure 1 Abdominal computed tomography imaging findings |
目前大多基于临床表现和影像学及实验室检查结果综合判断,主要包括:腹腔或肛门引流管或腹部切口引流出粪便样液体,术后引流量突然增多,出现腹膜炎体征,发热症状,血白细胞异常升高,影像检查见吻合口周围积气及肠壁不连续显影,二次手术证实吻合口裂开等[4-7]。
1.6 资料的收集检索该院电子病历系统,收集胃肠外科行Dixon手术患者的年龄、性别、吸烟、高血压、糖尿病、腹部手术史,术前血红蛋白、清蛋白情况、术中出血量和输血量、使用吻合器情况、手术时间、术后血红蛋白,以及发生吻合口瘘、肺部感染和预防造口情况等。
1.7 统计学方法应用SPSS 25.0统计软件对数据进行分析。①单因素分析及logistic回归分析:计量资料先进行正态性检验,正态分布的计量资料以x±s表示, 使用独立样本t检验,不符合正态分布的数据以中位数及四分位数间距表示。计数资料采用χ2检验,通过单因素分析筛选出有统计学意义的危险因素,进行多因素logistic回归分析,最终筛选出与直肠癌Dixon术后IAI高度相关的独立危险因素,P≤0.05为差异有统计学意义。②列线图预测模型的构建与验证: 应用R软件(4.0.2)根据独立危险因素建立列线图预测模型,通过Bootstrap法获得校准曲线,计算C-index,绘制独立危险因素的受试者工作特征(ROC)曲线及计算各曲线下面积(AUC),决策曲线分析评价该风险模型预测效能,以验证列线图预测模型。
2 结果 2.1 一般情况符合纳入标准的患者共247例,其中男性159例,女性88例,年龄30~84岁,术后发生IAI 32例,发生率为13.0%,发生于术后8 d左右,其中22例患者经再次手术治疗解决病灶好转,10例患者经保守治疗好转。
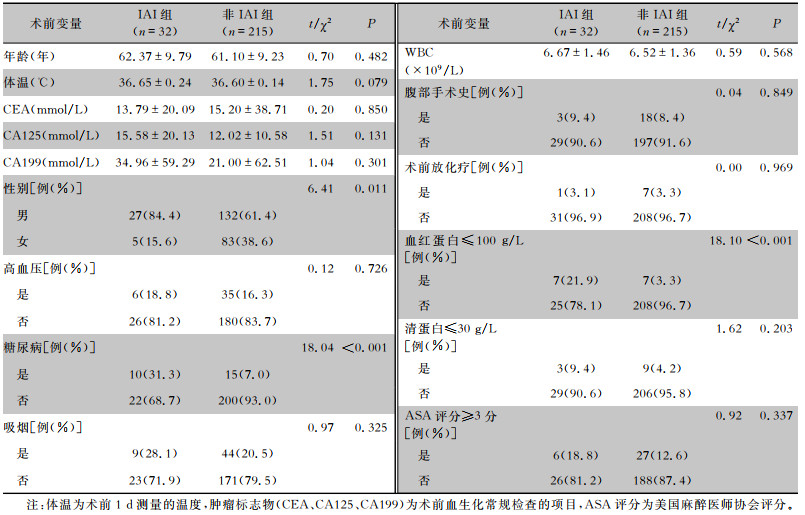
2.2 两组患者术前资料的单因素分析直肠癌患者Dixon术前资料中,患有糖尿病、性别、术前血红蛋白≤100 g/L,IAI组与非IAI组患者比较差异均具有统计学意义(均P<0.05);年龄、体温、术前WBC、术前CEA、术前CA125、术前CA199、吸烟、高血压病史、术前腹部手术史、术前清蛋白、术前放化疗、术前ASA评分,IAI组与非IAI组患者比较差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 两组直肠癌患者Dixon术前资料比较 Table 1 Comparison of pre-operative data of Dixon surgery between two groups of rectal cancer patients |
|
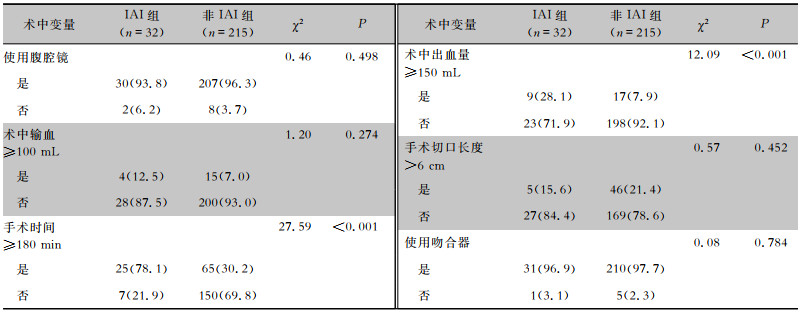
直肠癌患者Dixon术中资料中,手术时间≥180 min、术中出血量≥150 mL,IAI组与非IAI组患者比较差异均具有统计学意义(均P<0.05);使用腹腔镜、术中输血≥100 mL、手术切口长度>6 cm、使用吻合器,IAI组与非IAI组患者比较差异均无统计学意义(均P>0.05)。见表 2。
| 表 2 两组直肠癌患者Dixon术中资料比较[例(%)] Table 2 Comparison of peri-operative data of Dixon surgery between two groups of rectal cancer patients (No. of patients[%]) |
|
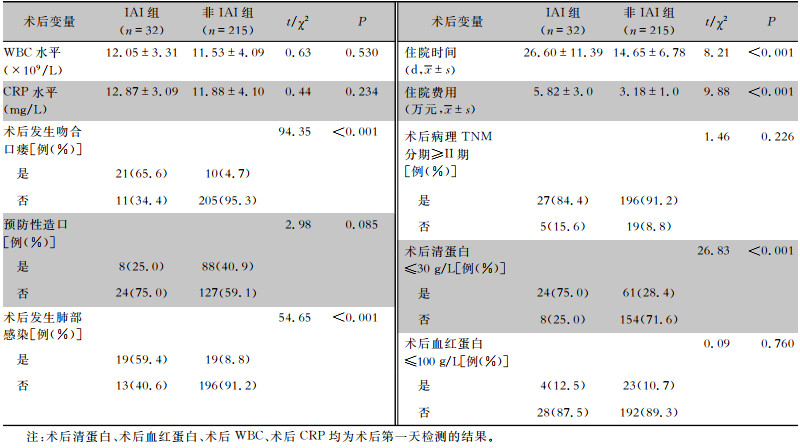
直肠癌患者Dixon术后资料中,术后发生吻合口瘘、术后发生肺部感染、术后清蛋白≤30 g/L、住院时间、住院费用,IAI组与非IAI组患者比较差异均具有统计学意义(均P<0.001);术后WBC水平、术后CRP水平、预防性造口、术后病理TNM分期、术后血红蛋白≤100 g/L,IAI组与非IAI组患者比较差异均无统计学意义(均P>0.05)。见表 3。
| 表 3 两组直肠癌患者Dixon术后资料的比较 Table 3 Comparison of post-operative data of Dixon surgery between two groups of rectal cancer patients |
|
按照表 4赋值方案,将P<0.05的变量设为自变量(X1,X2,X3……),将术后发生IAI设为因变量(Y),纳入logistic回归模型。最终多因素logistic回归分析筛选出术后IAI风险高度相关的危险因素为:糖尿病、手术时间≥180 min,术后吻合口瘘、术后发生肺部感染。见表 5。
| 表 4 各研究变量赋值方法 Table 4 Assignment methods of variables in each study |
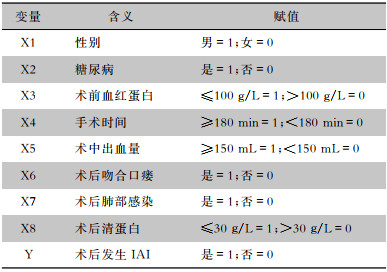
|
| 表 5 直肠癌Dixon术后患者IAI危险因素logistic回归多因素分析结果 Table 5 Multivariate logistic regression analysis on risk factors for IAI in rectal cancer patients after Dixon surgery |
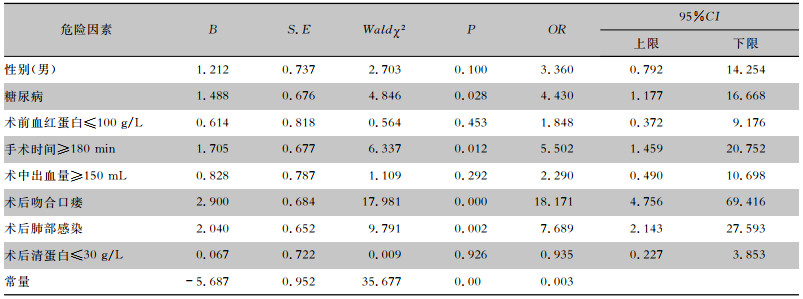
|
将上述多因素logistic回归分析筛选出的独立危险因素,运用R软件4.0.2及其rms程序包,构建直肠癌Dixon术后IAI发生风险的列线图模型,绘制Nomogram图(见图 2),首先通过各自变量的回归系数计算对应得分,分别为53.65(糖尿病)、59.60(手术时间≥180 min)、100.00(术后发生吻合口瘘)、77.83分(术后发生肺部感染),然后将各个变量的单项得分相加获得相应的总分,总分对应预测该直肠癌患者Dixon术后发生IAI的概率。
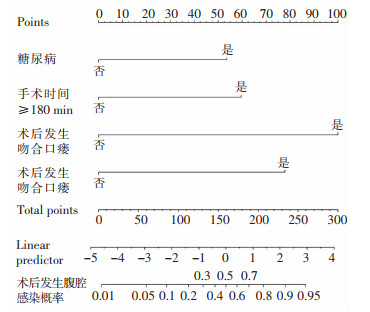 |
| 图 2 预测直肠癌Dixon术后IAI的直观Nomogram图 Figure 2 Visual nomogram for predicting IAI after Dixon surgery for rectal cancer |
通过Hosmer-Lemeshouw法检测评价预测模型的拟合优度,结果显示P=0.487, 说明该列线图预测模型具有较好的拟合度。使用Bootstrap自抽样法及计算预测模型的区分度对此模型进行内部验证。Bootstrap重复抽样1 000次,获得该模型的校准曲线(见图 3),显示该列线图模型直肠癌Dixon术后IAI的预测发生概率和实际发生概率之间一致性较好。计算的C-index值为0.945,意味着该列线图预测模型的区分能力较好。通过绘制ROC曲线(见图 4), 结果显示列线图预测模型ROC曲线的AUC为0.945(95%CI: 0.871~0.971), 证明该预测模型预测效能好,具有较好的判别能力。通过绘制决策曲线分析(见图 5)显示该预测模型价值性高。
 |
| 注:Y轴为实际的IAI发生概率,X轴为预测的IAI发生概率,对角虚线代表了一个理想模型的完美预测,实线代示列线图的性能,其中与对角线虚线越接近则表示预测性能越好。 图 3 列线图预测模型的校准曲线 Figure 3 Calibration curve of nomogram prediction model |
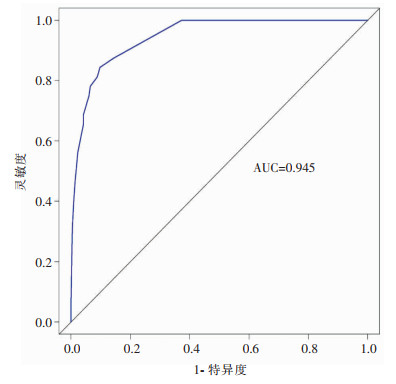 |
| 图 4 列线图预测模型的ROC曲线 Figure 4 ROC curve of nomogram prediction model |
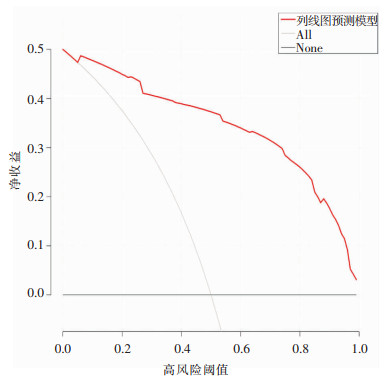 |
| 图 5 列线图预测模型的决策曲线分析图 Figure 5 Decision curve analysis of nomogram prediction model |
IAI是直肠癌患者术后严重的并发症,可能增加肿瘤复发等风险,Sverrisson等[8]研究发现术后IAI会增强肿瘤细胞在体外的迁移和侵袭能力;IAI一旦发生,延长患者住院时间,增加患者的住院费用,甚至导致肿瘤局部复发而严重影响患者预后,因此预防直肠癌Dixon术后IAI具有非常重要的意义。本研究回顾性分析了2017年12月—2020年9月收治的直肠癌Dixon手术患者的临床资料,结果显示术后IAI发病率为13.0%,与既往文献[9]报道的发病率基本相符。
本研究显示,糖尿病、手术时间≥180 min、术后吻合口瘘和术后肺部感染是直肠癌患者Dixon术后IAI的独立危险因素。糖尿病是直肠癌患者Dixon术后IAI的独立危险因素,可能与糖尿病患者的免疫功能受损,合并神经血管病变,血糖高利于细菌生长繁殖;微循环障碍导致吻合口血供不足,糖原储存不足,高血糖导致组织愈合延迟等原因有关[10-11]。陈晓霞等[12]通过logistic回归分析287例行腹腔镜手术的结直肠癌患者临床资料,显示手术时间长显著增加术后IAI的风险。分析其原因可能由于手术区域长期暴露导致细菌定植,牵拉器对组织长时间的牵拉压迫导致血液循环不佳,降低抗细菌的能力,易于感染[13-14]。张美娟[15]回顾性分析病历资料完整的796例结直肠癌患者的临床资料,logistic回归分析显示,发生吻合口瘘的患者IAI风险发生率是未发生吻合口瘘患者的4.459倍。当吻合口瘘发生,大量的细菌及消化液涌入腹腔,导致IAI,甚至感染中毒性休克。分析直肠癌患者根治手术后临床资料得出术后发生肺部感染是IAI的独立危险因素[16-17]。可能原因是直肠癌患者机体长期处于慢性消耗状态,免疫功能下降,尤其是长期吸烟的老年男性,更易出现小气道功能紊乱,肺通气功能降低并且患者术后卧床时间较长,咳痰无力,及腹腔镜手术时人工气腹的建立影响呼吸功能等均易导致肺部感染。当患者发生肺部感染,炎症因子爆布性释放,从而加重腹腔内炎性渗出,吻合口周围受炎症刺激,容易导致吻合口瘘,从而引起腹腔内感染的发生。
本研究中,直肠癌患者术后IAI 32例,22例患者再次手术解决病灶好转,10例患者经保守治疗好转,统计得知IAI组患者的住院时间及住院费用高于非IAI组患者,因此,术后IAI一旦发生,不仅增加患者住院费用,非计划再次手术增加患者痛苦,而且有可能增加肿瘤复发,影响远期生存质量。因此建立一个直观、简单、有效列线图预测模型为外科医生对术后IAI的预防与治疗提供指导意见。本研究基于单因素分析和多因素logistic回归分析结果,建立直肠癌Dixon术后IAI发生风险列线图预测模型。通过Hosmer-Lemeshouw法、校准曲线、C-index值、ROC曲线、AUC、决策曲线分析验证该模型预测准确及价值性较高。临床外科医生可通过本研究构建的直观预测模型对IAI高危患者进行早期预判,及早采取预防措施,如糖尿病患者应确保在手术前进行良好的血糖控制;及时找出吻合口瘘发生的危险因素及时干预;患者术前应积极戒烟,术后多翻身拍背加强排痰,围手术期加强雾化,若病情允许应多鼓励患者早期适当活动,以防止术后肺部感染的发生;高危患者应术后严密监测,从而降低IAI的发生,提高围手术期安全性。
综上所述,糖尿病、手术时间≥180 min,以及术后吻合口瘘、肺部感染是直肠癌Dixon术后IAI的的独立危险因素,以此建立的列线图预测模型准确性、价值性较高,可帮助外科医生对术后IAI的预防与治疗提供参考意见,有助于降低直肠癌前切除术后IAI的发生率。由于其为回顾性研究且病例数有限,对于直肠癌前切除术后IAI的发生仍需要进一步多中心大样本的研究。
| [1] |
De Pascale G, Carelli S, Vallecoccia MS, et al. Risk factors for mortality and cost implications of complicated intra-abdomi-nal infections in critically ill patients[J]. J Crit Care, 2019, 50: 169-176. DOI:10.1016/j.jcrc.2018.12.001 |
| [2] |
Battersby NJ, Bouliotis G, Emmertsen KJ, et al. Development and external validation of a nomogram and online tool to predict bowel dysfunction following restorative rectal cancer resection: the POLARS score[J]. Gut, 2018, 67(4): 688-696. |
| [3] |
Lo CH, Chen JH, Wu CW, et al. Risk factors and management of intra-abdominal infection after extended radical gastrectomy[J]. Am J Surg, 2008, 196(5): 741-745. DOI:10.1016/j.amjsurg.2007.11.031 |
| [4] |
Rahbari NN, Weitz J, Hohenberger W, et al. Definition and grading of anastomotic leakage following anterior resection of the rectum: a proposal by the international study group of rectal cancer[J]. Surgery, 2010, 147(3): 339-351. DOI:10.1016/j.surg.2009.10.012 |
| [5] |
中华医学会外科学分会结直肠外科学组. 中国直肠癌手术吻合口漏诊断、预防及处理专家共识(2019版)[J]. 中华胃肠外科杂志, 2019, 22(3): 201-206. |
| [6] |
Salvans S, Mayol X, Alonso S, et al. Postoperative peritoneal infection enhances migration and invasion capacities of tumor cells in vitro: an insight into the association between anastomotic leak and recurrence after surgery for colorectal cancer[J]. Ann Surg, 2014, 260(5): 939-943. DOI:10.1097/SLA.0000000000000958 |
| [7] |
Eagye KJ, Nicolau DP. Deep and organ/space infections in patients undergoing elective colorectal surgery: incidence and impact on hospital length of stay and costs[J]. Am J Surg, 2009, 198(3): 359-367. DOI:10.1016/j.amjsurg.2008.11.030 |
| [8] |
Sverrisson I, Nikberg M, Chabok A, et al. Low risk of intra-abdominal infections in rectal cancer patients treated with Hartmann's procedure: a report from a national registry[J]. Int J Colorectal Dis, 2018, 33(3): 327-332. DOI:10.1007/s00384-018-2967-0 |
| [9] |
贾磊, 陆锦琪, 马燮峰, 等. 结直肠癌术后腹腔感染发生的危险因素分析[J]. 中华胃肠外科杂志, 2016, 19(4): 409-413. DOI:10.3760/cma.j.issn.1671-0274.2016.04.013 |
| [10] |
Núñez SA, Lacal V, Núñez J, et al. Antibiotic resistance in community-acquired intra-abdominal infections: diabetes mellitus as a risk factor[J]. Surg Infect (Larchmt), 2020, 21(1): 62-68. DOI:10.1089/sur.2019.032 |
| [11] |
饶小娟, 吴毓敏. 老年2型糖尿病合并感染的类型及临床特点、易感因素及其疗效观察[J]. 实用糖尿病杂志, 2020, 16(2): 40-41. |
| [12] |
陈晓霞, 畅立宏, 张淑霞, 等. 结直肠癌患者腹腔镜术后医院感染的影响因素分析[J]. 中华医院感染学杂志, 2019, 29(17): 2669-2672. |
| [13] |
Huh JW, Lee WY, Park YA, et al. Oncological outcome of surgical site infection after colorectal cancer surgery[J]. Int J Colorectal Dis, 2019, 34(2): 277-283. DOI:10.1007/s00384-018-3194-4 |
| [14] |
Morris MS, Graham LA, Chu DI, et al. Oral antibiotic bowel preparation significantly reduces surgical site infection rates and readmission rates in elective colorectal surgery[J]. Ann Surg, 2015, 261(6): 1034-1040. DOI:10.1097/SLA.0000000000001125 |
| [15] |
张美娟. 结直肠癌术后发生腹腔感染的危险因素分析[J]. 中国卫生统计, 2020, 37(6): 926-928. |
| [16] |
郑晖. 结直肠癌患者手术部位切口感染的危险因素分析[D]. 福州: 福建医科大学, 2014.
|
| [17] |
Wu CH, Ho TW, Wu JM, et al. Preoperative biliary drainage associated with biliary stricture after pancreaticoduodenectomy: a population-based study[J]. J Hepatobiliary Pancreat Sci, 2018, 25(6): 308-318. DOI:10.1002/jhbp.559 |



