2. 中南大学湘雅医院医院感染控制中心, 湖南 长沙 410008;
3. 复旦大学附属中山医院感染病科, 上海 200032;
4. 北京大学第一医院感染管理科, 北京 100034;
5. 解放军总医院感染管理科, 北京 100039;
6. 华中科技大学同济医学院附属同济医院检验科, 湖北 武汉 430030;
7. 四川大学华西医院感染性疾病中心, 四川 成都 610041;
8. 中国人民解放军东部战区总医院呼吸科, 江苏 南京 210002;
9. 广州医科大学附属第一医院呼吸疾病国家重点实验室, 广东 广州 510120;
10. 北京大学第一医院感染科, 北京 100034;
11. 浙江大学传染病诊治国家重点实验室, 浙江 杭州 310003;
12. 北京市垂杨柳医院检验科, 北京 100022;
13. 浙江大学医学院附属第二医院检验科, 浙江 杭州 310009;
14. 复旦大学附属华山医院抗生素研究所, 上海 200040;
15. 郑州大学第一附属医院感染管理科, 河南 郑州 450052;
16. 南京大学医学院附属鼓楼医院感染管理科 江苏省医院感染管理质控中心, 江苏 南京 210008;
17. 福建医科大学附属协和医院血液科, 福建 福州 350001;
18. 南方医科大学南方医院感染管理科, 广东 广州 510515;
19. 浙江大学医学院附属邵逸夫医院感染科, 浙江 杭州 310020
2. Center for Healthcare-associated Infection Control, Xiangya Hospital, Central South University, Changsha 410008, China;
3. Department of Infectious Diseases, Fudan University Zhongshan Hospital, Shanghai 200032, China;
4. Department of Infection Control, Peking University First Hospital, Beijing 100034, China;
5. Department of Infection Control, Chinese PLA General Hospital, Beijing 100039, China;
6. Department of Clinical Laboratory, Tongji Hospital, Tongji Medical College Huazhong University of Science & Technology, Wuhan 430030, China;
7. Center for Infectious Diseases, West China Hospital of Sichuan University, Chengdu 610041, China;
8. Department of Respiratory Diseases, General Hospital of Eastern Theater Command, PLA, Nanjing 210002, China;
9. National Key Laboratory for Respiratory Diseases, The First Affiliated Hospital of Guangzhou Medical University, Guangzhou 510120;
10. Department of Infectious Diseases, Peking University First Hospital, Beijing 100034, China;
11. State Key Laboratory for Diagnosis and Treatment of Infectious Diseases, Zhejiang University, Hangzhou 310003, China;
12. Department of Clinical Laboratory, Beijing Chuiyangliu Hospital, Beijing 100022, China;
13. Department of Clinical Laboratory, The Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310009, China;
14. Institute of Antibiotics, Huashan Hospital, Fudan University, Shanghai 200040, China;
15. Department of Infection Control, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
16. Department of Infection Control, Nanjing Drum Tower Hospital, Nanjing University Medical School, Nanjing 210008, China;
17. Department of Hematology, Fujian Medical University Union Hospital, Fuzhou 350001, China;
18. Department of Infection Control, Nanfang Hospital, Southern Medical University, Guang-zhou 510515, China;
19. Department of Infectious Diseases, Sir Run Run Shaw Hospital, Zhejiang University School of Medicine, Hangzhou 310020, China
在过去的二十年,抗菌药物耐药病原菌已经成为全球重大公共卫生威胁。根据《中国抗菌药物管理和细菌耐药现状报告(2019)》[1]公布的数据,全国细菌耐药监测网(China Antimicrobial Resistance Surveillance System, CARSS)2018年耐甲氧西林金黄色葡萄球菌(MRSA)、耐青霉素肺炎链球菌(PRSP)、耐万古霉素屎肠球菌(VREM)、耐碳青霉烯类肺炎克雷伯菌(CRKP)、耐亚胺培南铜绿假单胞菌(IPM-R-PA)、耐亚胺培南鲍曼不动杆菌(IPM-R-AB)的分离率已达30.9%、1.8%、1.4%、10.1%、18.4%和52.6%。
各种病原菌可在人与人之间传播,且主要通过接触传播,医院内患者尤其是免疫缺陷患者往往是泛耐药菌的易感人群。泛耐药菌感染者和定植者均是传染源,医务人员也可能因为泛耐药菌的定植而成为新的传染源,导致在一定范围内的暴发流行。世界卫生组织(WHO)等国际组织已提出综合防控措施,包括病原菌监测、手卫生、接触预防、患者隔离、环境消毒等措施[2-4],但国内尚缺乏完善的、针对中国自身国情的临床重要耐药菌综合防控措施技术体系。本共识组织相关专家撰写了临床重要耐药菌感染传播防控策略,涉及通用策略和个性化策略,供临床参考。
1 术语定义 1.1 耐药(resistance)微生物对临床治疗(常规)使用的关键药物的敏感性减弱、丧失[5]。
1.2 多重耐药(multidrug-resistant,MDR)、广泛耐药(extensively drug-resistant,XDR)、全耐药(pandrug-resistant,PDR)和多重耐药的微生物(multidrug-resistant organism,MDRO)目前学术界对各种病原菌MDR、XDR、PDR的标准定义尚未统一,但有国际专家建议的暂行标准可供参考[6-7]。目前已发表的相关共识多定义如下。MDR:对可用药物中3类或更多(每类中的1种或更多)不敏感。XDR:对可用药物除了2类或1类之外,其余(每类中的1种或更多)均不敏感。PDR:对可用药物均不敏感。
1.3 医疗保健相关感染(healthcare -associated infection,HCAI)、医院获得性感染(hospital acquired infection,HAI)、医源性感染(iatrogenic infection,II)和社区获得性感染(community-acquired infection,CAI)HCAI:患者接受治疗过程中获得的感染,或某些人员(主要是医务人员)在医疗环境中获得的感染[5]。HAI:简称医院感染,指入院时不存在也不处在潜伏期,医院内获得的感染,包括出院后才发病的情况,实际工作中有的情况有明确的专业界定。HCAI的范围比HAI大, 二者一般情况可以视作同义词。II是由生物医用制品或医疗行为导致的因果关系明确的感染, 是HCAI/HAI的一种类型。CAI和HAI相对,是在一般的社会生活环境内——主要是社区内获得的感染,和医疗环境、医疗行为、医疗制品无关。
1.4 感染控制(infection control,IC)全称感染控制与预防(infection control and prevention), 指防止或终止感染的扩散(spread)[7]。广义而言即对感染进行预防与控制,避免发生、加重、体内播散(dissemination)、人际传播(transmission)并促进治愈的一门学科和实践。涉及生物学尤其是微生物学、诊断学、治疗学、行为学、材料学等。
1.5 抗微生物药物管理(antimicrobial stewardship,AMS)也称作抗生素管理(antibiotic stewardship,AS)、抗菌药物管理。是通过管理改善抗微生物药物(抗生素)处方和使用的方式[7]。
2 临床重要耐药菌的流行病学、耐药机制及实验室检测2017年,WHO发布公告,将临床重要耐药细菌按危险程度进行分级,指出目前亟需开发新抗菌药物以应对重要耐药菌所致感染,包括耐碳青霉烯类革兰阴性杆菌、产超广谱β-内酰胺酶肠杆菌目细菌、耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素屎肠球菌等[8]。
CHINET中国细菌耐药监测网2019年结果显示,肠杆菌目细菌对第三代头孢菌素的耐药率维持在较高水平,其中大肠埃希菌和肺炎克雷伯菌的耐药率分别约为55%、45%[9]。铜绿假单胞菌和鲍曼不动杆菌对碳青霉烯类的平均耐药率分别约为25%、75%。近年来,肺炎克雷伯菌对碳青霉烯类的耐药率呈快速上升趋势,且我国不同省份不同医疗机构分离菌株的耐药率相差较大[10]。研究表明,不同国家不同医疗机构不同人群分离的碳青霉烯类耐药菌株所产碳青霉烯酶基因型别有较大差别[11]。金黄色葡萄球菌中甲氧西林耐药菌株的平均检出率约为35%,且儿童分离菌株中该耐药菌株的检出率呈上升趋势[9];与国际上报道不同的是,我国临床分离的万古霉素耐药屎肠球菌的检出率处于低水平,< 3.5%[12]。
临床常见细菌对抗菌药物耐药的主要机制包括以下几个方面:(1)膜孔蛋白改变或缺失。膜孔蛋白编码基因的改变,或参与膜孔蛋白表达的调节基因的改变,使得相应的膜孔蛋白缺失或功能缺陷,从而引起抗菌药物耐药[13]。如肺炎克雷伯菌Ompk35和Ompk36的缺失,导致菌株对碳青霉烯类抗生素耐药[14],铜绿假单胞菌由于编码orpd膜孔蛋白的基因下调而对碳青霉烯类耐药[15]。(2)外排泵的过表达。外排泵在铜绿假单胞菌和不动杆菌等革兰阴性菌的β-内酰胺类耐药中起着重要作用[16]。研究[17-18]表明, 肺炎克雷伯菌对替加环素耐药的机制主要是由于RND型AcrAB-TolC外排泵和OqxAB外排泵高表达所致。(3)水解酶的生成。β-内酰胺酶能够水解β-内酰胺环,使得抗菌药物不能与青霉素结合蛋白PBP有效结合,从而干扰细胞壁的合成[19]。其中,碳青霉烯酶是最常见的β-内酰胺酶之一,其产生是肠杆菌目细菌对碳青霉烯类抗生素耐药最主要的机制[20]。(4)靶位点的改变。MRSA主要的耐药机制就是特有的mecA基因大量编码特殊的对β-内酰胺类抗生素低亲和力结合的青霉素结合蛋白PBP2a,从而导致β-内酰胺类抗生素耐药[21]。革兰阴性菌基因突变可导致DNA促旋酶或拓扑异构酶活性位点改变,从而引起喹诺酮类耐药[22]。(5)修饰酶的产生。氨基糖苷钝化酶能与氨基糖苷类抗生素特定的氨基或羟基结合,从而导致这类抗生素发生钝化而失效[23]。Tet(X)最早被认为是四环素灭活酶,可在氧气和NADPH同时存在的情况下化学修饰四环素类药物,导致四环素类耐药[24],而近来研究发现Tet(X)及其变异体与替加环素耐药密切相关[25]。(6)生物膜的形成。生物膜形成是细菌在抗菌药物环境下存活的有效途径[26],鲍曼不动杆菌和铜绿假单胞菌在医院环境中长期存在,并造成广泛的医院感染,与其较强的生物膜形成能力密切相关。
耐药基因在病原菌中的传播方式分为垂直传播和水平传播两种方式。第一种传播方式由于耐药基因位于菌株染色体上,耐药性仅能随着菌株的繁殖由亲代传给子代;而第二种传播方式由于质粒、转座子等可移动元件的存在,使得耐药基因可在不同菌种、不同菌属、不同菌株间互相传播,导致耐药性的广泛扩散。
以下简述耐药菌检测的实验室方法:
2.1 MRSA对受试葡萄球菌使用头孢西丁纸片法药敏试验,或头孢西丁或苯唑西林稀释法药敏试验,也可使用苯唑西林盐琼脂筛选MRSA[27]。一些商品化的显色培养基也可用于MRSA的筛查。由于绝大多数MRSA携带mecA基因,可采用PCR扩增mecA基因检测MRSA,也可采用乳胶凝集法测定PBP2a检测MRSA,其检测灵敏度和特异度分别可达100%和97.1%[28]。
2.2 耐万古霉素肠球菌(VRE)采用纸片扩散法、E-test法、脑心浸液琼脂筛选法和显色培养基法等。脑心浸液琼脂筛选法测定万古霉素MIC和动力试验及色素产生,可区别万古霉素获得性耐药(如VanA和VanB)与固有、中介水平耐药(VanC),万古霉素对鹑鸡肠球菌和铅黄肠球菌最低抑菌浓度(MICs)8~16 μg/mL属于固有、中介水平耐药,而对获得性耐药的VRE进行筛查,则是以预防感染为目的[27]。
2.3 产ESBLs肠杆菌目细菌可使用纸片扩散法或微量肉汤稀释法进行ESBLs的初筛及确证,相应操作和判读标准可参考CLSI M100文件。此外,三维试验、双纸片协同试验、E-test法和显色培养基法也可检测ESBLs。也可使用分子生物学方法检测blaCTX-M、blaSHV和blaTEM等ESBLs基因。
2.4 耐碳青霉烯类革兰阴性杆菌主要包括耐碳青霉烯类肠杆菌目细菌(CRE)、耐碳青霉烯类鲍曼不动杆菌(CRAB)和耐碳青霉烯类铜绿假单胞菌(CRPA),可采用纸片扩散法、自动化仪器法、微量稀释法或E-test法及显色培养基法等,也可采用分子生物学方法检测blaNDM、blaKPC、blaIMP、blaOXA-48等耐药基因。目前,实验室检测碳青霉烯酶的方法众多,主要包括CarbaNP试验、改良碳青霉烯灭活试验(mCIM)、碳青霉烯酶抑制剂增强试验、免疫层析试验以及分子生物学方法等。其中酶抑制剂增强试验使用3-氨基苯硼酸和EDTA可判断被测菌株是否产生A类碳青霉烯酶(主要为KPC酶)、B类金属酶或同时产两种类型的碳青霉烯酶,操作简单、结果易读[29]。免疫层析试验采用抗原抗体反应的技术,可在15 min内快速检测碳青霉烯酶并可分型, 总体灵敏度和特异度可分别达97.31%和99.75%[30]。
2.5 多重耐药艰难梭菌可采用环丝氨酸-头孢西丁-果糖琼脂(CCFA)培养基或艰难梭菌鉴定(CDIF)培养基对艰难梭菌(CD)进行培养,但单纯的细菌培养不能用于诊断CD的感染,仅用于菌株分型和耐药性的后续检测[31]。实验室常使用酶联免疫法或层析法测定CD毒素、CD高水平表达的代谢谷氨酸脱氢酶(GDH)以及分子生物学方法测定毒素基因的两步法或三步法联合检测CD的感染[32]。亦可使用分子生物学方法检测tcdA、tcdB、cdtA、cdtB等毒素基因。CD的耐药性检测可采用琼脂稀释法或E-test。
2.6 多重耐药耳念珠菌多重耐药耳念珠菌[7]可采用表型鉴定、分子生物学及基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)等方法进行鉴定,但基于表型的检测方法可能将耳念珠菌鉴定为希木龙假丝酵母菌或其他假丝酵母菌。药敏的检测通常采用CLSI M60推荐的微量肉汤稀释法[33]。亦可检测ERG基因是否存在突变或缺失,从而导致对唑类药物耐药;检测FKS基因是否存在突变,而导致棘白菌素类药物耐药。见表 1。
| 表 1 临床重要耐药菌的流行病学、耐药机制、传播方式以及实验室检测方法 |
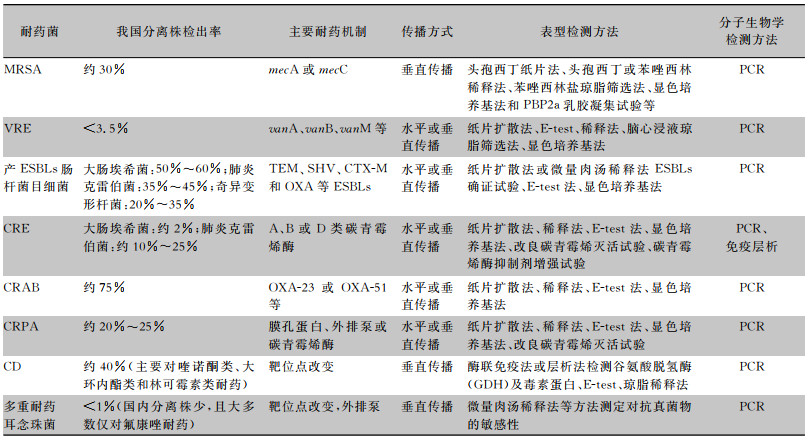
|
正确执行手卫生可减少手部微生物(包括耐药菌)污染,从而降低医院感染发生风险。手卫生被认为是预防和控制耐药菌传播的最基础、最有效、最经济的策略[34]。手卫生是减少病原体感染和传播不可或缺[35-36]的手段,也是感染防控的基础措施之一,是整体防控策略的一部分。规范的手卫生设施包括流动水洗手池、非手触式水龙头开关、洗手液、干手设施、手消毒剂和手卫生流程示意图等。手卫生设施的设置应方便可及,符合《医务人员手卫生规范》(WS/T 313—2019)[37]的要求。
各医疗机构应依据国家规范,制定本机构的手卫生制度,并实施有关策略。包括改善手卫生设施,保证手卫生用品充足且便于获取;张贴手卫生警示标识和提醒;开发领导层,提高重视程度并加强管理;增强对各级各类人员手卫生知识与技能培训教育,开展多种形式的手卫生宣传活动,提高各类人员手卫生意识与技能;加强手卫生监督、管理、考核与信息反馈;鼓励患者参与手卫生改进实践,提高耐药菌感染患者探视人员的手卫生意识;营造医疗机构内良好的手卫生文化等[38-41]。落实各项措施,切实提高医务人员手卫生意识、依从性和正确性,降低耐药菌交叉感染的风险。
3.2 接触预防 3.2.1 基本要求MDRO感染或定植的患者需在标准预防的基础上采取接触预防措施。根据标准预防原则,应在合理的时机正确地实施手卫生;当执行有喷溅操作(如伤口冲洗、吸痰、气管插管等)、护理气管切开的患者和有分泌物喷溅的患者时,以及在有证据支持感染或定植源(如烧伤创面)引发传播的环境中工作时,应进行面部防护,如佩戴口罩和护目镜或防护面屏[42-43]。标准预防措施对于防止潜在定植患者的传播也至关重要,MDRO定植通常不易被检测到,即使是主动监测也可能由于缺乏敏感性、实验室缺陷,或由于抗菌药物治疗导致间歇性定植而无法识别[44]。因此,采取接触预防的同时,不能忽略正确实施标准预防。
3.2.2 管理要求制定MDRO感染防控相关制度,包括抗菌药物合理应用管理、MDRO预防和控制措施、手卫生制度等;开展相关科室的教育培训,对所有医生、护士、医技人员、保洁人员、外送人员分层次分别进行培训和宣教,提高工作人员对MDRO的重视,严格执行工作人员工作过程中涉及到的MDRO防控措施;与微生物室合作,规范标本送检;获取上级行政支持,提高医院领导层面对MDRO防控工作的重视程度,配备合格、充足的隔离用品;专人负责MDRO的监测并监督各科室执行各项措施。
3.2.3 接触预防措施(1) 患者隔离(见3.3)。(2)接触隔离:对实施接触预防的患者进行诊疗护理时,医务人员可能接触患者或患者周围环境中可能受污染的区域时需穿隔离衣和戴手套。在进入患者病房之前穿好隔离衣和戴好手套,离开病房前摘掉手套并脱隔离衣[45-46]。医务人员对患者实施诊疗护理操作时,将MDRO感染或定植患者安排在最后进行,转诊或外出检查之前通知接诊或接待检查的科室,提醒其采取相应防控措施。(3)诊疗用品处理:与患者直接接触的相关医疗用品,如听诊器、血压计、体温表、输液架等要专人专用,并及时消毒处理。轮椅、担架、床旁心电图机等不能专人专用的医疗器械、器具及物品要在每次使用后擦拭消毒。(4)环境清洁消毒:清洁和消毒可能被病原体污染的环境表面和设备,包括邻近患者的物体表面(如床栏杆、床头桌)、患者诊疗环境中经常接触的表面(如门把手、病房中厕所的表面和周围);优先清洁实行接触隔离措施的房间,并重点清洁消毒患者经常接触的表面(如床栏杆、床头桌、病房浴室的设备、门把手)和临近患者的设备。(5)医疗废物管理:在患者床头放置医疗废物桶。在MDRO感染患者或定植患者诊疗过程中产生的医疗废物,以及沾有患者痰液、体液等的生活垃圾,应当按照医疗废物进行处置和管理。
3.3 患者隔离 3.3.1 病原体对于CRE、CRAB、CRPA、MRSA、VRE、CD感染或定植者,需要隔离。如果条件有限, 则优先对CRE感染者或定植者隔离; 我国普通人群中产ESBLs的肠杆菌目细菌比例较高,在医疗机构内通过隔离预防此类耐药菌传播,已无实际意义。
3.3.2 隔离方法(1) 单间隔离:应优先将CRE、CD感染或定植者安置于单人病室,尤其是传播风险大的患者,如有人工气道机械通气、大小便失禁、伤口持续有分泌物等情形的患者。隔离病室入口处应有明显隔离标识,隔离病室诊疗用品应专人专用,医务人员和探视者进入隔离病室应执行接触预防措施和手卫生。(2)集中安置:当不具备实施单间隔离的条件时, 应将同一种耐药菌感染或定植者安置在同一间病室或隔离区域, 保证与其他患者有足够的床间距。划定集中安置患者护理活动限制区域,可设物理屏障或划线标注。避免在耐药菌感染或定植者紧邻区留置各种导管、安置有开放伤口或免疫功能低下等易感患者。
接收隔离耐药菌感染或定植者,需安排专门的照护工作人员,即不应同时担负无耐药菌感染者,或非同种耐药菌感染或定植者的照护任务。其他医务人员,如护士、呼吸治疗师等视医疗机构具体情况参照执行,特别是在耐药菌感染流行或暴发期间。
3.3.3 隔离期限原则上应隔离至耐药菌培养连续两次阴性。对于部分长期携带耐药菌患者,可以至疾病症状消失出院时。
3.4 主动监测 3.4.1 感染患者监测对于有感染症状的患者,应及时送检相应的微生物标本进行检测(如培养、核酸检测等)。当从标本中检出临床重要耐药菌时,实验室应将结果及时通知相应的临床医务人员和感控人员。
3.4.2 无症状定植者的主动筛查 3.4.2.1 筛查的意义无症状的耐药菌定植患者可成为潜在的传染源,对其开展主动筛查有助于早发现、早应对。然而,在采取包括手卫生、环境卫生等标准预防情况下,对于特定耐药菌(如产ESBLs的肠杆菌目细菌)进行主动筛查是否有必要(是否能增加防控效果)还存有较大争议。除CRE、MRSA和VRE外,当前阶段主动筛查并非是一线防控措施,而往往作为一线措施控制不佳时或暴发调查时的强化防控措施。
3.4.2.2 筛查的耐药菌基于现有研究,主动筛查通常针对以下耐药菌和特定标本类型,CRE(粪便或直肠拭子)[47]、MRSA(鼻前庭拭子)、VRE(粪便或直肠拭子),由医疗机构依据自身防控重点和耐药菌情况等考虑开展。
此外,鼓励有条件的医疗机构对其他种类耐药菌(如鲍曼不动杆菌)和标本类型(如下呼吸道标本)进行主动筛查科研。
3.4.2.3 筛查的指征有条件的医疗机构宜依据自身医疗服务的特点和耐药菌监测数据等资料,确定特定或高风险人群,并对其开展特定耐药菌的主动筛查。(1)在非耐药菌感染暴发时,开展主动筛查的特定或高风险人群通常包括预估入住ICU>2 d患者,需入住新生儿ICU的新生儿,需进行器官、骨髓/干细胞移植的患者,器官移植的供体,需进行心脏手术患者(仅需筛查MRSA)等。(2)在暴发或怀疑暴发时,宜对涉及病区的所有入院和在院患者进行筛查。若受条件限制确实无法做到,则宜优先筛查高风险患者,通常包括:过去6个月内已知曾检出该耐药菌的患者,从耐药菌感染高风险科室(如ICU)转入者,有与已知耐药菌感染/定植者同一病室、免疫受限、移植术后、有开放气道、有大面积创面、新生儿、从别的医疗机构转入等耐药菌感染发生高危因素之一的患者。(3)不推荐对医务人员进行CRE、VRE等耐药菌的主动筛查。(4)不推荐常规对医务人员进行MRSA主动筛查。有报道医务人员携带MRSA可能与医院感染暴发有关,当面对MRSA感染暴发而经过环境采样、详细调查和采取干预措施后仍未能控制暴发时,在知情同意情况下方可考虑对医务人员进行MRSA主动筛查。
3.4.2.4 筛查的频率主动筛查包括入院/入病区48 h内采样以反映带入情况,以及在院/在病区采样以反映院内获得情况,其频率取决于筛查目的(如是否为暴发调查)、资源配置(如采样和检测的人力),常见为一周一次,在暴发调查时可能更频繁。
3.4.2.5 筛查的方法主动筛查通常包括对标本进行核酸扩增检测和培养鉴定两种方法。基于现有条件,最常采用的是培养鉴定方法(通常使用含特定抗菌药物的选择性培养基),但培养方法耗时较长(1~2 d),且敏感性较核酸方法低。鼓励有条件的医疗机构开展核酸扩增检测方法,并对其进行敏感性和特异性的观察。核酸方法检测已知的菌种和已知的耐药基因,但不能检测未被纳入的已知耐药基因或新的尚未知的耐药基因,同时也往往难以将特定耐药基因与特定菌种关联。
3.5 环境监测《病区医院感染管理规范》[48]和《医院消毒卫生标准》[49]中规定怀疑医院感染暴发或疑似暴发与医院环境有关时,应进行目标微生物检测;应每季度对重症监护病房物体表面、医务人员手和空气进行消毒效果监测,当怀疑医院感染暴发、ICU新建或改建以及病室环境的消毒方法改变时,应随时进行监测。《医疗机构环境表面清洁与消毒管理规范》[50]、《多重耐药菌医院感染预防与控制技术指南(试行)》[51]规范均未对MDRO的环境监测是否需要常规开展、监测频率及方法作出具体要求。
针对环境监测,国际上发达国家已取消常规微生物监测,美国疾病控制与预防中心(CDC)和加拿大在环境相关指南中指出医疗机构不需要对空气、水和环境表面进行常规采样监测,认为常规环境卫生学监测投入成本大、收益不足,而环境卫生学监测阳性结果与医院感染发生的相关性也待明确。目前,国内常规环境监测仍停留在医院的普通环境表面,很少开展临近患者诊疗区域内高频接触表面的监测,且现有的检测环境清洁卫生的方法[50],包括目测法、化学法(荧光标记法、荧光粉迹法、ATP法)、微生物法,各有利弊,仍缺乏科学、简便、成本低廉的方法。
3.6 环境清洁消毒环境的清洁与消毒在控制临床重要耐药菌的感染与传播中发挥着不可或缺的作用,环境包括地面、床单元及各种物体表面,重点在于床单元及高频接触的设备。根据相关行业标准和技术规范,医疗机构应对床单元表面及高频接触的设备进行定期清洁消毒,或者在遇到污染时进行及时消毒,患者出院时应进行终末消毒。当医院感染暴发或检出MDRO时,应强化清洁与消毒,主要是增加清洁与消毒的频率, 而非增加消毒剂浓度,此主要基于耐药菌为抗感染药物耐药而非对消毒剂耐药的考虑。常用含有效氯400~700 mg/L消毒剂作用时间10 min,频次≥2次/天;被患者血液、体液、分泌物等污染的环境表面,应先采用可吸附的材料将其清除,然后采用含有效氯2 000~5 000 mg/L的消毒剂作用30 min;非艰难梭菌耐药菌感染环境也可以采用季铵盐,或采用季铵盐加紫外线消毒[52]。与此同时,需要注意重复使用的清洁工具应及时清洗消毒、干燥保存。此外,保洁人员的配备及培训、环境清洁消毒过程的监督与监测也是确保环境清洁卫生质量的重要方面[53]。
3.7 去定植(decolonization)去定植是一种基于循证依据的干预措施,可用于预防CHAI[54]。去定植分为普遍性去定植和目标去定植,后者往往通过筛查临床重要的MDRO,而采取相应的干预措施。术前鼻拭子筛查金黄色葡萄球菌,并对定植者鼻腔局部涂抹2%莫匹罗星软膏或与葡萄糖酸氯己定(CHG)擦浴联用,可有效降低术后(特别是心脏手术和整形手术)感染的风险[55]。CHG是最具有循证依据的皮肤去定植剂,在交叉对照临床试验中,每日CHG洗浴能降低原发血流感染(BSI)[54]。在重症监护病房(ICU)中,CHG洗浴已被证明能减少MRSA和VRE的交叉传染率,但广泛使用莫匹罗星和氯己定可能会加速耐药[56]。因此,作为加强的MRSA控制措施,CDC建议只对特定人群实施有限的去定植[57]。
肠道CRE和VRE去定植一般是比较困难的。在血液病患者中,粘菌素选择性肠道去定植可能有利于在短期内降低MDR/广泛耐药革兰阴性杆菌(XDR-GNB)肠道定植率和BSI风险,但不具有长期持续的效果[58]。CDC不推荐对肠道VRE或多重耐药革兰阴性杆菌(MDR-GNB)定植患者去定植。ESCMID-EUCIC专家小组亦不建议对第3代头孢耐药肠杆菌目细菌和CRE携带者进行常规去定植。对于CRAB、全耐药革兰阴性杆菌(PDRGNB)和泛耐药铜绿假单胞菌(XDRPA)等定植患者,目前证据还不足以提供任何干预的建议[59]。粪菌移植(fecal microbiota transplantation,FMT)是一种非常有效的治疗难治性CD感染的方法,有希望用于肠道MDR细菌去定植[60]。
3.8 临床应用管理为有效遏制耐药菌的快速增长,持续做好临床抗菌药物合理应用管理工作,医疗机构应成立抗菌药物合理应用与管理小组,按照安全、有效、经济的原则,制订医院抗菌药物目录,优先选择循证医学证据充分的品种,并在实践中不断优化与动态调整;对围手术期及非手术患者预防用药应严格掌握指征。治疗用药应充分考虑患者、微生物以及抗菌药物三要素,医疗机构要制订详细的抗菌药物合理应用培训及考评方案,并严格培训落实;医生应掌握各类抗菌药物的抗菌谱、药代药效学参数、药物的不良反应,在启用抗菌药物前尽可能送检微生物标本,积极查找病原体,以开展针对性治疗;治疗过程中综合考虑患者的感染部位、基础疾病、发病场所、病理生理状态选择抗菌药物[61-62]。充分发挥临床药师在抗菌药物管理中的技术支撑作用,将抗菌药物管理纳入处方审核和点评,推荐信息化手段实现处方的前置审核、过程干预,不断加强重点抗菌药物以及联合用药的监管[63];推荐开展重点抗菌药物的治疗浓度监测,指导临床精准用药;感控部门专业技术人员应当参与抗菌药物临床应用、耐药菌的管理以及感染性疾病多学科会诊;感染性疾病科医生应发挥专业优势,对临床其他科室抗菌药物临床应用提供技术指导[64];检验学科积极探索快速诊断技术,以提高感染性疾病诊断效率,促进抗菌药物精准使用;信息部门通过信息化手段实现抗菌药物临床使用的动态监测。
3.9 多学科协作管理模式按照《抗菌药物临床应用管理办法》和《抗菌药物临床应用指导原则》要求,各级医疗机构应建立抗菌药物临床应用多学科管理体系与多学科专业技术团队。由医务、感染、药学、临床微生物、医院感染管理、信息、质量控制、护理等多学科专家组成抗菌药物管理工作组负责抗菌药物管理日常工作,以及由包括感染性疾病、药学(尤其临床药学)、临床微生物、医院感染管理等相关专业人员组成的专业技术团队为抗菌药物管理提供技术支撑。管理工作组和专业技术团队都必须做好多部门、多学科分工合作,多数医院由医务部门牵头,少数医院由药学部门牵头。管理工作组负责审定抗菌药物管理政策与策略、抗菌药物供应目录、处方集与感染性疾病诊治指南。技术团队负责为抗菌药物临床应用管理提供专业技术支持,对临床科室抗菌药物临床应用进行技术指导和咨询,为医务人员和辐射的医疗机构提供抗菌药物临床应用相关专业培训。临床药学部门负责抗菌药物临床应用监测,信息化部门负责充分利用信息化管理手段进行抗菌药物临床应用管理,临床微生物部门负责病原微生物检测和细菌耐药监测,医院感染管理部门负责医院感染预防与控制,临床科室提高合理用药水平并注重采取综合措施预防感染。管理工作组与专业技术团队共同实施抗菌药物管理的核心策略—抗菌药物临床应用的分级管理,以及诊疗指南培训、使用合理性评估、督查反馈和质量持续提高等工作。
医院感染防控信息化建设是医院感染协作管理的重要内容,各级医院应加强医院感染信息的电子化以及实时化,能及时监控医院感染常见MDRO,并可信息化查询各个医院感染相关指标。
4 临床重要耐药菌感染防控个性化要点 4.1 MRSA(1) 根据当地MRSA流行病学和患者人群易感性,针对地应用实时PCR从鼻拭子中快速筛查MRSA无症状定植患者[65]。(2)对于无症状MRSA定植患者,使用洗必泰沐浴和鼻腔莫匹罗星对MRSA进行去定植治疗, 可降低MRSA感染风险[66]。(3)医护人员接触MRSA定植患者或处理被MRSA污染的器材可能造成手部被MRSA污染甚至短期定植, 提高医护人员和患者手卫生依从性, 可减少MRSA医院内播散[67]。(4)医护人员在护理MRSA定植患者时使用接触预防措施(如使用一次性隔离衣和手套)。(5)MRSA可污染患者周围环境中接触过的物品和器械, 并持续存在, 故有效的清洁和消毒是常规策略的重要部分。
4.2 VRE(1) VRE的临床筛查:针对VRE的筛选方法国内多数临床实验室采用临床拭子培养,主动筛查的标本包括粪便、肛门或肛周拭子。除此之外还有选择性富集肉汤、显色琼脂以及微阵列法直接从临床拭子中鉴定VRE[68]。美国CDC 2007年的指导方针建议进行常规监测[69],国内VRE分离率高的医疗机构应进行主动筛查监测,尤其是危重症患者和免疫抑制人群。(2)VRE的接触预防措施:2019年美国CDC认为,维持和改善感染预防和控制措施,如手卫生和表面消毒,对于进一步减少VRE感染的数量和保护脆弱的患者群体至关重要[7]。(3)环境清洁与消毒:加强环境清洁与消毒可降低VRE传播风险[70]。清洁措施可包括紫外线清洗系统、使用荧光标记评估的微纤维和蒸汽技术、室内消毒(含有效氯1 000 mg/L的消毒剂)与医院范围内改进的手卫生相结合等。VRE感染患者使用专用或一次性护理设备,所有重复使用的设备均应在使用后进行彻底清洁和消毒。(4)VRE的去定植:针对高危患者的VRE去定植化,目前还没有标准的或公认的去定植方案,采取的VRE去定植措施应在感染控制小组和临床微生物专家或感染病医生协商评估后制定,曾使用过的去定植方法包括粪菌移植、使用杆菌肽或口服利奈唑胺和达托霉素[68]。(5)抗菌药物管理:了解和监测抗菌药物的使用模式,尤其与VRE感染病例相关的抗菌药物使用更应受到重视,限制诸如万古霉素和头孢菌素之类广谱抗菌药物的不必要使用,减少住院时间, 以防止VRE的出现和扩散[71]。
4.3 产ESBLs肠杆菌目细菌产超广谱β-内酰胺酶肠杆菌目细菌(extended-spectrum beta-lactamase -producing Enterobacterales, ESBL-PE),亚洲儿童ESBL-PE的血流感染率为7%,致新生儿的病死率为36%,个性化防控ESBL-PE感染的措施值得高度重视。(1)针对ESBL-PE感染菌及定植菌,逐步建立国家级或省级自愿主动报告系统[72]。(2)及时发现与诊断ESBL-PE感染,对高危人群及时取肛拭子,筛查ESBL-PE定植状况,酌情予益生菌或噬菌体去定植,对感染高危人群根据感染部位,适时采集合格标本送培养,尽量早诊、早防、早治[73]。(3)针对特殊人群,妊娠妇女有症状尿路感染者中ESBL-PE感染占21%,无症状菌尿症者中ESBL-PE为28%, 对妊娠妇女及时筛查尿液与粪便ESBL-PE携带状态有助于早诊、早防、早治[74]。(4)ESBL-PE感染社区发病者(community onset),应特别关注旅游人群,提倡餐厅配备洗手液,取进食者先洗手再取进食,备餐时应生熟分开,提倡分餐制,医院发病(hospital onset)者,规范防控医院交叉感染; 植入物相关感染(DRI),尽量规范使用各种置管(动静脉置管、鼻胃管、气管插管等),酌情拔除导管或去除植入物[75]。(5)研发床旁快速检测试条,尽快明确定植或感染,临床应力争合理使用各类抗菌药物。一旦出现ESBL-PE感染病,若为血流感染或免疫功能低下人群,宜选碳青霉烯类药物; 若非危及生命或免疫功能相对正常者感染,可选酶抑制剂复合制剂,如含克拉维酸、他唑巴坦、阿维巴坦的制剂。ESBL-PE感染应慎用头孢哌酮/舒巴坦,不宜选用氨基糖苷类、磺胺类、喹诺酮类,禁用不含酶抑制剂的青霉素类、头孢菌素类及氨曲南[76-77],及时清除感染者的ESBL-PE也能防止传播。
4.4 碳青霉烯耐药肠杆菌目细菌肺炎克雷伯菌及大肠埃希菌等肠杆菌目细菌对碳青霉烯类耐药(CRE)形势日趋严峻,对我国及我国周边的其他东南亚国家构成严重威胁[78]。
(1) 由于CRE可分布于社区与医院环境、食物、动物之中,应逐步建立国家或省级医畜自愿主动筛查报告体系[79-80]。(2)加强国家层面定期爱国卫生运动,重视环境卫生与消毒。就CRE定植和/或感染的风险进行全民教育与培训, 借助各种媒体手段宣传与测试等,提高大众认知水平,践行实施所有感染病(包含传染病)的预防措施,做到正确的手卫生、适时佩戴口罩、食物生熟分开、分餐制,医院病室内换床单避免扬尘,病室内垃圾作为医疗废物加以彻底处理[81]。(3)以危急值管理CRE。用过碳青霉烯类药物者肠道携带CRE发生CRE血流感染的概率高于未携带者4倍,40% CRE携带可≥1年,故对使用碳青霉烯类药物者,尤其拟作器官捐献及接受者,应常规筛查粪便CRE携带情况,促进早知早防,可探讨益生菌或噬菌体去定植的可行性[82]。(4)目前, 欧盟指南不推荐用抗菌药物去定植CRE[52]。对8例CRE定植者用粪菌移植去定植,在粪菌移植后3个月内,8例定植者中3例去定植成功,具有中等去定植效果[83],值得尝试。筛查CRE定植者的密切接触者,或许能助推预防传播的教育与实践。(5)在重点病区(如ICU、移植病房等)或CRE高发病区对CRE定植和感染者进行主动监测, 并对CRE携带者进行隔离, 有助于降低病区内CRE发生率。主动监测标本类型推荐直肠拭子[47]。
4.5 CRAB和CRPA侵袭性操作和环境卫生均可以影响ICU中CRAB和CRPA感染发生和克隆传播。降低中心静脉导管、气管导管和导尿管等侵入性医疗器械的使用率,严格执行有创操作的适应证和无菌技术, 留置患者体内的医疗器械应定期评估使用的必要性, 不需要时应立即终止器械使用。呼吸机应严格按照规范清洁消毒, 呼吸机管道、湿化器应规范更换,频次为1次/周。采用复方氯己定含漱液、呋喃西林漱口液等帮助患者清洗口腔内部细菌,高效的口腔护理可降低感染发生。医护人员应促进ICU环境管理体系建立, 加强空气和环境消毒。加强医护人员的接触预防知识,加强抗菌药物管理,提高手卫生依从性,实施不同操作前手部均应严格消毒,使用一次性或专用的患者护理设备。
4.6 艰难梭菌感染(CDI)CDI可导致严重的腹泻甚至死亡。无症状感染者也可排出CD芽孢,但传染性较有症状的CDI患者轻[31]。由于缺乏足够的证据,不建议对无症状感染者进行筛查和隔离[84]。合理使用抗菌药物是预防和控制CDI最有效手段之一。胃酸抑制剂(PPI)的使用与CDI存在关联,应避免非必要PPI的使用。为防止医院内传播,发现CDI患者时,将患者安排在有独立卫生间的单人病房[84]。医护人员或陪护者在进入病房时应穿戴好隔离衣和手套[84]。对疑似CDI患者也应做好预防性接触隔离措施[85]。在接触CDI患者前后及脱下手套后应严格执行手卫生。CD芽孢对乙醇类消毒剂存在很强的抵抗性,在常规环境中可使用乙醇类消毒剂执行手卫生,在暴发或高流行环境中应优先使用软肥皂和清水洗手[84, 86]。建议使用合法有效的杀芽孢消毒剂或含有效氯浓度为5 000 mg/L的消毒剂进行环境的每日清洁消毒与CDI患者病房的终末消毒[31, 85]。不推荐利用非接触式消毒技术(如紫外线照射、过氧化氢蒸汽消毒)预防CDI[84]。
4.7 多重耐药耳念珠菌近年来,唑类严重耐药和高致死率的耳念珠菌(C.auris)血流感染在医疗机构暴发性流行,引起了全球的重视[87-90],尤其重视其防控:(1)建立国家以及省市级主动报告体系和耳念珠菌监测网,纳入当前或既往曾检测出耳念珠菌的患者或定植者, 评估传播情况。(2)耳念珠菌感染以及定植患者进行接触隔离。(3)患者尽量使用一次性医疗设备和耗材,相同病例可共用设备。(4)医护人员、探视人员应严格遵守标准手卫生规范。(5)加强环境清洁消毒,推荐使用含氯消毒剂每日三次常规环境消毒或终末消毒,或洗必泰葡萄糖酸盐消毒。已报道存在耳念珠菌的部位包括患者的床、手机、摇床控制器、地板,医务人员工作区域的椅子、床单、医疗仪器、门把手、壁橱、洗手池、便盆和墩布池,医院感染暴发时还见于公用的腋温计、公用的血压袖带。(6)耳念珠菌感染患者接受心胸手术前的皮肤准备:推荐10%聚维酮碘。见表 2。
| 表 2 临床重要耐药菌的感染防控推荐措施a |
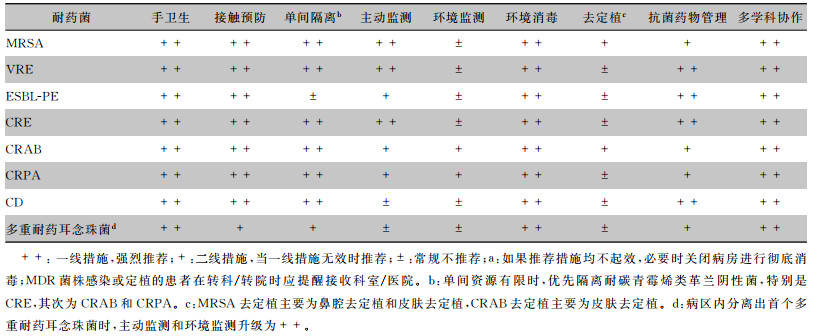
|
耐药菌的传播严重威胁人类健康,加强耐药菌感染的预防、控制和诊疗能力建设,是医疗机构防控耐药菌感染传播的重要内容。目前,我国政府和医疗机构高度重视细菌耐药问题,并且耐药菌防控初见成效,我国大部分常见临床耐药细菌的检出率呈下降趋势或保持平稳,医院感染防控水平逐渐提高。但耐药菌防控不可松懈,广大医务工作者仍需积极探索,寻找更契合我国国情的防控策略。
利益冲突:所有作者均声明不存在利益冲突。
编审专家(排名不分先后):刘正印(中国医学科学院北京协和医院感染内科)、马小军(中国医学科学院北京协和医院感染内科)、梅丹(中国医学科学院北京协和医院药剂科)、李若瑜(北京大学第一医院皮肤性病科)、郑波(北京大学第一医院感染科)、王明贵(复旦大学附属华山医院抗生素研究所)、胡付品(复旦大学附属华山医院抗生素研究所)、俞云松(浙江大学医学院附属邵逸夫医院感染科)、卓超(广州呼吸疾病研究所)、吕晓菊(四川大学华西医院感染科)、王睿(中国人民解放军总医院第一医学中心临床药理研究室)、马筱玲(中国科技大学附属第一医院检验科)、胡继红(北京医院)、魏莲花(甘肃省人民医院检验科)、林勇平(广州医科大学附属第一医院检验科)、刘勇(中国医科大学附属盛京医院检验科)、朱镭(山西省儿童医院检验科)、刘文恩(中南大学湘雅医院检验科)、赵明(国家食品药品监督管理总局药品评价中心)、刘玉庆(山东省农业科学院)、鲁辛辛(北京同仁医院检验科)、苏建荣(首都医科大学附属北京友谊医院检验科)、汤一苇(美国纽约斯隆-凯特琳肿瘤纪念医院)、肖永红(浙江大学医学院附属第一医院传染病诊治国家重点实验室)、薛博仁(台湾大学医学院附属医院感染科)、尹红(瑞典法路医院)、游雪甫(中国医学科学院药用生物技术研究所)、张建中(中国疾病预防控制中心传染病预防控制所)
| [1] |
国家卫生健康委员会. 中国抗菌药物管理和细菌耐药现状报告(2019)[M]. 北京: 中国协和医科大学出版社, 2019: 137.
|
| [2] |
Tacconelli E, Cataldo MA, Dancer SJ, et al. ESCMID guidelines for the management of the infection control measures to reduce transmission of multidrug-resistant Gram-negative bacteria in hospitalized patients[J]. Clin Microbiol Infect, 2014, 20(Suppl 1): 1-55. |
| [3] |
Siegel JD, Rhinehart E, Jackson M, et al. 2007 guideline for isolation precautions:preventing transmission of infectious agents in health care settings[J]. Am J Infect Control, 2007, 35(10 Suppl 2): S65-S164. |
| [4] |
World Health Organization. Antimicrobial resistance: infection prevention and control[EB/OL].[2020-10-08]. https://www.who.int/antimicrobial-resistance/global-action-plan/infection-prevention-control/en/.
|
| [5] |
Jarvis WR. Bennett & Brachman's hospital infections[M]. 6th ed. Philadelphia: Wolters Kluwer, 2013.
|
| [6] |
国家卫生计生委办公厅.国家卫生计生委办公厅关于印发麻醉等6个专业质控指标(2015年版)的通知国卫办医函(2015)252号[EB/OL]. (2015-04-10)[2020-10-08]. http://www.nhc.gov.cn/yzygj/s3585/201504/5fa7461c3d044cb6a93eb6cc6eece087.shtml.
|
| [7] |
Centers for Disease Control and Prevention. Antibiotic resis-tance threats in the United States 2019[EB/OL].[2020-10-08]. https://www.cdc.gov/drugresistance/pdf/threats-report/2019-ar-threats-report-508.pdf.
|
| [8] |
World Health Organization. WHO publishes list of bacteria for which new antibiotics are urgently needed[EB/OL]. (2017-02-27)[2020-10-08]. https://www.who.int/news/item/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed.
|
| [9] |
CHINET中国细菌耐药监测网.2019年CHINET三级医院细菌耐药监测[EB/OL]. (2020-05-27)[2020-10-08]. http://www.chinets.com.
|
| [10] |
国家卫生计生委合理用药专家委员会, 全国细菌耐药监测网. 2018年全国细菌耐药监测报告[J]. 中国合理用药探索, 2020, 17(1): 1-10. |
| [11] |
胡付品, 郭燕, 朱德妹, 等. 2019年CHINET三级医院细菌耐药监测[J]. 中国感染与化疗杂志, 2020, 20(3): 233-243. |
| [12] |
Chen CH, Sun JY, Guo Y, et al. High prevalence of vanM in vancomycin-resistant Enterococcus faecium isolates from Shanghai, China[J]. Antimicrob Agents Chemother, 2015, 59(12): 7795-7798. DOI:10.1128/AAC.01732-15 |
| [13] |
Gong JH, Maki G, Klingemann HG. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells[J]. Leukemia, 1994, 8(4): 652-658. |
| [14] |
Suck G, Odendahl M, Nowakowska P, et al. NK-92:an 'off-the-shelf therapeutic' for adoptive natural killer cell-based cancer immunotherapy[J]. Cancer Immunol Immunother, 2016, 65(4): 485-492. DOI:10.1007/s00262-015-1761-x |
| [15] |
Maki G, Klingemann HG, Martinson JA, et al. Factors regulating the cytotoxic activity of the human natural killer cell line, NK-92[J]. J Hematother Stem Cell Res, 2001, 10(3): 369-383. DOI:10.1089/152581601750288975 |
| [16] |
King DT, Sobhanifar S, Strynadka NCJ. The mechanisms of resistance to β-lactam antibiotics[M]//Gotte M, Berghuis A, Matlashewski G, et al. Handbook of antimicrobial resistance. New York: Springer, 2017: 177-201.
|
| [17] |
Sheng ZK, Hu FP, Wang WX, et al. Mechanisms of tigecycline resistance among Klebsiella pneumoniae clinical isolates[J]. Antimicrob Agents Chemother, 2014, 58(11): 6982-6985. DOI:10.1128/AAC.03808-14 |
| [18] |
De Majumdar S, Veleba M, Finn S, et al. Elucidating the regulon of multidrug resistance regulator RarA in Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 2013, 57(4): 1603-1609. DOI:10.1128/AAC.01998-12 |
| [19] |
Yang QW, Jia XM, Zhou ML, et al. Emergence of ST11-K47 and ST11-K64 hypervirulent carbapenem-resistant Klebsiella pneumoniae in bacterial liver abscesses from China:a molecular, biological, and epidemiological study[J]. Emerg Microbes Infect, 2020, 9(1): 320-331. DOI:10.1080/22221751.2020.1721334 |
| [20] |
Yang QW, Wang H, Sun HL, et al. Phenotypic and genotypic characterization of Enterobacteriaceae with decreased susceptibility to carbapenems:results from large hospital-based surveillance studies in China[J]. Antimicrob Agents Chemother, 2010, 54(1): 573-577. DOI:10.1128/AAC.01099-09 |
| [21] |
Tam YK, Martinson JA, Doligosa K, et al. Ex vivo expansion of the highly cytotoxic human natural killer-92 cell-line under current good manufacturing practice conditions for clinical adoptive cellular immunotherapy[J]. Cytotherapy, 2003, 5(3): 259-272. DOI:10.1080/14653240310001523 |
| [22] |
Hooper DC. Bacterial topoisomerases, anti-topoisomerases, and anti-topoisomerase resistance[J]. Clin Infect Dis, 1998, 27(Suppl 1): S54-S63. |
| [23] |
Llano-Sotelo B, Azucena EF Jr, Kotra LP, et al. Aminoglycosides modified by resistance enzymes display diminished bin-ding to the bacterial ribosomal aminoacyl-tRNA site[J]. Chem Biol, 2002, 9(4): 455-463. DOI:10.1016/S1074-5521(02)00125-4 |
| [24] |
Volkers G, Palm GJ, Weiss MS, et al. Structural basis for a new tetracycline resistance mechanism relying on the TetX monooxygenase[J]. FEBS Lett, 2011, 585(7): 1061-1066. DOI:10.1016/j.febslet.2011.03.012 |
| [25] |
He T, Wang R, Liu DJ, et al. Emergence of plasmid-mediated high-level tigecycline resistance genes in animals and humans[J]. Nat Microbiol, 2019, 4(9): 1450-1456. DOI:10.1038/s41564-019-0445-2 |
| [26] |
Hall-Stoodley L, Costerton JW, Stoodley P. Bacterial biofilms:from the natural environment to infectious diseases[J]. Nat Rev Microbiol, 2004, 2(2): 95-108. DOI:10.1038/nrmicro821 |
| [27] |
Clinical and Laboratory Standards Institute. M100. Perfor-mance standards for antimicrobial susceptibility testing, 30th ed[EB/OL]. (2020-01-21)[2020-10-08]. https://clsi.org/standards/products/microbiology/documents/m100.
|
| [28] |
Bressler AM, Williams T, Culler EE, et al. Correlation of penicillin binding protein 2a detection with oxacillin resistance in Staphylococcus aureus and discovery of a novel penicillin binding protein 2a mutation[J]. J Clin Microbiol, 2005, 43(9): 4541-4544. DOI:10.1128/JCM.43.9.4541-4544.2005 |
| [29] |
Doi Y, Potoski BA, Adams-Haduch JM, et al. Simple disk-based method for detection of Klebsiella pneumoniae carbape-nemase-type beta-lactamase by use of a boronic acid compound[J]. J Clin Microbiol, 2008, 46(12): 4083-4086. DOI:10.1128/JCM.01408-08 |
| [30] |
Hopkins KL, Meunier D, Naas T, et al. Evaluation of the NG-Test CARBA 5 multiplex immunochromatographic assay for the detection of KPC, OXA-48-like, NDM, VIM and IMP carbapenemases[J]. J Antimicrob Chemother, 2018, 73(12): 3523-3526. |
| [31] |
Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections[J]. Am J Gastroenterol, 2013, 108(4): 478-498. DOI:10.1038/ajg.2013.4 |
| [32] |
Alcalá L. Laboratory tests for diagnosis of Clostridium difficile infection:past, present, and future[J]. Enferm Infecc Microbiol Clin, 2013, 31(2): 65-67. DOI:10.1016/j.eimc.2012.10.003 |
| [33] |
Clinical and Laboratory Standards Institute. M60. Performance standards for antifungal susceptibility testing of yeasts, 2nd ed[EB/OL]. (2020-06-29)[2020-10-08]. https://clsi.org/standards/products/microbiology/documents/m60.
|
| [34] |
Boyce JM, Pittet D. Guideline for hand hygiene in health-care settings[EB/OL].[2020-10-08]. https://www.cdc.gov/mmwr/preview/mmwrhtml/rr5116a1.htm.
|
| [35] |
Seo HJ, Sohng KY, Chang SO, et al. Interventions to improve hand hygiene compliance in emergency departments:a systematic review[J]. J Hosp Infect, 2019, 102(4): 394-406. DOI:10.1016/j.jhin.2019.03.013 |
| [36] |
World Health Organization. WHO guidelines on hand hygiene in health care[EB/OL].[2020-10-08]. https://apps.who.int/iris/handle/10665/44102.
|
| [37] |
中华人民共和国国家卫生健康委员会.医务人员手卫生规范: WS/T 313-2019[S].北京: 中国标准出版社, 2019.
|
| [38] |
中华预防医学会医院感染控制分会, 中华医学会感染病学分会, 中国医院协会医院感染管理专业委员会, 等. 中国碳青霉烯耐药革兰阴性杆菌(CRO)感染预防与控制技术指引[J]. 中华医院感染学杂志, 2019, 29(13): 2075-2080. |
| [39] |
李六亿. 标准预防——防控多重耐药菌感染的基本策略[J]. 中国护理管理, 2019, 19(8): 1121-1125. DOI:10.3969/j.issn.1672-1756.2019.08.001 |
| [40] |
Pittet D, Allegranzi B, Boyce J, et al. The World Health Organization guidelines on hand hygiene in health care and their consensus recommendations[J]. Infect Control Hosp Epidemiol, 2009, 30(7): 611-622. DOI:10.1086/600379 |
| [41] |
Valim MD, Rocha ILS, Souza TPM, et al. Efficacy of the multimodal strategy for hand hygiene compliance:an integrative review[J]. Rev Bras Enferm, 2019, 72(2): 552-565. DOI:10.1590/0034-7167-2018-0584 |
| [42] |
Fierobe L, Lucet JC, Decré D, et al. An outbreak of imipe-nem-resistant Acinetobacter baumannii in critically ill surgical patients[J]. Infect Control Hosp Epidemiol, 2001, 22(1): 35-40. DOI:10.1086/501822 |
| [43] |
Ostrowsky BE, Trick WE, Sohn AH, et al. Control of vancomycin-resistant enterococcus in health care facilities in a region[J]. N Engl J Med, 2001, 344(19): 1427-1433. DOI:10.1056/NEJM200105103441903 |
| [44] |
D'Agata EM, Gautam S, Green WK, et al. High rate of false-negative results of the rectal swab culture method in detection of gastrointestinal colonization with vancomycin-resis-tant Enterococci[J]. Clin Infect Dis, 2002, 34(2): 167-172. DOI:10.1086/338234 |
| [45] |
Duckro AN, Blom DW, Lyle EA, et al. Transfer of vancomycin-resistant Enterococci via health care worker hands[J]. Arch Intern Med, 2005, 165(3): 302-307. DOI:10.1001/archinte.165.3.302 |
| [46] |
Bhalla A, Pultz NJ, Gries DM, et al. Acquisition of nosocomial pathogens on hands after contact with environmental surfaces near hospitalized patients[J]. Infect Control Hosp Epidemiol, 2004, 25(2): 164-167. DOI:10.1086/502369 |
| [47] |
Zhou ML, Kudinha T, Du B, et al. Active surveillance of carbapenemase-producing organisms (CPO) colonization with Xpert Carba-R assay plus positive patient isolation proves to be effective in CPO containment[J]. Front Cell Infect Microbiol, 2019, 9: 162. DOI:10.3389/fcimb.2019.00162 |
| [48] |
陈琳.病区医院感染管理规范[C]//浙江省预防医学会第五届之江公共卫生论坛论文集, 杭州, 2017-09-14, 2017: 133-136.
|
| [49] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.医院消毒卫生标准: GB 15982-2012[S].北京: 中国标准出版社, 2012.
|
| [50] |
陆烨.医疗机构环境表面清洁与消毒管理规范[C]//浙江省预防医学会第五届之江公共卫生论坛论文集, 杭州, 2017-09-14, 2017: 137-151.
|
| [51] |
中华人民共和国国家卫生部.卫生部办公厅关于印发《多重耐药菌医院感染预防与控制技术指南(试行)》的通知卫办医政发(2011)5号[EB/OL]. (2011-01-17)[2020-11-08]. http://www.sific.com.cn/InsidePage/1000/38/793.html.
|
| [52] |
Anderson DJ, Chen LF, Weber DJ, et al. Enhanced terminal room disinfection and acquisition and infection caused by multidrug-resistant organisms and Clostridium difficile (the benefits of enhanced terminal room disinfection study):a cluster-randomised, multicentre, crossover study[J]. Lancet, 2017, 389(10071): 805-814. DOI:10.1016/S0140-6736(16)31588-4 |
| [53] |
Rutala WA, Weber DJ. Disinfectants used for environmental disinfection and new room decontamination technology[J]. Am J Infect Control, 2013, 41(5 Suppl): S36-S41. |
| [54] |
Septimus EJ, Schweizer ML. Decolonization in prevention of health care-associated infections[J]. Clin Microbiol Rev, 2016, 29(2): 201-222. DOI:10.1128/CMR.00049-15 |
| [55] |
Septimus EJ. Nasal decolonization:what antimicrobials are most effective prior to surgery?[J]. Am J Infect Control, 2019, 47S: A53-A57. |
| [56] |
Madden GR, Sifri CD. Antimicrobial resistance to agents used for Staphylococcus aureus decolonization:is there a reason for concern?[J]. Curr Infect Dis Rep, 2018, 20(8): 26. DOI:10.1007/s11908-018-0630-0 |
| [57] |
Siegel JD, Rhinehart E, Jackson M, et al. Management of multidrug-resistant organisms in healthcare settings, 2006[EB/OL]. (2017-02-15)[2020-10-08]. https://www.cdc.gov/infectioncontrol/pdf/guidelines/mdro-guidelines.pdf.
|
| [58] |
Stoma I, Karpov I, Iskrov I, et al. Decolonization of intestinal carriage of MDR/XDR Gram-negative bacteria with oral colistin in patients with hematological malignancies:results of a randomized controlled trial[J]. Mediterr J Hematol Infect Dis, 2018, 10(1): e2018030. DOI:10.4084/mjhid.2018.030 |
| [59] |
Tacconelli E, Mazzaferri F, de Smet AM, et al. ESCMID-EUCIC clinical guidelines on decolonization of multidrug-resistant Gram-negative bacteria carriers[J]. Clin Microbiol Infect, 2019, 25(7): 807-817. DOI:10.1016/j.cmi.2019.01.005 |
| [60] |
Yoon YK, Suh JW, Kang EJ, et al. Efficacy and safety of fecal microbiota transplantation for decolonization of intestinal multidrug-resistant microorganism carriage:beyond Clostri-dioides difficile infection[J]. Ann Med, 2019, 51(7/8): 379-389. |
| [61] |
中华人民共和国国家卫生与计划生育委员会医政管理局.关于印发遏制细菌耐药国家行动计划(2016-2020年)的通知, 国卫医发(2016)43号[EB/OL]. (2016-08-25)[2020-10-08]. http://www.nhc.gov.cn/yzygj/s3593/201608/f1ed26a0c8774e1c8fc89dd481ec84d7.shtml.
|
| [62] |
中华人民共和国国家卫生与计划生育委员会医政管理局.关于印发抗菌药物临床应用指导原则(2015年版)的通知, 国卫办医发(2015)43号[EB/OL]. (2015-08-27)[2020-10-08]. http://www.nhc.gov.cn/yzygj/s3593/201508/c18e1014de6c45ed9f6f9d592b43db42.shtml.
|
| [63] |
Barlam TF, Cosgrove SE, Abbo LM, et al. Executive summary:implementing an antibiotic stewardship program:guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America[J]. Clin Infect Dis, 2016, 62(10): 1197-1202. DOI:10.1093/cid/ciw217 |
| [64] |
Charani E, Castro-Sanchéz E, Bradley S, et al. Implementation of antibiotic stewardship in different settings-results of an international survey[J]. Antimicrob Resist Infect Control, 2019, 8: 34. DOI:10.1186/s13756-019-0493-7 |
| [65] |
Methicillin-resistant Staphylococcus aureus[J]. Nat Rev Dis Primers, 2018, 4: 18034.
|
| [66] |
Huang SS, Singh R, Mckinnell JA, et al. Decolonization to reduce postdischarge infection risk among MRSA carriers[J]. N Engl J Med, 2019, 380(7): 638-650. DOI:10.1056/NEJMoa1716771 |
| [67] |
Stone SP, Fuller C, Savage J, et al. Evaluation of the national Cleanyourhands campaign to reduce Staphylococcus aureus bacteraemia and Clostridium difficile infection in hospitals in England and Wales by improved hand hygiene:four year, prospective, ecological, interrupted time series study[J]. BMJ, 2012, 344: e3005. DOI:10.1136/bmj.e3005 |
| [68] |
Isenman H, Fisher D. Advances in prevention and treatment of vancomycin-resistant Enterococcus infection[J]. Curr Opin Infect Dis, 2016, 29(6): 577-582. DOI:10.1097/QCO.0000000000000311 |
| [69] |
Siegel JD, Rhinehart E, Jackson M, et al. Management of multidrug-resistant organisms in health care settings, 2006[J]. Am J Infect Control, 2007, 35(10 Suppl 2): S165-S193. |
| [70] |
Fisher D, Pang L, Salmon S, et al. A successful vancomycin-resistant Enterococci reduction bundle at a Singapore hospital[J]. Infect Control Hosp Epidemiol, 2016, 37(1): 107-109. DOI:10.1017/ice.2015.251 |
| [71] |
耐万古霉素肠球菌感染防治专家委员会. 耐万古霉素肠球菌感染防治专家共识[J]. 中华实验和临床感染病杂志(电子版), 2010, 4(2): 224-231. DOI:10.3969/cma.j.issn.1674-1358.2010.02.022 |
| [72] |
Hsu YJ, Weeks K, Yang T, et al. Impact of self-reported guideline compliance:bloodstream infection prevention in a national collaborative[J]. Am J Infect Control, 2014, 42(10 Suppl): S191-S196. |
| [73] |
Flokas ME, Karanika S, Alevizakos M, et al. Prevalence of ESBL-producing Enterobacteriaceae in pediatric bloodstream infections:a systematic review and meta-analysis[J]. PLoS One, 2017, 12(1): e0171216. DOI:10.1371/journal.pone.0171216 |
| [74] |
Mansouri F, Sheibani H, Javedani Masroor M, et al. Exten-ded-spectrum beta-lactamase (ESBL)-producing Enterobacteriaceae and urinary tract infections in pregnant/postpartum women:a systematic review and Meta-analysis[J]. Int J Clin Pract, 2019, 73(12): e13422. |
| [75] |
Mcdanel J, Schweizer M, Crabb V, et al. Incidence of extended-spectrum β-lactamase (ESBL)-producing Escherichia coli and Klebsiella infections in the United States:a systematic literature review[J]. Infect Control Hosp Epidemiol, 2017, 38(10): 1209-1215. DOI:10.1017/ice.2017.156 |
| [76] |
Ghafourian S, Sadeghifard N, Soheili S, et al. Extended spectrum beta-lactamases:definition, classification and epidemiology[J]. Curr Issues Mol Biol, 2015, 17: 11-22. |
| [77] |
D'Angelo RG, Johnson JK, Bork JT, et al. Treatment options for extended-spectrum beta-lactamase (ESBL) and AmpC-producing bacteria[J]. Expert Opin Pharmacother, 2016, 17(7): 953-967. DOI:10.1517/14656566.2016.1154538 |
| [78] |
Hsu LY, Apisarnthanarak A, Khan E, et al. Carbapenem-resistant Acinetobacter baumannii and Enterobacteriaceae in South and Southeast Asia[J]. Clin Microbiol Rev, 2017, 30(1): 1-22. DOI:10.1128/CMR.00042-16 |
| [79] |
Bartsch SM, Wong KF, Stokes-Cawley OJ, et al. Knowing more of the iceberg:how detecting a greater proportion of carbapenem-resistant Enterobacteriaceae carriers influences transmission[J]. J Infect Dis, 2020, 221(11): 1782-1794. DOI:10.1093/infdis/jiz288 |
| [80] |
Lee BY, Bartsch SM, Hayden MK, et al. How introducing a registry with automated alerts for carbapenem-resistant Entero-bacteriaceae (CRE) may help control CRE spread in a region[J]. Clin Infect Dis, 2020, 70(5): 843-849. |
| [81] |
Logan LK, Weinstein RA. The epidemiology of carbapenem-resistant Enterobacteriaceae:the impact and evolution of a global menace[J]. J Infect Dis, 2017, 215(Suppl_1): S28-S36. DOI:10.1093/infdis/jiw282 |
| [82] |
Brink AJ. Epidemiology of carbapenem-resistant Gram-negative infections globally[J]. Curr Opin Infect Dis, 2019, 32(6): 609-616. DOI:10.1097/QCO.0000000000000608 |
| [83] |
Davido B, Batista R, Michelon H, et al. Is faecal microbiota transplantation an option to eradicate highly drug-resistant enteric bacteria carriage?[J]. J Hosp Infect, 2017, 95(4): 433-437. |
| [84] |
McDonald LC, Gerding DN, Johnson S, et al. Clinical practice guidelines for Clostridium difficile infection in adults and children:2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA)[J]. Clin Infect Dis, 2018, 66(7): e1-e48. |
| [85] |
Sartelli M, Di Bella S, McFarland LV, et al. 2019 update of the WSES guidelines for management of Clostridioides (Clostridium) difficile infection in surgical patients[J]. World J Emerg Surg, 2019, 14: 8. |
| [86] |
Tschudin-Sutter S, Kuijper EJ, Durovic A, et al. Guidance document for prevention of Clostridium difficile infection in acute healthcare settings[J]. Clin Microbiol Infect, 2018, 24(10): 1051-1054. |
| [87] |
Escandón P, Chow NA, Caceres DH, et al. Molecular epidemiology of Candida auris in Colombia reveals a highly related, countrywide colonization with regional patterns in amphotericin B resistance[J]. Clin Infect Dis, 2019, 68(1): 15-21. |
| [88] |
Cadnum JL, Shaikh AA, Piedrahita CT, et al. Effectiveness of disinfectants against Candida auris and other Candida species[J]. Infect Control Hosp Epidemiol, 2017, 38(10): 1240-1243. |
| [89] |
Ruiz Gaitán AC, Moret A, López Hontangas JL, et al. Nosocomial fungemia by Candida auris:first four reported cases in continental Europe[J]. Rev Iberoam Micol, 2017, 34(1): 23-27. |
| [90] |
Centers for Disease Control and Prevention. Identification of Candida auris[EB/OL]. (2020-05-29)[2020-10-08]. https://www.cdc.gov/fungal/candida-auris/identification.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Ffungal%2Fcandida-auris%2Frecommendations.html.
|



