2. 中南大学湘雅医院眼科, 湖南 长沙 410008
2. Department of Ophthalmology, Xiangya Hospital, Central South University, Changsha 410008, China
艾滋病是感染人类免疫缺陷病毒(HIV)引起的一种传染病。HIV通过大量破坏CD4+T淋巴细胞(低于200个/mm3), 使机体丧失免疫功能,发生多种机会性感染或肿瘤,导致患者死亡[1]。2018年全球已有3 690万HIV携带者,其中58.81%的感染者接受了HIV抗逆转录病毒治疗(antiretroviral therapy,ART),HIV感染已被世界卫生组织(WHO)认为是全球范围内重要的公共卫生事件[2]。近年来,ART的改进成功延长了HIV感染者的预期寿命[3],将其从绝症领域过渡到慢性病领域,HIV感染者日益老龄化。艾滋病主要死亡原因为艾滋病相关机会性感染和非HIV感染死亡,高收入国家、发展中国家分别有53%、34%的HIV感染者死亡归因于非HIV感染死亡,尤其是心血管疾病[4-6]。研究显示,80%的心血管疾病发生在低收入和中等收入国家[7],而HIV感染者罹患心血管疾病的风险为普通人群的1.5~2倍[8]。心力衰竭(heart failure,HF)是一种复杂的临床综合征,可导致患者病死率和再住院率增加,是最主要的心血管疾病之一,但非心血管疾病也可引起HF[9]。近年来,国内外已有大量关于HIV感染与HF发生风险的流行病学研究,一直怀疑HF与HIV感染有关[10],但目前HIV感染与HF发生风险之间的关联尚未完全阐明。本研究通过对国内外HIV感染与HF发生风险的前瞻性队列研究进行Meta分析,从统计学角度达到增加样本量,提高检验效能,提高对初步结论的论证强度和效应分析评估力度,为HIV感染的流行病学研究,HIV相关性HF的预防和治疗策略提供循证依据。
1 资料与方法 1.1 纳入标准(1) 研究对象:主要探讨HIV感染与HF发生风险相关性的人群;(2)暴露因素:HIV感染;(3)对照组:非HIV感染;(4)结局指标:HF的发生;(5)研究设计:公开发表的前瞻性队列研究;(6)语言:中文、英文;(7)可获取校正的风险比(HR)值及其95%置信区间(CI)。
1.2 排除标准(1) 无法获取全文或无法提取数据;(2)横断面调查、病例对照研究、综述;(3)研究包含其他暴露因素及其结局终点;(4)确诊为HIV感染时已有HF者。
1.3 文献检索本研究采用预检索后正式检索,主题词和自由词相互组合,必要时采用文献追溯等方法进行检索,通过计算机检索PubMed、Embase、中国生物医学文献数据库(CBM)、中国知网(CNKI)、万方数据库、维普中文科技期刊数据库(VIP),检索时限均为自建库至2019年5月15日。中文检索词包括HIV感染、艾滋病病毒感染、人类免疫缺陷病毒感染、心力衰竭,英文检索词包括HIV infection、acquired immunodeficiency syndrome、human immunodeficiency virus infection、heart failure。
1.4 文献筛选与质量评价由2名研究人员按照制定的纳入及排除标准独立进行文献筛选,并根据非随机研究质量评价工具纽卡斯尔-渥太华量表(NOS)[11]进行文献质量评价,如双方有争议,则由第三方研究人员评定后确定。NOS得分:最高分为9分,0~3分为低质量,4~6分为中等质量,7~9为高质量。
1.5 统计学方法由2人核查,应用Stata 12.0软件对纳入的文献资料进行Meta分析,以校正后的HR作为合并效应指标。异质性分析采用Q检验和I2统计, 若P>0.10,I2<50%,可认为各研究异质性可以接受,则采用固定效应模型;若P≤0.10,I2≥50%,认为各研究间存在异质性,采用随机效应模型[12]。按照纳入研究HIV-1 RNA病毒载量、CD4+细胞计数、不同人群进行亚组分析,P≤0.05则认为差异有统计学意义。合并效应量检验采用CI,当其95%CI包含1时,则无统计学意义。
2 结果 2.1 文献检索结果文献初筛获得PubMed 608篇, Embase 831篇, CBM 26篇, CNKI 30篇, 万方数据库36篇, VIP 15篇,共1 546篇,最终纳入5篇前瞻性队列研究文献[13-17]进行Meta分析。见图 1。
 |
| 图 1 HIV感染与HF发生风险Meta分析文献筛选流程图 Figure 1 Flow chart of literature screening for Meta-analysis on HIV infection and onset risk of HF |
纳入患者303 734例,其中HIV感染暴露组(暴露组)84 557例,非HIV感染暴露组(非暴露组)219 177例,均为大样本研究,随访时间长达6~17年。4项研究[13-16]的NOS评分为9分,1项研究[17]为8分,文献质量评价结果均为高质量,所纳入文献的基本情况及NOS评分结果见表 1。
| 表 1 HIV感染与HF发生风险Meta分析纳入文献的基本情况及NOS评分郑文爱结果 Table 1 Basic condition and NOS scores of included literatures for Meta-analysis on HIV infection and onset risk of HF |
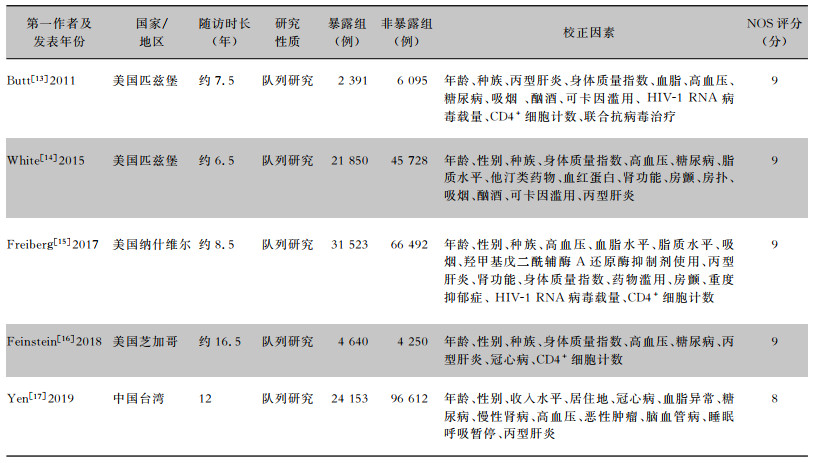
|
由于各研究存在异质性(I2=64.4%,P=0.024),故采用随机效应模型进行Meta分析,结果显示:与未感染HIV人群相比,HIV感染可使HF发生风险增加48%(HR=1.48,95%CI:1.31~1.67,P<0.001),见图 2。由于纳入研究少,未进行Egger’s检验及敏感性分析。
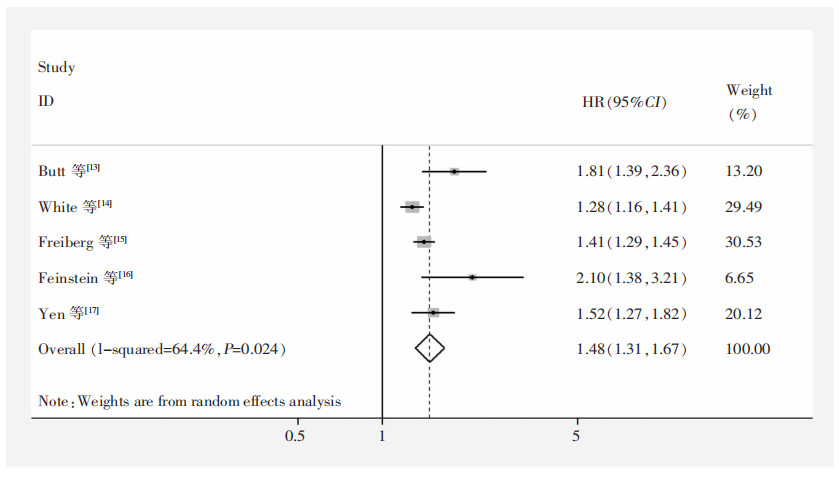 |
| 图 2 HIV感染与HF发生风险的Meta分析森林图 Figure 2 Forest plot of Meta-analysis on HIV infection and onset risk of HF |
按照HIV-1 RNA病毒载量进行亚组分析,结果显示当HIV-1 RNA病毒载量<500 copies/mL时,合并效应值HR=1.62(95%CI:0.91~2.86), 差异无统计学意义(P=0.100);当HIV-1 RNA病毒载量≥500 copies/mL时,HR=1.79(95%CI:1.21~2.64),差异有统计学意义(P= 0.003)。见图 3。按照CD4+细胞计数进行亚组分析,结果显示CD4+细胞计数<200个/mm3组(HR=1.75,95%CI:1.54~1.99)高于CD4+细胞计数(200≤CD4+≤499个/mm3)组(HR=1.41,95%CI:1.25~1.58),且两组异质性均可接受(I2=0),差异均有统计学意义(P<0.001)。见图 4。按照研究人群来源进行亚组分析,结果显示普通人群组(HR=1.68,95%CI:1.25~2.26)高于退役军人组(HR=1.41,95%CI:1.24~1.61),且普通人群组异质性可接受(I2=47.5%),而退役军人组的异质性较大(I2=69.3%)高于总体水平(I2=64.4%)。见图 5。
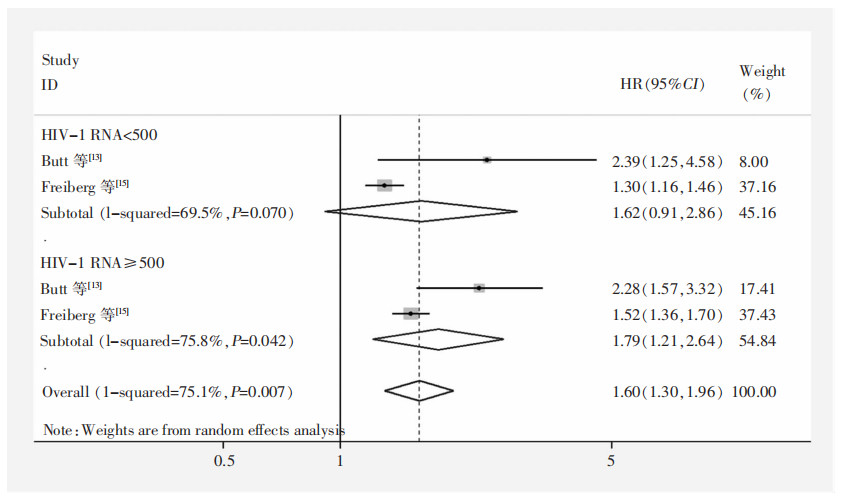 |
| 图 3 不同HIV-1 RNA病毒载量患者HF发生风险Meta分析森林图 Figure 3 Forest plot of Meta-analysis on onset risk of HF in patients with different HIV-1 RNA viral load |
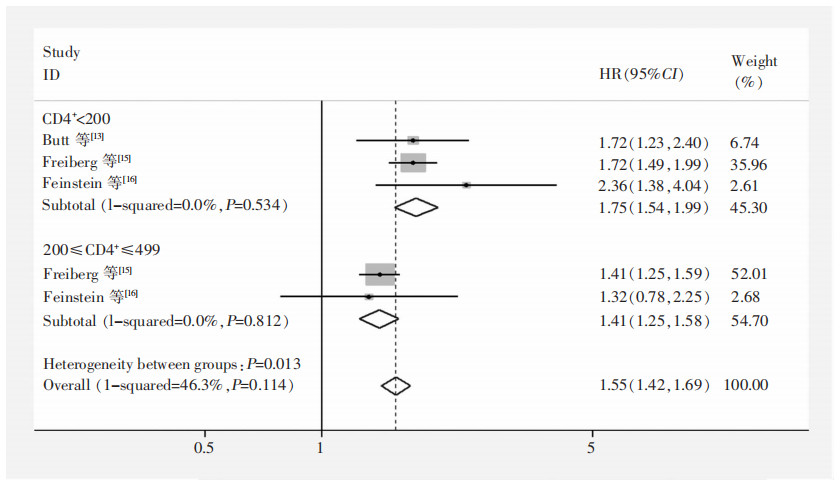 |
| 图 4 不同CD4+细胞计数的HIV患者HF发生风险Meta分析森林图 Figure 4 Forest plot of Meta-analysis on onset risk of HF in HIV patients with different CD4+ cell count |
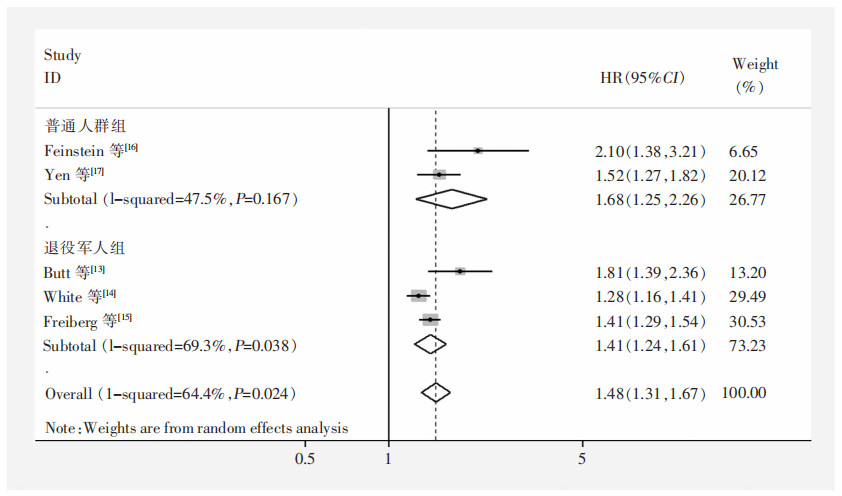 |
| 图 5 不同人群HIV患者HF发生风险Meta分析森林图 Figure 5 Forest plot of Meta-analysis on onset risk of HF in HIV patients of different population |
HF是由于多种原因出现心脏结构和/或功能的异常改变,导致心室收缩和/或舒张功能发生障碍,是各种心脏疾病的严重表现或晚期阶段,临床表现为呼吸困难、疲劳、体液潴留等。HF根据左室射血分数(left ventricular ejection fraction,LVEF)分为3个亚型,包括射血分数降低的HF(LVEF<40%)、射血分数中间值的HF(40%≤LVEF≤49%)、射血分数保留的HF(LVEF≥50%)[9],其中射血分数保留的HF占HF病例的一半以上[18]。在引起HF的诸多病因中最常见的病因为原发性心肌损伤和异常, 但不少非心血管疾病也可能导致HF。近年来,HF患病率及病死率均升高。控制HF危险因素(如高血压、糖尿病)并积极治疗无症状的左心室收缩功能异常,可延缓甚至预防HF的发生[9]。因此,建议按照HF指南进行诊疗,识别患者出现HF的病因并控制危险因素,尽早采取特异性或针对性的治疗,提高患者的生存率及生活质量[9]。HIV感染者随着有效的ART以及其寿命的延长,HF变得更加慢性和隐匿性[19],加大了对HIV感染者共病诊断和治疗的难度。本研究从循证的角度探讨HIV感染是否是引起HF的非心血管危险因素之一,可为HIV相关性HF的预防和针对性治疗提供新思路。
3.1 HIV感染与HF的风险关系本研究将HIV感染与HF风险之间的相关性进行Meta分析,结果表明,HIV感染可使HF发生风险增加48%(HR=1.48,95%CI:1.31~1.67,P<0.001),可认为HIV感染是HF发生的危险因素之一。本研究存在异质性(I2=64.4%),在亚组分析发现退役军人组的异质性较大,而普通人群组具有同质性,说明本研究异质性来源主要来自退役军人组的3个研究中,可能与退役军人中职业性强且主要人群是男性有关。Lai等[20]研究团队随访了26 272例HIV患者,发现其发生HF的风险是未感染者的1.50倍,与本Meta分析研究结果(1.48倍)结果类似。Al-Kindi等[21]采用病例对照研究分析36 400例HIV感染者(病例组)和12 208 430例HIV未感染者(对照组),结果显示HIV感染者HF发病率为7.2%,高于对照组的4.4%,HIV感染患者HF风险是对照组的1.64倍,HIV相关HF的风险在年轻患者和女性中最高。Alvi等[22]随访了2 308例HIV感染者,其中有374例(16.2%)HIV感染者合并HF,发现CD4+细胞计数低或可检测病毒载量(≥200 copies/mL)的HIV感染者可增加30天HF再入院率。Janjua等[23]研究结果也显示,HIV感染增加HF再入院的风险(HR=2.58,95%CI:1.55~4.29)。
3.2 HIV感染增加HF发生风险的机制目前,HIV感染增加HF发生风险的机制尚未完全阐明。研究认为HIV相关HF的病理生理学是多方面的,假设机制包括与病毒感染直接相关(如HIV心肌炎、细胞因子生成增加和慢性炎症)、机会性感染、自身免疫、ART副作用等[10, 21-22, 24-28],而越来越多的证据表明,HIV相关心肌纤维化和心脏脂肪变性可能是HIV感染者发生HF高风险的两大重要原因。一项横断面调查[24]结果显示,与对照组相比,HIV感染者的心脏收缩功能明显下降, 其心肌内脂质水平和纤维化指数均升高(P≤0.04),心肌内脂质水平与ART时间和内脏脂肪量呈正相关。Holloway等[25]采用磁共振成像对HIV感染与HF风险进行了研究,结果显示76%的无症状HIV感染患者有心肌纤维化,此比率高于未感染HIV患者的心肌纤维化(13%);随后,Ntusi等[26]发现44%的HIV相关心肌病患者存在心肌炎,患者出现了心肌纤维化。心肌纤维化可降低心室顺应性,加速HF病程的进展[27],此可能是HIV相关HF的重要原因。Holloway等[25]也发现HIV感染者的心肌脂质值比未感染HIV患者高47%。动物试验证实,心肌细胞内脂质过盛可产生脂毒中间体,引起细胞凋亡,从而导致HF的发生[28]。此外,ART可能与心血管疾病的风险增加有关,但对ART与HF发展之间关系的研究有限,Alvi等[22]认为接受蛋白酶抑制剂治疗艾滋病伴HF的患者,其30天HF再入院次数增加,然而,Yen等[17]却发现在HIV感染者中,没有一种高度活跃的ART与发生HF的风险显著相关。
3.3 本研究的局限性首先,本研究仅纳入发表的中英文文献,未检索其他语种和灰色文献,可能存在文献收录不全的问题。其次,分析的5篇文献,有4篇来自于美国,存在地域局限性。此外,本研究存在异质性,但因纳入文献有限,未进行Egger’s检验及敏感性分析。最后,纳入研究对混杂因素校正不一,应考虑多种混杂因素可能带来的影响。因此,本Meta分析的结果需要开展更大范围、更多样本、多中心、高质量的研究予以验证。
在全球范围内,至少有3 690万HIV感染者,且有逐年增长的趋势。本Meta分析结果发现,HIV感染可使HF发生风险增加48%,表明HIV感染可能是HF发生的危险因素之一,提示在HF预防方面,减少及控制HIV感染可能有助于降低HF发生风险。医疗卫生人员应注重指南推荐的HIV感染治疗和HF危险因素的预防,对已患HIV感染者可选择做HF的筛查,并在适当情况下对新发HF患者进行HIV筛查,做到早筛查、早诊断、早治疗。建议开发相关工具,对HIV感染者进行HF风险分层,筛选出高风险人群,进而为HIV感染者中有关HF的预防和治疗提供可预见性的帮助。
| [1] |
Rolston KV, Bodey GP. Acquired immunodeficiency syndrome[J]. Semin Surg Oncol, 1986, 2(2): 53-71. DOI:10.1002/ssu.2980020202 |
| [2] |
AIDS. Global HIV/AIDS overview[EB/OL]. (2018-11-20)[2019-09-05].http://libdb.csu.edu.cn/rwt/PUBMED/https/P75YPLUBNFTHGLUHN75A/federal-resources/around-the-world/global-aids-overview.
|
| [3] |
Antiretroviral Therapy Cohort Collaboration. Survival of HIV-positive patients starting antiretroviral therapy between 1996 and 2013:a collaborative analysis of cohort studies[J]. Lancet HIV, 2017, 4(8): e349-e356. DOI:10.1016/S2352-3018(17)30066-8 |
| [4] |
Shah ASV, Stelzle D, Lee KK, et al. Global burden of athero-sclerotic cardiovascular disease in people living with HIV:systematic review and Meta-analysis[J]. Circulation, 2018, 138(11): 1100-1112. DOI:10.1161/CIRCULATIONAHA.117.033369 |
| [5] |
Farahani M, Mulinder H, Farahani A, et al. Prevalence and distribution of non-AIDS causes of death among HIV-infected individuals receiving antiretroviral therapy:a systematic review and Meta-analysis[J]. Int J STD AIDS, 2017, 28(7): 636-650. DOI:10.1177/0956462416632428 |
| [6] |
Eckard AR, Meissner EG, Singh I, et al. Cardiovascular di-sease, statins, and HIV[J]. J Infect Dis, 2016, 214(Suppl 2): S83-S92. DOI:10.1093/infdis/jiw288 |
| [7] |
Volpe M, Uglietti A, Castagna A, et al. Cardiovascular di-sease in women with HIV-1 infection[J]. Int J Cardiol, 2017, 241: 50-56. DOI:10.1016/j.ijcard.2017.02.117 |
| [8] |
Hanna DB, Post WS, Deal JA, et al. HIV infection is associa-ted with progression of subclinical carotid atherosclerosis[J]. Clin Infect Dis, 2015, 61(4): 640-650. DOI:10.1093/cid/civ325 |
| [9] |
中华医学会心血管病学分会心力衰竭学组, 中国医师协会心力衰竭专业委员会, 中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2018[J]. 中华心血管病杂志, 2018, 46(10): 760-789. |
| [10] |
Chen R, Scherzer R, Hsue PY, et al. Association of tenofovir use with risk of incident heart failure in HIV-infected patients[J]. J Am Heart Assoc, 2017, 6(4): e005387. |
| [11] |
Jüni P, Witschi A, Bloch R, et al. The hazards of scoring the quality of clinical trials for Meta-analysis[J]. JAMA, 1999, 282(11): 1054-1060. DOI:10.1001/jama.282.11.1054 |
| [12] |
Higgins JP, Thompson SG, Deeks JJ, et al. Measuring inconsistency in Meta-analyses[J]. BMJ, 2003, 327(7414): 557-560. DOI:10.1136/bmj.327.7414.557 |
| [13] |
Butt AA, Chang CC, Kuller L, et al. Risk of heart failure with human immunodeficiency virus in the absence of prior diagnosis of coronary heart disease[J]. Arch Intern Med, 2011, 171(8): 737-743. |
| [14] |
White JR, Chang CC, So-Armah KA, et al. Depression and human immunodeficiency virus infection are risk factors for incident heart failure among veterans:veterans aging cohort study[J]. Circulation, 2015, 132(17): 1630-1638. DOI:10.1161/CIRCULATIONAHA.114.014443 |
| [15] |
Freiberg MS, Chang CH, Skanderson M, et al. Association between HIV infection and the risk of heart failure with reduced ejection fraction and preserved ejection fraction in the antiretroviral therapy era:results from the veterans aging cohort study[J]. JAMA Cardiol, 2017, 2(5): 536-546. DOI:10.1001/jamacardio.2017.0264 |
| [16] |
Feinstein MJ, Steverson AB, Ning H, et al. Adjudicated heart failure in HIV-infected and uninfected men and women[J]. J Am Heart Assoc, 2018, 7(21): e009985. |
| [17] |
Yen YF, Ko MC, Yen MY, et al. Human immunodeficiency virus increases the risk of incident heart failure[J]. J Acquir Immune Defic Syndr, 2019, 80(3): 255-263. DOI:10.1097/QAI.0000000000001917 |
| [18] |
Moayedi Y, Walmsley SL. Heart failure with preserved ejection fraction in women living with HIV:another inflammatory comorbidity?[J]. J Infect Dis, 2020, 221(8): 1219-1222. |
| [19] |
Hsue PY, Waters DD. Heart failure in persons living with HIV infection[J]. Curr Opin HIV AIDS, 2017, 12(6): 534-539. DOI:10.1097/COH.0000000000000409 |
| [20] |
Lai YJ, Chen YY, Huang HH, et al. Incidence of cardiovascular diseases in a nationwide HIV/AIDS patient cohort in Taiwan from 2000 to 2014[J]. Epidemiol Infect, 2018, 146(16): 2066-2071. DOI:10.1017/S0950268818002339 |
| [21] |
Al-Kindi SG, ElAmm C, Ginwalla M, et al. Heart failure in patients with human immunodeficiency virus infection:epidemiology and management disparities[J]. Int J Cardiol, 2016, 218: 43-46. DOI:10.1016/j.ijcard.2016.05.027 |
| [22] |
Alvi RM, Afshar M, Neilan AM, et al. Heart failure and adverse heart failure outcomes among persons living with HIV in a US tertiary medical center[J]. Am Heart J, 2019, 210: 39-48. DOI:10.1016/j.ahj.2019.01.002 |
| [23] |
Janjua SA, Triant VA, Addison D, et al. HIV infection and heart failure outcomes in women[J]. J Am Coll Cardiol, 2017, 69(1): 107-108. DOI:10.1016/j.jacc.2016.11.013 |
| [24] |
Thiara DK, Liu CY, Raman F, et al. Abnormal myocardial function is related to myocardial steatosis and diffuse myocardial fibrosis in HIV-infected adults[J]. J Infect Dis, 2015, 212(10): 1544-1551. DOI:10.1093/infdis/jiv274 |
| [25] |
Holloway CJ, Ntusi N, Suttie J, et al. Comprehensive cardiac magnetic resonance imaging and spectroscopy reveal a high burden of myocardial disease in HIV patients[J]. Circulation, 2013, 128(8): 814-822. DOI:10.1161/CIRCULATIONAHA.113.001719 |
| [26] |
Ntusi NAB. HIV and myocarditis[J]. Curr Opin HIV AIDS, 2017, 12(6): 561-565. DOI:10.1097/COH.0000000000000416 |
| [27] |
Travers JG, Kamal FA, Robbins J, et al. Cardiac fibrosis:the fibroblast awakens[J]. Circ Res, 2016, 118(6): 1021-1040. DOI:10.1161/CIRCRESAHA.115.306565 |
| [28] |
Sharma S, Adrogue JV, Golfman L, et al. Intramyocardial lipid accumulation in the failing human heart resembles the lipotoxic rat heart[J]. FASEB J, 2004, 18(14): 1692-1700. DOI:10.1096/fj.04-2263com |



