2. 湖北医药学院附属襄阳市第一人民医院 中医科康复科, 湖北 襄阳 441000;
3. 湖北医药学院附属襄阳市第一人民医院内分泌科, 湖北 襄阳 441000;
4. 武当特色中药研究湖北省重点实验室, 湖北 十堰 442000
2. Department of Traditional Chinese Medicine and Rehabilitation, Xiangyang No.1 People's Hospital, Hubei University of Medicine, Xiangyang 441000, China;
3. Department of Endocrinology, Xiangyang No.1 People's Hospital, Hubei University of Medicine, Xiang-yang 441000, China;
4. Hubei Key Laboratory of Wudang Local Chinese Medicine Research, Shiyan 442000, China
2019年12月以来,湖北省武汉市陆续出现了多例不明原因病毒性肺炎患者,部分患者病情迅速进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),并出现医护及密切接触者感染现象,后证实为新型冠状病毒感染。世界卫生组织(World Health Organization,WHO)命名此次新型冠状病毒引起的疾病为COVID-19(coronavirus disease 2019)。国际病毒分类委员会将此病毒命名为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)。SARS-CoV-2是目前已知的第7种可以感染人的冠状病毒,其余6种分别是HCoV-229E、HCoV-OC43、HCoV-NL63、HCoV-HKU1、SARS-CoV[引发严重急性呼吸综合征(SARS)][1]和MERS-CoV[引发中东呼吸综合征(MERS)][2]。SARS-CoV-2感染机制、临床表现与SARS相似[3],对SARS死亡患者和动物模型的研究表明,过度和异常的宿主免疫反应是导致疾病快速恶化、致命的病因[4-6]。SARS死亡患者肺间质和肺泡滤液中有大量炎性浸润细胞,与外周血中性粒细胞和单核细胞数量增加以及Th和Tc细胞计数降低有关[7-8]。我国《新型冠状病毒肺炎诊疗方案》一直强调淋巴细胞(TLC)减少与重症有关联,《新型冠状病毒肺炎诊疗方案(试行第七版)》增加重型、危重型临床预警指标,针对成人包括:外周血TLC进行性下降,外周血炎症因子如白细胞介素(IL)-6、C反应蛋白(CRP)进行性上升,乳酸进行性升高,肺内病变在短期内迅速进展[9]。最近研究发现,COVID-19患者血浆中与炎症相关的细胞因子水平上升, 包括IL-2、7、10, 粒细胞集落刺激因子(G-CSF), 干扰素-γ诱导蛋白10(IP-10), 单核细胞趋化蛋白-1(MCP-1), 巨噬细胞炎性蛋白1α(MIP1-α)和肿瘤坏死因子α(TNF-α), 尤其是在危重症患者中升高更加明显[10-11],SARS-CoV-2感染患者在影像学上出现了特征性的肺磨玻璃影改变[8, 12],病理学特征为ARDS,与SARS-CoV和MERS-CoV感染相似,外周血中Th和Tc细胞数量明显减少,但这些细胞处于过度激活状态[13]。SARS-CoV-2感染者中也存在严重的肺部炎症和细胞因子风暴。
在COVID-19感染者重症化过程中,炎症风暴的发生可能扮演了重要角色[14]。炎症风暴也是引起ARDS和多器官衰竭的重要原因[15]。目前,对SARS-CoV-2感染导致机体炎症风暴发生的关键炎性因子仍需进一步研究,COVID-19炎症风暴的发生机制及预测评估方式尚不明确,TLC、CD4+辅助性T细胞与CD8+效应T细胞比值(Th/Tc)能否作为COVID-19重症化评估和预测指标亟待阐明。本研究收集某院12例确诊患者实验室检测资料,分析不同病情患者TLC、Th/Tc值,判断以TLC、Th/Tc值评估COVID-19患者病情进展的可行性,以进一步了解SARS-CoV-2感染的病理、生理机制。
1 对象与方法 1.1 研究对象回顾性分析2020年1月28日—2月10日某院12例COVID-19确诊病例。患者均于收治当日通过咽拭子采样后送SARS-CoV-2核酸检测,并行胸部CT检查,经2次SARS-CoV-2核酸检测均为阳性,5例病例在入院后病情进展迅速,纳入重型/危重型组;7例病例病情平稳,纳入轻型/普通型组。本研究已通过襄阳市第一人民医院医学伦理委员会审核批准(2020GCP005),符合2013年修订的《赫尔辛基宣言》的要求。
1.2 研究方法 1.2.1 实验室检测最初的实验室检测包括血细胞计数、血清生化检测、肝和肾功能、肌酸激酶(CK)、乳酸脱氢酶(LDH)、电解质、尿常规、血气分析、CRP、血沉(ESR)、降钙素原(PCT)、肌红蛋白(MYO)、凝血,以及胸部CT。使用经国家食品药品监督管理总局批准的Realtime逆转录聚合酶链反应(RT-PCR)检测方法,检测包括鼻咽拭子或痰在内的呼吸道标本,以排除流感病毒、呼吸道合胞病毒、人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)等感染。
1.2.2 外周血TLC和T细胞及其亚群检测采用多色抗人单克隆抗体(mAbs)联合试剂PE-CD3/PE·CY7-CD8/BB515-CD4和匹配的同型对照,在入院后2 d内测定外周血免疫细胞亚群。将外周血进行抗体染色,裂红液裂解红细胞,采用绝对计数管进行流式细胞术检测。所有试剂均购自BD公司(BD, Franklin Lakes, USA),所有标本均采用BD FACS Aria Ⅱ流式细胞仪进行检测,并使用BD流式细胞仪Diva软件进行分析。
1.3 统计学分析应用SPSS 24.0统计软件进行数据的统计学分析,连续变量用均数表示,Mann-Whitney U检验进行比较。轻型/普通型组与重型/危重型组病例以(频数)百分数表示,用χ2检验或确切概率法进行比较,P≤0.05为差异有统计学意义。
2 结果 2.1 患者基本临床特征12例COVID-19患者中轻型/普通型组7例,重型/危重型组5例,两组患者年龄、性别、基础疾病、症状特征比较,差异均无统计学意义。见表 1。
| 表 1 两组COVID-19患者基本信息 Table 1 Basic information of two groups of COVID-19 patients |
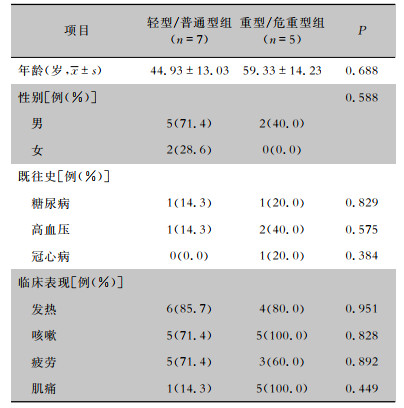
|
12例COVID-19患者流感病毒、呼吸道合胞病毒、HIV、HBV、HCV检测均为阴性。两组患者外周血TLC计数比较,差异有统计学意义(P<0.05),轻型/普通型组患者TLC计数在正常值范围下限,重型/危重型组患者TLC计数小于正常范围值。两组患者CRP、ESR、PCT浓度均高于正常水平。见表 2。
| 表 2 两组COVID-19患者入院时实验室生化指标比较(x±s) Table 2 Comparison of laboratory biochemical indicators between two groups of COVID-19 patients on admission(x±s) |
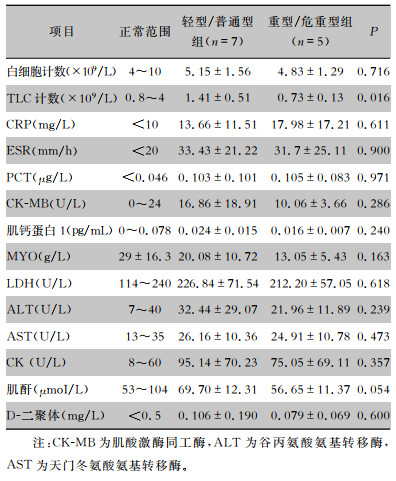
|
流式圈门策略及典型示例如图 1所示。对两组患者TLC、T、Th、Tc以及Th/Tc值进行统计,并与正常值范围进行比较,COVID-19患者TLC占比低于正常值范围,重型/危重型组较轻型/普通型组更低(图 2A);两组患者T细胞(CD3+)占比均在正常范围(图 2B);两组患者Tc细胞(CD3+CD8+)占比均在正常范围(图 2C),COVID-19患者Th细胞(CD3+CD4+)占比高于正常范围,重型/危重型组比轻型/普通型组患者更高(图 2D);COVID-19患者Th/Tc值高于正常值范围,重型/危重型组比轻型/普通型组患者更高(图 2E)。统计学分析发现重型/危重型组TLC和Th占比与正常值比较,差异有统计学意义(图 2A、D)。
 |
| A:轻型/普通型组; B:重型/危重型组。 图 1 COVID-19患者外周血TLC、Th和Tc细胞流式散点图结果 Figure 1 Flow cytometry results of TLC, Th and Tc cell in the peripheral blood of COVID-19 patients |
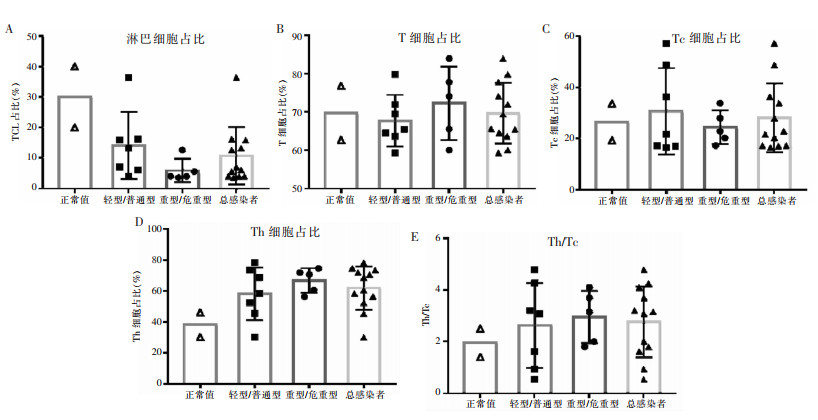 |
| 图 2 COVID-19患者外周血流式细胞仪检测结果 Figure 2 Flow cytometry result of peripheral blood in COVID-19 patients |
流式检测结果显示,两组患者T淋巴细胞占比均在正常范围内;但绝对值均降低,轻型/普通型组、重型/危重型组T淋巴细胞绝对值比较,差异有统计学意义[(913±275) μL VS (526±228) μL,P=0.028];轻型/普通型组、重型/危重型组Th细胞占比高于正常值范围,但绝对计数值均低于正常范围值,两组间差异有统计学意义[(530±99) μL VS(351±41) μL,P=0.004];轻型/普通型组、重型/危重型组Tc细胞绝对计数值均低于正常范围值,两组间差异有统计学意义[(255±84) μL VS (128±70) μL,P=0.020]。
3 讨论冠状病毒属病毒是一类具有囊膜、基因组为线性单股正链RNA病毒,是自然界广泛存在的一大类病毒。SARS-CoV-2是β属冠状病毒,2019年12月31日被明确是冠状病毒,2020年1月3日毒株被分离,1月7日报告地方和国家疾病预防控制中心。在近20年间,冠状病毒已引发3次大规模的流行病,包括SARS、MERS和COVID-19。COVID-19重症患者多在发病一周后出现呼吸困难和/或低氧血症,严重者可快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍及多器官功能衰竭等[10, 13]。病毒逃避宿主免疫反应和病毒诱导的细胞病变作用被认为是疾病严重程度的关键,SARS-CoV-2感染者与SARS-CoV及MERS-CoV感染患者相似,也存在严重的肺部炎症和细胞因子风暴[8, 13, 16]。肺部免疫损伤的严重程度与肺广泛浸润的中性粒细胞和巨噬细胞相关,同时伴有中性粒细胞和单核细胞数量的增加,还伴有外周血样本中Th和Tc细胞计数的降低[16-18]。研究影响COVID-19患者预后的因素,发现Tc细胞显著减少,中性粒细胞、Tc细胞比值与COVID-19患者预后相关[19]。
T细胞在获得性免疫应答以及清除病毒感染过程中发挥重要作用,Th/Tc值可以间接反映机体免疫状态。Th细胞的功能为产生多种细胞因子,传递抗原信息,促进T、B细胞分化增殖,辅助B细胞产生抗体和诱导迟发性变态反应。Tc细胞是免疫反应中的直接杀伤细胞,而Th/Tc值升高,表明细胞免疫功能处于“过度激活”状态[20-21]。因此,Th/Tc值作为预测COVID-19患者重症化指标具有可行性。同济大学对21例SARS-CoV-2感染患者免疫学特征进行分析,结果显示危重症患者TLC、T细胞与中重度患者相比显著降低,同时,Th细胞、Tc细胞的计数在重症和中重症患者中均显著下降[22]。与本研究结果一致。中科院和中国科技大学合作的研究结果显示,在SARS-CoV-2感染后,患者Th细胞迅速被激活,成为致病性辅助T细胞(Th1),并产生GM-CSF等细胞因子,SARS-CoV-2免疫病理报告提示存在致病性GM-CSF+Th1细胞和炎性CD14+、D16+单核细胞过度激活的免疫应答现象。异常的、过度的免疫细胞可能大量进入肺循环,对肺功能失能和快速死亡起免疫损伤作用[23],表明COVID-19重症患者出现过度免疫反应与TLC计数减低,Th和Tc细胞比例失调有关。
本研究对12例COVID-19患者进行回顾性研究,发现两组患者血尿素和肌酐水平等生化指标无差异,重型/危重型患者TLC计数比轻型/普通型患者明显减低(P<0.05),因此,TLC可作为COVID-19患者重症化的预测指标之一;流式检测结果显示,两组患者T、Tc细胞的占比均在正常值范围,Th细胞的占比高于正常值范围,但绝对计数发现,重型/危重型患者TLC、T、Th、Tc细胞绝对计数比轻型/普通型患者明显减低(P<0.05),由此可见,单纯从T、Th、Tc占比很难判断患者病情与免疫状态,TLC、T、Th、Tc细胞绝对计数在判断COVID-19患者病情进展方面更有意义。现有文献显示,促炎因子水平与COVID-19患者重症化密切相关[10-11, 23]。但是,多种促炎因子的检测和流式细胞术检测T淋巴细胞及其亚群的绝对计数,不是所有级别的医院都能快速完成。血常规检测简单、经济,短时间内即可得到TLC计数,可为医生快速、初步判断病情提供重要信息。重型/危重型患者Th/Tc值比轻型/普通型患者更高,说明重型/危重型患者中发生过度激活的免疫反应。因此,通过TLC、Th/Tc值判断COVID-19患者的免疫状态,预测炎症水平,有一定的可行性,可以将TLC计数值、Th/Tc值作为患者炎症反应的指标,结合促炎因子指标,判断患者是否发生炎症风暴。本研究的局限性为病例数较少,没有检测炎症因子指标与TLC、T细胞、Th、Tc的相关性。因此,在条件充足的情况下仍应该采用流式细胞仪进行T细胞及其亚群和细胞因子检测,以获得COVID-19病情进展阶段的直接证据,更好地指导临床治疗。
| [1] |
Marra MA, Jones SJ, Astell CR, et al. The genome sequence of the SARS-associated coronavirus[J]. Science, 2003, 300(5624): 1399-1404. |
| [2] |
Drosten C, Kellam P, Memish ZA. Evidence for camel-to-human transmission of MERS coronavirus[J]. N Engl J Med, 2014, 371(14): 1359-1360. |
| [3] |
周娟, 李丹, 龙云铸. 新型冠状病毒(2019-nCoV)相关研究进展[J]. 中国感染控制杂志, 2020, 19(3): 288-292. |
| [4] |
Hui DS, Chan MC, Wu AK, et al. Severe acute respiratory syndrome (SARS):epidemiology and clinical features[J]. Postgrad Med J, 2004, 80(945): 373-381. |
| [5] |
Rockx B, Baas T, Zornetzer GA, et al. Early upregulation of acute respiratory distress syndrome-associated cytokines promotes lethal disease in an aged-mouse model of severe acute respiratory syndrome coronavirus infection[J]. J Virol, 2009, 83(14): 7062-7074. |
| [6] |
Smits SL, deLang, van den Brand JM, et al. Exacerbated innate host response to SARS-CoV in aged non-human primates[J]. PLoS Pathog, 2010, 6(2): e1000756. |
| [7] |
Cui W, Fan Y, Wu W, et al. Expression of lymphocytes and lymphocyte subsets in patients with severe acute respiratory syndrome[J]. Clin Infect Dis, 2003, 37(6): 857-859. |
| [8] |
Channappanavar R, Perlman S. Pathogenic human coronavirus infections:causes and consequences of cytokine storm and immunopathology[J]. Semin Immunopathol, 2017, 39(5): 529-539. |
| [9] |
国家卫生健康委办公厅.新型冠状病毒肺炎诊疗方案(试行第七版)[EB/OL].(2020-03-03)[2020-03-04]. http://www.gov.cn/zhengce/zhengceku/2020-03/04/content_5486705.htm.
|
| [10] |
Huang CL, Wang YM, Li XW, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. |
| [11] |
Chen NS, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China:a descriptive study[J]. Lancet, 2020, 395(10223): 507-513. |
| [12] |
Li G, Fan Y, Lai Y, et al. Coronavirus infections and immune responses[J]. J Med Virol, 2020, 92(4): 424-432. |
| [13] |
Xu Z, Shi L, Wang YJ, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020, 8(4): 420-422. |
| [14] |
中华预防医学会新型冠状病毒肺炎防控专家组. 新型冠状病毒肺炎流行病学特征的最新认识[J]. 中华流行病学杂志, 2020, 41(2): 139-144. |
| [15] |
Chousterman BG, Swirski FK, Weber GF. Cytokine storm and sepsis disease pathogenesis[J]. Semin Immunopathol, 2017, 39(5): 517-528. |
| [16] |
Ding YQ, Wang HJ, Shen H, et al. The clinical pathology of severe acute respiratory syndrome (SARS):a report from China[J]. J Pathol, 2003, 200(3): 282-289. |
| [17] |
Wong CK, Lam CW, Wu AK, et al. Plasma inflammatory cytokines and chemokines in severe acute respiratory syndrome[J]. Clin Exp Immunol, 2004, 136(1): 95-103. |
| [18] |
Tisoncik JR, Korth MJ, Simmons CP, et al. Into the eye of the cytokine storm[J]. Microbiol Mol Biol Rev, 2012, 76(1): 16-32. |
| [19] |
Liu J, Li SM, Liu J, et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients[J]. EBioMedicine, 2020, 55: 102763. |
| [20] |
冯丹丹, 李爱新, 汪雯, 等. 长期抗病毒治疗后人类免疫缺陷病毒感染和艾滋病患者CD4+/CD8+比值的变化特点[J]. 中华传染病杂志, 2018, 36(7): 425-427. |
| [21] |
畅毅平, 张玉强, 张永利, 等. CD3+、CD4+、CD8+T细胞和CD19+B细胞在急性呼吸窘迫综合征发病中的作用[J]. 中华急诊医学杂志, 2018, 27(7): 769-773. |
| [22] |
Chen G, Wu D, Guo W, et al. Clinical and immunologic features in severe and moderate forms of coronavirus disease[J/OL]. medRxiv, February 19, 2020. DOI: https://doi.org/10.1101/2020.02.16.20023903.
|
| [23] |
Zhou Y, Fu B, Zheng X, et al. Aberrant pathogenic GM-CSF+ T cells and inflammatory CD14+CD16+ monocytes in severe pulmonary. syndrome patients of a new coronavirus[J/OL]. bioRxiv, 2020, Feb 12. https://doi.org/10.1101/2020.02.12.945576.
|



