2. 电子科技大学医学院, 四川 成都 610054
2. School of Medicine, University of Electronic Science and Technology of China, Chengdu 610054, China
中国丙型病毒性肝炎血清流行病学调查显示,1~59岁人群抗丙型肝炎病毒(HCV)调整流行率为0.43%[1]。中国血液透析患者中HCV感染的发病率为9.9%,远高于非透析人群[2]。《KDIGO慢性肾脏病中丙型肝炎的预防、诊断、评估和治疗指南》推荐所有合并HCV感染的慢性肾病(CKD)患者均应行抗病毒治疗,并且建议使用无干扰素治疗方案[3]。目前,中国食品药品监督管理总局批准并上市的直接抗病毒药物(DAAs)包括索磷布韦、索磷布韦/维帕他韦、奥比帕利/帕利瑞韦/利托那韦+达塞布韦、达诺瑞韦、达卡他韦/阿舒瑞韦、艾尔巴韦/格拉瑞韦等。由于多种方案在估算肾小球滤过率(eGFR)<30 mL/min·1.73 m2的CKD 4~5期患者中使用容易发生不良反应,除艾尔巴韦/格拉瑞韦外均未推荐应用于透析人群[3-5]。目前国内尚无透析患者使用艾尔巴韦/格拉瑞韦的相关文献,本文将在HCV感染透析患者中使用该药的经验报告如下。
1 对象与方法 1.1 研究对象2018年9—10月在本院透析的HCV感染患者。纳入标准:(1)高精度HCV-RNA检测病毒拷贝数>1.50E1 IU/mL;(2)病毒基因分型检测为HCV 1b型。排除标准:肝硬化及肝癌患者,合并其他恶性肿瘤患者,乙型肝炎病毒以及人类免疫缺陷病毒感染患者。
1.2 治疗方案抗病毒治疗方案为使用艾尔巴韦(50 mg)/格拉瑞韦(100 mg)qd,空腹或与食物同服,治疗共12周。如治疗过程中出现漏服药物,距平时服药时间不超过16 h,可补服一剂药物,如超过16 h则不再补服漏服剂量,按正常给药计划服用下一剂药物。患者在治疗期间避免使用与艾尔巴韦/格拉瑞韦存在相互作用的药物。
1.3 观察指标观察治疗前,治疗后4、8、12、24周高精度HCV RNA载量的变化,以及血红蛋白(Hb)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、血清清蛋白(Alb)、总胆红素(TBiL)、肌酐(Cr)、尿素氮(BUN)变化。于治疗前,治疗后12、24周分别计算透析充分性指标尿素清除指数(Kt/V),其中血液透析患者单次透析Kt/V>1.2为达标,腹膜透析患者每周总Kt/V>1.7为达标。观察并记录患者治疗后出现的新发临床症状。持续病毒应答(sustained virologic response,SVR12)定义为治疗结束后12周血清HCV RNA检测阴性,获得SVR12的患者判定为临床治愈。
1.4 HCV标本采集及检测患者血样采集均为空腹,血液透析患者采血时间为透析治疗前。全部血样送医院检验科完成检测,血清高精度HCV-RNA水平检测和HCV基因分型检测均使用实时荧光定量PCR,TaqMan探针法(COBASⓇ Ampliprep试剂盒和泰普生物的diagnostic kit for hepatitis C virus genotyping试剂盒)。高精度HCV-RNA水平检测判定标准:(1)TND,未检测到HCV-RNA。(2) < 1.5E1 IU/mL,检测到HCV-RNA,但低于检测下限。(3)>1.00E8 IU/mL,HCV-RNA拷贝数高于检测上限。
2 结果 2.1 一般资料共纳入3例患者,患者1、2为血液透析患者,患者3为腹膜透析患者,平均年龄(43.0±5.6)岁。见表 1。
| 表 1 3例HCV感染透析患者一般资料 Table 1 General data of 3 dialysis patients with HCV infection |
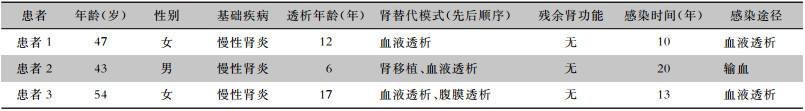
|
3例患者艾尔巴韦/格拉瑞韦治疗前HCV病毒载量为1.24E3~1.44E6 IU/mL,治疗后4、8、12、24周分别检测HCV-RNA均为TND,获得SVR12。见表 2。
| 表 2 抗病毒治疗前后患者HCV病毒载量变化(IU/mL) Table 2 Changes in HCV viral load in patients before and after treatment with elbasvir/grazoprevir (IU/mL) |

|
艾尔巴韦/格拉瑞韦治疗前及治疗4、8、12、24周后患者Alb、ALT、AST、TBIL无明显变化,且AST、ALT、TBiL检测值均在正常范围。见表 3。
| 表 3 抗病毒治疗前后HCV透析患者血液生化指标对比 Table 3 Comparison of blood biochemical markers of HCV dialysis patients before and after treatment with elbasvir/grazoprevir |
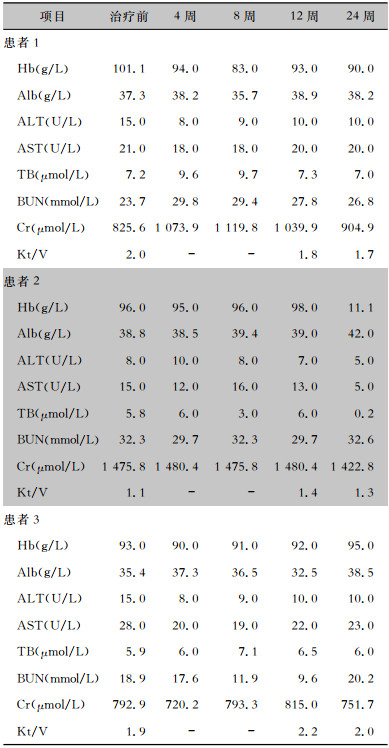
|
3例患者依从性均良好,均未漏服药物。1例腹膜透析患者新增疲乏表现,但于治疗结束后症状缓解,1例血液透析患者用药后Hb下降>1 g,无患者因不良反应退出研究。
3 讨论透析患者多通过输血、血液透析过程中交叉感染等途径感染HCV。透析患者合并HCV感染后不仅增加肝疾病相关的住院率,也增加肝脏疾病和心血管疾病的死亡风险[2, 6]。虽然血液透析中心通过设置传染病透析区域,使用一次性透析器材,规范透析操作等方法,投入大量的医疗资源以防止HCV感染,但仍时有血液透析患者HCV感染报道[7-9],尤其是近期暴发的多例东台血液透析患者HCV感染更是成为恶性公共卫生事件[10]。治疗合并HCV感染的透析患者可消除传染源,减少医院感染的机会,抗HCV治疗具有重要意义[11]。
然而,临床上合并HCV感染的透析患者在选择抗病毒药物时受到较多限制,透析患者合并HCV感染后获得抗病毒治疗的比率仅为1.5%[2]。透析患者使用传统的抗HCV治疗方案干扰素+利巴韦林时可出现药物清除减慢,引起严重不良反应,尤其是利巴韦林可诱发严重的溶血性贫血[12]。虽然DAAs在eGFR > 30 mL/min·1.73 m2的CKD 3期以上患者中使用不需减量,但多种方案在CKD 4~5期患者中使用受限,适用于透析患者的更少[3-5]。由于80%的索磷布韦需经肾清除,该药在CKD患者中血浆药物/曲线下面积(AUC)可增高20倍,并可导致持续肾功能恶化,故不推荐在CKD 4期以下患者中使用[13]。西米匹韦只能用于eGFR>15 mL/min·1.73 m2的患者[14-15]。阿舒瑞韦在CKD 4期患者中需要减量使用。虽然没有观察到达卡他韦在CKD患者中存在有临床意义的AUC改变,但因其通常需要同其他抗病毒药物联用而缺乏在CKD 4期以上患者中使用的依据[3-5]。2019年5月国内新上市的格卡瑞韦/哌仑他韦是全基因型抗病毒新药,Gane等[16]研究证实,在CKD 4~5期患者中使用不需减量,该方案也受到多个指南推荐适用于透析患者,但该药在国内多数地方目前尚无法获得。近期Lawitz等[17]研究结果显示,奥比他韦/帕利瑞韦/利托那韦+达塞布韦方案在透析患者中使用也具有很好的安全性和病毒清除率,但该方案尚未获得指南推荐。
艾尔巴韦是一种HCV非结构蛋白NS5A抑制剂,可抑制病毒RNA复制和病毒装配。格拉瑞韦是一种HVC NS3/4A蛋白酶抑制剂,对HCV编码的多蛋白蛋白酶切和病毒复制起抑制作用。因此,艾尔巴韦/格拉瑞韦可用于治疗基因1型和4型HCV感染。两种药物主要通过氧化代谢消除,主要排泄途径为粪便,肾排泄剂量 < 1%。相对于肾功能正常的患者,伴有严重肾损伤的患者使用艾尔巴韦/格拉瑞韦后AUCs仅高1.65和1.86倍。而血液透析患者服用该药后药物AUC与肾功正常患者相似。由于具有较高的蛋白结合率,血液透析仅能清除0.5%的格拉瑞韦,且不能清除艾尔巴韦,腹膜透析预期也不会清除这两种药物[18]。既往文献[19]报道,艾尔巴韦/格拉瑞韦用于治疗基因1型HCV感染,可有效减少透析患者肝、肾并发症,以及死亡风险,具有良好的治疗效益和经济学意义。
本研究中使用艾尔巴韦/格拉瑞韦进行抗病毒治疗的3例透析患者均获得SVR12,达到临床治愈。3例患者在治疗过程中均未出现肝功能受损的临床症状及表现,亦未在治疗过程中发生严重的不良反应。1例血液透析患者在治疗后第4周出现血红蛋白下降,第8周最明显,但在未调整促红素剂量和增加其他改善贫血药物的情况下,第12周患者血红蛋白出现回升。1例腹膜透析患者治疗过程中出现疲乏现象,治疗结束后消失。Roth等[20]观察了HCV基因1型的CKD 4~5期224例患者(包含179例血液透析患者)使用该药的情况,发现常见药物相关不良反应可达34.5%,主要表现为头痛、恶心、疲乏,其中疲乏发生率可达15%;此外,血红蛋白降低至8.35~ < 10.0 g/dL的患者可达24.3%,提示在治疗过程中应密切监测血红蛋白变化。但该研究同时也发现,患者对这些不良反应有较高的耐受性,仅有5例因为不良反应退出研究。本研究也显示尽管在抗病毒过程中出现贫血加重和疲乏的不良反应,患者均能够耐受并继续治疗,并且不良反应在停药后缓解。
透析患者是否进行抗HCV治疗需要权衡患者健康获益、治疗风险及治疗费用多方面的因素[21]。尽管腹膜透析患者传播HCV的可能性远低于血液透析患者,但从生活质量角度考虑,如患者有治疗意愿仍然可考虑抗病毒治疗。现今腹膜透析患者使用DAAs治疗丙型肝炎的研究很少,Shuster等[22]报道了2例腹膜透析患者使用奥比他韦/帕利瑞韦/利托那韦;Stark等[23]报道了1例腹膜透析患者使用奥比他韦/帕利瑞韦/利托那韦+达塞布韦;Aggarwal等[24]报道了1例腹膜透析患者使用索磷布韦,这些报道中患者均未出现严重不良反应并获得较高治愈率。虽然药代动力学并没有指出腹膜透析患者使用艾尔巴韦/格拉瑞韦后会与血液透析患者存在不同,但目前在腹膜透析患者中使用该药的资料还很欠缺[14]。本研究纳入的1例腹膜透析患者,因为长期携带HCV,给工作和家庭生活造成极大困扰而主动要求治疗。治疗中未观察到该患者具有不同于文献报道的特殊不良反应及生化指标异常改变。
综上所述,艾尔巴韦/格拉瑞韦治疗合并1b型HCV感染的血液透析和腹膜透析患者安全有效,且无严重不良反应。
| [1] |
陈园生, 李黎, 崔富强, 等. 中国丙型肝炎血清流行病学研究[J]. 中华流行病学杂志, 2011, 32(9): 888-891. DOI:10.3760/cma.j.issn.0254-6450.2011.09.009 |
| [2] |
Goodkin D, Bieber B, Jadoul M, et al. Mortality, hospitalization, and quality of life among patients with hepatitis C infection on haemodialysis[J]. Clin J Am Soc Nephrol, 2017, 12(2): 287-297. DOI:10.2215/CJN.07940716 |
| [3] |
Kidney Disease:Improving Global Outcomes (KDIGO) Hepatitis C Work Group. KDIGO 2018 Clinical practice guideline for the prevention, diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease[J]. Kidney Int Suppl, 2018, 8(3): 91-165. DOI:10.1016/j.kisu.2018.06.001 |
| [4] |
Pawlotsky JM, Negro F, Aghemo A, et al. EASL recommendations on treatment of hepatitis C 2018[J]. J Hepatol, 2018, 69(2): 461-511. DOI:10.1016/j.jhep.2018.03.026 |
| [5] |
Chung RT, Ghany MG, Kim AY, et al. Hepatitis C guidance 2018 update:AASLD-IDSA recommendations for testing, managing, and treating hepatitis C virus infection[J]. Clin Infect Dis, 2018, 67(10): 1477-1492. DOI:10.1093/cid/ciy585 |
| [6] |
Jadoul M, Bieber B, Martin P, et al. Prevalence, incidence, and risk factors for hepatitis C virus infection in hemodialysis patients[J]. Kidney Int, 2019, 95(4): 939-947. DOI:10.1016/j.kint.2018.11.038 |
| [7] |
Miskulin DC, Gul A. Infection monitoring in dialysis units:a plea for "cleaner" data[J]. Clin J Am Soc Nephrol, 2017, 12(7): 1038-1039. DOI:10.2215/CJN.05220517 |
| [8] |
陈香美. 血液净化标准操作规程[M]. 北京: 人民军医出版社, 2010.
|
| [9] |
李新芳, 张晓飞, 陈燕明, 等. 从我国HCV感染暴发事件探讨HCV经血传播感染的风险[J]. 中国感染控制杂志, 2017, 16(10): 969-970. DOI:10.3969/j.issn.1671-9638.2017.10.018 |
| [10] |
姚常房.江苏东台丙肝感染已确诊69人[N].健康报, 2019-05-28(03).
|
| [11] |
李荣山, 周芸. 血液透析中心乙型肝炎、丙型肝炎的控制[J]. 中国血液净化, 2015, 14(3): 177-179. DOI:10.3969/j.issn.1671-4091.2015.03.014 |
| [12] |
Espinosa M, Hernàndez J, Arenas MD, et al. Pegylated interferon (alone or with ribavirin) for chronic hepatitis C in haemodialysis population[J]. Kidney Blood Press Res, 2015, 40(3): 258-265. DOI:10.1159/000368501 |
| [13] |
Saxena V, Koraishy FM, Sise ME, et al. Safety and efficacy of sofosbuvir-containing regimens in hepatitis C-infected patients with impaired renal function[J]. Liver Int, 2016, 36: 807-816. DOI:10.1111/liv.13102 |
| [14] |
Jadoul M, Martin P. Hepatitis C treatment in chronic kidney disease patients:the kidney disease improving global outcomes perspective[J]. Blood Purif, 2017, 43(1-3): 206-209. DOI:10.1159/000452730 |
| [15] |
Maruyama A, Partovi N, Yoshida EM, et al. A review of direct-acting antivirals for the treatment of hepatitis C in patients with advanced chronic kidney disease[J]. Nephrol Dial Transplant, 2017, 32(1): 35-41. |
| [16] |
Gane E, Lawitz E, Pugatch D, et al. Glecaprevir and pibrentasvir in patients with HCV and severe renal impairment[J]. N Engl J Med, 2017, 377(15): 1448-1455. DOI:10.1056/NEJMoa1704053 |
| [17] |
Lawitz E, Gane E, Cohen E, et al. Efficacy and safety of ombitasvir/paritaprevir/ritonavir in patients with hepatitis C virus genotype 1 or 4 infection and advanced kidney disease[J]. Kidney Int Rep, 2019, 4: 257-266. DOI:10.1016/j.ekir.2018.10.003 |
| [18] |
Caro L, Wenning L, Feng HP, et al. Pharmacokinetics of elbasvir and grazoprevir in subjects with end-stage renal disease or severe renal impairment[J]. Eur J Clin Pharmacol, 2019, 75(5): 665-675. DOI:10.1007/s00228-018-2585-3 |
| [19] |
Elbasha E, Greaves W, Roth D, et al. Cost-effectiveness of elbasvir/grazoprevir use in treatment-naive and treatment-experienced patients with hepatitis C virus genotype 1 infection and chronic kidney disease in the United States[J]. J Viral Hepat, 2017, 24(4): 268-279. DOI:10.1111/jvh.12639 |
| [20] |
Roth D, Nelson DR, Bruchfeld A, et al. Grazoprevir plus elbasvir in treatment-naive and treatment-experienced patients with hepatitis C virus genotype 1 infection and stage 4-5 chronic kidney disease (the C-SURFER study):a combination phase 3 study[J]. Lancet, 2015, 386(10003): 1537-1545. DOI:10.1016/S0140-6736(15)00349-9 |
| [21] |
Fabrizi F, Aghemo A, Messa P. Hepatitis C treatment in patients with kidney disease[J]. Kidney Int, 2013, 84(5): 874-879. DOI:10.1038/ki.2013.264 |
| [22] |
Shuster DL, Menon RM, Ding B, et al. Effects of chronic kidney disease stage 4, end-stage renal disease, or dialysis on the plasma concentrations of ombitasvir, paritaprevir, ritonavir, and dasabuvir in patients with chronic HCV infection:pharmacokinetic analysis of the phase 3 RUBY-I and RUBY-II trials[J]. Eur J Clin Pharmacol, 2019, 75(2): 207-216. DOI:10.1007/s00228-018-2566-6 |
| [23] |
Stark JE, Cole J. Successful treatment of chronic hepatitis C virus infection in a patient receiving daily peritoneal dialysis[J]. Am J Health Syst Pharm, 2017, 74(19): 1541-1544. DOI:10.2146/ajhp160729 |
| [24] |
Aggarwal A, Yoo ER, Perumpail RB, et al. Sofosbuvir use in the setting of end-stage renal disease:a single center experience[J]. J Clin Transl Hepatol, 2017, 5(1): 23-26. |



