2. 湖南省疾病预防控制中心微生物检验室, 湖南 长沙 410005;
3. 湖南省人民医院(湖南师范大学附属第一医院)呼吸内科, 湖南 长沙 410005
2. Microbiology Laboratory, Hunan Provincial Center for Disease Control and Prevention, Changsha 410005, China;
3. Department of Respiratory Medicine, Hunan Provincial People's Hospital[The First Affiliated Hospital of Hunan Normal University], Changsha 410005, China
高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae,HvKP)是肺炎克雷伯菌(Klebsiella pneumoniae,KP)高毒力变种,有别于引起机会性感染的经典KP(classic Klebsiella pneumoniae,cKP),可引起既往体健和年轻者严重的社区获得性感染,如肝脓肿、肺炎、脑膜炎和眼内炎等[1-2]。自发现以来,HvKP的分子特征及毒力作用机制一直被广泛研究,但目前为止仍缺乏严格定义。HvKP毒力因子主要位于一些毒力质粒(如pLVPK)和可移动的遗传原件[3-4],荚膜多糖产生的上调(rmpA和/或rmpA2介导)和铁载体系统的过表达(如salmochelin和aerobactin)对HvKP的高毒力有着重要贡献[5]。迄今为止,HvKP荚膜血清型大多数为K1或K2[6-7],分布于一些特定的克隆谱系中,如ST23[2, 8]。HvKP在全球的流行具有显著的地域特征,主要分布于亚洲,特别是中国[9]。近年来,对于耐碳青霉烯类高毒力肺炎克雷伯菌(carbapenem-resistant hypervirulent Klebsiella pneumoniae,CR-HvKP)的报道不断增加,且这些CR-HvKP以产KPC-2酶为主[2, 10-11]。CR-HvKP因其高毒力和高耐药性,严重威胁患者健康,加重患者经济负担,给医院感染的防控带来了严峻的挑战。为此,对1例由CR-HvKP引起的重症肺炎患者病例资料及其分子、毒力特征进行报告,旨在提高医务人员对CR-HvKP及其致病特点的认识。
1 对象与方法 1.1 研究对象患者男性,87岁,无业,因“反复咳嗽、咳痰4月余,加重伴发热、气促1个月”就诊于本院呼吸内科。既往有高血压、陈旧性肺结核病史和“风湿病”史,8年前因“支气管扩张”行支气管栓塞术,否认糖尿病和外伤史,无吸烟和出游史。门诊以“重症肺炎”收治入院。入院后完善三大常规、肝肾功能、心肌酶、风湿免疫检查、心电图、胸部CT、痰培养及支气管镜检查等,并对分离代表株行进一步研究。重症肺炎诊断标准参照中华医学会呼吸病学分会制定的指南[12]。将对碳青霉烯耐药、含有毒力基因并且经大蜡螟毒力模型评估具有高毒力的耐碳青霉烯类肺炎克雷伯菌(CRKP)定义为CR-HvKP。
1.2 菌株鉴定和药敏试验分离株通过VITEK MS(法国梅里埃)和VITEK 2 Compact全自动微生物鉴定和药敏系统(法国梅里埃)进行鉴定及抗菌药物最低抑菌浓度(MIC)测定,其中亚胺培南、美罗培南(郑州安图生物)和替加环素(深圳康泰生物)MIC通过E-test法复核,粘菌素MIC采用微量肉汤稀释法检测。替加环素MIC结果判断参照美国食品和药物管理局(FDA)文件[13],多粘菌素敏感性判断参照欧洲临床微生物和感染病学会药敏委员会(EUCAST)文件[14],其余抗菌药物的敏感性判断参照美国临床试验室标准化协会(CLSI)2018文件[15]。
1.3 碳青霉烯耐药机制的检测采用耐药表型和耐药基因检测法。耐药表型检测采用CLSI 2018文件推荐的改良碳青霉烯灭活试验[15]。耐药基因检测采用PCR扩增blaKPC、blaNDM和blaIMP三种常见的碳青霉烯酶基因[16]。菌株DNA提取采用煮沸法,PCR反应体系包括引物F/R各0.2 μL,2×PCR super mixture(北京全式金)12.5 μL,DNA模板3 μL,加ddH2O至25 μL。引物序列及退火温度见表 1。扩增产物经1%琼脂糖凝胶电泳后,阳性产物送长沙擎科生物技术公司测序并分析。
| 表 1 CR-HvKP碳青霉烯酶耐药基因及毒力基因引物序列及退火温度 Table 1 Primer sequence and annealing temperature of CR-HvKP carbapenemase resistance genes |

|
采用拉丝试验确定该菌是否为高黏液表型[2]。将菌株接种至5%羊血培养基中,置于35℃ 5%的CO2培养箱中孵育18~24 h后,用干燥的5 μL接种环轻轻挑取菌落,若拉丝>5 mm则判定为拉丝阳性,即为高黏液表型。
1.5 毒力基因、荚膜抗原基因检测和多位点序列分型(MLST)扩增iucA、iroN、prmpA和prmpA2四种毒力基因确定菌株毒力基因表达情况[2]。扩增所用的引物序列及退火温度见表 1,PCR反应体系同1.3。通过多重PCR的方法检测K1、K2、K5、K20、K54和K57毒力相关荚膜抗原基因了解该菌的荚膜抗原基因表达情况,检测方法参照文献[17]。根据Pasteur Institute MLST网站(http://bigsdb.pasteur.fr/klebsiella/klebsiella.html)提供的引物序列和条件对该菌进行MLST。
1.6 动物模型毒力试验采用大蜡螟模型了解CR-HvKP株菌在体外的毒力表现[2, 18]。大蜡螟是鳞翅目、螟蛾科、蜡螟亚科、蜡螟属的昆虫。该幼虫模型目前已成为研究许多人类病原体发病机制的可靠模型[2, 18]。幼虫在注射菌液后会产生免疫反应并黑化(图 1),失去运动能力后死亡,通过观察接种后幼虫的死亡情况即可比较菌株的毒力大小[19]。将待测菌株经35℃孵育过夜后,挑取单个菌落并用磷酸盐缓冲液(PBS)分别调至1×104、1×105、1×106、1×107 CFU/mL,然后采用微量注射器将各浓度菌液以10 μL/只的量注入体长2~3 cm活力较好的大蜡螟幼虫(购自天津惠裕德公司)体内,每间隔2 h观察幼虫死亡情况并记录。每个浓度设10只平行试验。将HvKP菌株NTUH-K2044和非HvKP菌株ZR2以同样的方式进行试验并分别作为阳性对照组和阴性对照组,同时设置PBS空白对照组。试验重复至少2次。
 |
| A:未接种菌液的幼虫;B:黑化并死亡的幼虫。 图 1 大蜡螟幼虫CR-HvKP接种结果的观察 Figure 1 Inoculation results CR-HvKP of larva of Galleria mellonella |
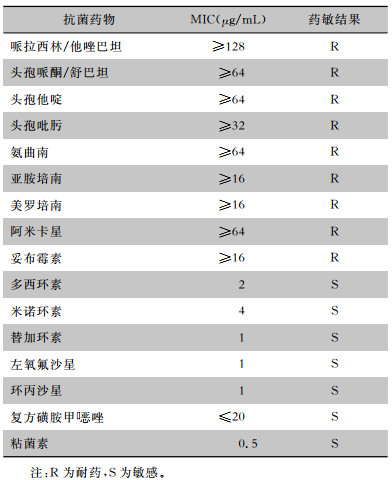
患者入院时反复咳嗽,咳淡黄色脓性痰,且痰不易咳出,并有呼吸困难,无明显发热,无盗汗及痰中带血。体格检查:体温36.5℃,呼吸21次/min,脉搏79次/min,血压122/76 mmHg。扶入病房,神志清楚,精神欠佳。口唇无发绀,双肺呼吸音粗,右下肺可闻及中等湿啰音,心腹部查体未见异常。入院后予以吸氧、止咳化痰及改善通气功能等对症支持治疗,并经验性地予以头孢哌酮/舒巴坦钠(2 g, 静脉滴注,q6h)抗感染,患者咳嗽、气促症状未见明显改善。行胸部CT检查示右上肺病变和双下肺炎症,进一步完善纤维支气管镜检查。患者肺泡灌洗液培养分离出CR-HvKP1235,药敏结果见表 2。遂根据药敏结果改用其敏感的盐酸左氧氟沙星(0.3 g,静脉滴注,q12h)和盐酸多西环素(0.1 g,静脉滴注,q12h)联合抗感染,同时予以对症支持治疗。5日后患者咳嗽、呼吸困难症状得到明显改善,无发热、胸闷不适,肺部湿啰音较前明显减少,各项生命体征平稳,复查痰培养阴性,遂予出院。两周后患者门诊复查胸部CT提示肺部炎症较前明显好转。
| 表 2 CR-HvKP1235药物敏感性试验结果 Table 2 Antimicrobial susceptibility testing results of CR-HvKP1235 |
|
血气分析:pH 7.49,pCO2 37 mmHg,pO2122 mmHg,HCO3- 28.3 mmol/L,FiO2 0.29;血常规:中性粒细胞百分比81.2%(正常值参考范围50.0%~70.0%),淋巴细胞百分比8.2%(正常值参考范围18.0%~40.0%);尿常规、粪便常规、电解质、心肌酶、血糖、甘油三酯和总胆固醇均在正常范围;肝功能:丙氨酸氨基转移酶7.6 U/L(正常值参考范围9.0~50.0 U/L),门冬氨酸氨基转移酶在正常范围;肾功能:β2微球蛋白3.54 mg/L(正常值参考范围1.00~3.00 mg/L);凝血功能:D-二聚体1.06 mg/L(正常值参考范围0~0.55 mg/L);红细胞沉降率38 mm/h(正常值参考范围0~20 mm/h);高敏C反应蛋白、降钙素原在正常范围;肺炎支原体抗体阴性;真菌(1, 3)-β-D葡聚糖检测和曲霉菌抗原检测为阴性;结核菌素试验及痰和肺泡灌洗液抗酸杆菌检测均为阴性;狼疮全套:抗核抗体阳性(核颗粒型1:1 000),抗蛋白酶3抗体IgG 23.08 RU/mL(正常值参考范围0~20.00 RU/mL),抗SS-A/52kD抗体阳性,抗SS-B抗体阳性。心电图检查未见异常。肺泡灌洗液培养:KPN(≥1×105 CFU/mL)。胸部CT提示右上肺病变,性质待定:考虑肺结核并肺不张可能;右中肺钙化灶;双下肺炎症。
2.3 碳青霉烯耐药表型及基因型检测结果CR-HvKP1235改良碳青霉烯灭活试验结果为碳青霉烯酶阳性(抑菌圈直径6 mm)。PCR扩增检测碳青霉烯基因结果显示,该菌含有blaIMP-4,未检测出blaKPC和blaNDM。见图 2。
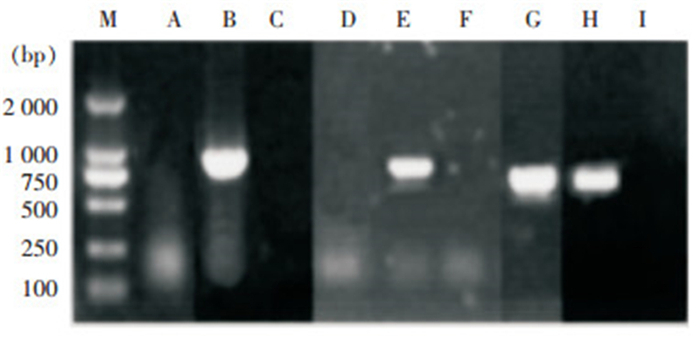 |
| M为Marker,A~C分别为CR-hvKP1235 blaKPC、阳性对照和阴性对照,D~F分别为CR-HvKP1235 blaNDM、阳性对照和阴性对照,G~I分别为CR-HvKP1235 blaIMP、阳性对照和阴性对照。 图 2 CR-HvKP1235碳青霉烯酶基因PCR扩增产物电泳图 Figure 2 Electrophoresis map of PCR amplification pro-ducts of CR-HvKP1235 carbapenemase genes |
CR-HvKP1235拉丝试验结果显示,拉丝长度<5 mm,拉丝阴性,为非高黏液表型。
2.5 耐药基因、毒力基因、荚膜抗原基因检测和MLST结果CR-HvKP1235仅prmpA2阳性,未检出iucA、iroN和prmpA,荚膜抗原基因检测提示含有K54荚膜抗原基因,MLST为ST2928型。见图 3。
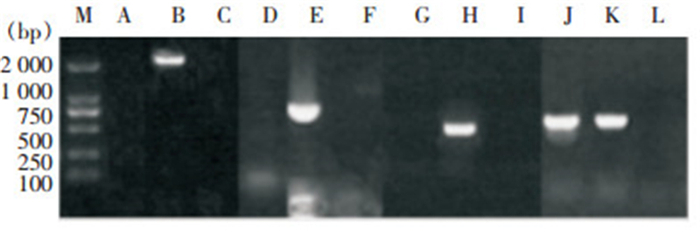 |
| M为Marker,A~C分别为CR-HvKP1235 iucA、阳性对照和阴性对照,D~F分别为CR-HvKP1235 iroN、阳性对照和阴性对照,G~I分别为CR-HvKP1235 prmpA、阳性对照和阴性对照,J~L分别为CR-HvKP1235 prmpA2、阳性对照和阴性对照。 图 3 CR-hvKP1235毒力基因PCR扩增产物电泳图 Figure 3 Electrophoresis map of PCR amplification pro-ducts of CR-HvKP1235 virulence genes |
选择在菌液浓度为1×106 CFU/mL时进行各组间比较。PBS空白对照组幼虫全部存活,CR-HvKP1235试验组幼虫在接种菌液14 h后存活率低于NTUH-K2044高毒力KP组和ZR2非高毒力cKP组,表明该菌株在大蜡螟幼虫毒力模型中表现出较高的毒力。见图 4。
 |
| 图 4 CR-HvKP1235的大蜡螟感染模型试验结果 Figure 4 Galleria mellonella infection model test results for CR-HvKP1235 |
自1986年第1例HvKP引起的肝脓肿被报道以来,HvKP这一高毒力变种逐渐引起人们的重视[20]。以往报道的HvKP大多引起社区获得性感染,并且常对多种抗菌药物有较高的敏感性,但随着抗菌药物的大量使用及其他诸多因素的共同作用,近几年CR-HvKP已广泛出现,给医院感染的预防和控制带来了巨大的挑战[2, 21]。随着对HvKP毒力机制研究的深入,许多毒力相关因子已被发现,如高黏液表型、荚膜血清型、MLST型及包含毒力基因的毒力质粒等[22]。虽然研究表明,peg-344、iroB、iucA、prmpA和prmpA2等毒力因子在鉴定HvKP时表现出较高的诊断正确性[5],但目前仍缺乏精确区分HvKP和cKP的方法。为了解本地区KP的分子流行病学及毒力情况,为此对本院临床微生物室分离的KP进行了连续搜集并分析,发现了1株具有不常见的ST型和荚膜血清型的CRKP,经进一步研究最终鉴定为CR-HvKP。
本研究中感染CR-HvKP的患者为老年男性,合并有高血压和支气管扩张病史,入院时精神差,虽未出现发热,但有反复咳嗽、气促的临床表现,肺部炎症范围广泛且迁延不愈。行纤维支气管镜检查并送检肺泡灌洗液培养为KP,且为多重耐药菌,根据药敏结果更改抗菌药物并积极对症支持治疗后患者症状逐渐好转。老年患者的重症肺炎表现可不典型,若早期未引起重视易导致难以挽回的结局[23]。本例患者无发热,白细胞计数、C反应蛋白及降钙素原等炎症指标均正常,血常规中性粒细胞比例升高,胸部CT发现双下肺广泛炎症,临床极易忽视和漏诊。本次引起感染的病原菌为致病性较强并且对多种常用抗菌药物具有较高耐药性的KP,给临床诊治增加了一定的难度。及时完善纤维支气管镜检查,明确病原菌并选择恰当的抗菌药物是本例治愈的关键。值得注意的是,CR-HvKP的典型感染症状是肝脓肿[24],但该患者并未出现此种感染的表现。
本研究通过毒力基因和大蜡螟毒力模型两种方法定义了CR-hvKP。以往报道中的CR-HvKP多属于ST11,并且大多产KPC-2[10-11]。本研究发现的CR-hvKP属于ST2928、荚膜抗原为K54型和产IMP-4碳青霉烯酶,ST2928 CR-HvKP目前尚未见报道,说明HvKP克隆谱系具有多样性。虽然该株CR-HvKP在体外动物模型中表现了较高的毒力,但患者并未出现严重的结局,其原因目前尚不明确,菌株在体内的毒力表现和宿主免疫之间的作用关系值得探究,相关结论需要更大样本量和更深入研究数据的支持。由于研究的样本十分有限,难以进一步分析这种新型ST CR-HvKP的感染危险因素或流行病学特征,同时对此株新型CR-HvKP的毒力基因背景了解也十分有限,但研究结果提示HvKP可能正在向新的克隆谱系进化,提醒应该更加密切关注CR-HvKP,需要更加积极地监测此种病原体,以便为临床医生和流行病学家提供可靠的信息。在中国,CR-HvKP的报道正在增加,新的ST型出现令人担忧,及早发现并隔离是控制此菌进一步传播的主要措施,同时,对CR-HvKP的毒力机制和耐药性的发生需要进行更深入地研究,以帮助临床医生应对危机。
| [1] |
Russo TA, Marr CM. Hypervirulent Klebsiella pneumoniae[J]. Clin Microbiol Rev, 2019, 32(3): e00001-19. |
| [2] |
Gu D, Dong N, Zheng Z, et al. A fatal outbreak of ST11 carbapenem-resistant hypervirulent Klebsiella pneumoniae in a Chinese hospital:a molecular epidemiological study[J]. Lancet Infect Dis, 2018, 18(1): 37-46. DOI:10.1016/S1473-3099(17)30489-9 |
| [3] |
Chen YT, Chang HY, Lai YC, et al. Sequencing and analysis of the large virulence plasmid pLVPK of Klebsiella pneumo-niae CG43[J]. Gene, 2004, 337: 189-198. DOI:10.1016/j.gene.2004.05.008 |
| [4] |
Marcoleta AE, Berríos-Pastén C, Nuñez G, et al. Klebsiella pneumoniae asparagine tDNAs are integration hotspots for different genomicislands encoding microcin E492 production determinants and other putative virulence factors present in hypervirulent strains[J]. Front Microbiol, 2016, 7: 849. |
| [5] |
Russo TA, Olson R, Fang CT, et al. Identification of biomarkers for differentiation of hypervirulent Klebsiella pneumoniae from classical K. pneumoniae[J]. J Clin Microbiol, 2018, 56(9): e00776-18. |
| [6] |
Lin YT, Cheng YH, Juan CH, et al. High mortality among patients infected with hypervirulent antimicrobial-resistant capsular type K1 Klebsiella pneumoniae strains in Taiwan[J]. Int J Antimicrob Agents, 2018, 52(2): 251-257. DOI:10.1016/j.ijantimicag.2018.06.008 |
| [7] |
Remya P, Shanthi M, Sekar U. Occurrence and characterization of hyperviscous K1 and K2 serotype in Klebsiella pneumoniae[J]. J Lab Physicians, 2018, 10(3): 283-288. DOI:10.4103/JLP.JLP_48_18 |
| [8] |
Lee IR, Molton JS, Wyres KL, et al. Differential host susceptibility and bacterial virulence factors driving Klebsiella liver abscess in an ethnically diverse population[J]. Sci Rep, 2016, 6: 29316. DOI:10.1038/srep29316 |
| [9] |
Guo Y, Wang S, Zhan L, et al. Microbiological and clinical characteristics of hypermucoviscous Klebsiella pneumoniae isolates associated with invasive infections in China[J]. Front Cell Infect Microbiol, 2017, 7: 24. |
| [10] |
Zhang Y, Zhao C, Wang Q, et al. High prevalence of hypervirulent Klebsiella pneumoniae infection in China:geographic distribution, clinical characteristics, and antimicrobial resis-tance[J]. Antimicrob Agents Chemother, 2016, 60(10): 6115-6120. DOI:10.1128/AAC.01127-16 |
| [11] |
Xu M, Fu Y, Fang Y, et al. High prevalence of KPC-2-producing hypervirulent Klebsiella pneumoniae causing meningitis in Eastern China[J]. Infect Drug Resist, 2019, 12: 641-653. DOI:10.2147/IDR.S191892 |
| [12] |
中华医学会呼吸病学分会. 社区获得性肺炎诊断和治疗指南[J]. 中华结核和呼吸杂志, 2006, 29(10): 651-655. DOI:10.3760/j:issn:1001-0939.2006.10.002 |
| [13] |
FDA. Tygacil® (Tigecycline) for Injection[EB/OL].[2019-12-01]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2007/021821s010lbl.pdf.
|
| [14] |
European Committee on Antimicrobial Susceptibility Testing. Breakpoints tables for interpretation of MICs and zone diameters[EB/OL]. (2016-01-01)[2019-12-01]. https://www.doc88.com/p-9903176364070.html.
|
| [15] |
Weinstein MP, Patel JB, Campeau S, et al. Performance standards for antimicrobial susceptibility testing[S]. 28th ed. PA, USA: Clinical and Laboratory Standards Institute, 2018.
|
| [16] |
Nordmann P, Naas T, Poirel L. Global spread of carbapenemase-producing Enterobacteriaceae[J]. Emerg Infect Dis, 2011, 17(10): 1791-1798. DOI:10.3201/eid1710.110655 |
| [17] |
Turton JF, Perry C, Elgohari S, et al. PCR characterization and typing of Klebsiella pneumoniae using capsular type-specific, variable number tandem repeat and virulence gene targets[J]. J Med Microbiol, 2010, 59(Pt 5): 541-547. |
| [18] |
Insua JL, Llobet E, Moranta D, et al. Modeling Klebsiella pneumoniae pathogenesis by infection of the wax moth galleria mellonella[J]. Infect Immun, 2013, 81(10): 3552-3565. DOI:10.1128/IAI.00391-13 |
| [19] |
Peleg AY, Jara S, Monga D, et al. Galleria mellonella as a model system to study Acinetobacter baumannii pathogenesis and therapeutics[J]. Antimicrob Agents Chemother, 2009, 53(6): 2605-2609. DOI:10.1128/AAC.01533-08 |
| [20] |
Qian Y, Wong CC, Lai S, et al. A retrospective study of pyogenic liver abscess focusing on Klebsiella pneumoniae as a primary pathogen in China from 1994 to 2015[J]. Sci Rep, 2016, 6: 38587. DOI:10.1038/srep38587 |
| [21] |
史庆丰, 蒋良芝, 李春燕, 等. 碳青霉烯酶的起源与进化及流行和传播[J]. 中华医院感染学杂志, 2018, 28(9): 1424-1428. |
| [22] |
Catalán-Nájera JC, Garza-Ramos U, Barrios-Camacho H. Hypervirulence and hypermucoviscosity:two different but complementary Klebsiella spp. phenotypes?[J]. Virulence, 2017, 8(7): 1111-1123. DOI:10.1080/21505594.2017.1317412 |
| [23] |
杨建华. 老年性肺炎的临床治疗探讨[J]. 中国医药指南, 2017, 15(12): 196-197. |
| [24] |
Rossi B, Gasperini ML, Leflon-Guibout V, et al. Hypervirulent Klebsiella pneumoniae in cryptogenic liver abscesses, Paris, France[J]. Emerg Infect Dis, 2018, 24(2): 221-229. DOI:10.3201/eid2402.170957 |




 唑
唑